Similar presentations:
Альдегиды и кетоны
1. АЛЬДЕГИДЫ И КЕТОНЫ
Лекции для 3-го курса Института Химии ТюмГУПрофессор кафедры органической и экологической химии,
д.х.н. Кулаков И.В.
2.
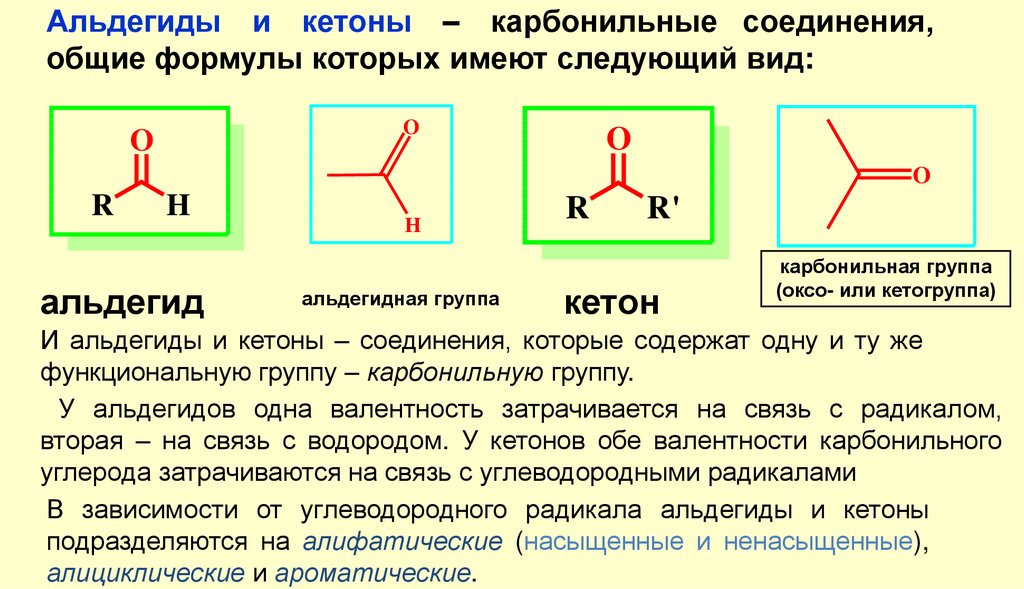
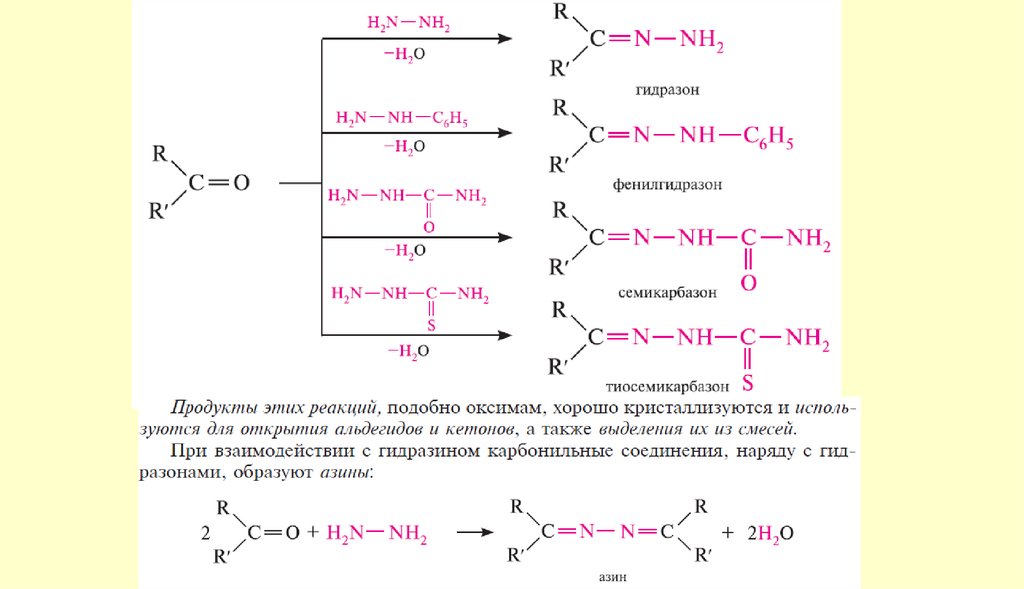
Альдегиды и кетоны – карбонильные соединения,общие формулы которых имеют следующий вид:
O
O
O
O
R
H
альдегид
H
альдегидная группа
R
R'
кетон
карбонильная группа
(оксо- или кетогруппа)
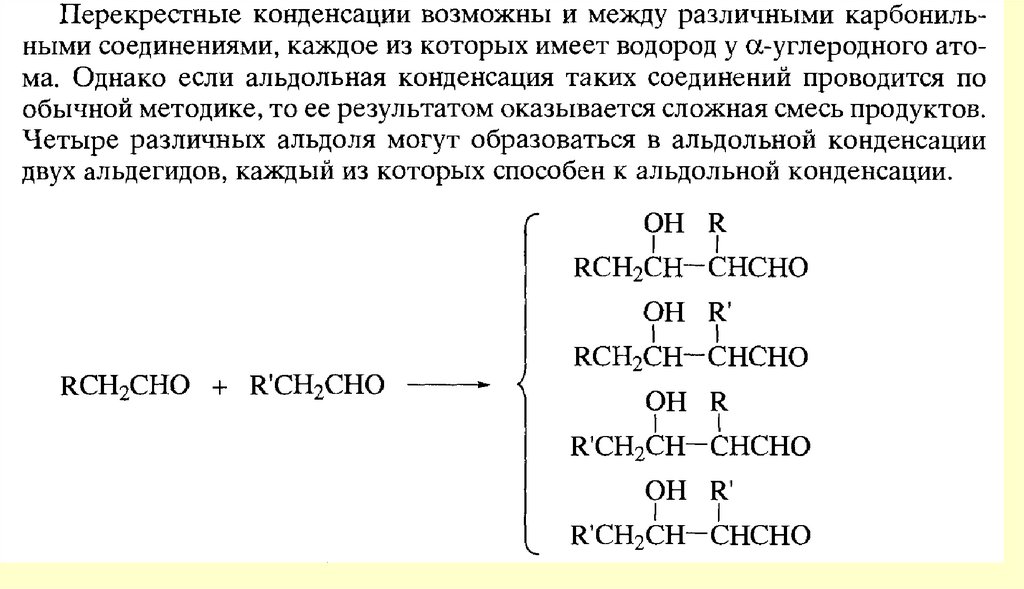
И альдегиды и кетоны – соединения, которые содержат одну и ту же
функциональную группу – карбонильную группу.
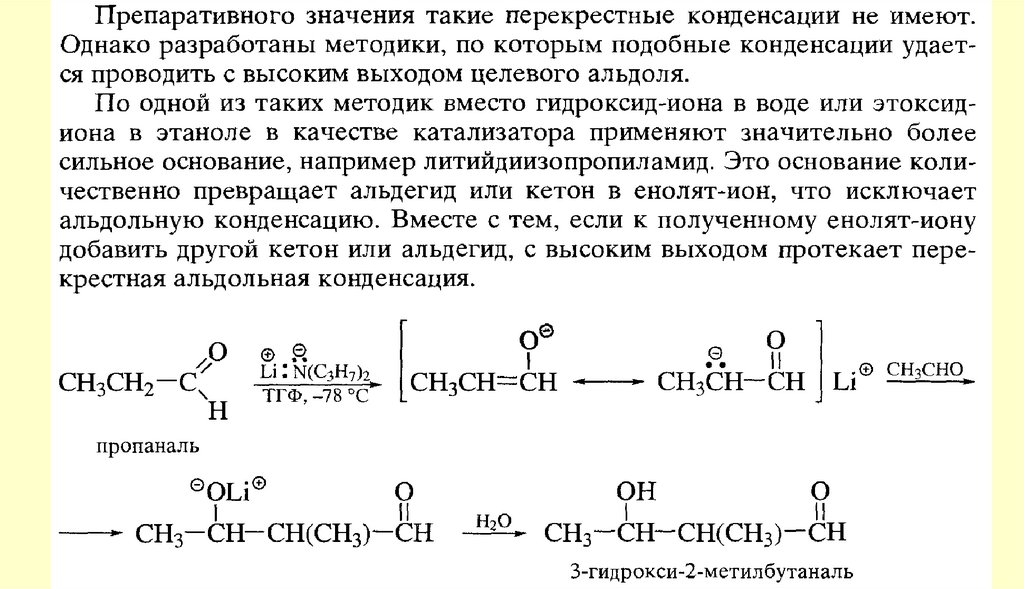
У альдегидов одна валентность затрачивается на связь с радикалом,
вторая – на связь с водородом. У кетонов обе валентности карбонильного
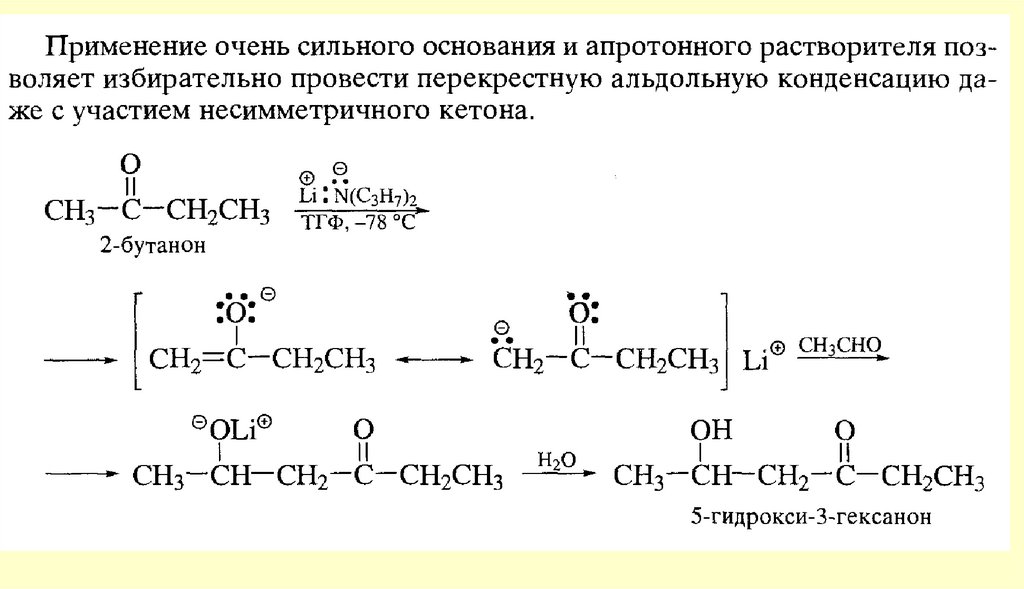
углерода затрачиваются на связь с углеводородными радикалами
В зависимости от углеводородного радикала альдегиды и кетоны
подразделяются на алифатические (насыщенные и ненасыщенные),
алициклические и ароматические.
3. Насыщенные АЛЬДЕГИДЫ И КЕТОНЫ
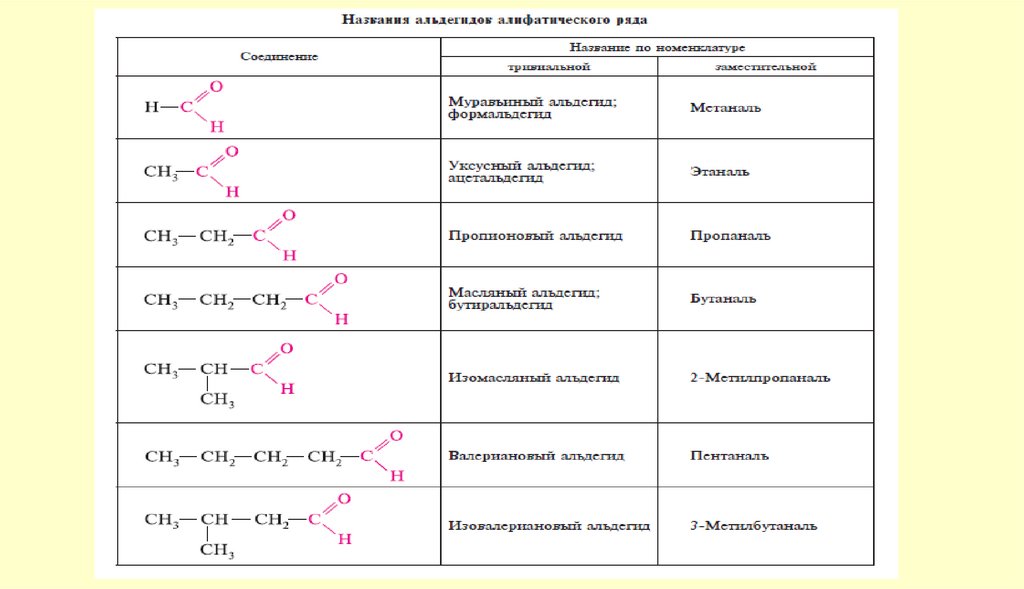
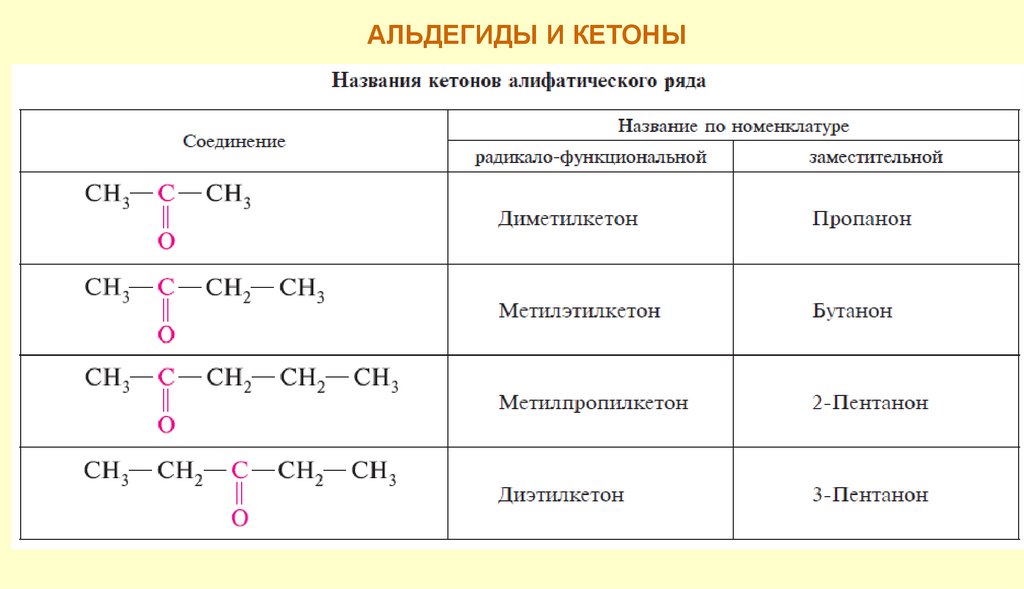
Номенклатура. Изомерия4.
5.
АЛЬДЕГИДЫ И КЕТОНЫ6.
АЛЬДЕГИДЫ И КЕТОНЫ7.
АЛЬДЕГИДЫ И КЕТОНЫ8.
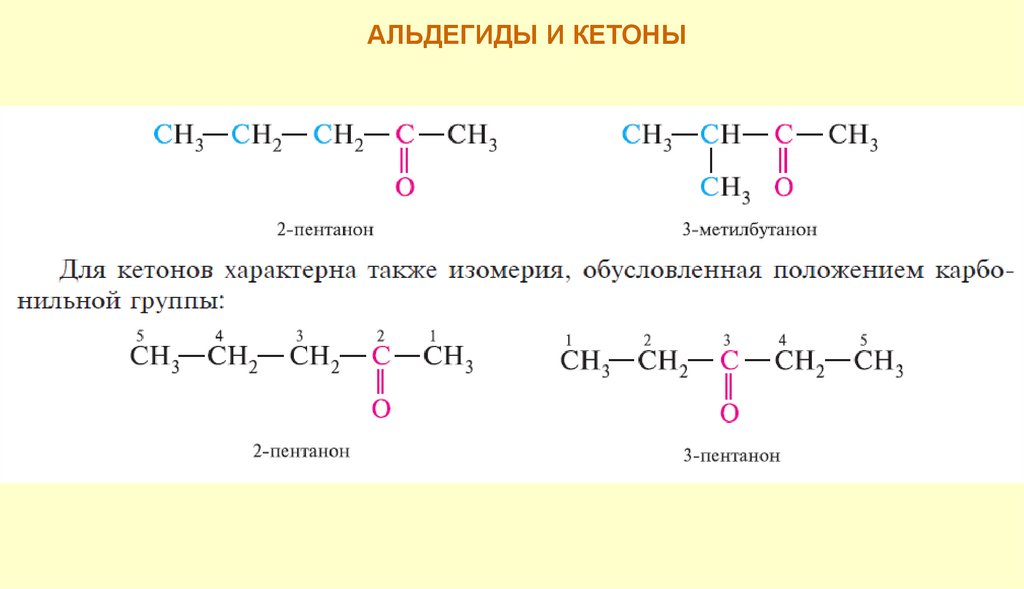
АЛЬДЕГИДЫ И КЕТОНЫАльдегиды и кетоны изомерны:
общая формула насыщенных
CnH2nO
альдегидов и кетонов
9.
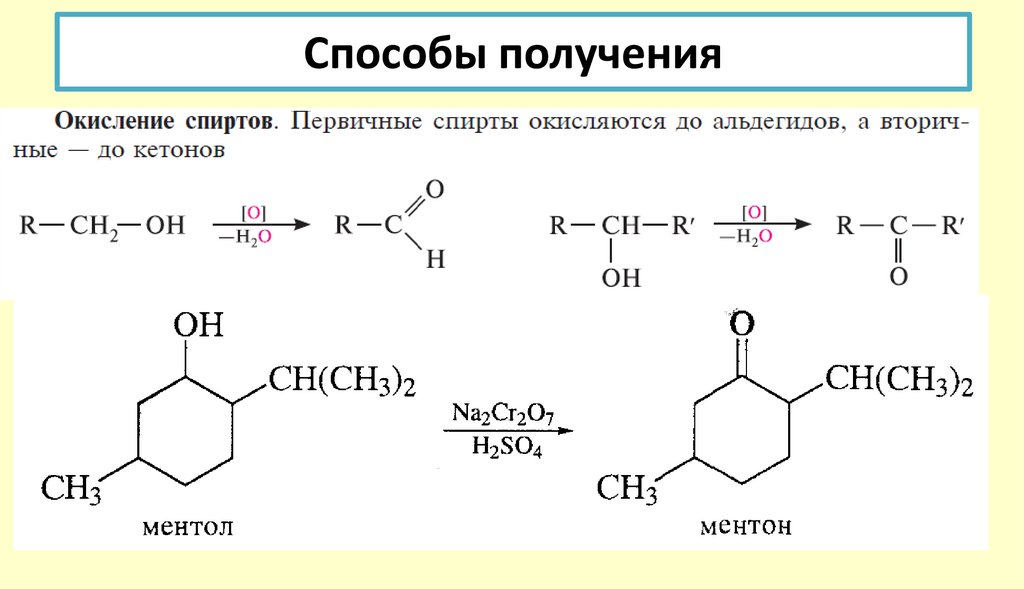
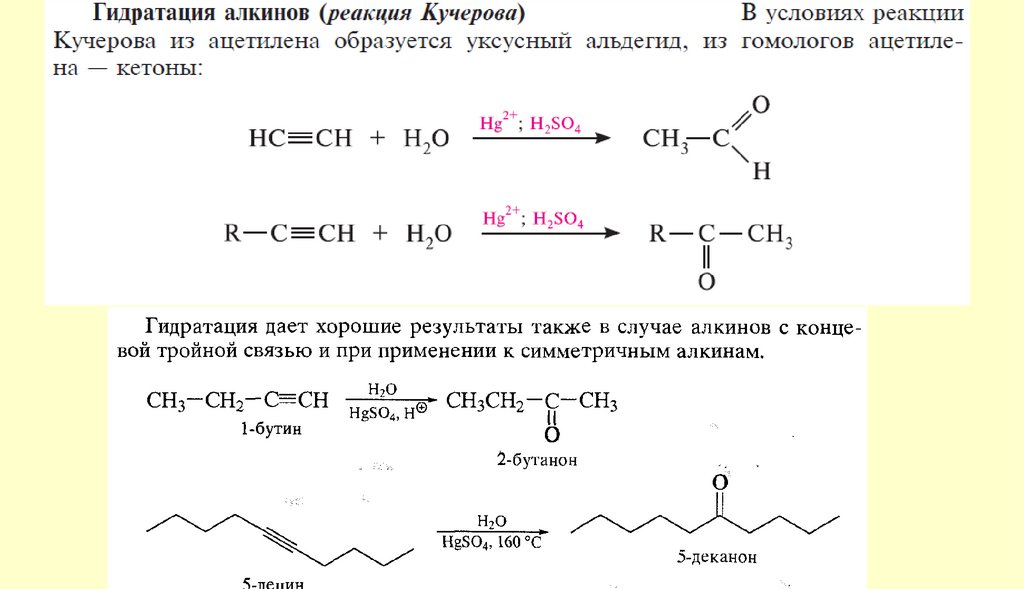
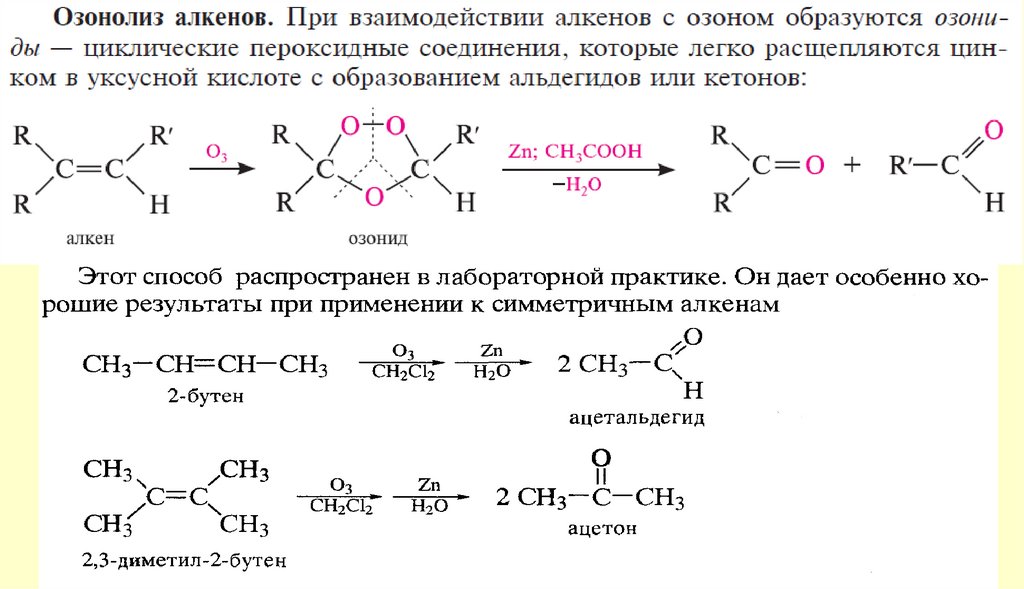
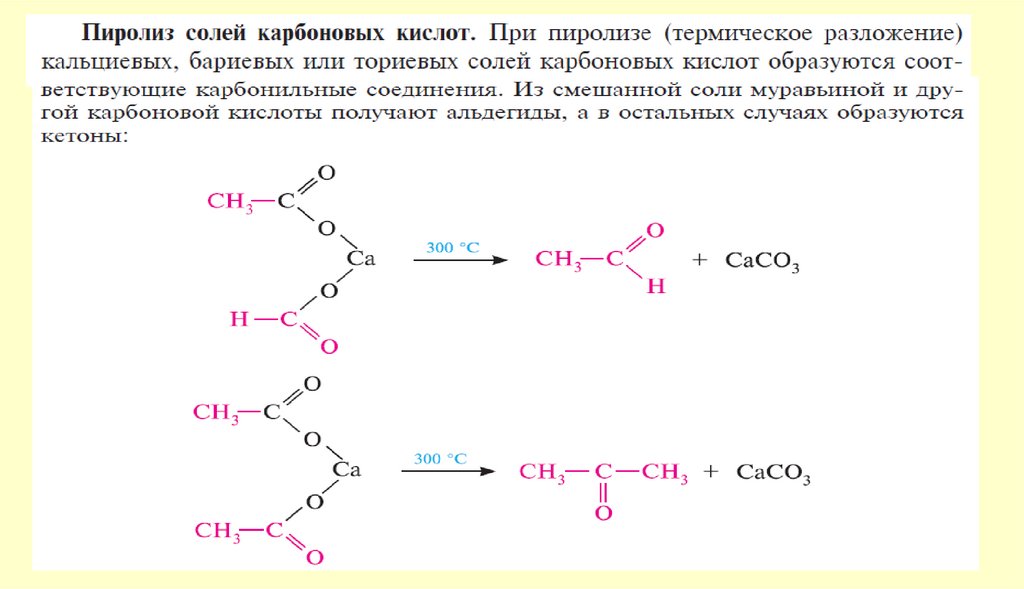
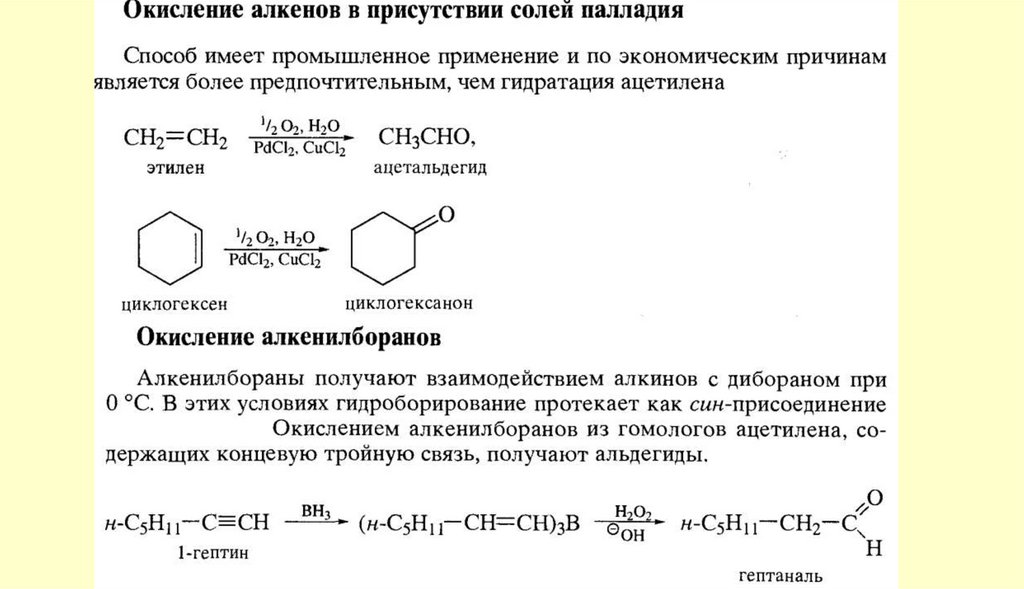
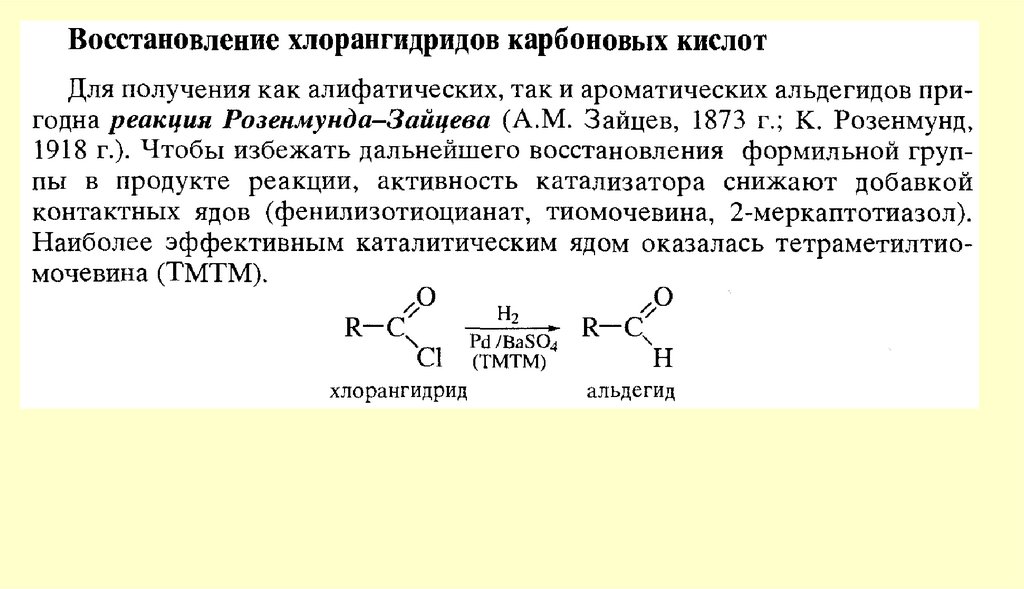
АЛЬДЕГИДЫ И КЕТОНЫ10. Способы получения
11.
12.
13.
14.
15.
16.
17.
18.
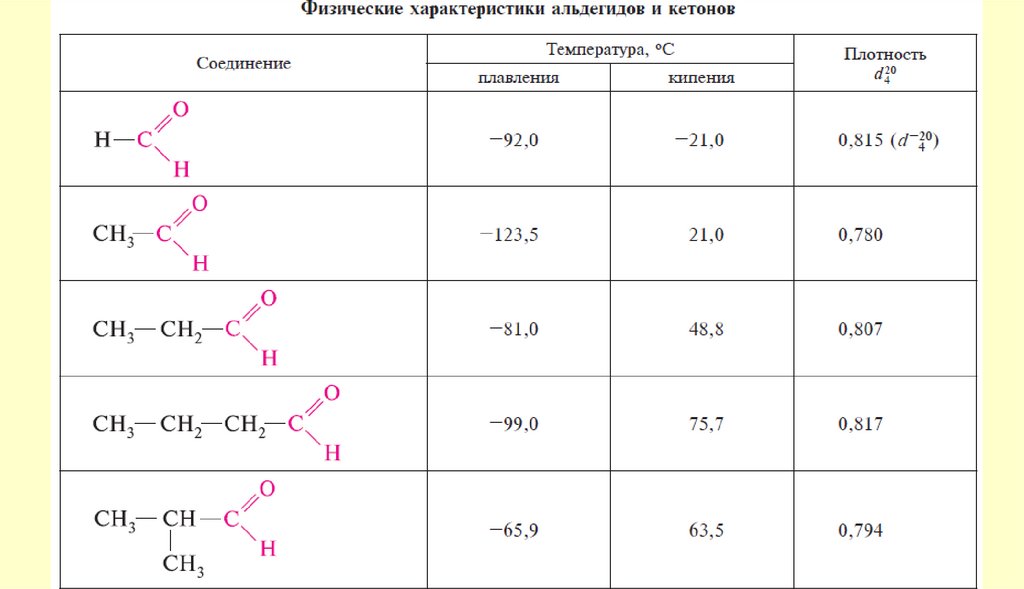
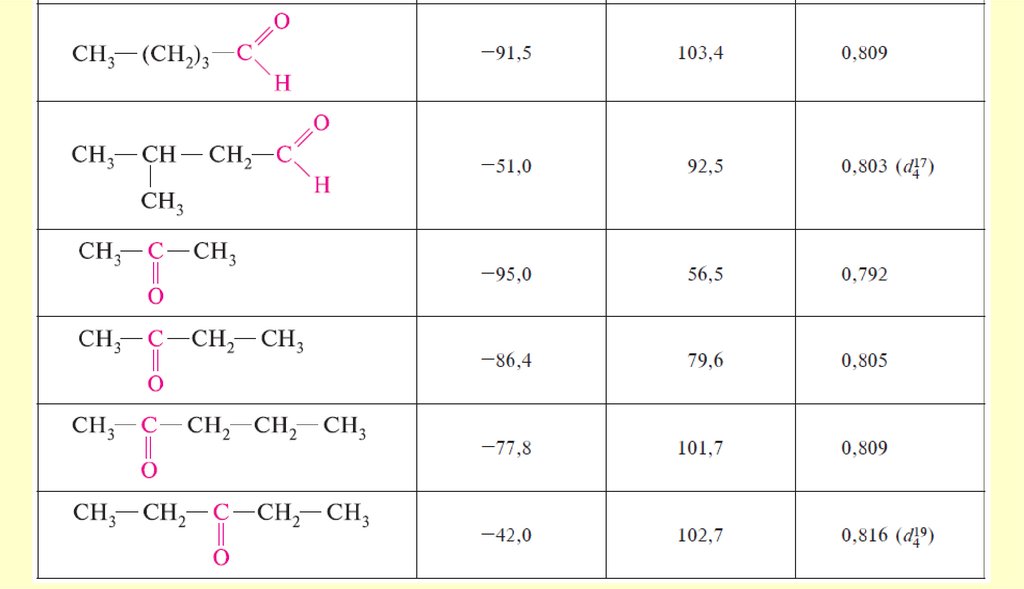
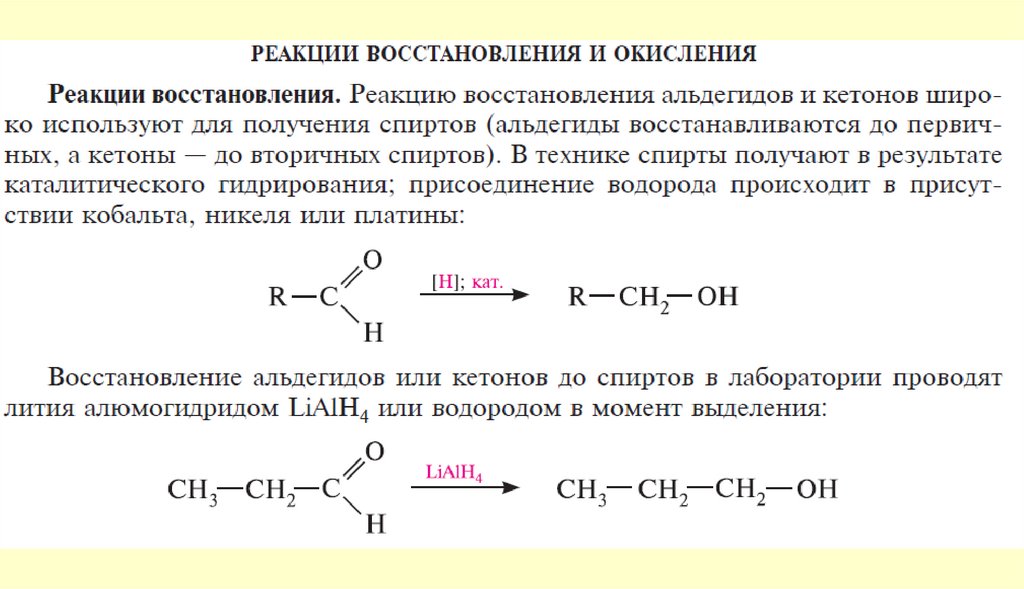
19. Физические свойства
Так как альдегиды и кетоны полярные соединения, они имеютболее высокие температуры кипения, чем неполярные соединения
сравнимого молекулярного веса, но ниже, чем у спиртов, что
указывает на отсутствие у оксосоединений существенной
молекулярной ассоциации.
Низшие оксосоединения заметно растворимы в воде, вероятно,
вследствие образования водородных связей; обладают резким
запахом.
С увеличением размера молекул (начиная с С5) растворимость
резко уменьшается; высшие альдегиды и кетоны обладают
приятным запахом
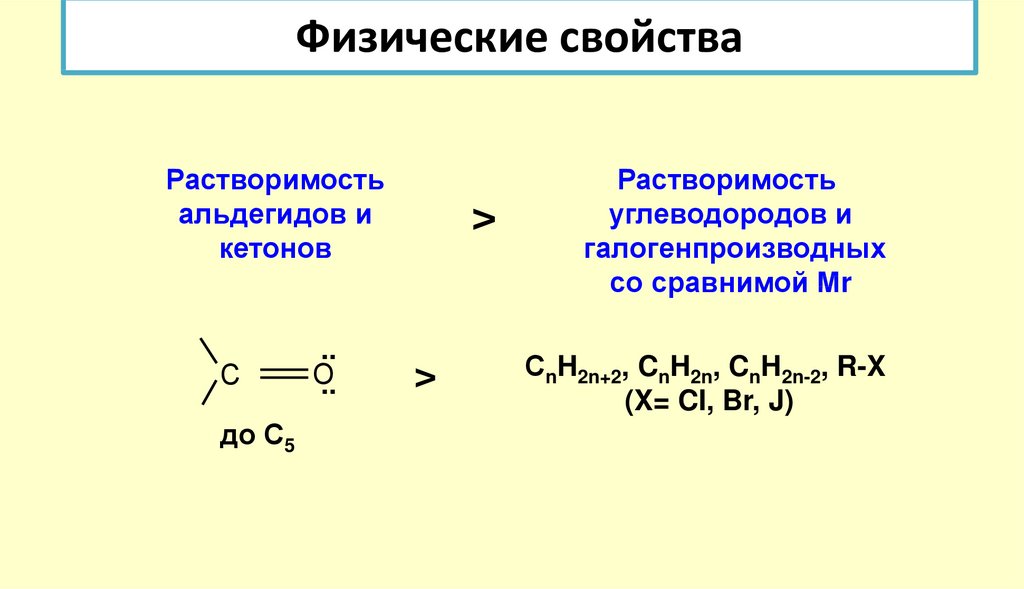
20. Физические свойства
Растворимостьальдегидов и
кетонов
С
до С5
..
О..
>
>
Растворимость
углеводородов и
галогенпроизводных
со сравнимой Мr
СnH2n+2, CnH2n, CnH2n-2, R-X
(X= CI, Br, J)
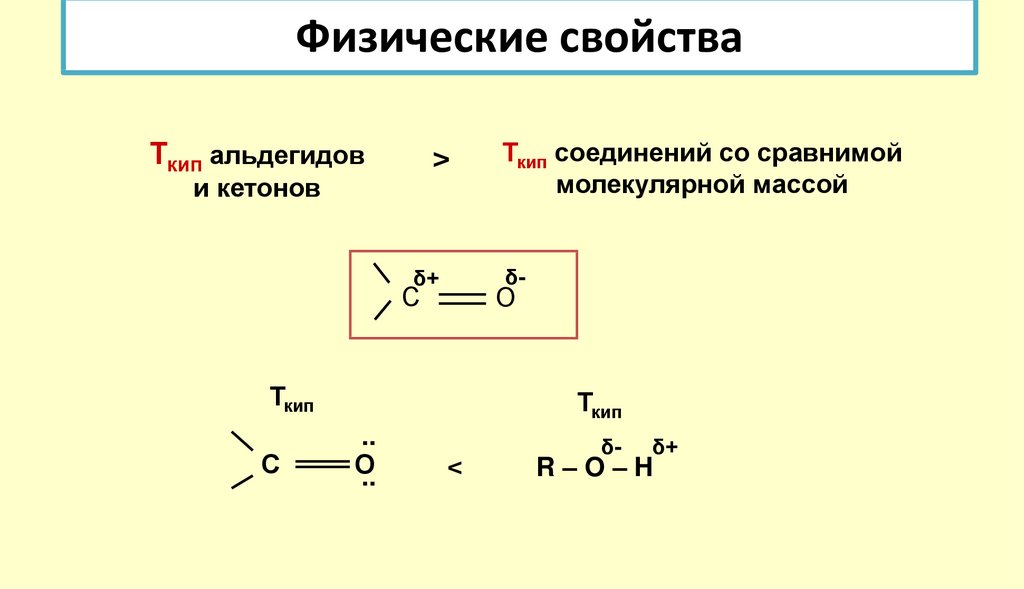
21. Физические свойства
Ткип альдегидов>
и кетонов
δ-
δ+
С
О
Ткип
С
Ткип соединений со сравнимой
молекулярной массой
Ткип
..
О
..
<
δ-
δ+
R–O–H
22.
23.
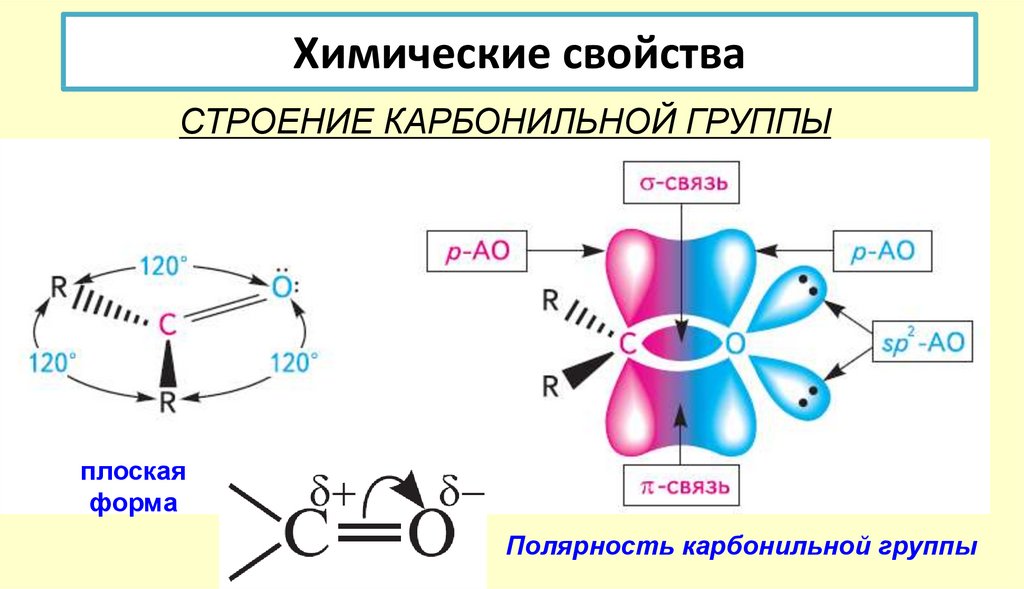
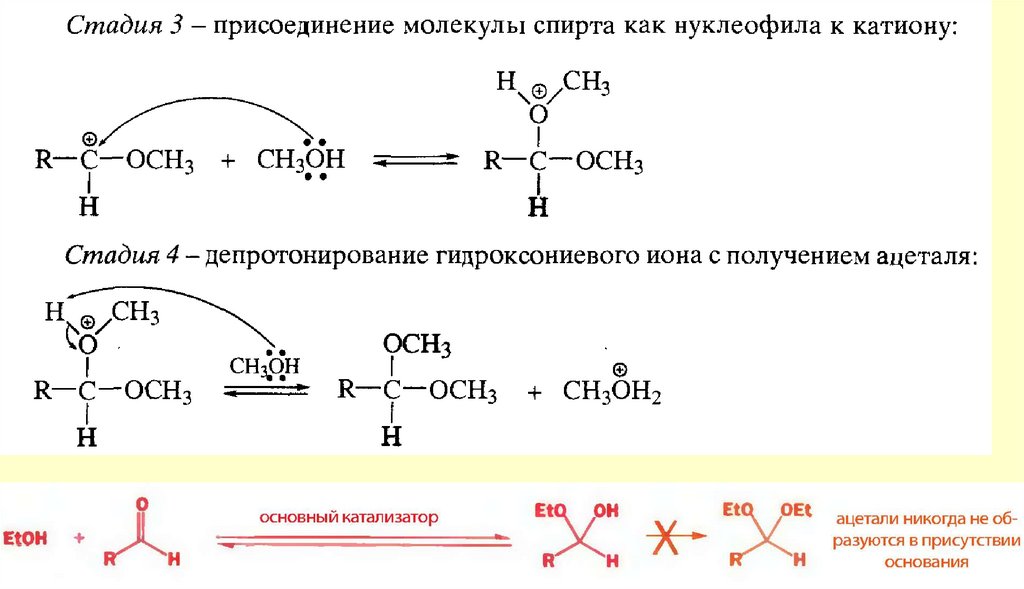
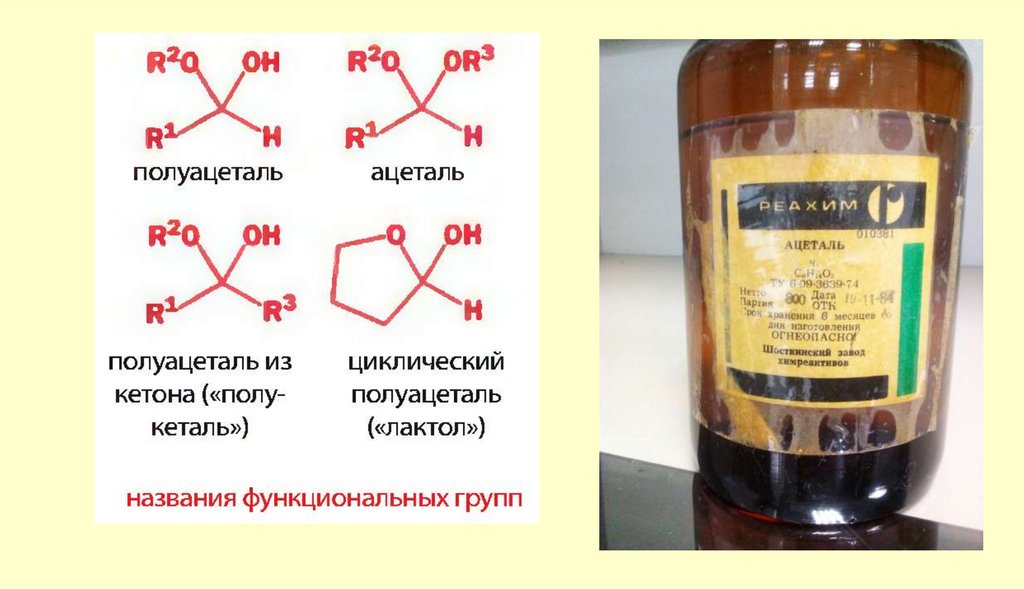
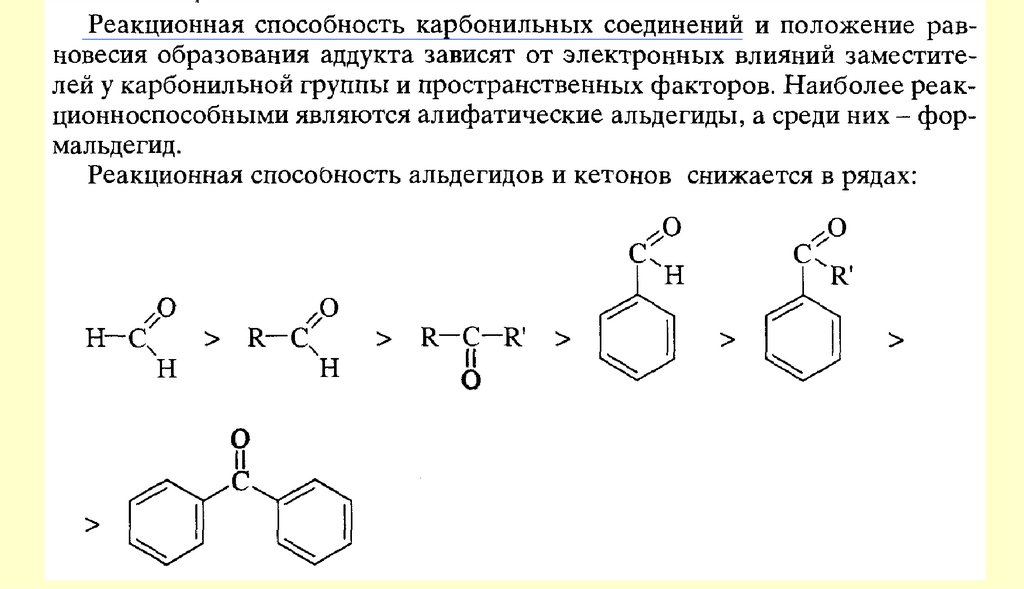
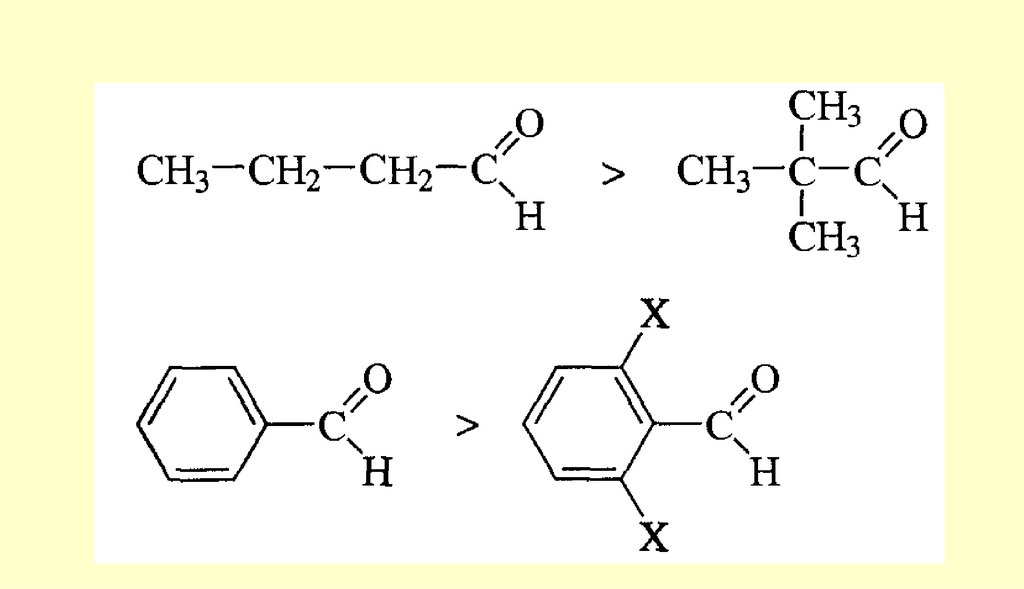
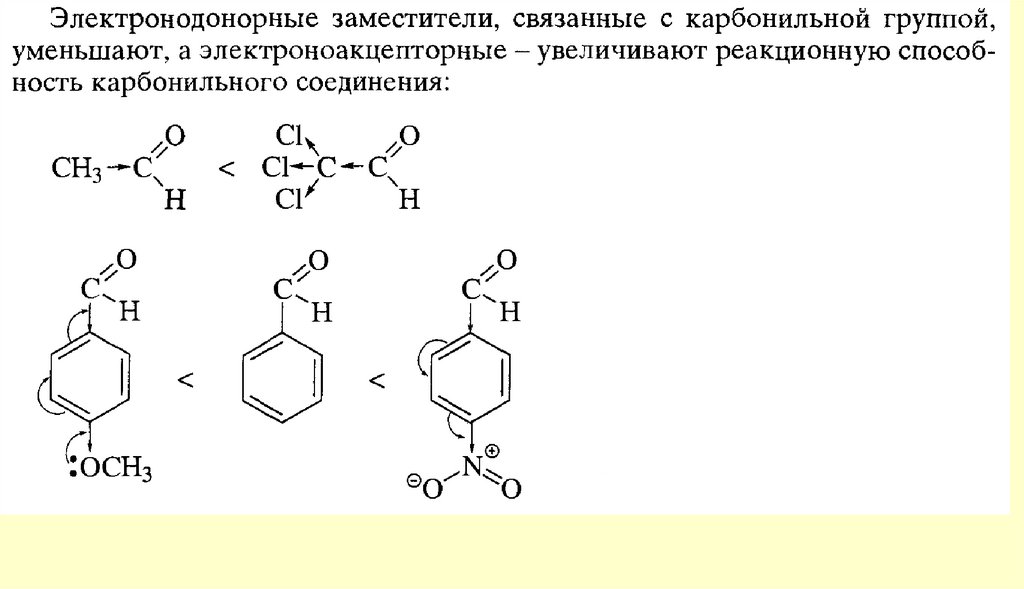
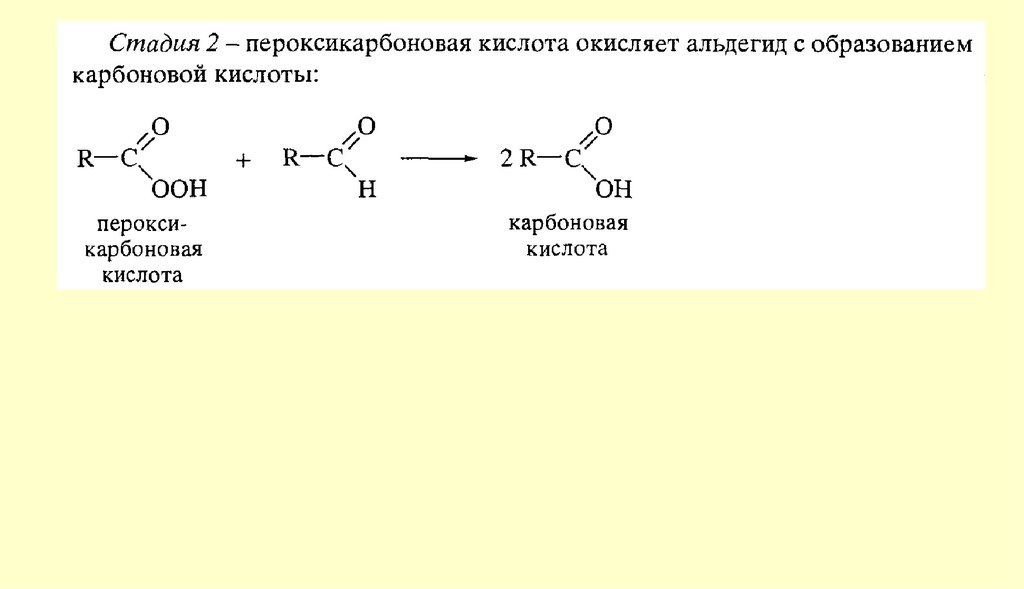
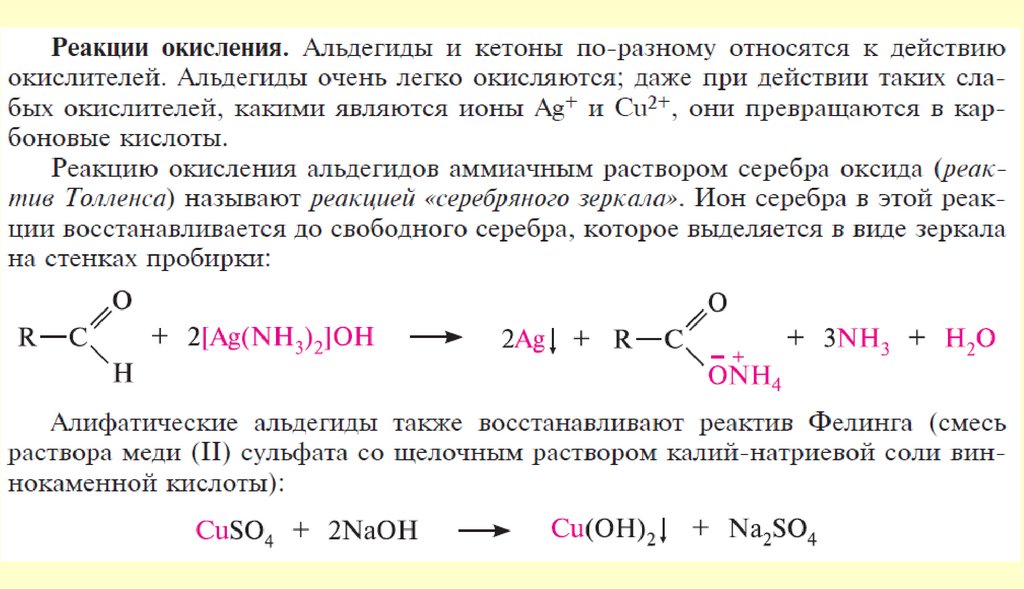
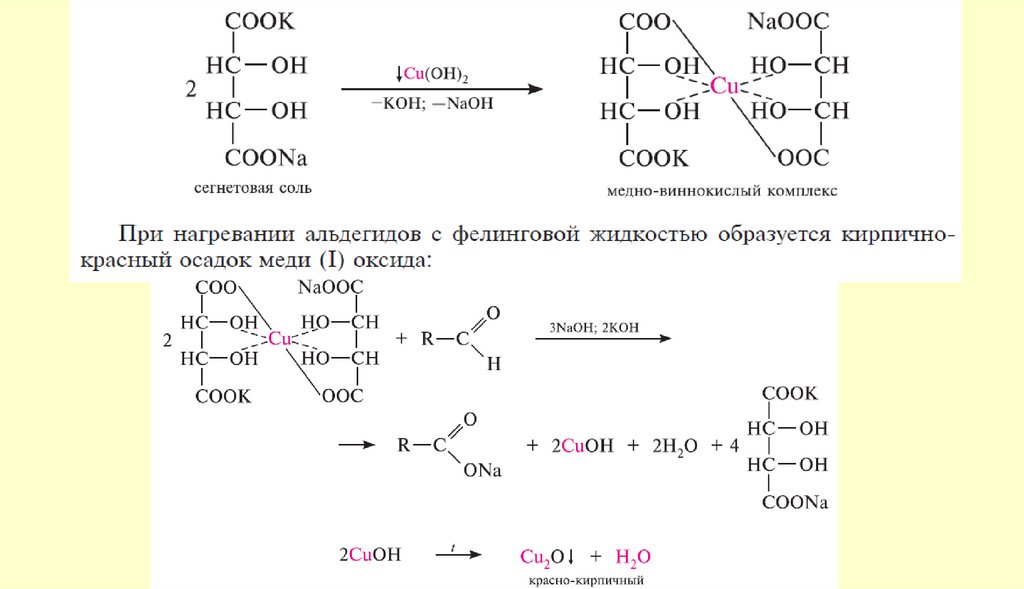
24. Химические свойства
СТРОЕНИЕ КАРБОНИЛЬНОЙ ГРУППЫплоская
форма
Полярность карбонильной группы
25. СТРОЕНИЕ КАРБОНИЛЬНОЙ ГРУППЫ
26.
27.
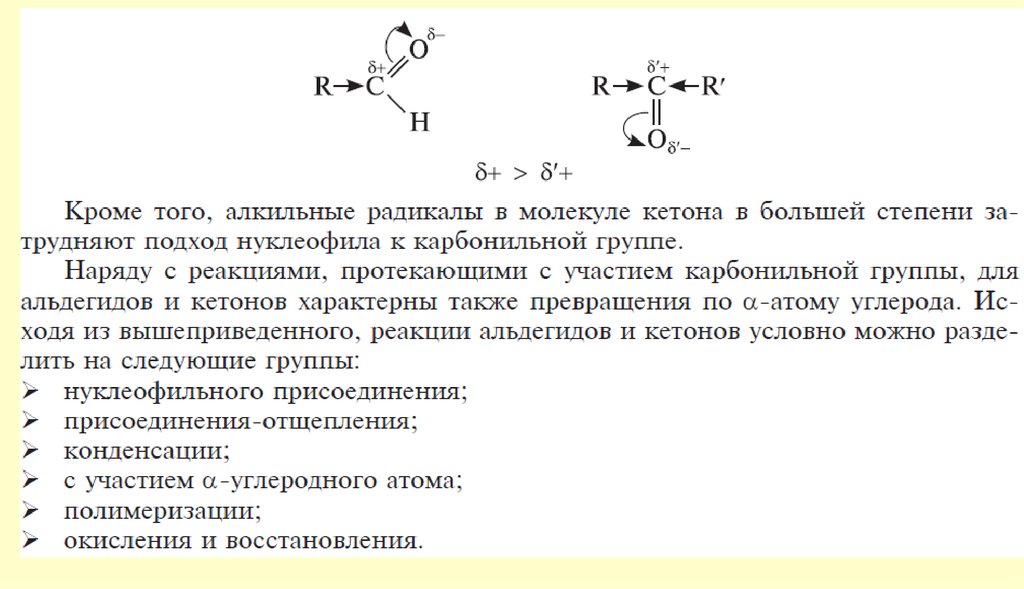
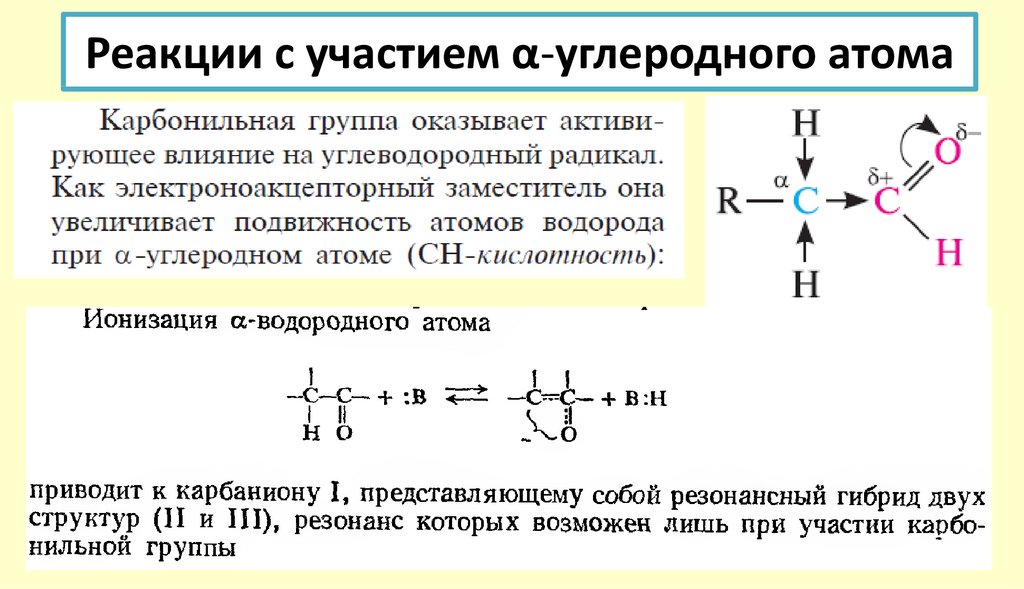
Способность кислорода приобретать и нести отрицательный заряд:.. ‒
:
–С– О
..
в этом состоянии кислород
не проявляет большой
реакционной способности
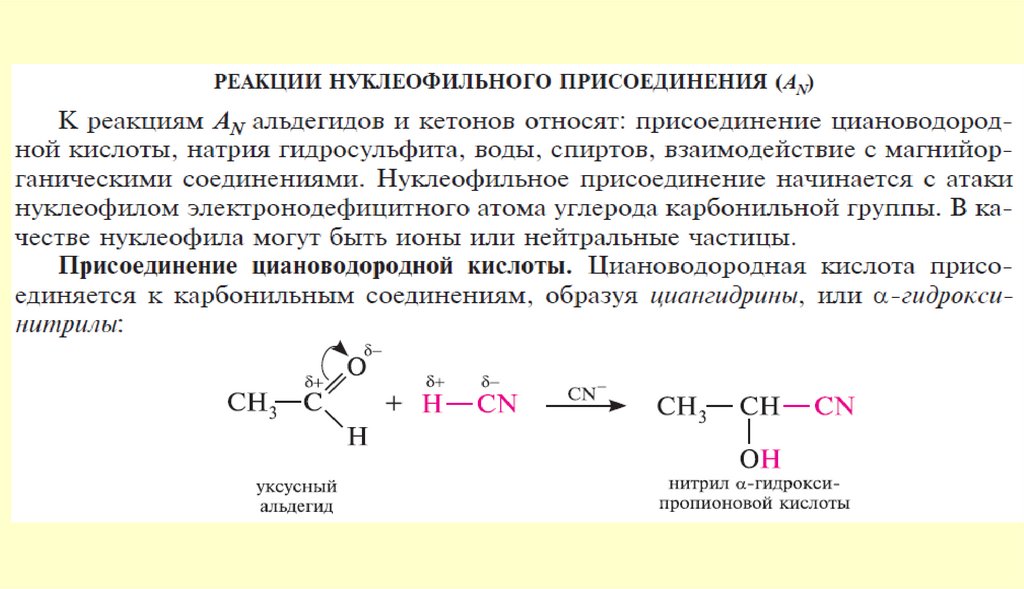
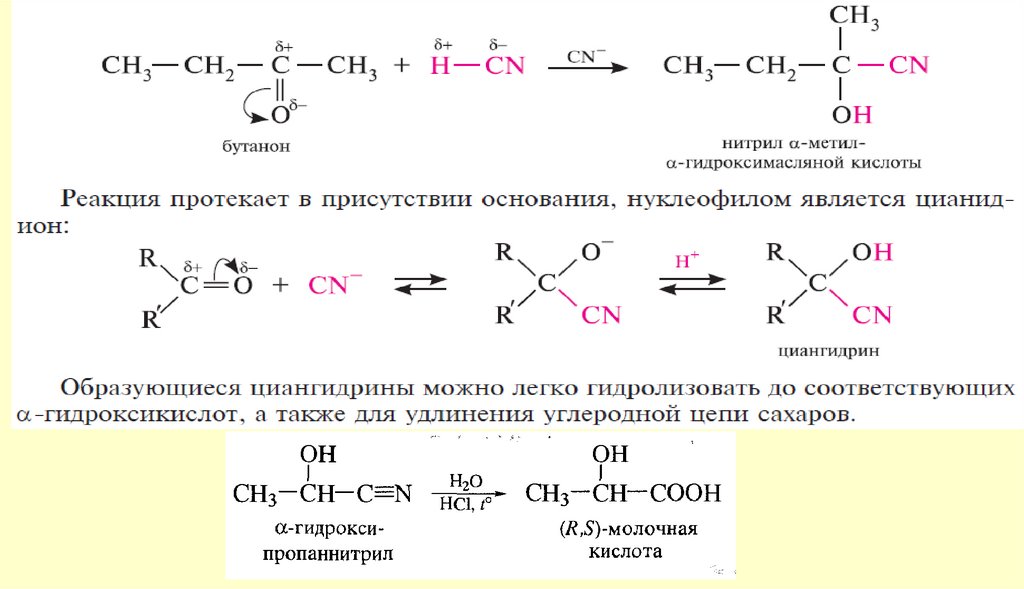
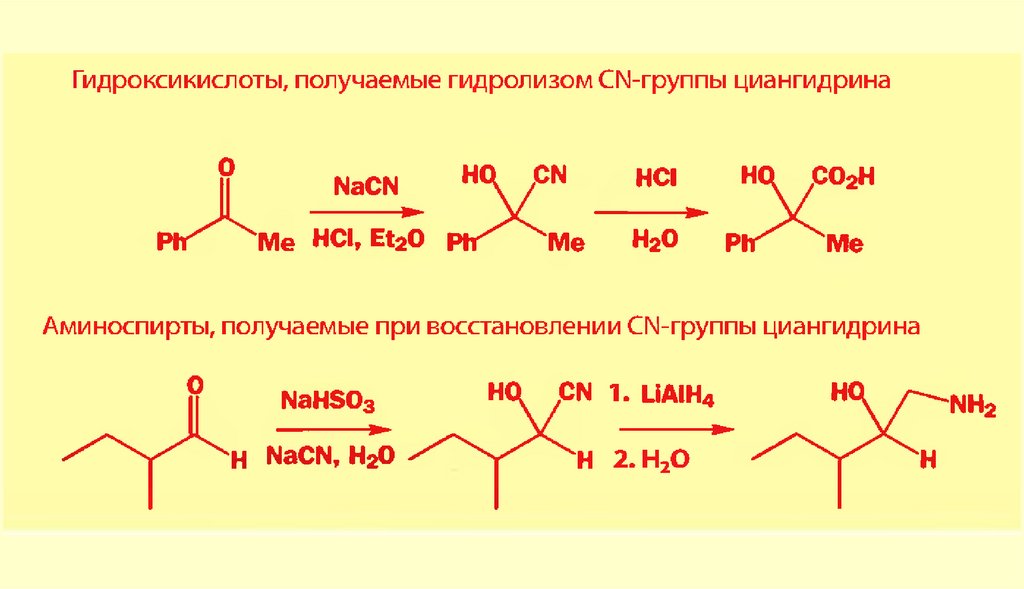
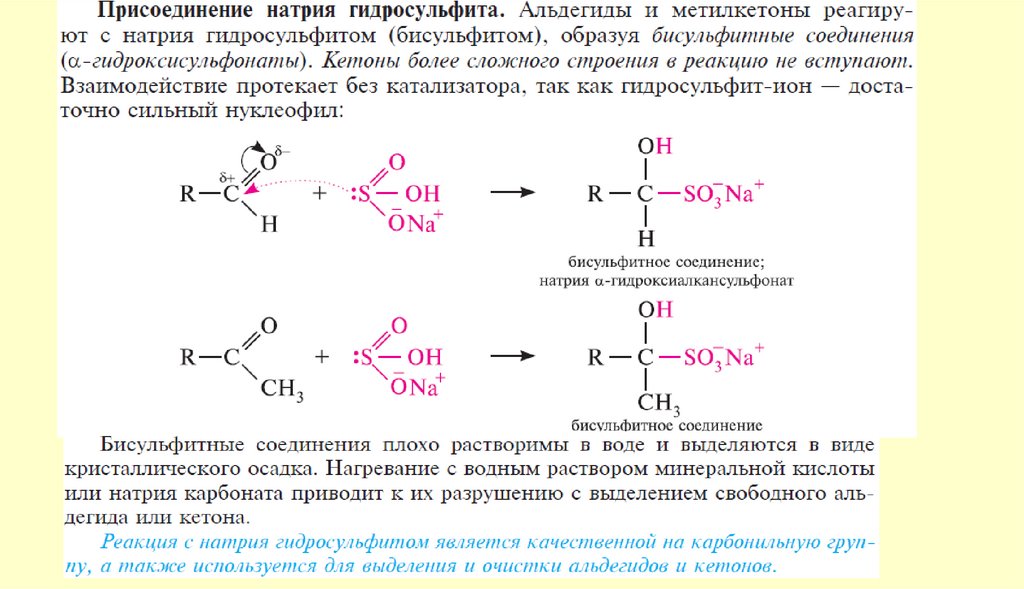
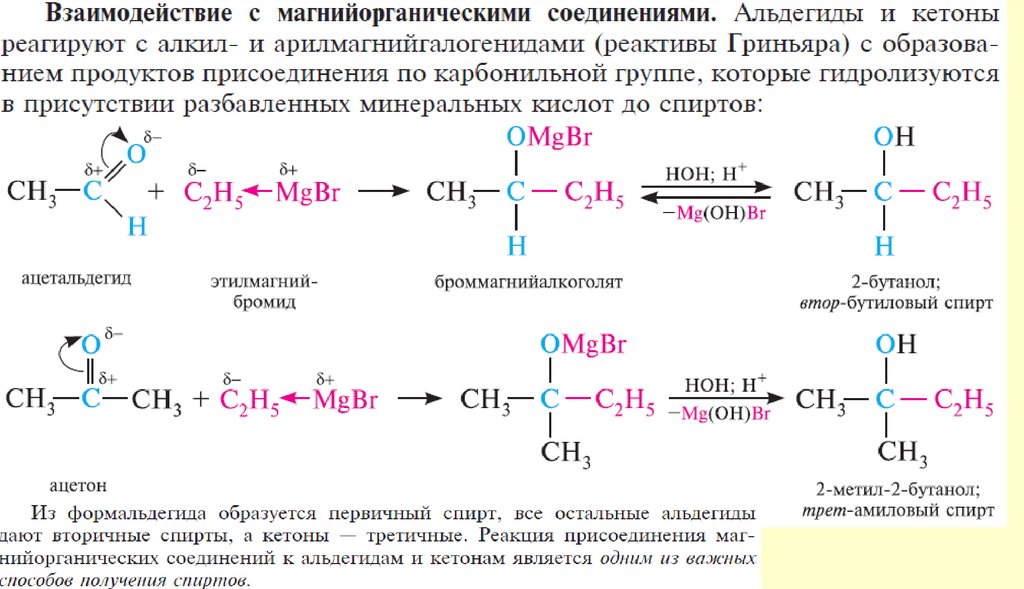
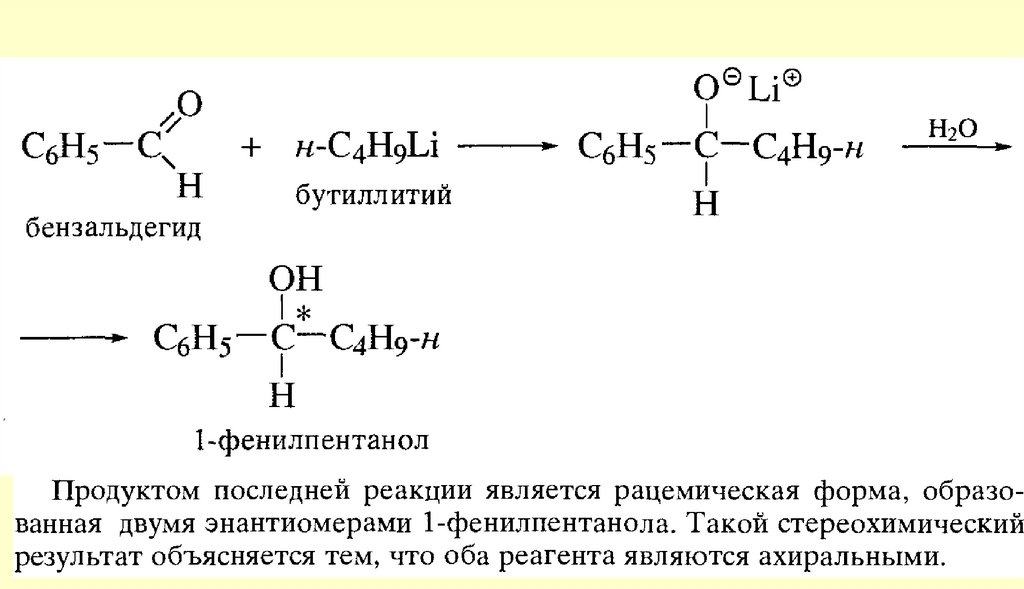
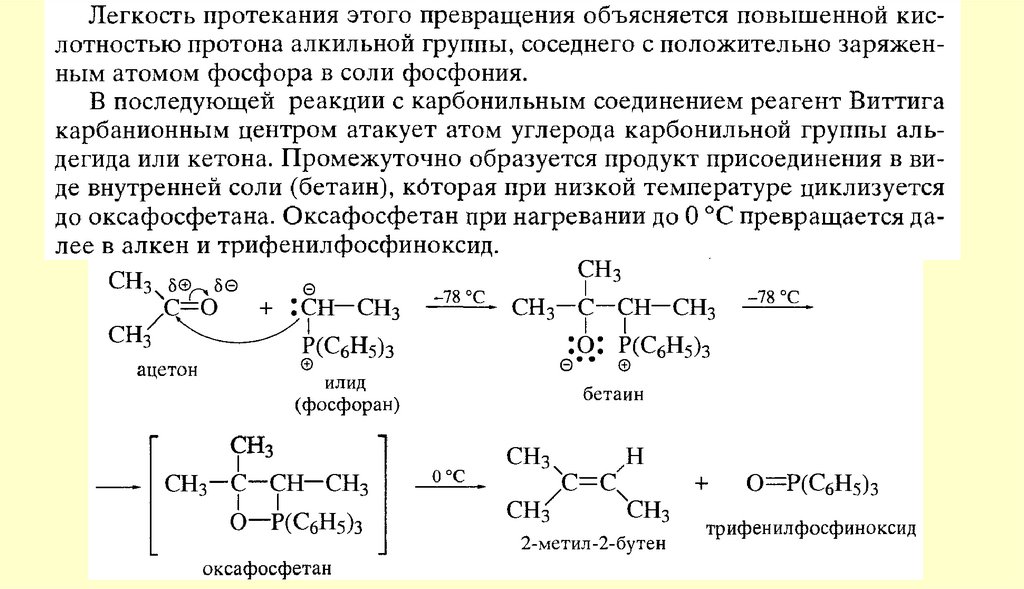
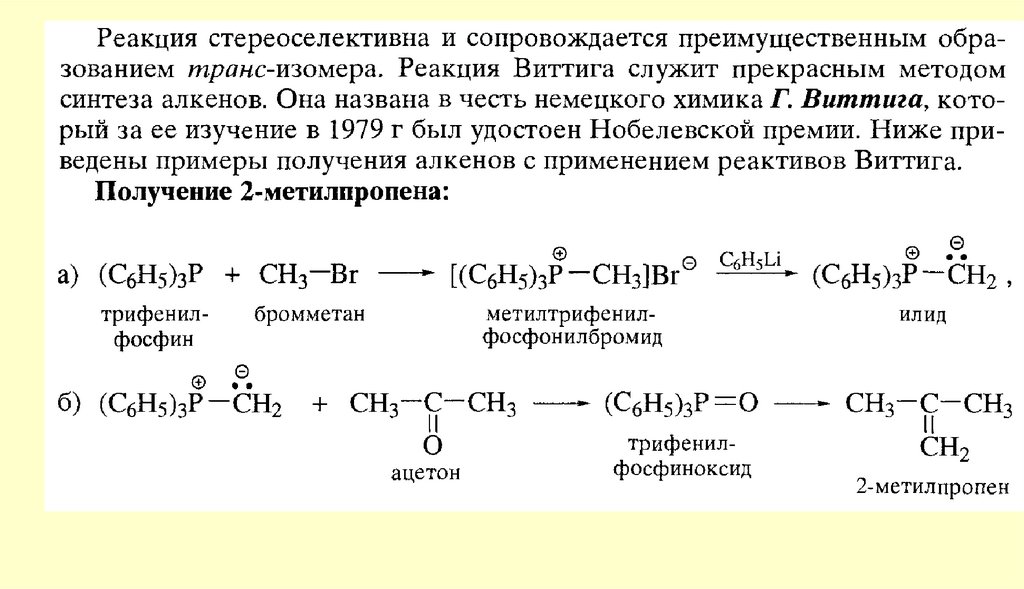
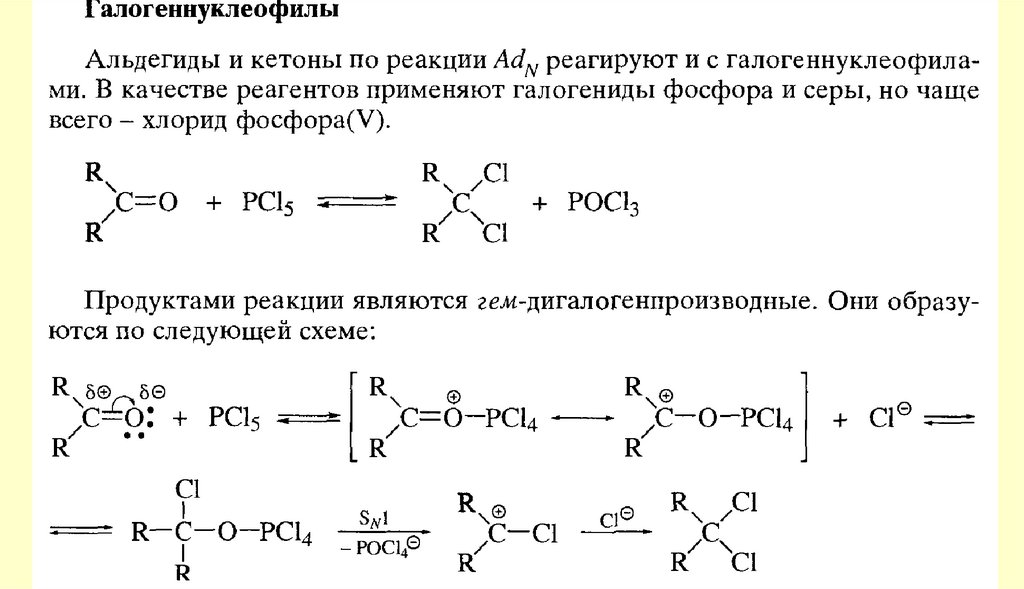
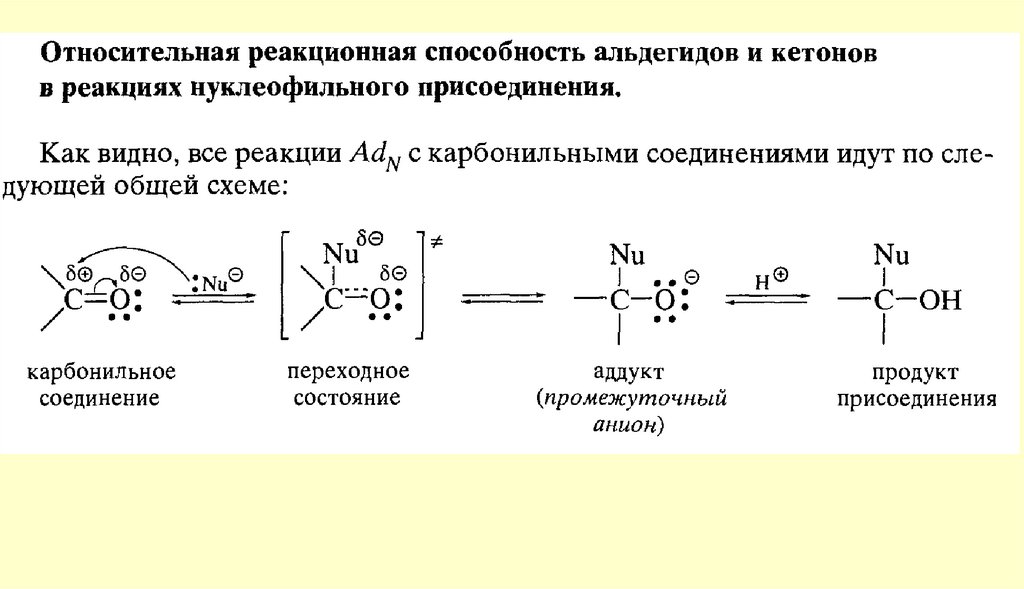
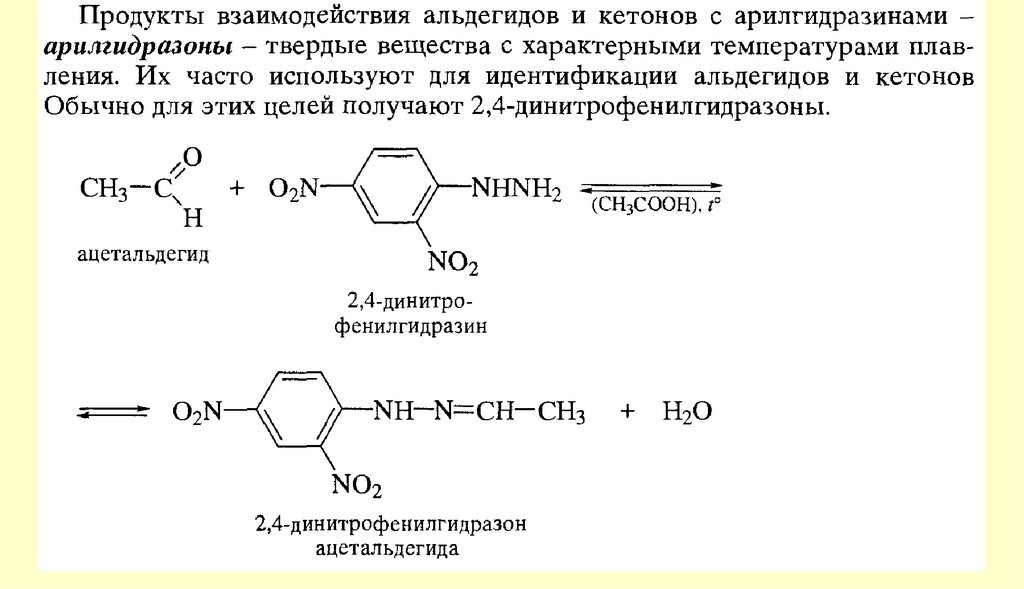
Вывод: типичными реакциями альдегидов и кетонов будут реакции
нуклеофильного присоединения.
28.
29.
30.
31.
32.
33.
34.
35.
36.
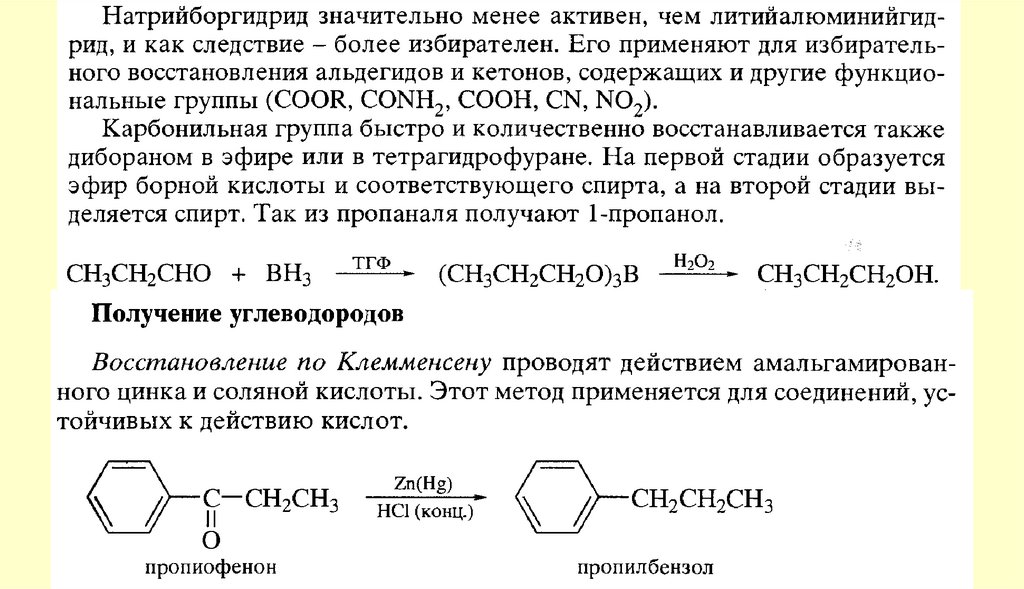
37.
38.
39.
40.
41.
42.
43.
44.
45.
46.
47.
48.
49.
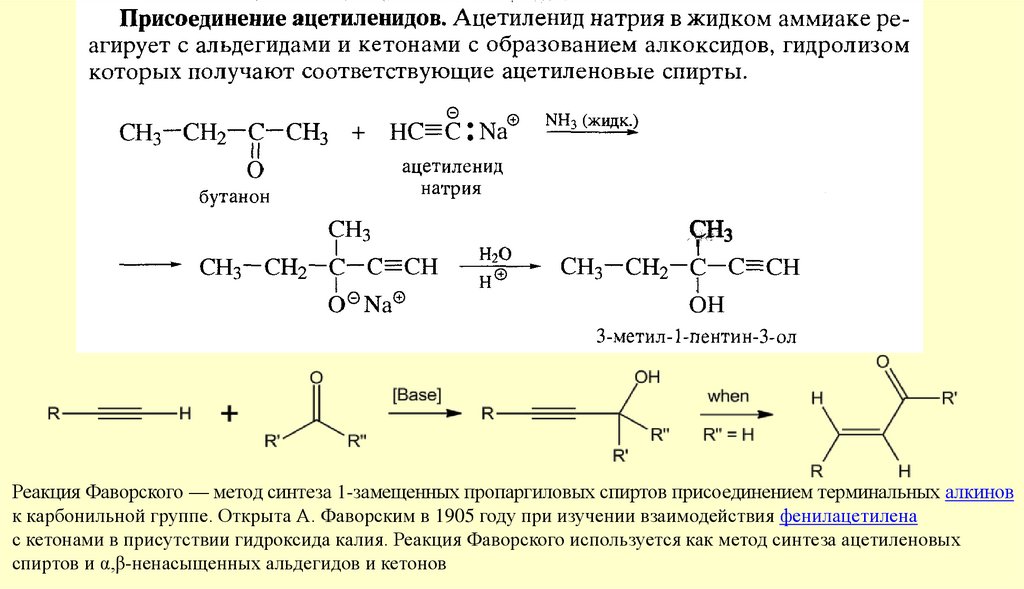
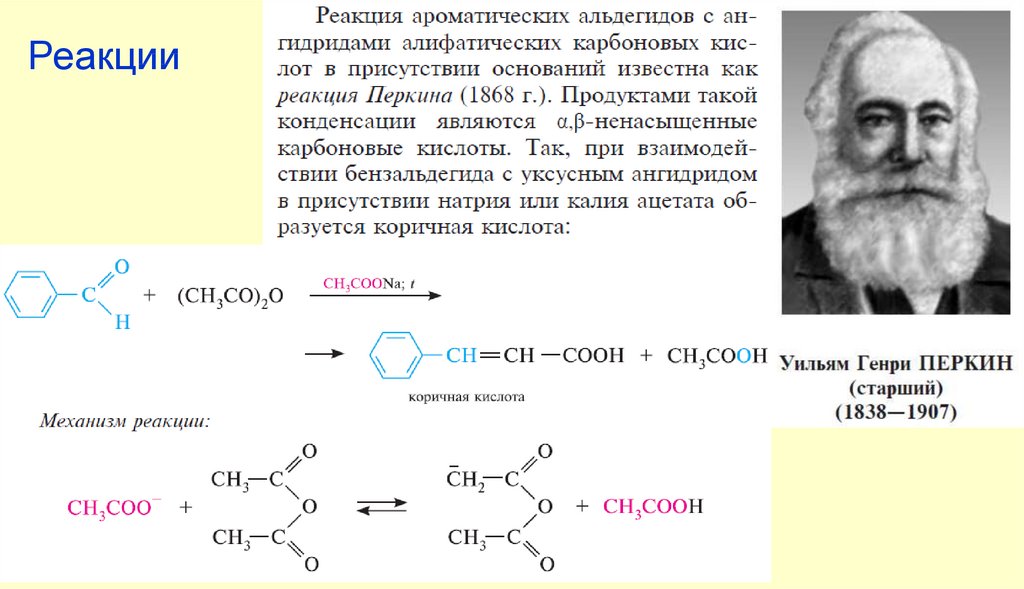
Реакция Фаворского — метод синтеза 1-замещенных пропаргиловых спиртов присоединением терминальных алкиновк карбонильной группе. Открыта А. Фаворским в 1905 году при изучении взаимодействия фенилацетилена
с кетонами в присутствии гидроксида калия. Реакция Фаворского используется как метод синтеза ацетиленовых
спиртов и α,β-ненасыщенных альдегидов и кетонов
50.
51.
52.
53.
54.
55.
56.
57.
58.
59.
60.
61.
62.
63.
64.
65.
66.
67.
68.
69.
70.
71.
72.
73.
74.
75.
76.
77.
78.
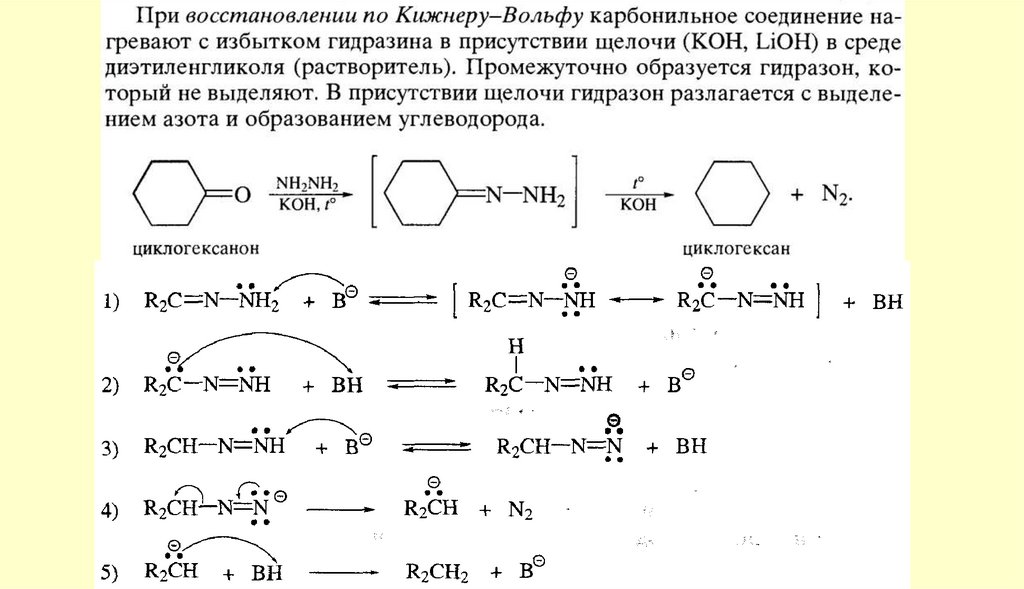
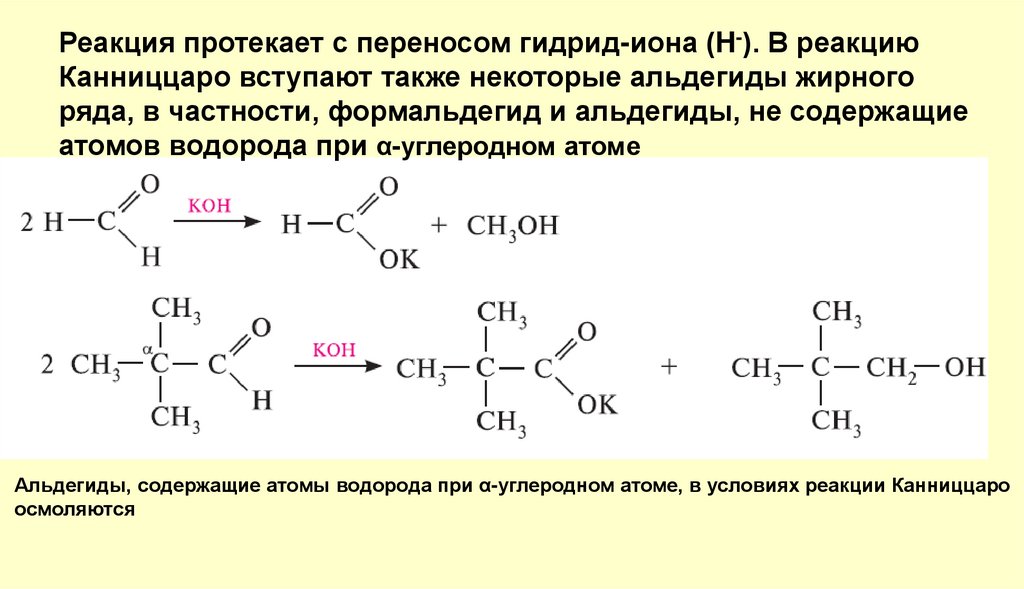
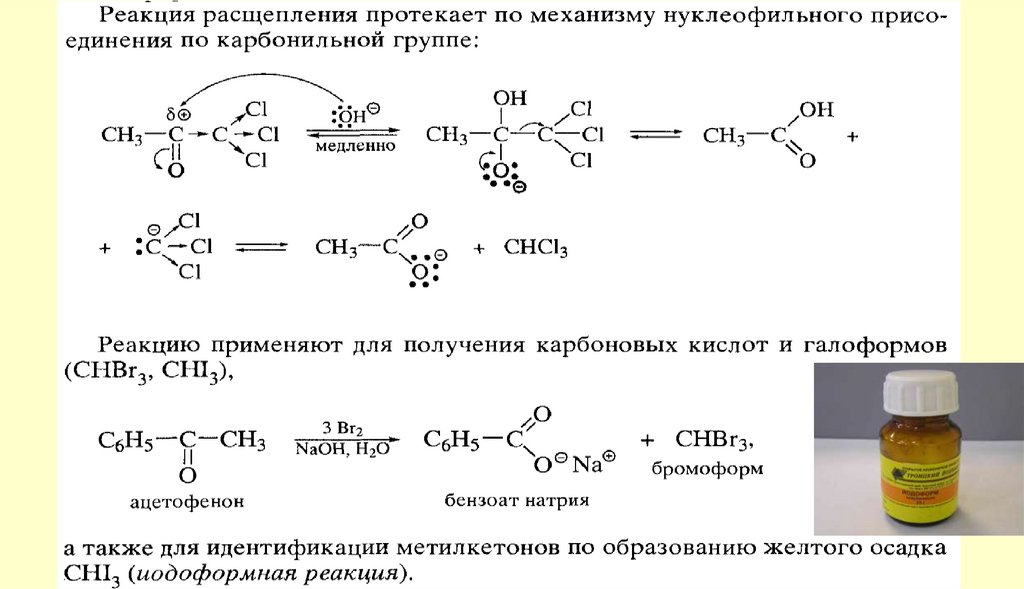
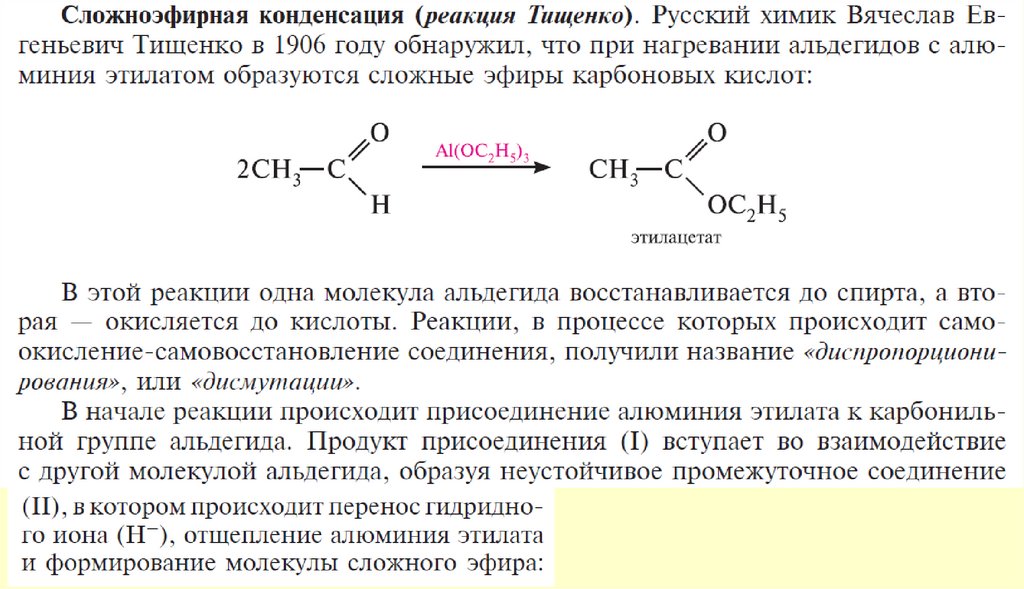
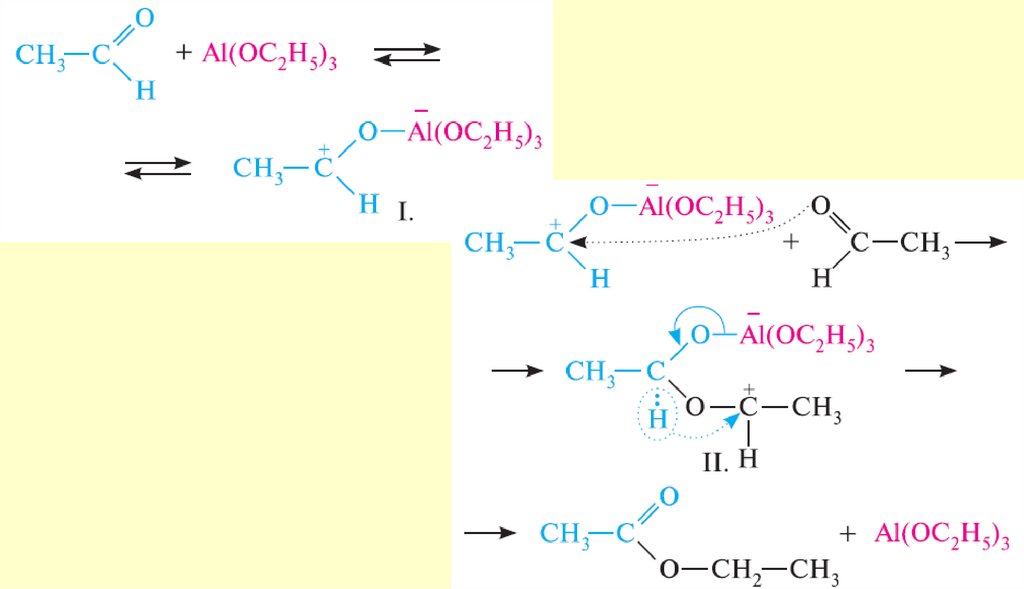
Реакция протекает с переносом гидрид-иона (H-). В реакциюКанниццаро вступают также некоторые альдегиды жирного
ряда, в частности, формальдегид и альдегиды, не содержащие
атомов водорода при α-углеродном атоме
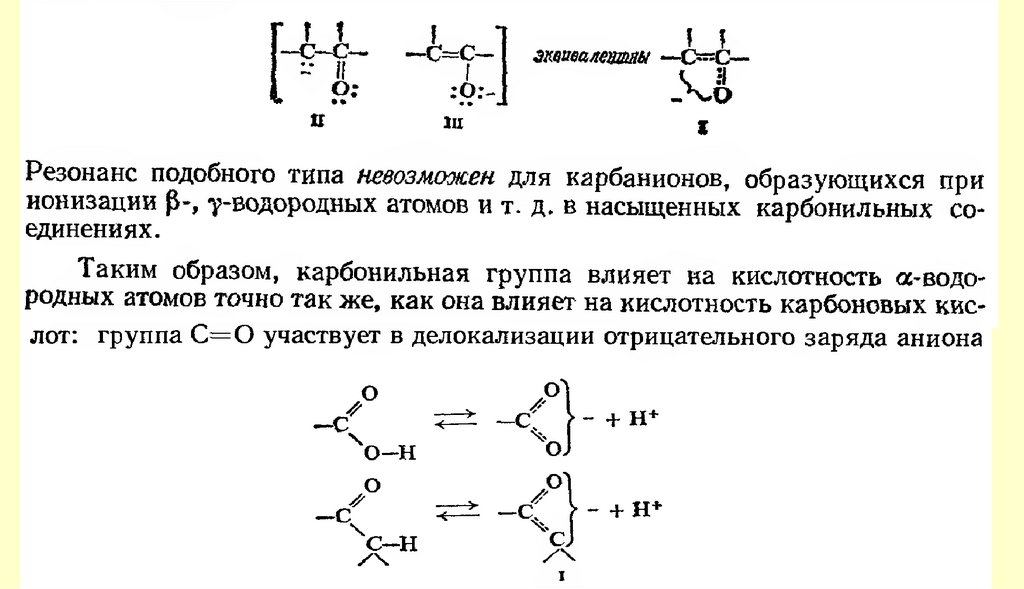
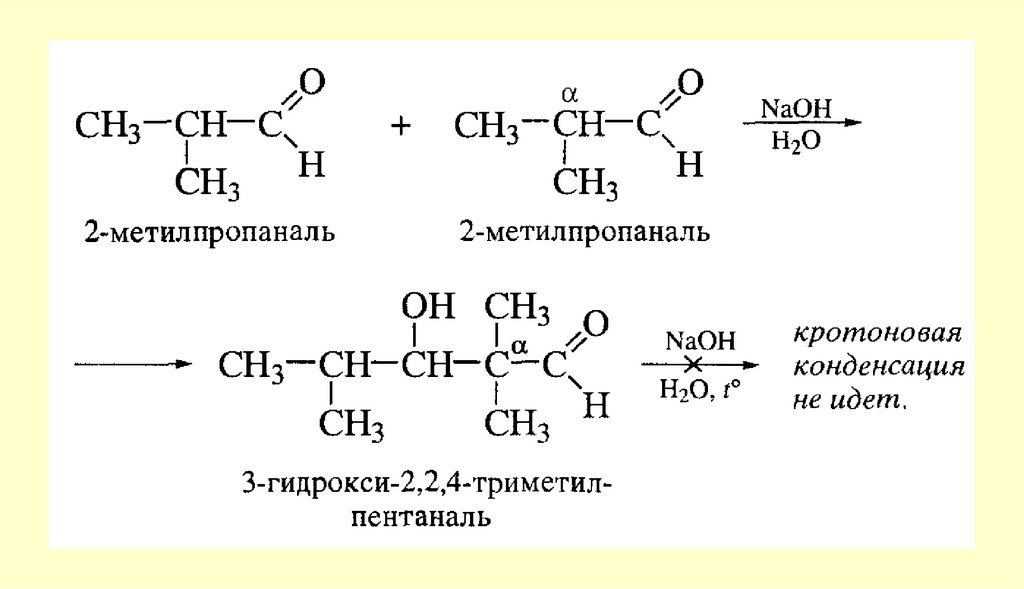
Альдегиды, содержащие атомы водорода при α-углеродном атоме, в условиях реакции Канниццаро
осмоляются
79.
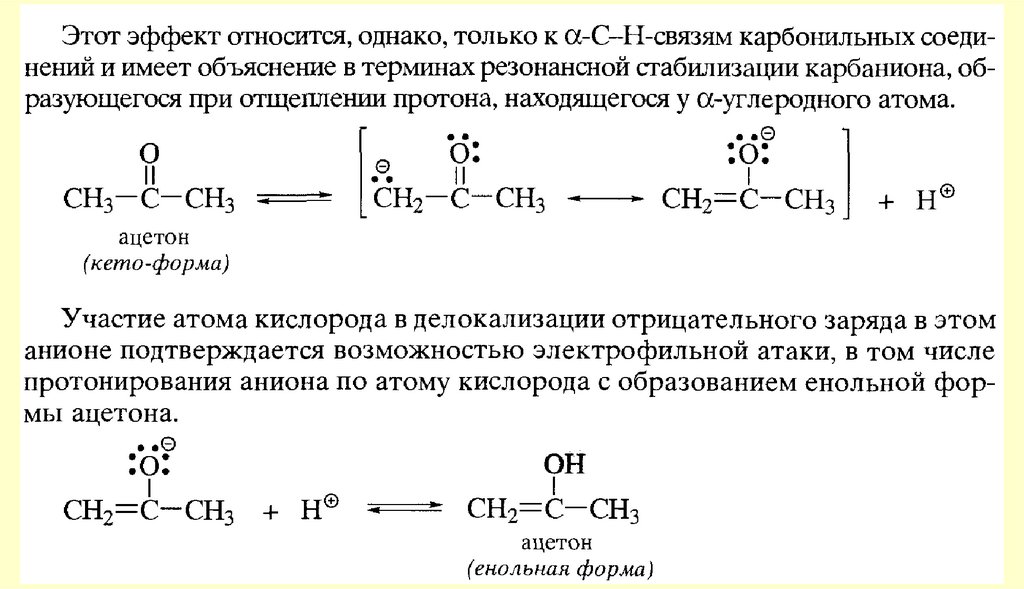
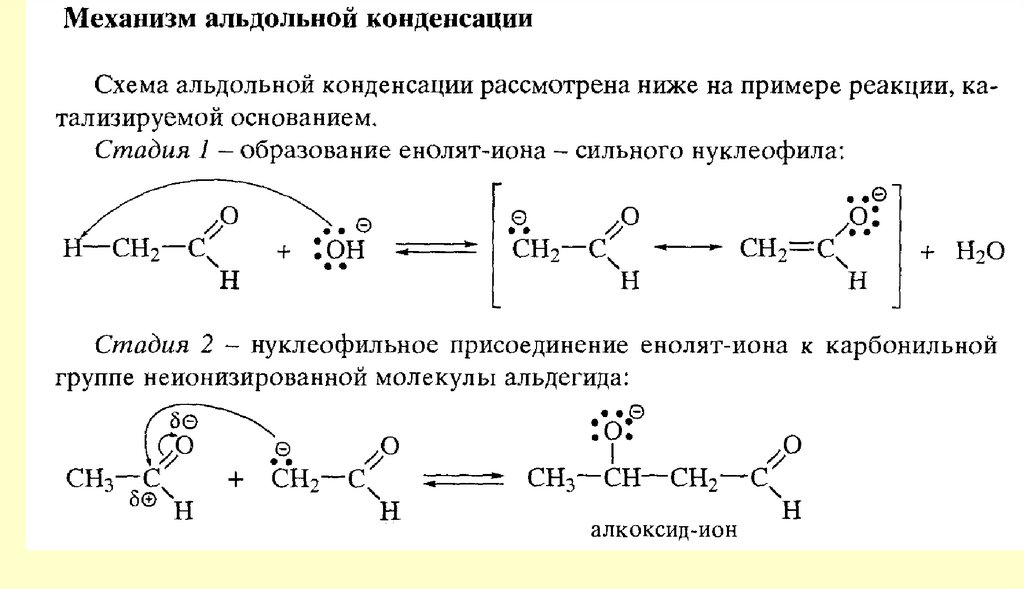
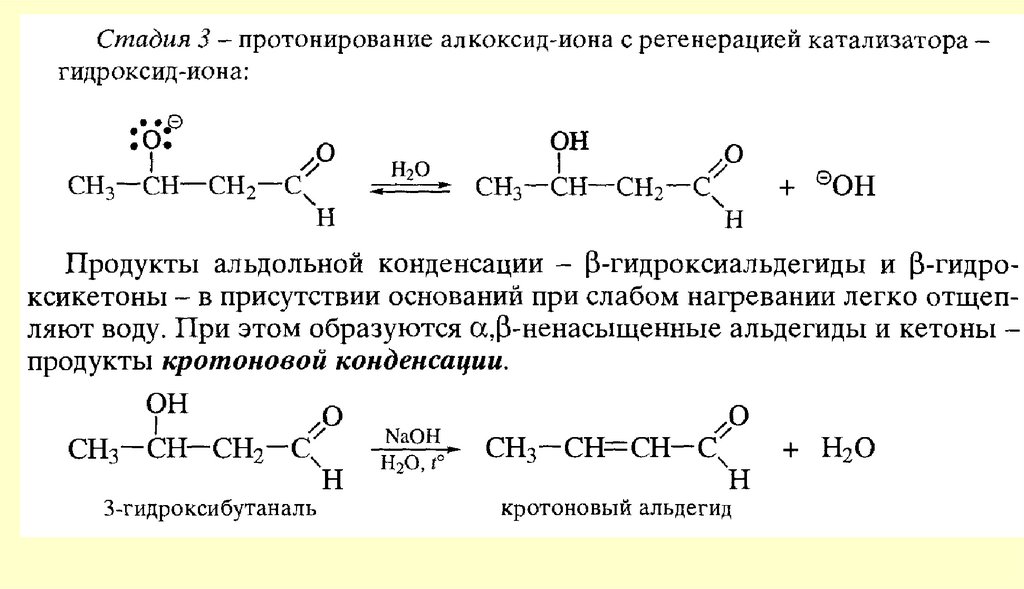
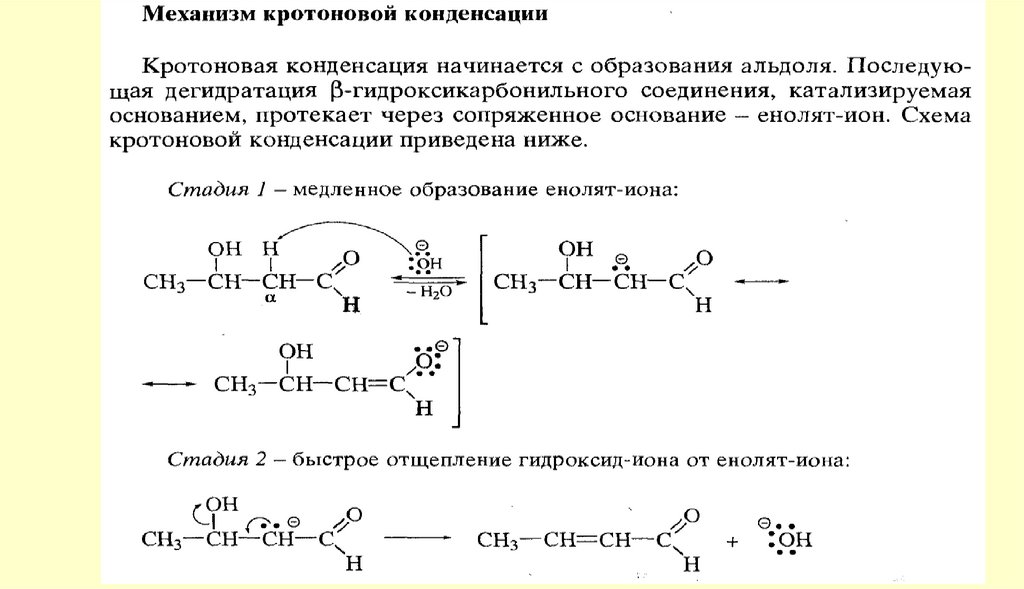
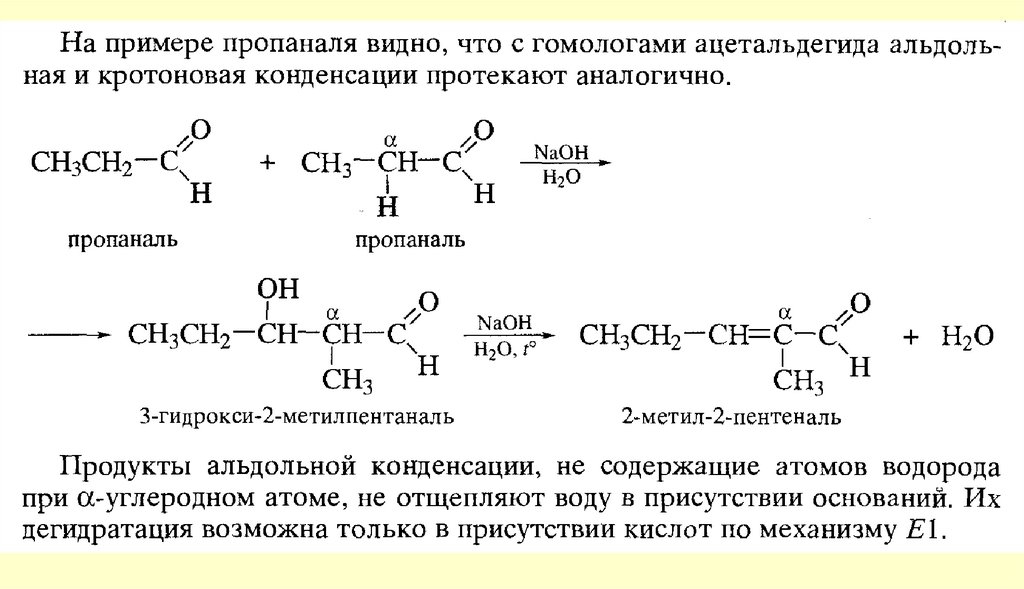
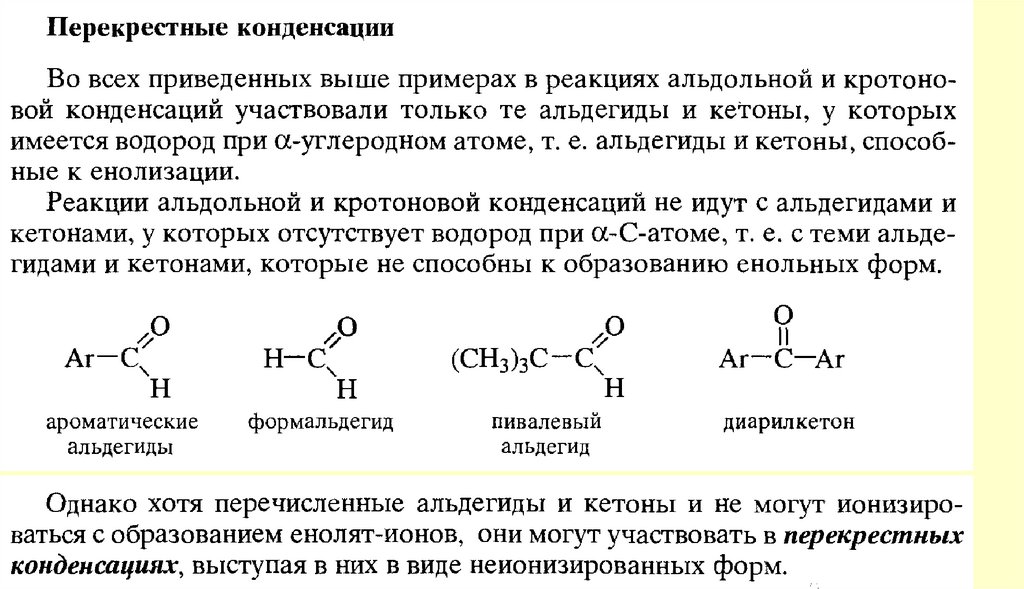
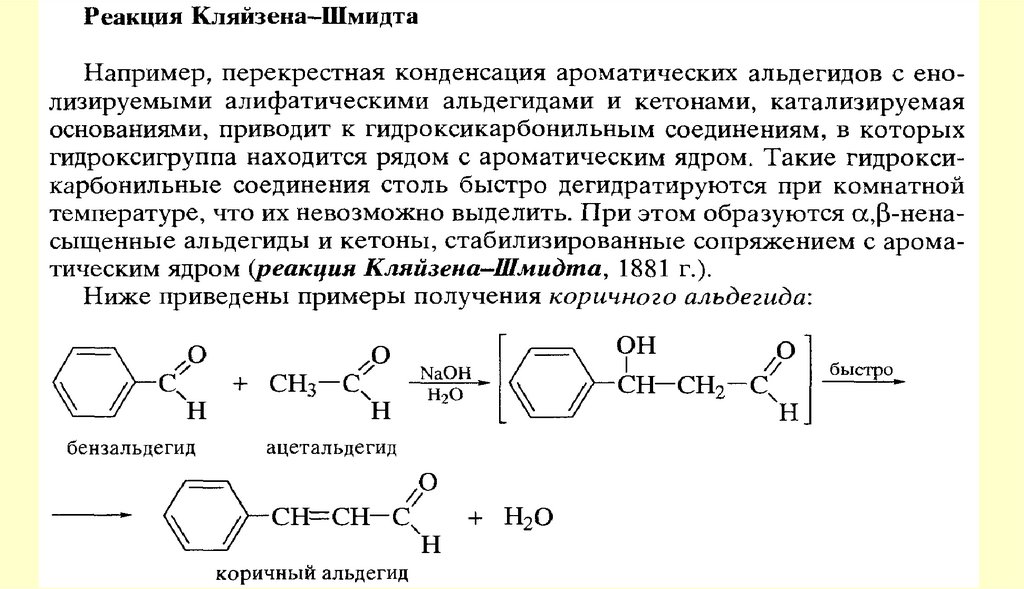
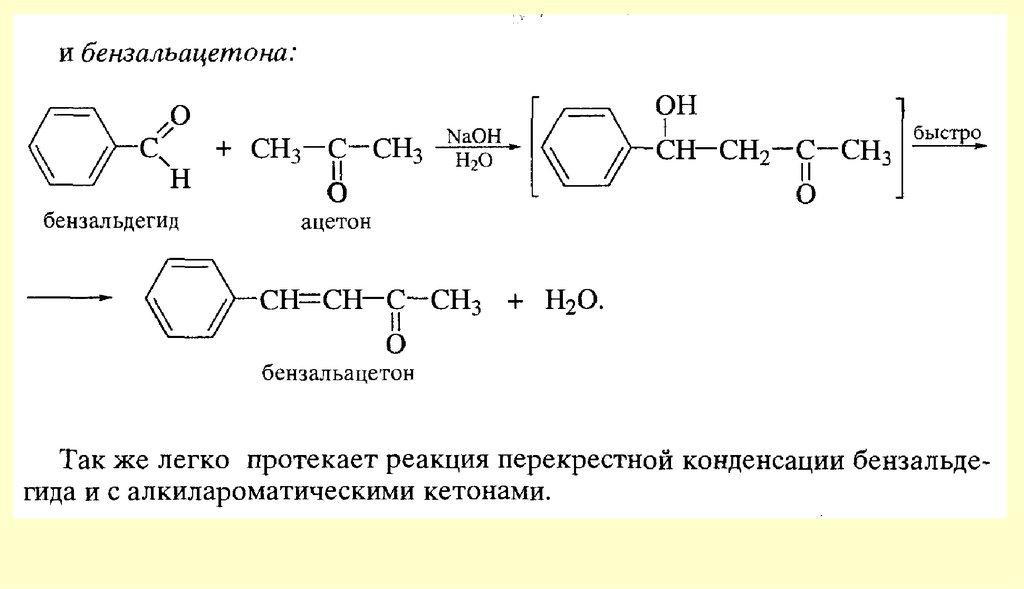
80. Реакции с участием α-углеродного атома
81.
82.
83.
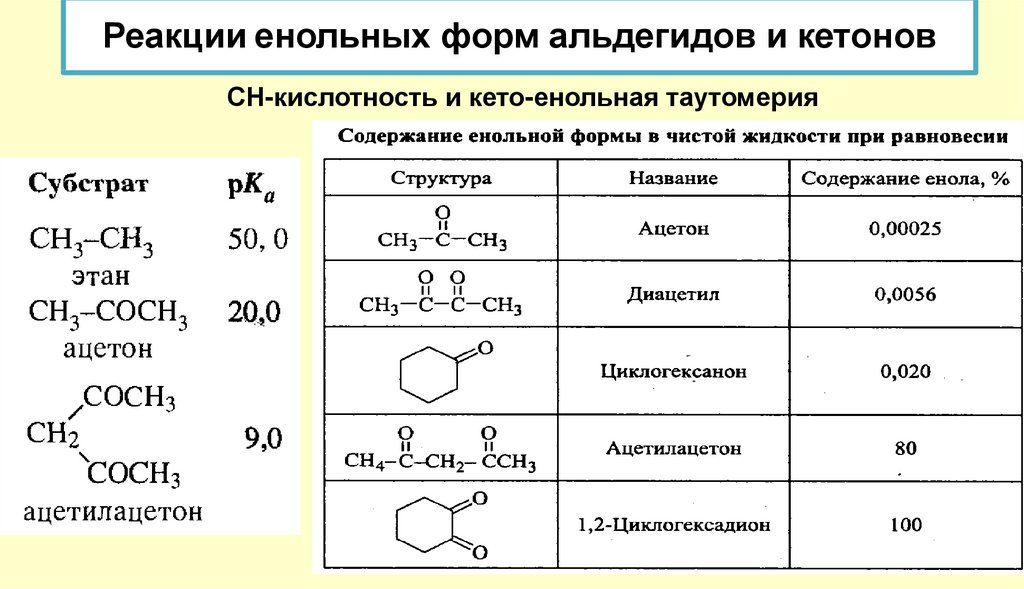
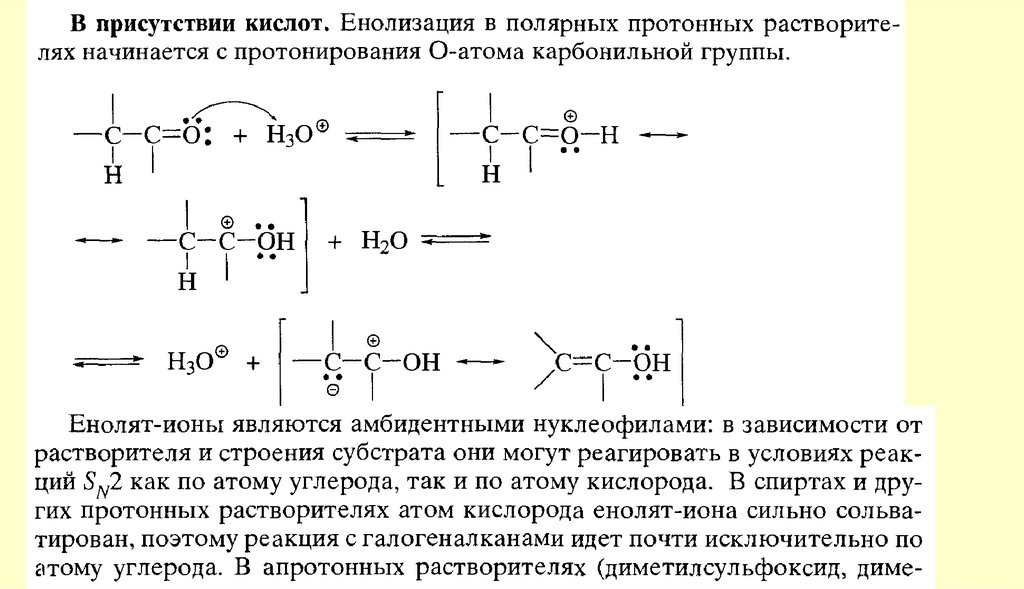
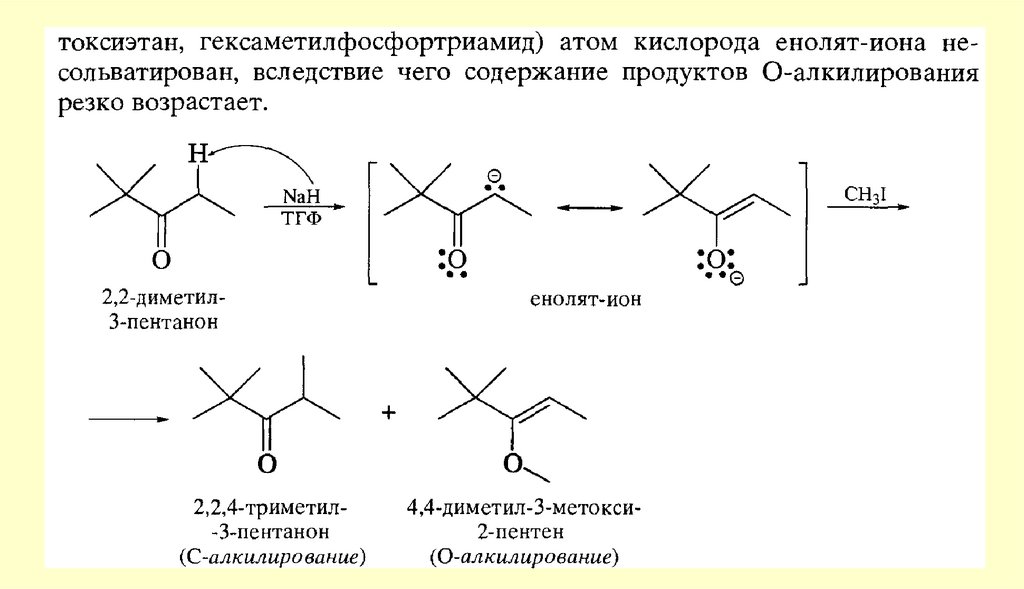
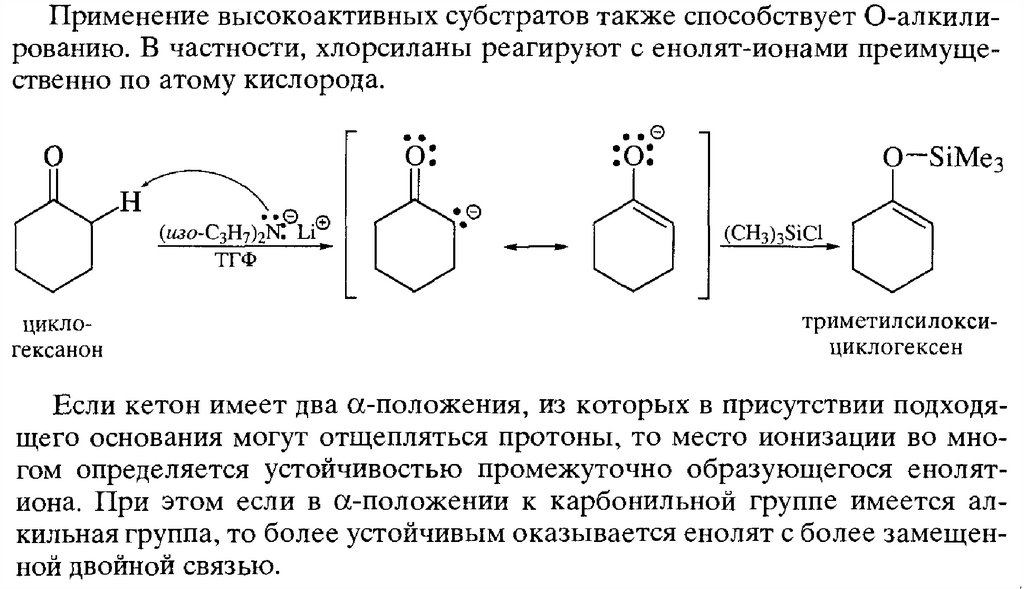
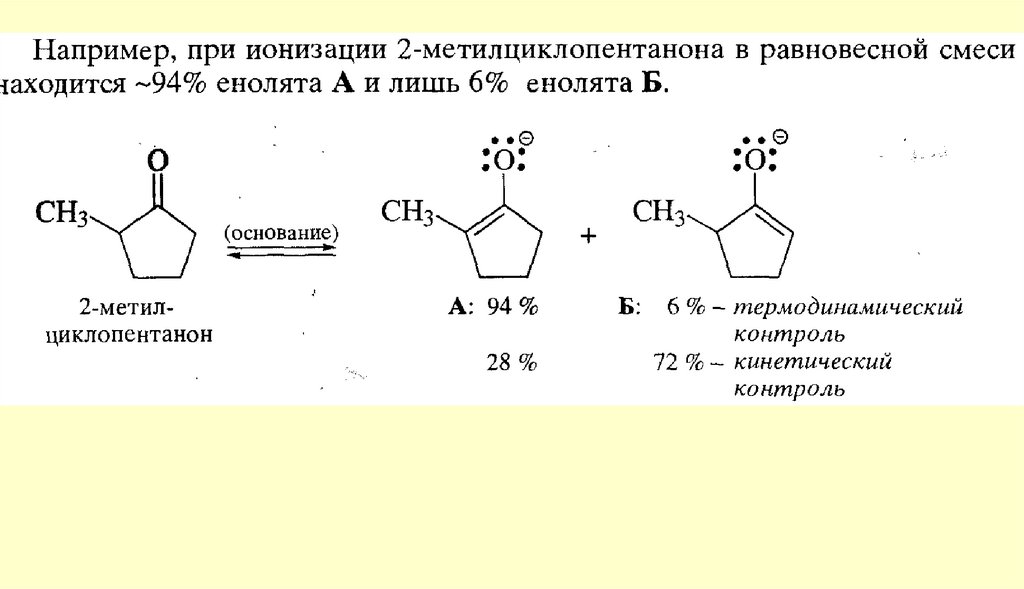
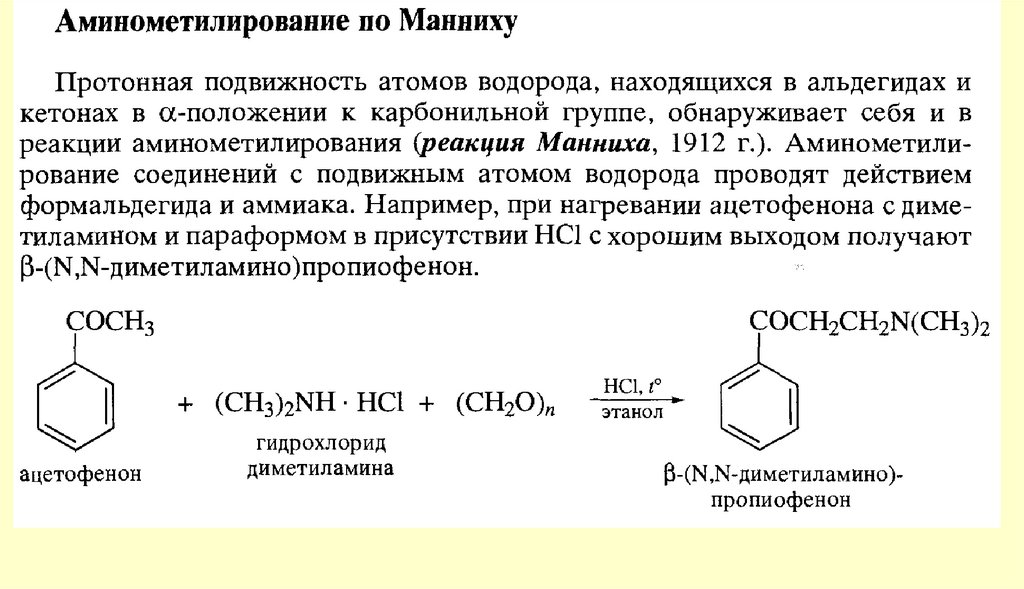
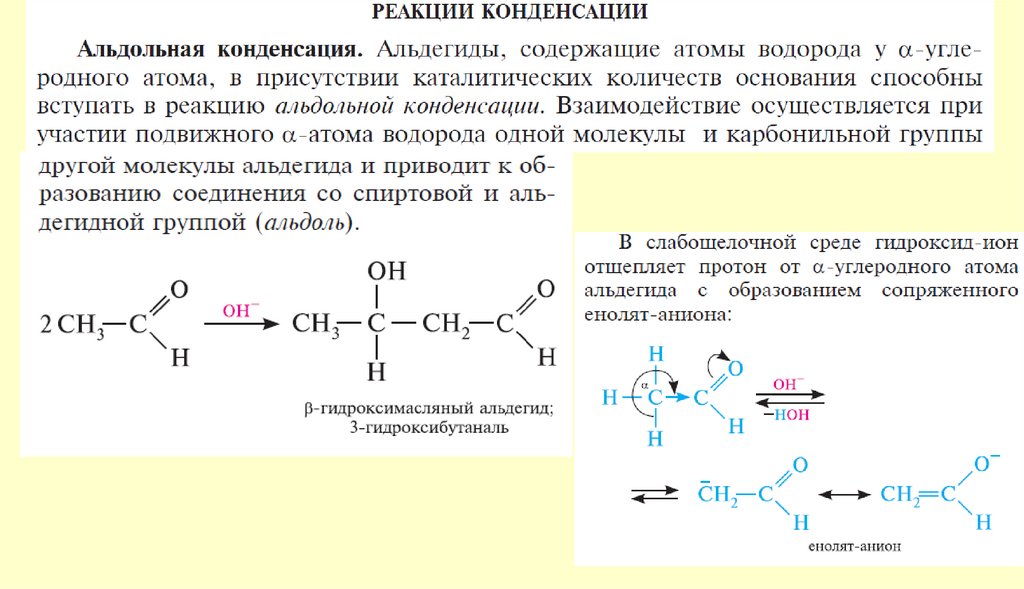
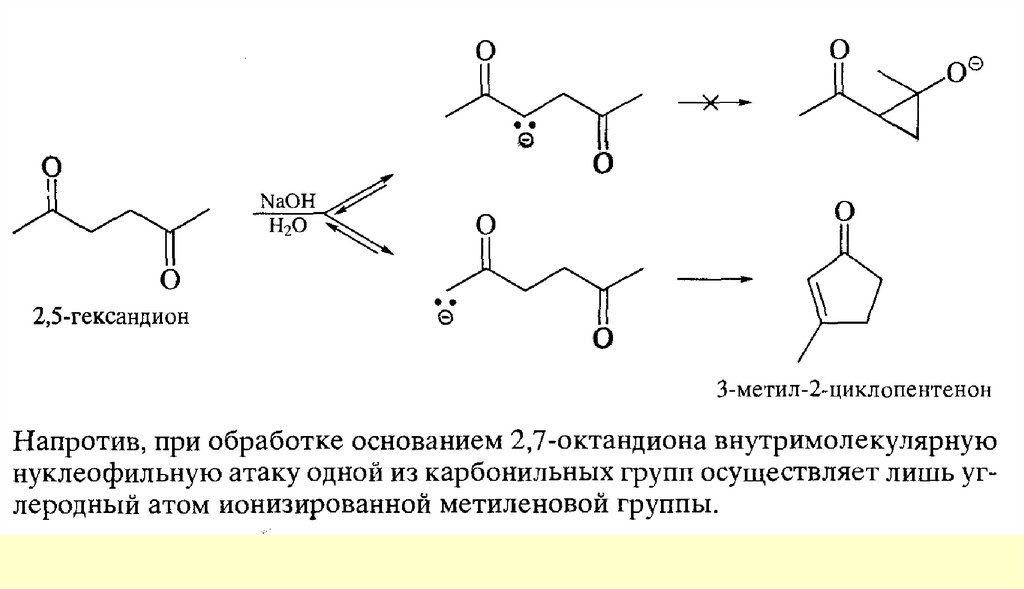
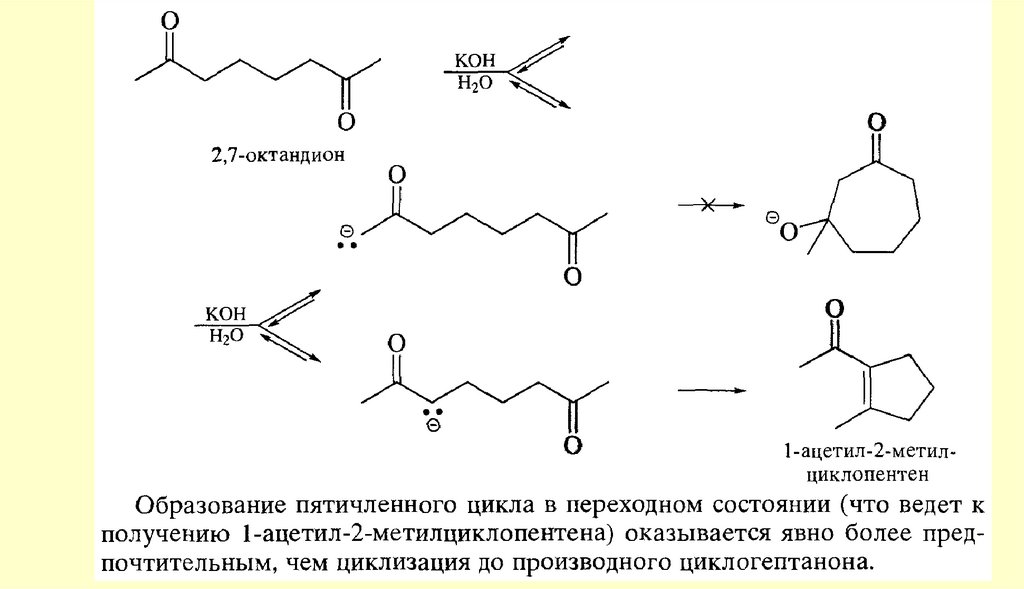
Реакции енольных форм альдегидов и кетоновСН-кислотность и кето-енольная таутомерия
84.
85.
86.
87.
88.
89.
90.
Кроме того, оказалось, что на положение равновесия довольно сильно влияют растворители.Электролитически диссоциирующие растворители благоприятствуют образованию кетонной формы
(«кетизируют»), а неполярные растворители благоприятствуют образованию енольной формы
(«енолизируют»). Это видно из следующих данных о содержании енольной формы ацетоуксусного эфира в
разных растворителях (вычислены по присоединению брома при 18 °С к растворенному ацетоуксусному
эфиру после установления равновесия между обеими формами)
91.
92.
93.
94.
95.
96.
97.
98.
99.
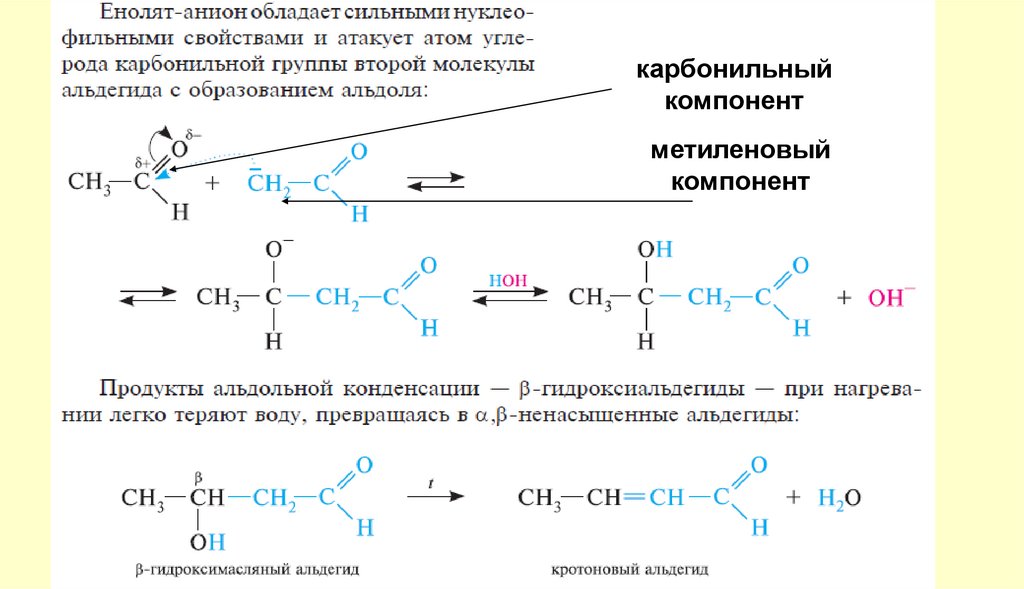
карбонильныйкомпонент
метиленовый
компонент
100.
101.
102.
103.
104.
105.
106.
107.
108.
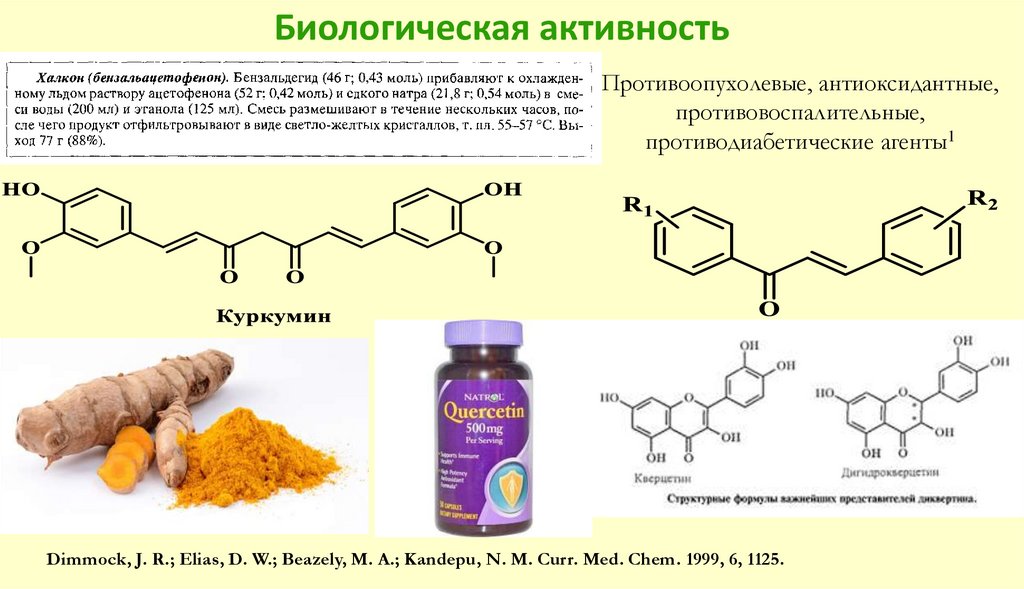
109. Биологическая активность
Противоопухолевые, антиоксидантные,противовоспалительные,
противодиабетические агенты1
Dimmock, J. R.; Elias, D. W.; Beazely, M. A.; Kandepu, N. M. Curr. Med. Chem. 1999, 6, 1125.
110.
111.
112.
113.
114.
115.
116.
117.
118.
119.
120.
121.
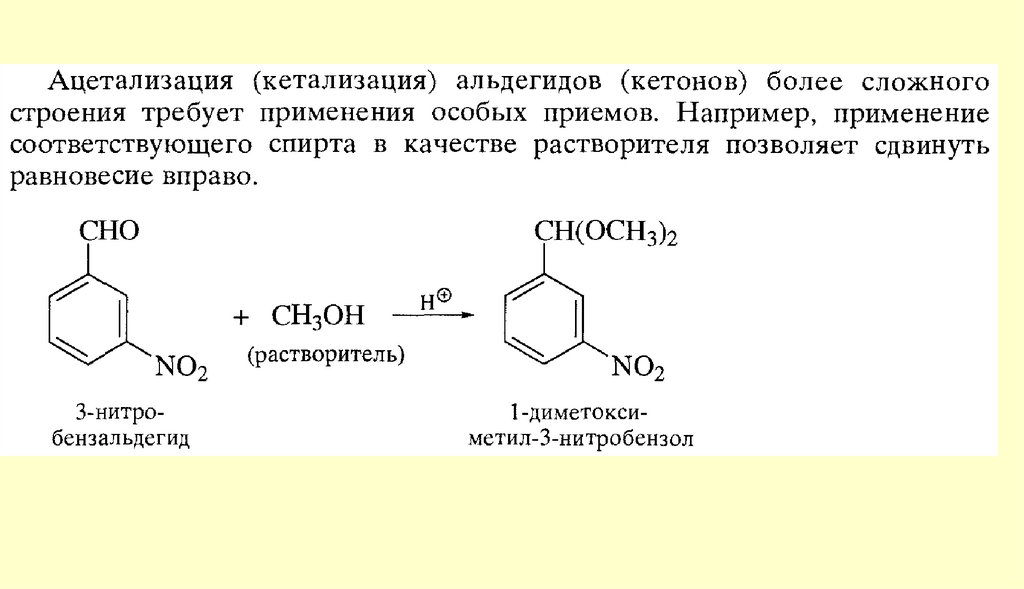
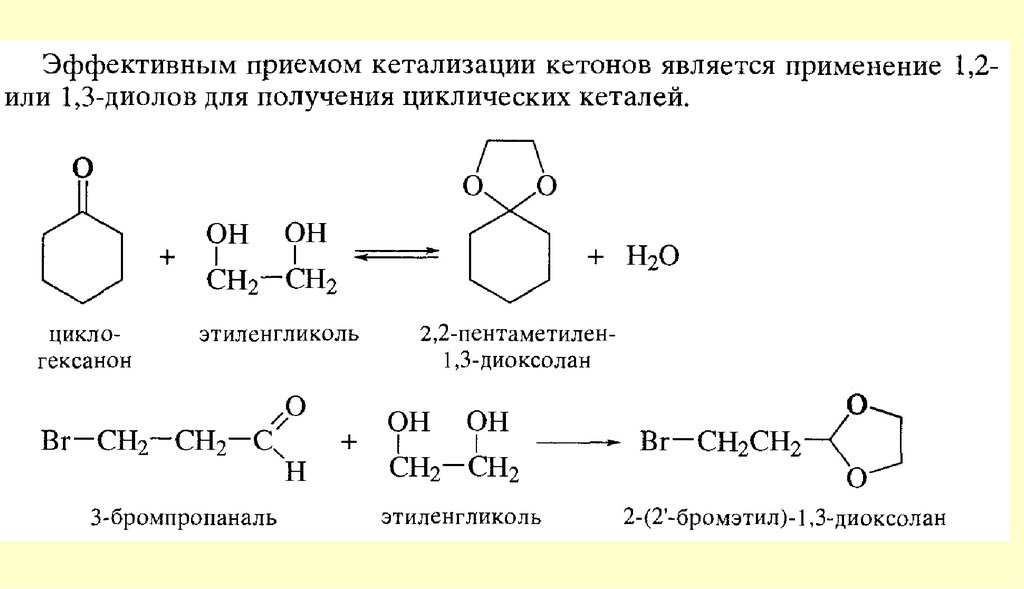
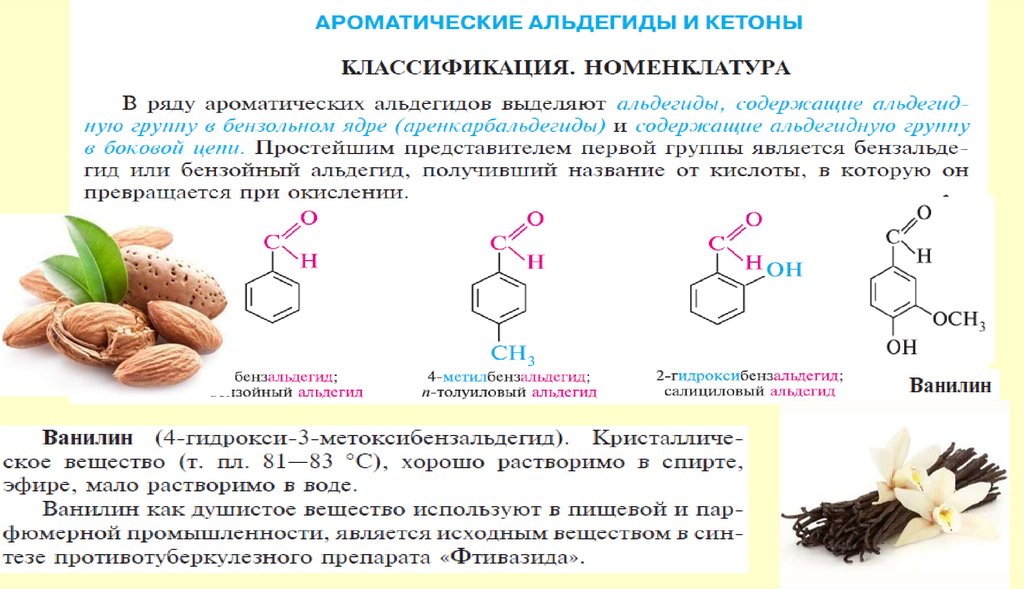
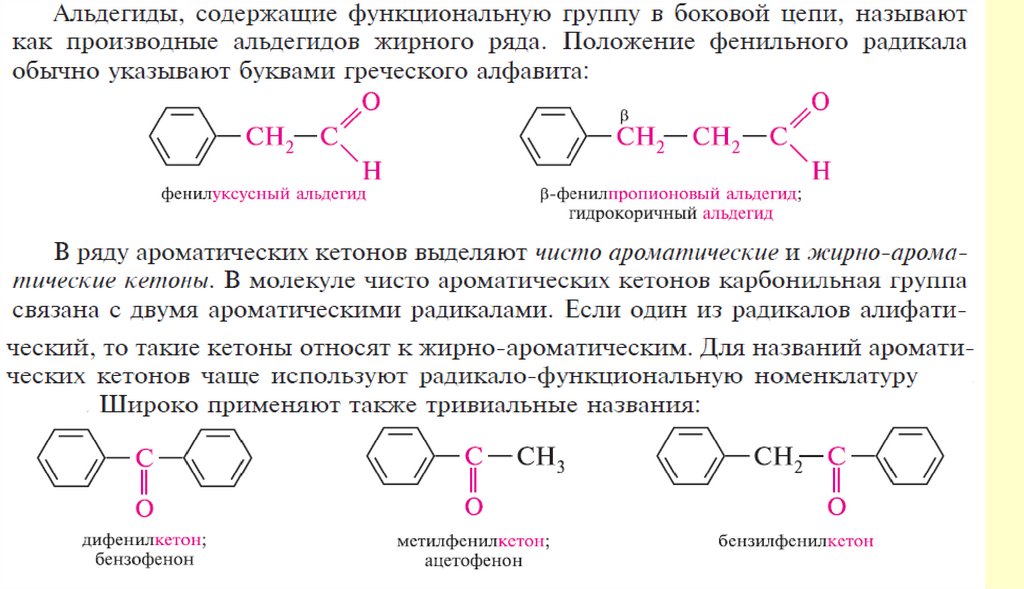
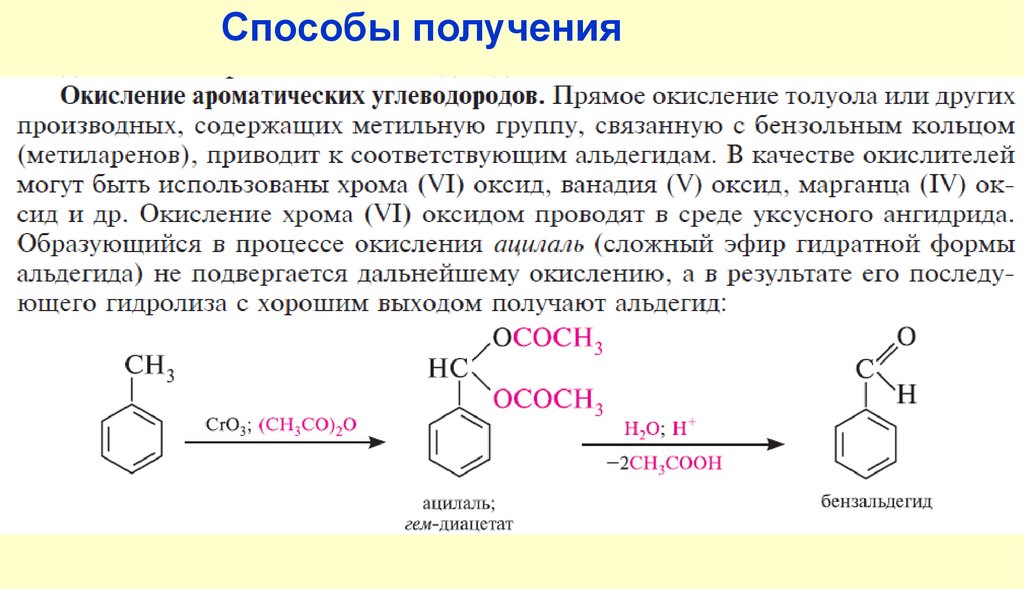
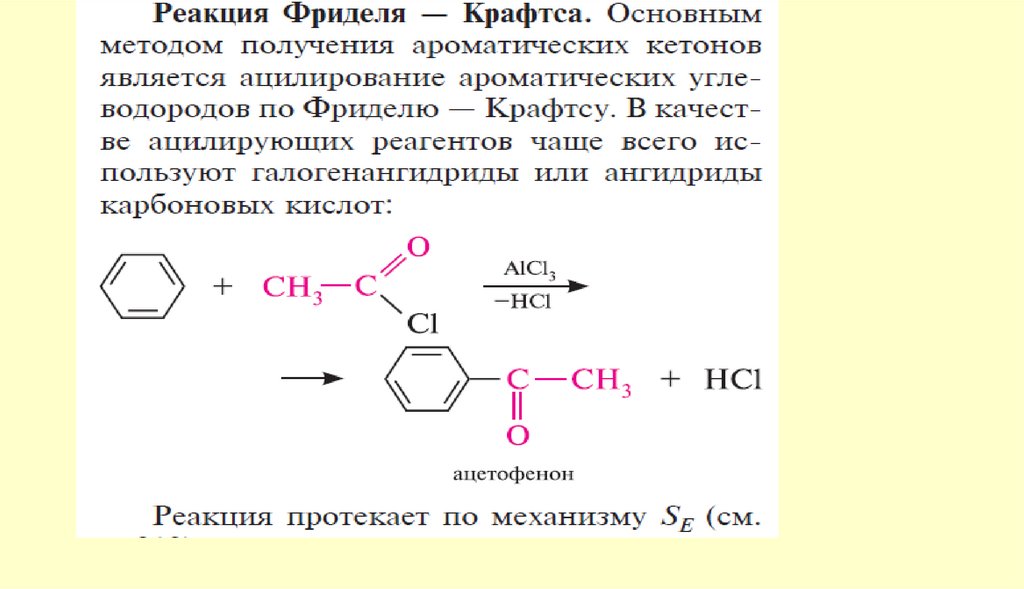
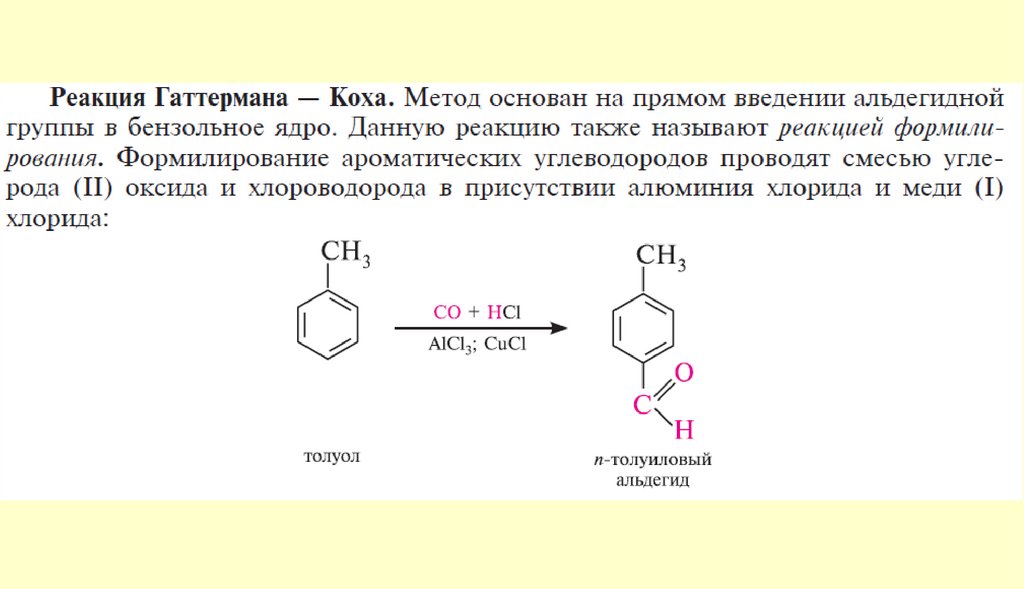
Способы получения122.
123.
124.
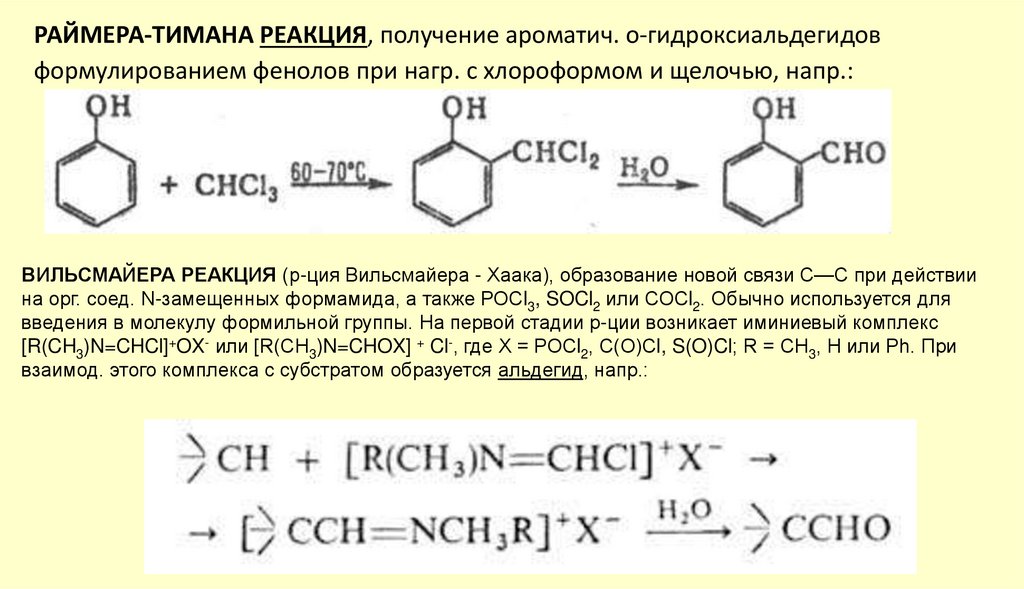
РАЙМЕРА-ТИМАНА РЕАКЦИЯ, получение ароматич. о-гидроксиальдегидовформулированием фенолов при нагр. с хлороформом и щелочью, напр.:
ВИЛЬСМАЙЕРА РЕАКЦИЯ (р-ция Вильсмайера - Хаака), образование новой связи С—С при действии
на орг. соед. N-замещенных формамида, а также РОСl3, SOCl2 или СОСl2. Обычно используется для
введения в молекулу формильной группы. На первой стадии р-ции возникает иминиевый комплекс
[R(CH3)N=CHCl]+OX- или [R(CH3)N=CHOX] + Cl-, где X = РОСl2, С(О)Сl, S(O)Cl; R = СН3, Н или Ph. При
взаимод. этого комплекса с субстратом образуется альдегид, напр.:
125.
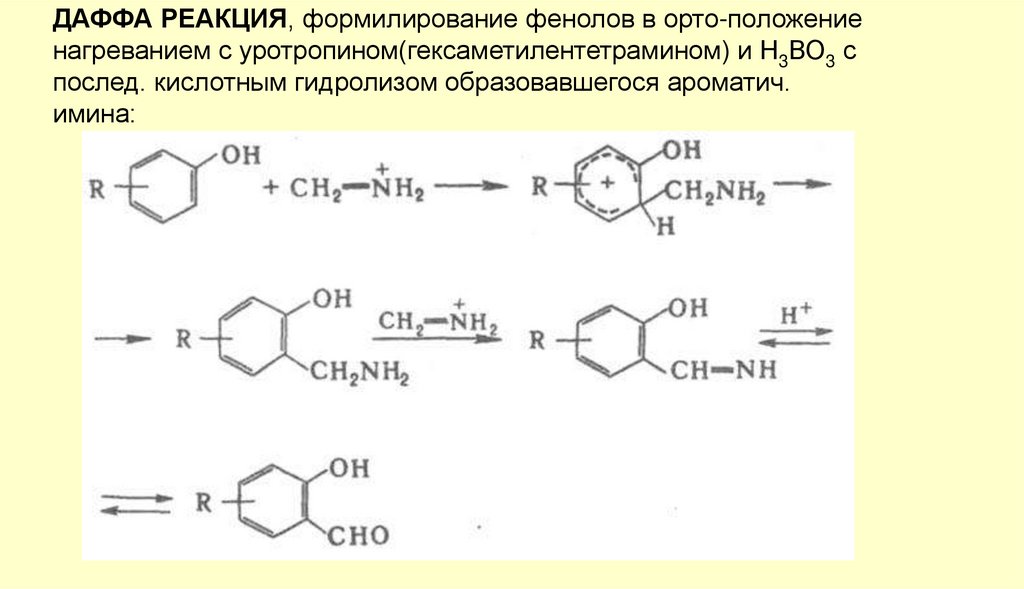
ДАФФА РЕАКЦИЯ, формилирование фенолов в орто-положениенагреванием с уротропином(гексаметилентетрамином) и Н3ВО3 с
послед. кислотным гидролизом образовавшегося ароматич.
имина:











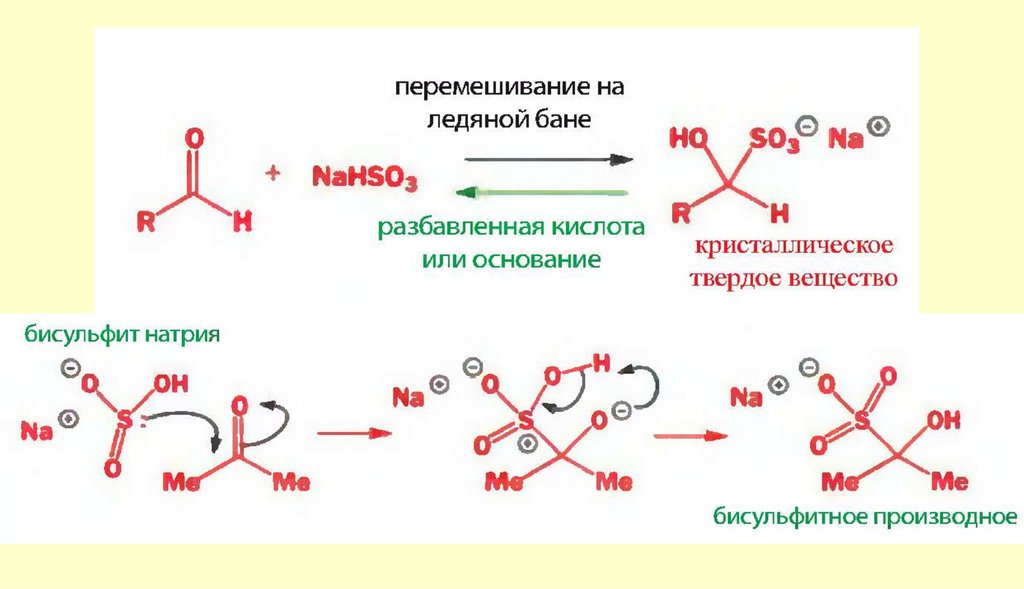

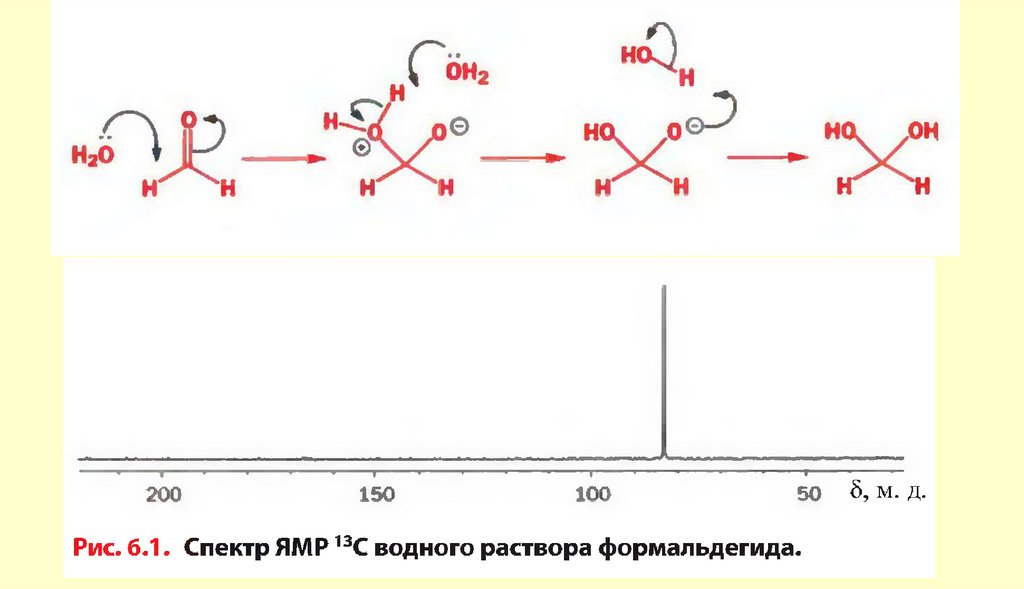
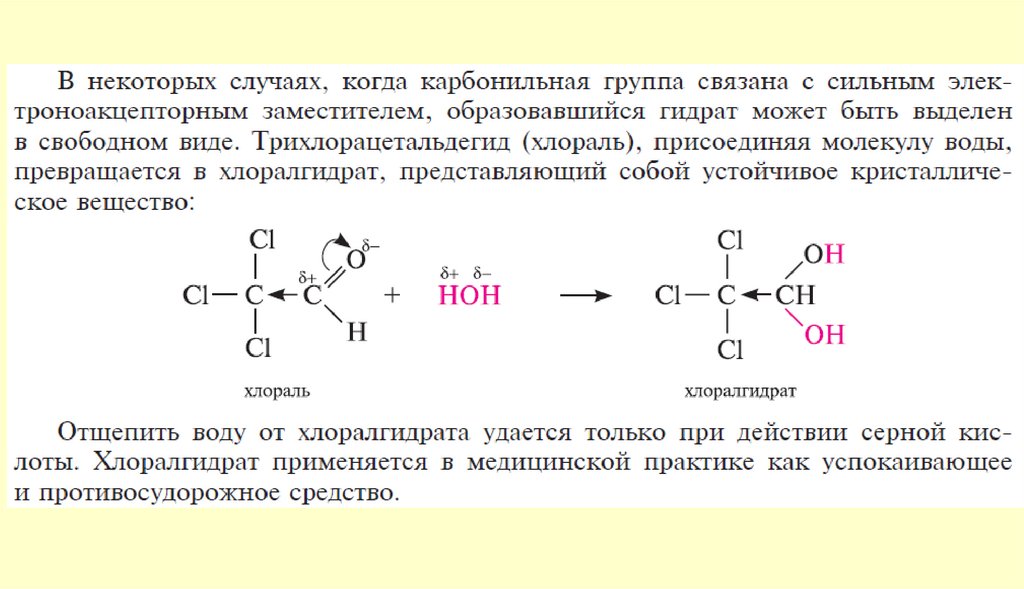

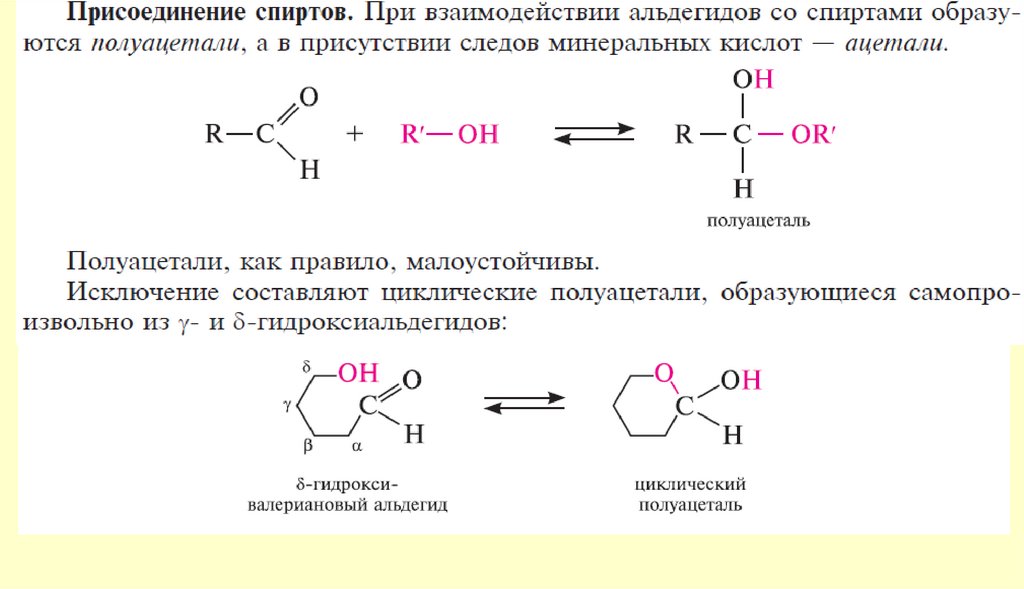
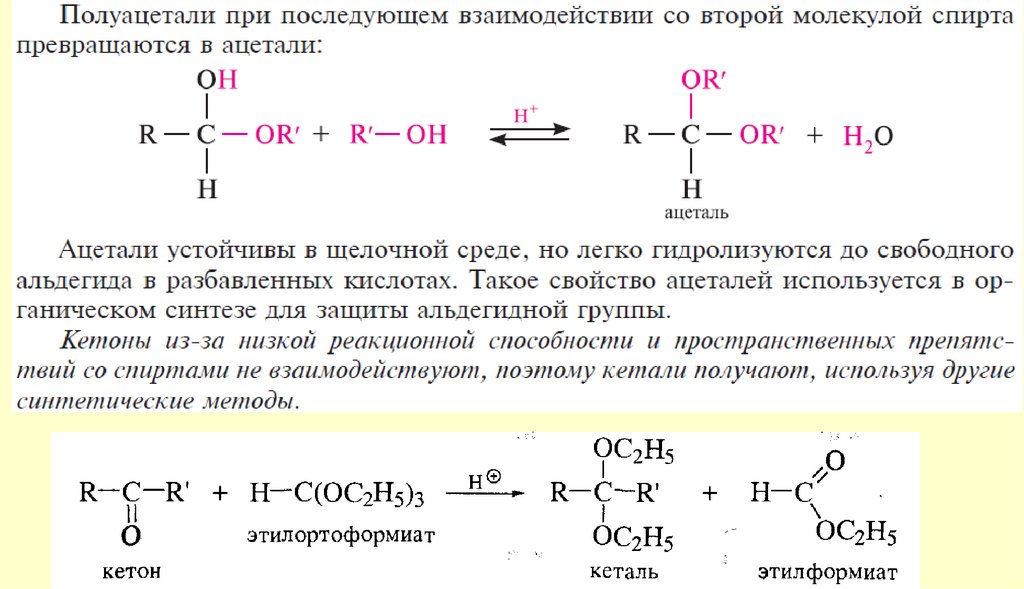

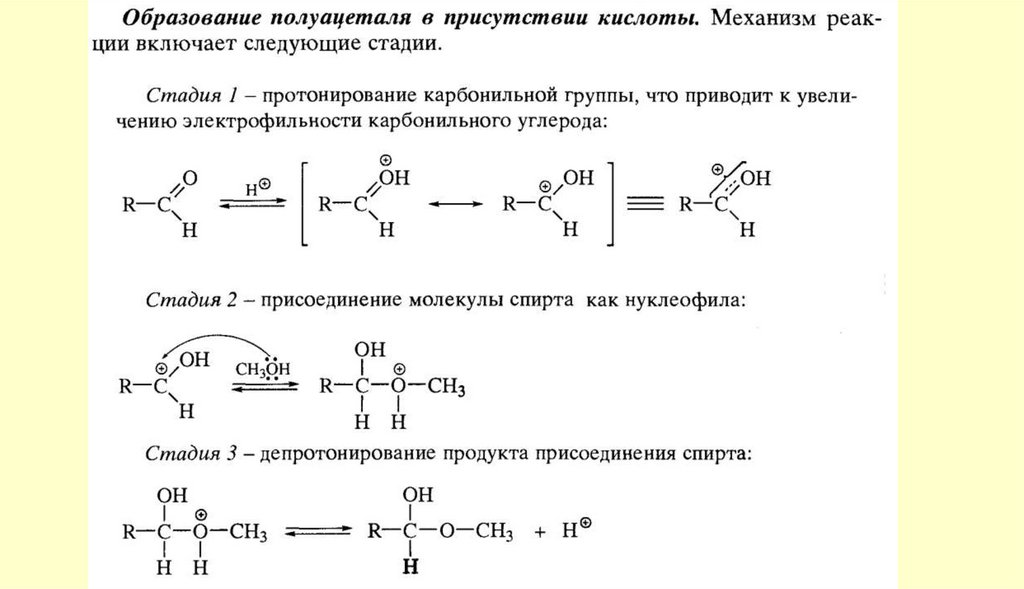
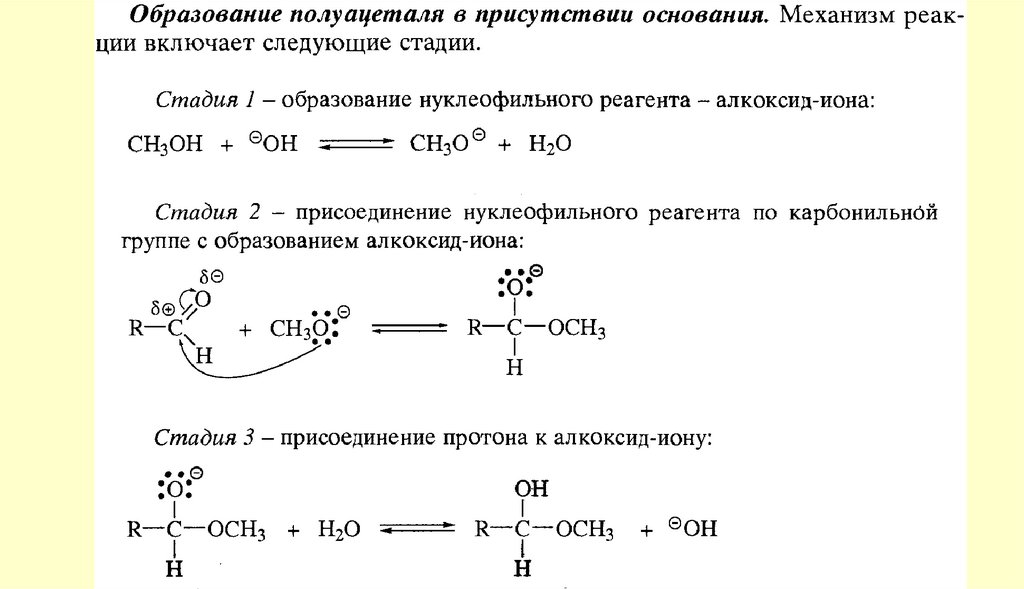
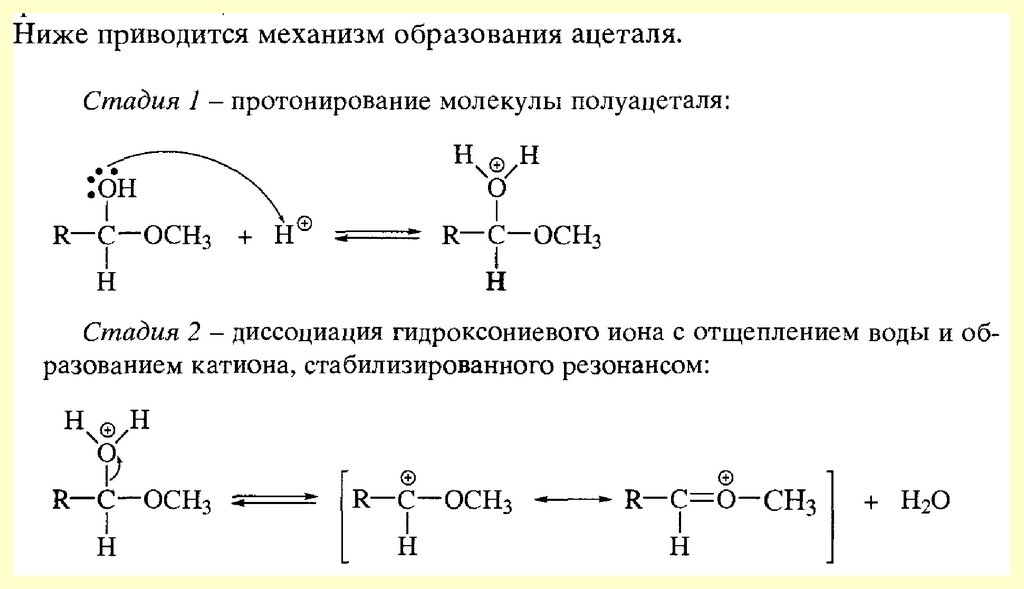












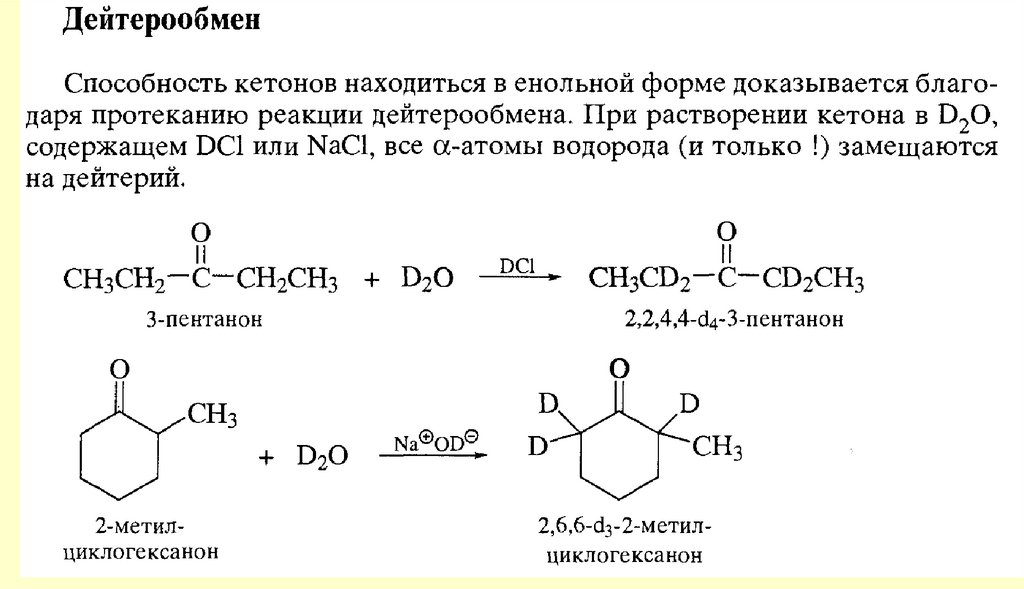

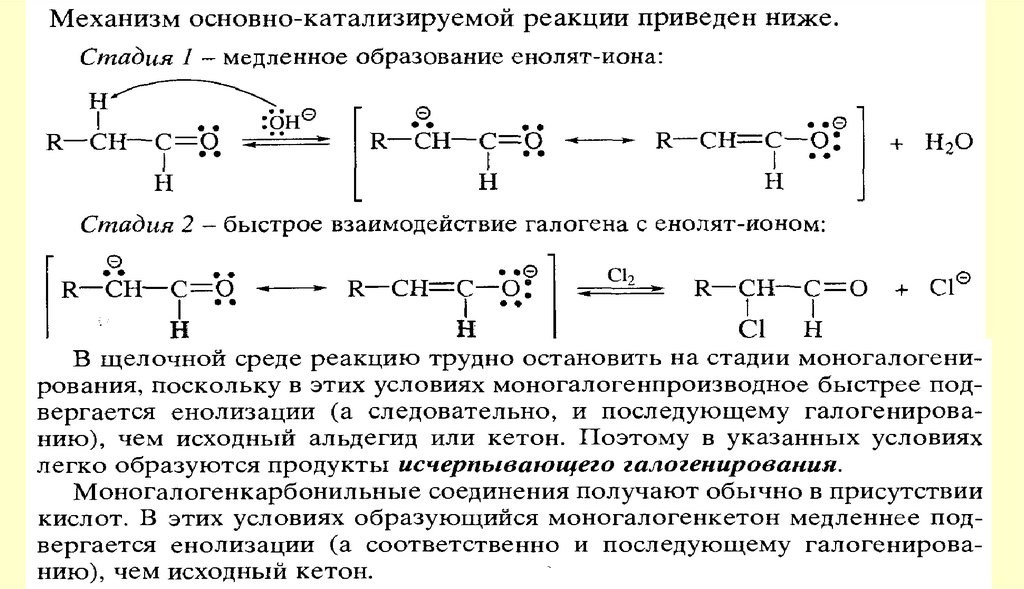
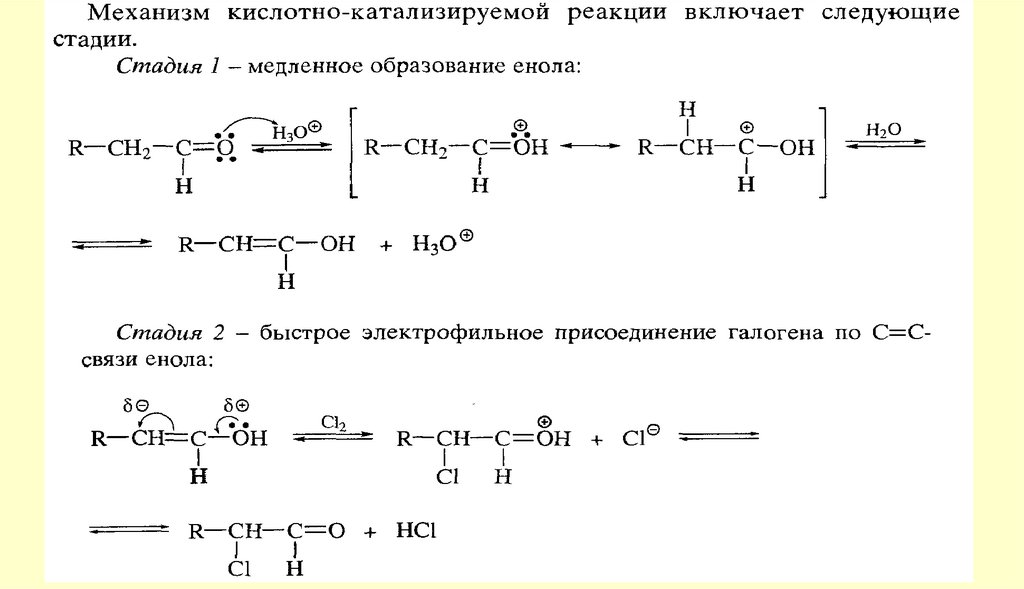
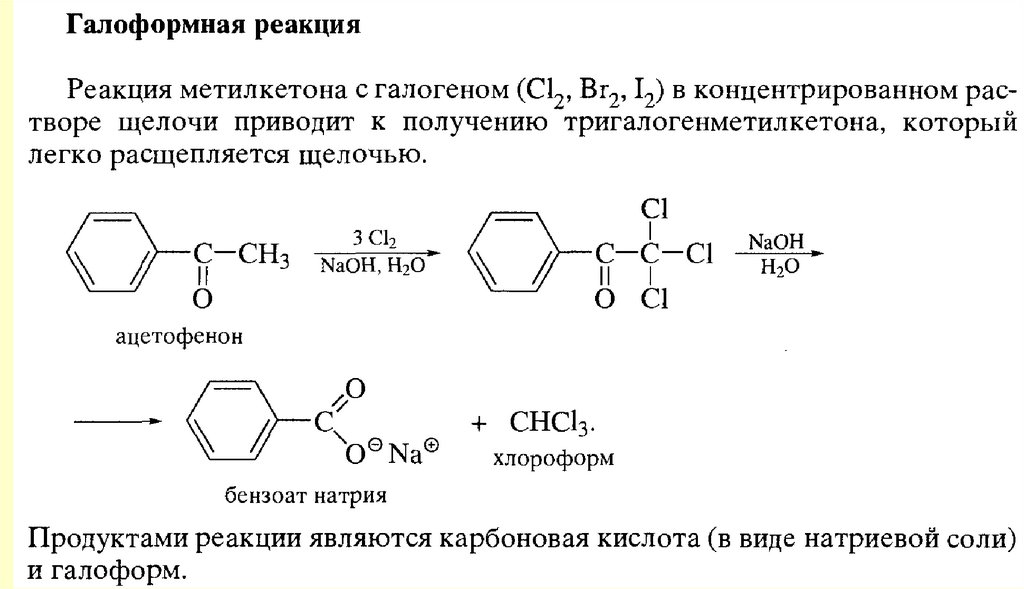



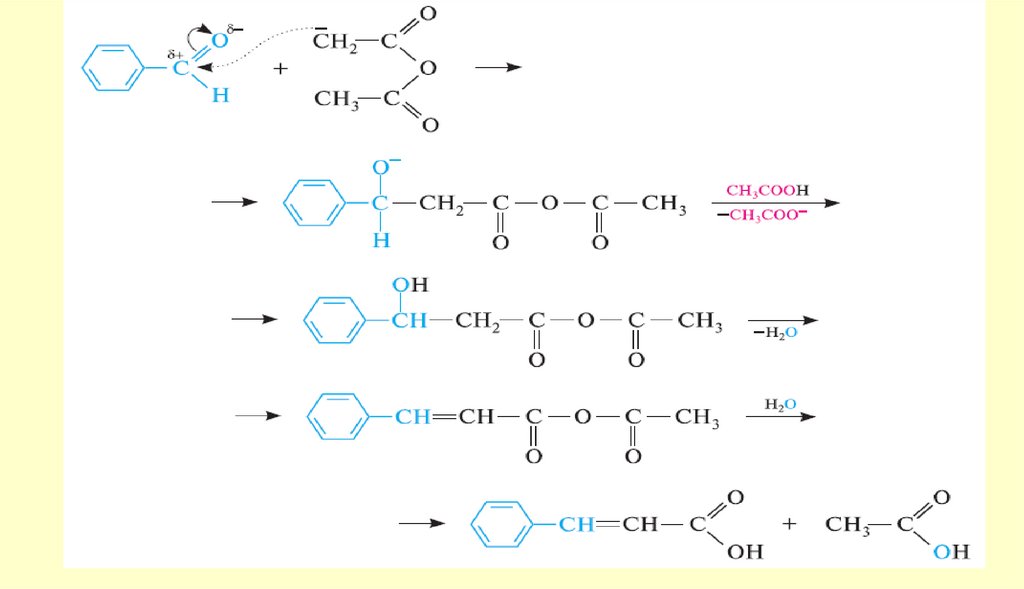
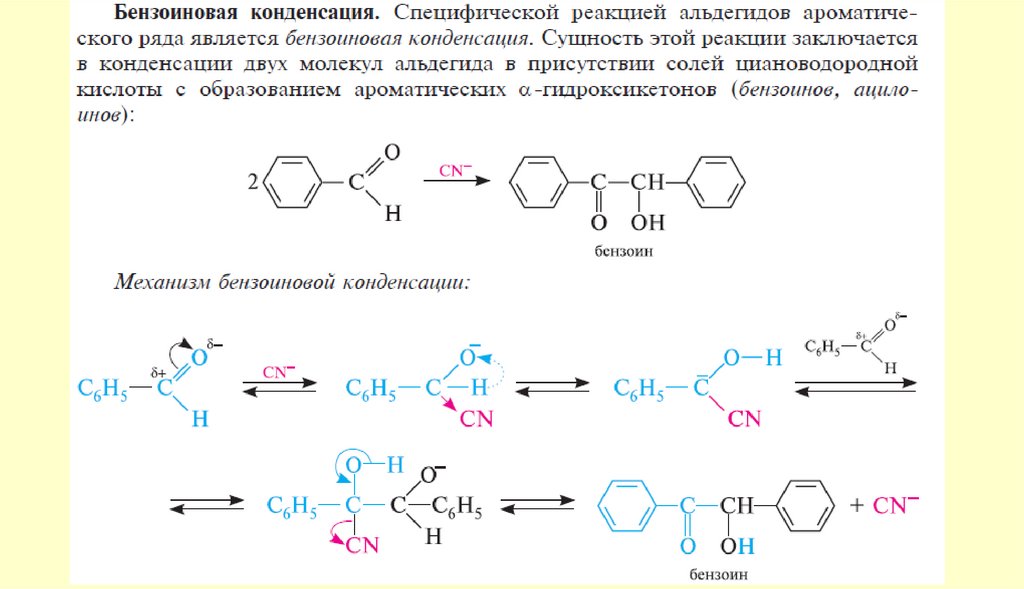
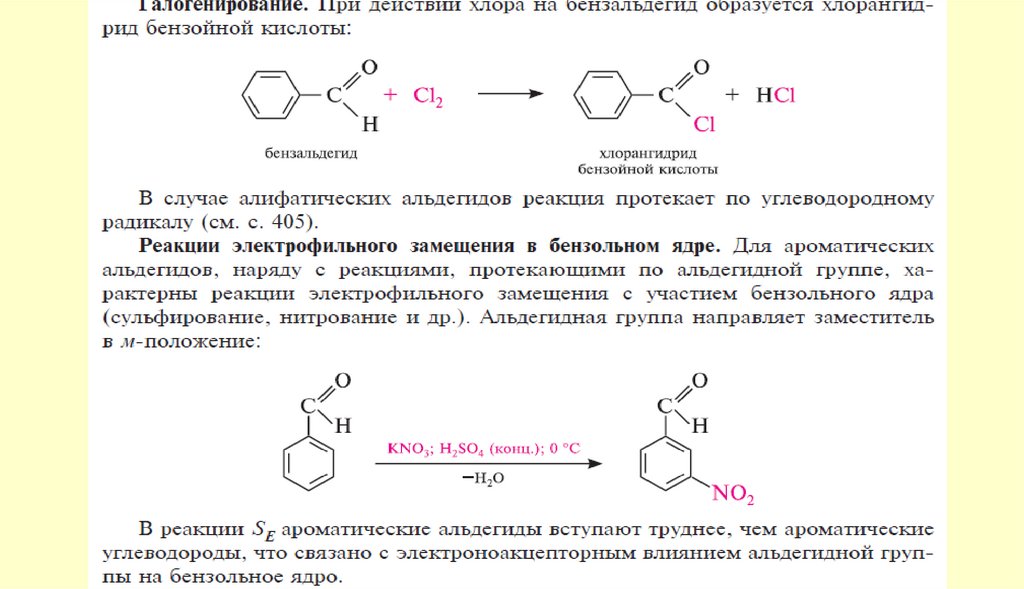
 chemistry
chemistry








