Similar presentations:
Элементы термодинамики. Лекция 13
1. Лекция 13 ТЕРМОДИНАМИКА
2. Элементы термодинамики
Задача термодинамики – изучениесвойств тел (систем), характеризуемых
набором макроскопических параметров, на основе так называемых
законов (начал) термодинамики.
2
3. Место термодинамики в естествознании
1. Введено понятие температуры (нулевой законтермодинамики).
2. Дана формулировка закона сохранения энергии в
общем виде – 1 - закон термодинамики
3. Определено направление процессов – 2 - закон
термодинамики. Он абсолютен термодинамически
и не абсолютен статистически.
4. 3 - закон указывает на ограничение процессов.
5. В дополнение к макроскопическим параметрам p, V,
T введены термодинамические функции – функции
состояния системы U, S и другие.
3
4.
Внутренняя энергия. РаботаU вн. U к. U вз. U вн.мол. U
для идеального газа Eп U вз. 0
Кинетическую энергию Ек – системы
как целого не учитывают, поскольку
при этом внутренняя энергия Uвн. не
меняется, т.к. и неизменна Uвн.мол
Итак, для моля (кмоля) газа:
i
i
Eк kT U RT
2
2
i nпост. nвращ. 2nколеб.
Работа по расширению газа равна:
A F l pS l p V
S – площадь поршня
p – давление под поршнем
A pdV A (13.1)
4
5. Теплота
Совокупность микроскопических процессов (т.е.захватывающих не все тело сразу, а только отдельные
группы молекул), приводящих к передаче энергии от
тела к телу – от одной части тела к другой, называется
теплообменом.
Q – теплота – энергия в специфической форме, в виде
хаотического молекулярного движения.
1-е начало термодинамики
Q U A Q dU A
Q dU pdV (13.2а)
pdV dU Q
(13.2)
(13.2 а)
5
6. Теплоемкость
Теплоемкость тела (вещества) – величина, равная количествутепла, которое необходимого передать телу, чтобы повысить
его температуру на один градус. Характеристичной является
молярная (удельная) теплоемкость:
Q Q C – молярная; Q
C
C p – молярная
V
; dT
V
dT
dT p
1
Q
1
Q
с
удельная
=
C
;
с p - удельная =
Cp
V
V
M
M
mdT V
mdT p
Q dU
(13.3)
dT
dT
0
V
V
Q dU pdV
V const CV Q dU p dV
Q
Cp
dT p
U U V , T
U
U
dU
dV
dT
V T
T V
(13.4)
6
7. Теплоемкость
UU
U
U
Q
dT
dV pdV
dT p
dV
T V
V T
T V
V T
U
CV dT p
dV
V T
По определению
Q
Cp
, тогда
dT p
Q
U V
Cp
CV p
dT p
V T T p
(13.5)
V
Здесь
– величина, определяемая экспериментально из
T p
изобарического теплового расширения газа
7
8. Теплоемкость
Для идеального газа:R
Vm
RT
i
i
U RT CV R; pVm RT Vm
T p p
p
2
2
Здесь i – число степеней свободы молекул газа
R
U Vm
C p CV p
V T T p p
U
C p CV R
но поскольку
0
V T
C p CV R – уравнение Майера
Cp
CV
i
2 R R
i 2
γ
i
R
2
i
(13.6)
(13.7)
8
9. Работа, совершаемая в изо-процессах
A pdVp1V1T1 pV
i iTi p2V2T2
pVT
Рассматриваем только равновесные:
i i i const
Процесс:
Изо - процессы:
Изо-V:
Изо-р:
V const
p const
A 0
т.к.
2
2
1
1
dV 0
(13.9)
A pdV p V1 V2 RdT R T1 T2 (13.10)
Изо-Т:
p1V1 p2V2
pdVm RdT
pVm RT
2
V2
p1
dV
(13.11)
RT ln RT ln
A pdV A RT
V
V1
p2
1
9
10. Адиабатический процесс
Адиабатические процессы – это процессы, происходящиебез теплообмена с внешней средой:
Q dU pdV dU pdV 0 (13.12)
RT dV
p
0
dVm 0 dT
CV dT pdVm 0 dT
CV V
CV
dVm dV
т.к. pVm = RT но
Vm
V
dT R dV
dT C p CV dV
dT
dV
0;
(
)
0
γ 1
0
T CV V
T
CV
V
T
V
Q 0
TV γ 1 const (13.13) но pV / T = const и pV γ const (13.13 а)
Уравнения 13.13 и 13.13а – наз. уравнениями Пуассона
Cp
A dU CV dT (13.14) A CV T1 T2 (13.14 а)
CV
10
11. Политропные (политропические) процессы
Политропные (политропические) процессы – процессы,протекающие при постоянной теплоемкости С:
pV n const
C Cp
n
C CV
1 n γ
C
(13.16)
(13.15)
nCV C p
n 1
(13.17)
Здесь С – теплоемкость при произвольном процессе.
CT
Если n 1
т.е. Изо-Т процессу соответствует бесконечная величина
теплоемкости СТ .
Адиабатический
процесс идет без теплообмена и
теплоемкость равна 0. Это следует и из уравнения 13.16.
n
C Cp
C CV
Cp
CV
при C 0
11
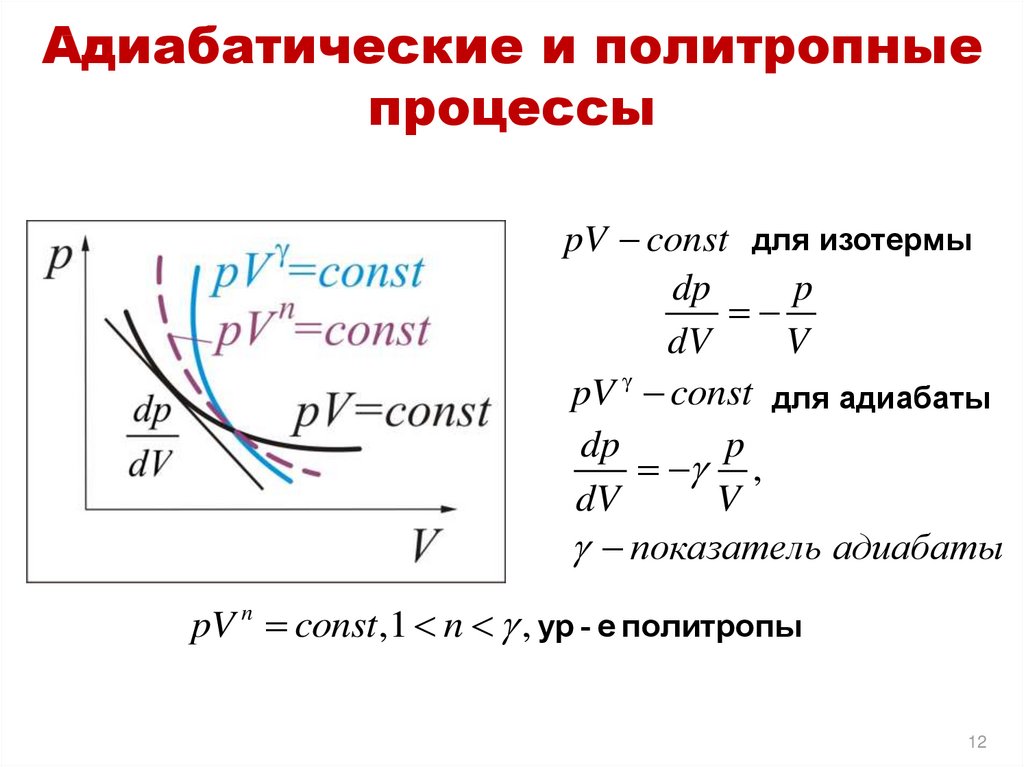
12. Адиабатические и политропные процессы
pV const для изотермыdp
p
dV
V
pV γ const для адиабаты
dp
p
,
dV
V
показатель адиабаты
pV n const ,1 n , ур - e политропы
12
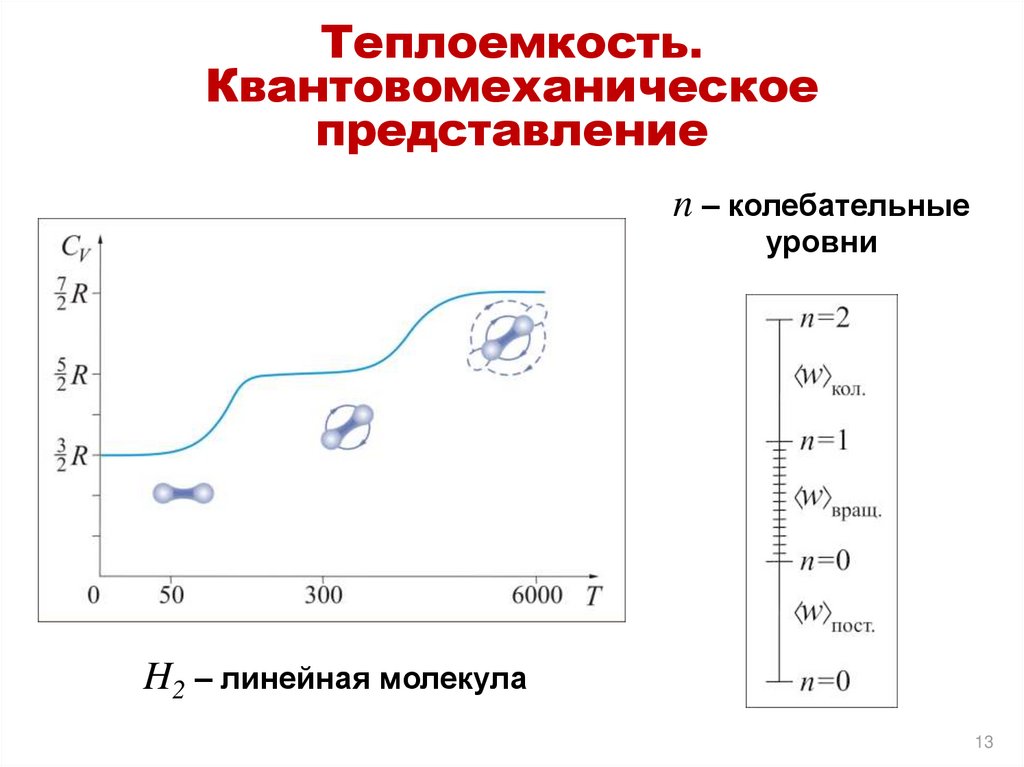
13.
Теплоемкость.Квантовомеханическое
представление
n – колебательные
уровни
H2 – линейная молекула
13
14. Термодинамика. Предыстория
Эволюция основного закона природы – Закона сохранениявещества и энергии:
1686 – Г. Лейбниц (философ, математик. физик…) – установил
Закон сохранения механической энергии.
1756 – М. Ломоносов (физико-химик, … ) – экспериментально
установил
Закон
сохранения
вещества,
указав
на
некорректность более ранних опытов Р. Бойля.
1773 – А.-Л. Лавуазье (естествоиспытатель, химик) повторил
опыты и подтвердил выводы Ломоносова.
1842 – Р. Майер (врач). Впервые опубликовал формулировку
Закона сохранения энергии в общем виде: «Энергия в
изолированных системах не может увеличиваться или
уменьшаться, а может переходить из одного вида в другой».
Закон получил известность в 1848 г.
1847 – Г. Гельмгольц (физик... врач…). Ввел понятие «внутренняя
энергия» и дал свою трактовку Закона сохранения энергии.
14
15. Термодинамика. Предыстория
Формулировка Р. Майера:«Движение, теплота, и, как мы намерены показать в
дальнейшем, электричество представляют собой явления,
которые могут быть сведены к единой силе, которые
изменяются друг другом и переходят друг в друга по
определенным законам. Всеобщий закон природы, не
допускающий никаких исключений, гласит, что для
образования тепла необходима известная затрата. Эту
затрату, как бы разнообразна она ни была, всегда можно
свести к двум главным категориям, а именно, она сводится
либо к химическому материалу, либо к механической
работе (с учетом астрономических явлений)».
15
16. Предтеча открытия основного закона природы
В путешествии на шхуне Майер отметил, изучая работыЛавуазье, что при жарких температурах происходит меньшее
потребление энергии. По прибытии на сушу у членов
экипажа началась лихорадка и с лечебными целями делали
кровопускания.
Майер
обнаружил,
что
во
время
осуществления кровопускания венозная кровь очень яркая,
насыщенная, похожа на артериальную. Он сделал
заключение, что в условиях жаркого климата кислорода из
крови на окислительные процессы тратится меньше. Далее
пришел к выводу, что энергия, которая поступает в организм,
равна тому количеству энергии, которое выделяется.
Изучение чисто физиологических явлений и легли в основу
фундаментального закона сохранения и превращения
энергии.
16














 physics
physics