Similar presentations:
Полный момент импульса электрона
1.
Полный момент импульса электронаС механическими моментами связаны магнитные моменты.
В результате их взаимодействия происходит сложение
моментов орбитального и спинового в полный момент
импульса электрона. Символическая запись:
M j Ml M s;
где j – квантовое число полного момента.
Правило сложения угловых
моментов одинаковы для спинов и
орбитальных моментов, полный
момент определяется аналогично
орбитальному моменту.
Mj
j j 1 ;
j l s l 12 ;
2.
Полный момент импульса электронаКвантовое число j – полуцелое и положительное,
при l = 0,
j = s = ½.
Спин может быть сонаправлен орбитальному моменту, тогда
они складываются:
j = l + s,
и может быть противоположен, тогда
j = l – s,
M jz m j ;
проекции полного момента:
m j j , j 1,.... j;
2j + 1 состояния,
отличающиеся значениями mj
т.е. возможны
3.
Полный момент импульса электронаВ случае l
= 0, квантовое число полного момента j имеет
только одно значение: j = s = ½, в остальных случаях – два
значения.
Орбитальный и спиновый моменты взаимодействуют друг с
другом. Энергия этого взаимодействия зависит от взаимной
ориентации, расщепление энергетических уровней.
каждый уровень, начиная с l
= 1 расщепляется на два
подуровня. Все уровни, кроме s, имеют дублетную структуру.
4.
Полный момент импульса электронаУровни (или термы) имеют
символическое обозначение:
νL
j
где L – символ состояния, определяемого квантовым числом
l, только большими латинскими буквами; S, P, D, F;
ν – мультиплетность: ν = 2s + 1.
Примеры:
2S
1/2
2P
1/2
2P
3/2
5.
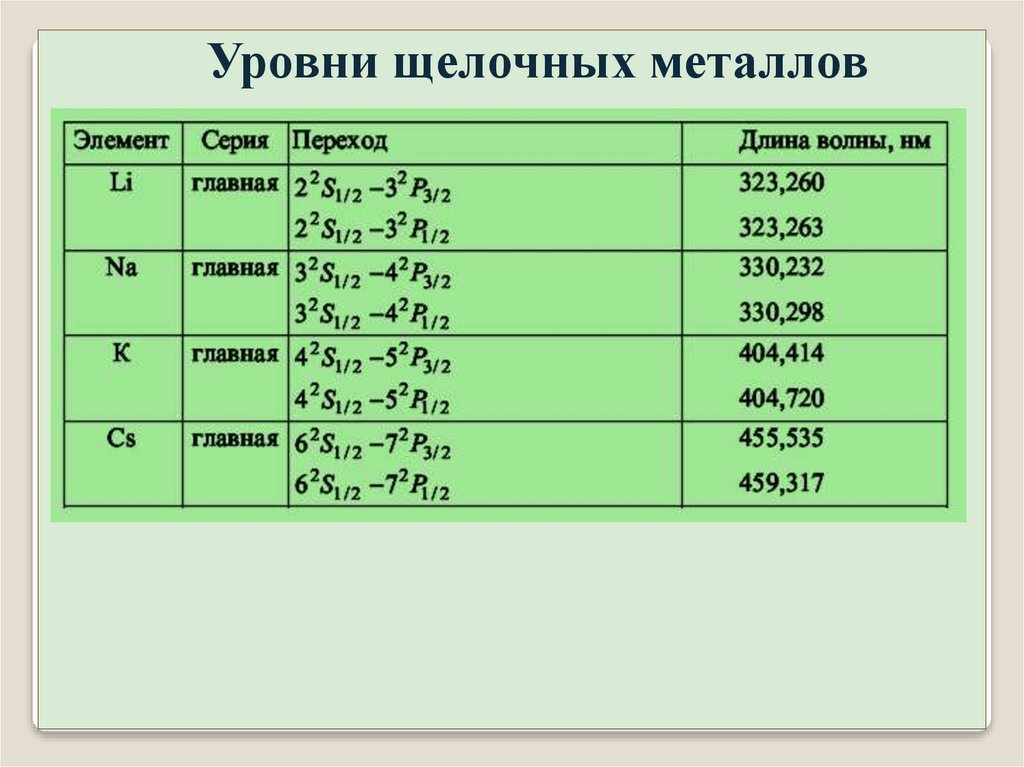
Уровни щелочных металловИсследования
спектральных линий
щелочных металлов
приборами с большой
разрешающей
способностью показали,
что линии являются
двойными, т.е. образуют
тонкую структуру.
Спектральные линии из
нескольких компонент
называются
мультиплетами, а
количество компонент –
мультиплетностью.
6.
Уровни щелочных металлов7.
Тонкая структураДля щелочных металлов расщепление энергетических
уровней мало по сравнению с расстоянием между основными
уровнями.
Для Li 10–5 эВ,
Для Cs 10–1 эВ.
Тонкая структура уровней и спектральных линий атомов
щелочных металлов обусловлено спин-орбитальным
взаимодействием. У водорода тоже была экспериментально
обнаружена тонкая структура, но расщепление
энергетических уровней оказалось слишком мало и обычно
им пренебрегают.
8.
Тонкая структураПравило отбора для
j
j = 0, ±1.
Закономерности: главная серия:
переход np s две
близкорасположенные линии.
Расщепление разных
энергетических p – уровней
различно, разное расщепление
линий.
4P3/2
4P1/2
3P3/2
3P1/2
3S1/2
Главная серия:
9.
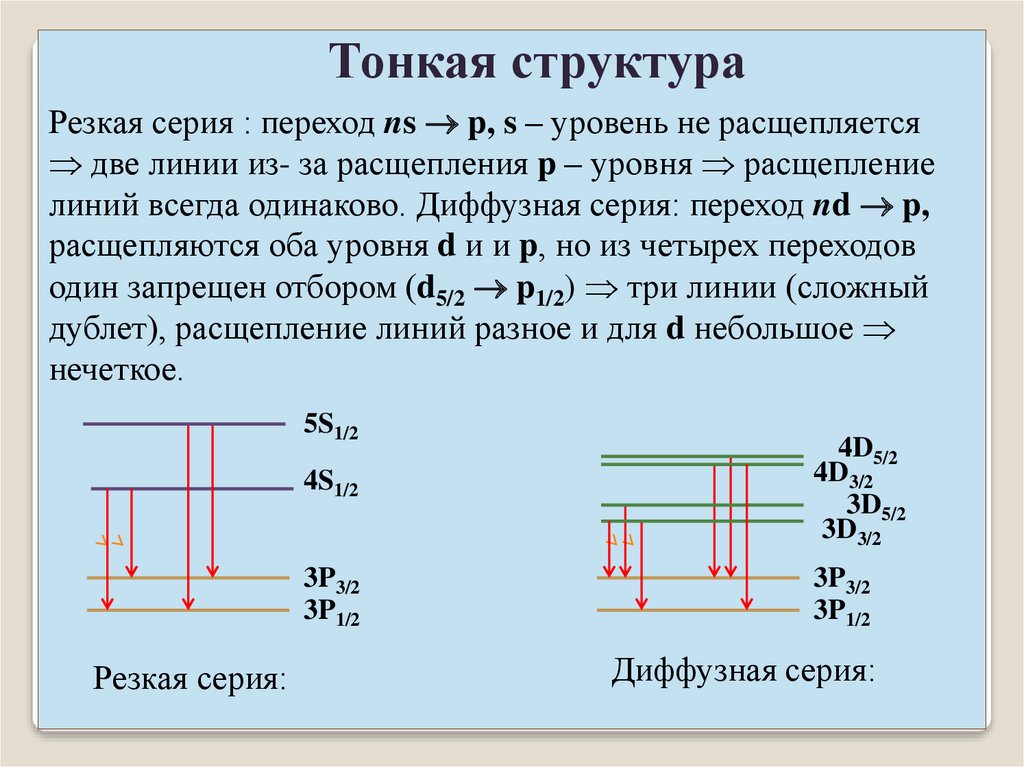
Тонкая структураРезкая серия : переход ns p, s – уровень не расщепляется
две линии из- за расщепления p – уровня расщепление
линий всегда одинаково. Диффузная серия: переход nd p,
расщепляются оба уровня d и и p, но из четырех переходов
один запрещен отбором (d5/2 p1/2) три линии (сложный
дублет), расщепление линий разное и для d небольшое
нечеткое.
5S1/2
Резкая серия:
4S1/2
4D5/2
4D3/2
3D5/2
3D3/2
3P3/2
3P1/2
3P3/2
3P1/2
Диффузная серия:
10.
Многоэлектронные атомыКаждый электрон в атоме обладает орбитальным
Ml
и собственным M s
моментами. M J
соответствующие магнитные моменты,
взаимодействие между ними.
Орбитальный и спиновый моменты складываются в
результирующий момент
возможны два случая.
11.
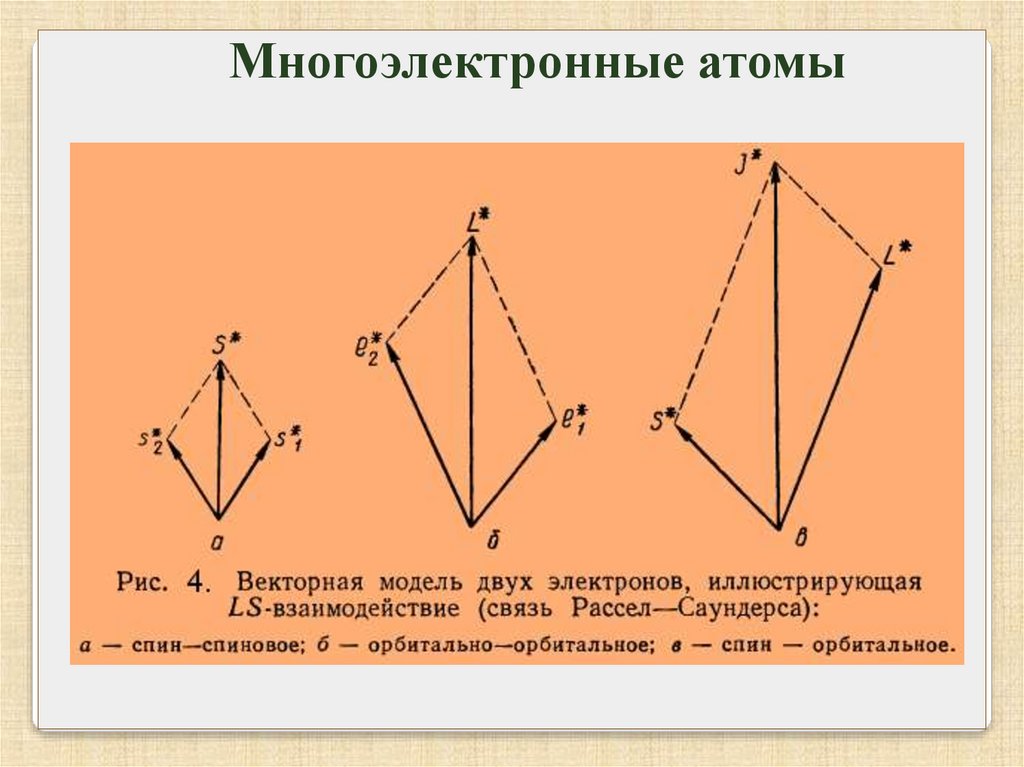
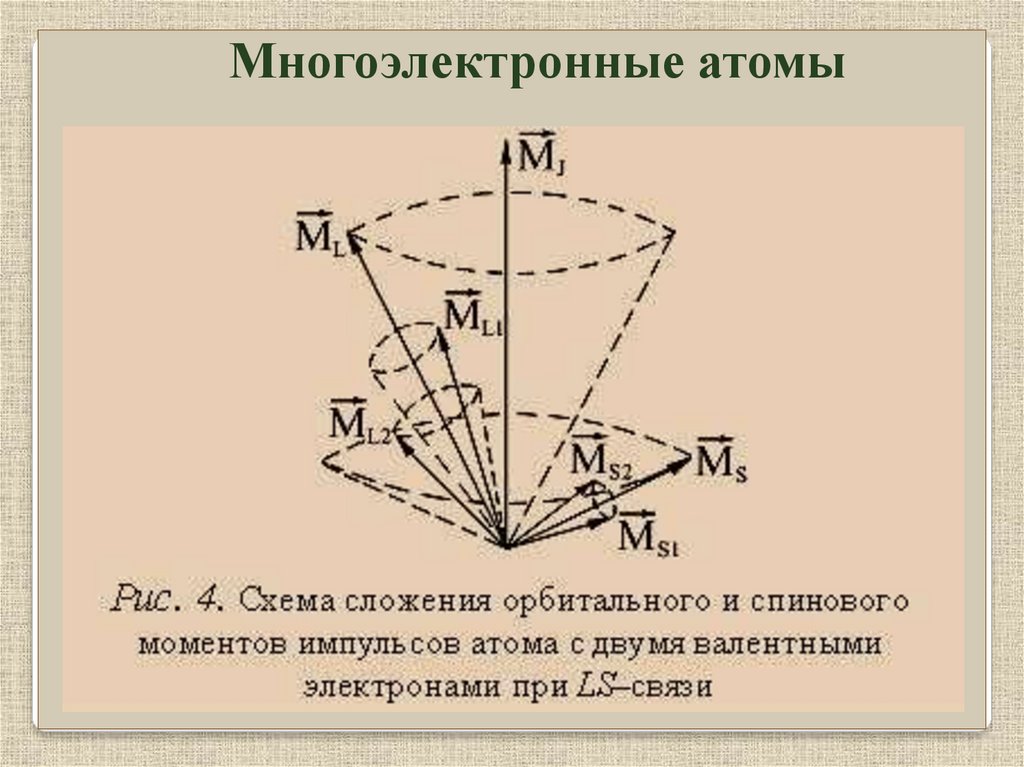
Многоэлектронные атомыОрбитальные моменты взаимодействуют между собой
сильнее чем со спинами, аналогично спины тоже сильнее
взаимодействуют между собой,
все орбитальные моменты M l
складываются в общий орбитальный момент
а спины M s в общий спин
ML
MS
затем они складываются в полный момент атома M
Связь Рессель – Саундерса.
J
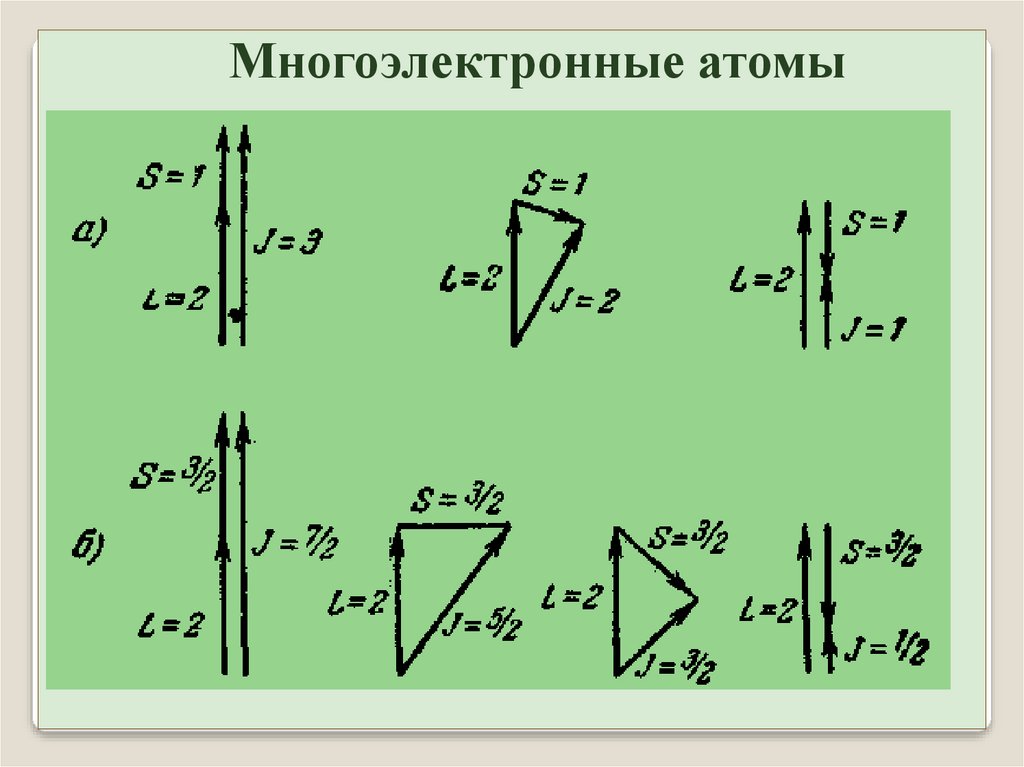
12.
Многоэлектронные атомы13.
Многоэлектронные атомы14.
Многоэлектронные атомыВторой случай:
орбитальный момент
M l и спин M s
каждого электрона складываются в полный момент M j
а затем моменты M j
всех электронов складываются в полный момент атома
Это так называемая
j–j
связь,
наблюдается у тяжелых атомов.
MJ
15.
Многоэлектронные атомыСложение моментов происходит по квантовым законам.
Процедура:
Сложение двух моментов:
квантовое число
L = l1 + l2, l1 + l2 – 1, ….. l1 – l2 ,
потом так же с третьим и т.д.
li всегда целое число, L тоже всегда целое число.
Lmax = li ,
Lmin = ± li min
суммарный момент может быть нулем.
Процедура сложения спинов такая же.
Smax = si = n∙½ При четном количестве принимает целые
значения от 0 до n∙½. При нечетном – полуцелые значения
от ½ до n∙½.
16.
Многоэлектронные атомы17.
Многоэлектронные атомыПри данных
момента
J
L
и
S
квантовое число результирующего
будет целым или полуцелым, в зависимости от
S, т.е. при четном количестве электронов – целое, при
нечетном – полуцелое.
Терм атома
νL
j
– под L подразумевается одна из
букв: S, P, D, F;
символ содержит сведения о всех квантовых числах
атома.
ν = 2S + 1.
При S L дает мультиплетность.
Т.е. количество подуровней, различающихся числом J.
18.
,Многоэлектронные атомы
Энергия атома зависит от взаимной ориентации всех
и суммарных LL LS
моментов Ll Ls
между собой.
Правила отбора:
L = 0 ±1
S = 0
J = 0 ±1
19.
Магнитный момент атомаОпределенное экспериментально гиромагнитное соотношение
для орбитального момента совпадает с классическим.
e
e
L
LL
L L 1 B L L 1 ;
2m
2m
ˆ z BmL ;
Гиромагнитное соотношение для спина в два раза больше
классического
e
S
m
Из за удвоенного магнетизма
спина, гиромагнитное
соотношение для полного
момента:
LS 2 B S S 1 ;
J B g J J 1 ;
Jz B gmJ ;
20.
Магнитный момент атомаФактор Ланде:
J J 1 S S 1 L L 1
g
1;
2 J J 1
Если
если
S = 0, то J = L
L = 0, то J = S,
и
и
g = 1,
g = 2.
Фактор Ланде может быть нулем и даже иметь значения
меньше единицы. Т.е. магнитный момент может быть равен
нулю, хотя механический момент отличен от нуля.
21.
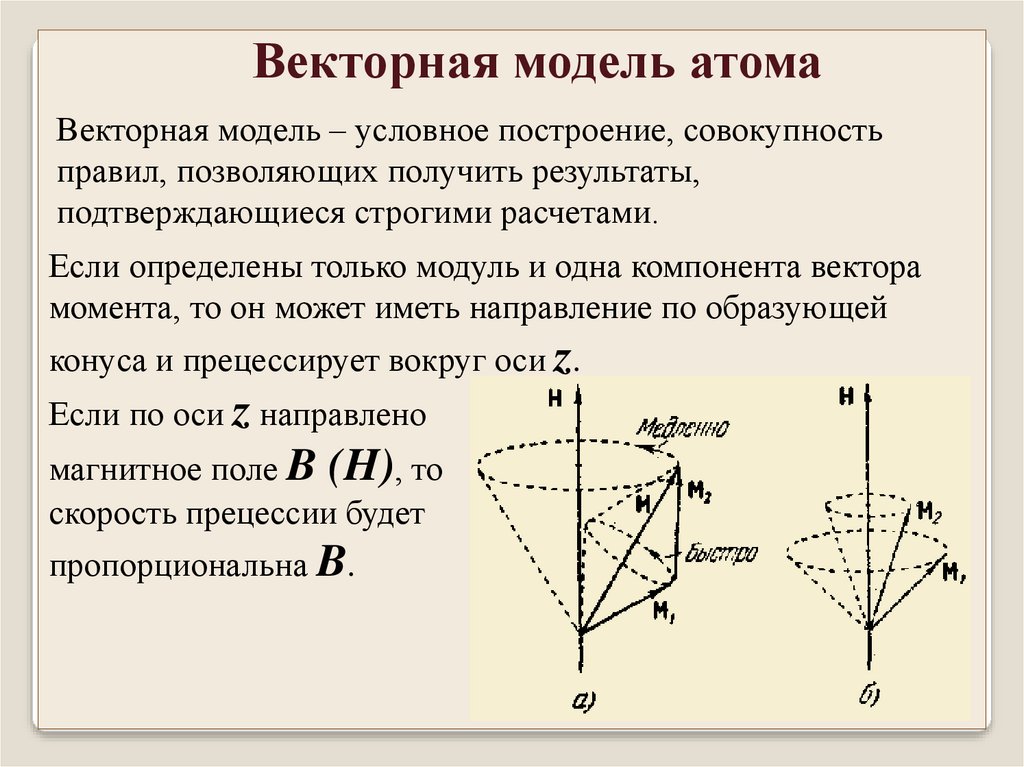
Векторная модель атомаВекторная модель – условное построение, совокупность
правил, позволяющих получить результаты,
подтверждающиеся строгими расчетами.
Если определены только модуль и одна компонента вектора
момента, то он может иметь направление по образующей
конуса и прецессирует вокруг оси z.
Если по оси z направлено
магнитное поле B (H), то
скорость прецессии будет
пропорциональна B.
22.
Векторная модель атомаПо правилам векторной модели складываемые моменты L1
и L2 прецессируют вокруг направления результирующего
момента. Через магнитные моменты они взаимодействуют
друг с другом. Скорость прецессии предполагается
пропорциональной интенсивности взаимодействия. И, т.к.
определены L и Lz, вектор L прецессирует вокруг оси z.
Если вдоль оси z направлено
поле B (H), то в
зависимости от сил
взаимодействия моментов
между собой и полем
возможны два случая.
23.
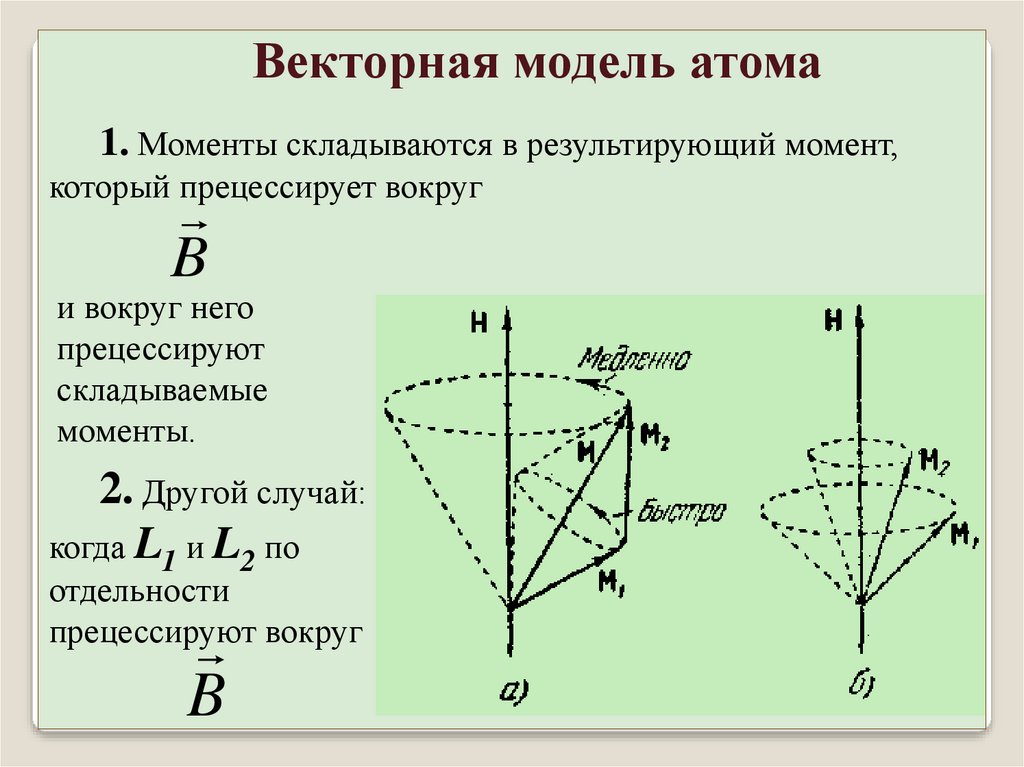
Векторная модель атома1. Моменты складываются в результирующий момент,
который прецессирует вокруг
B
и вокруг него
прецессируют
складываемые
моменты.
2. Другой случай:
когда L1 и L2 по
отдельности
прецессируют вокруг
B
24.
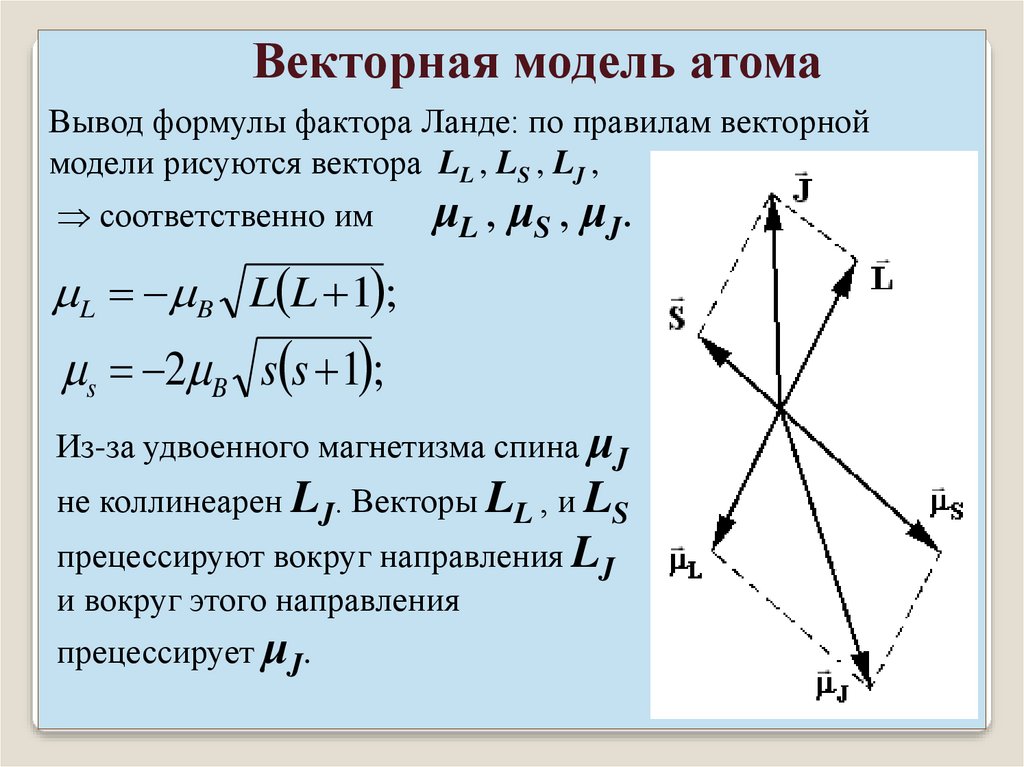
Векторная модель атомаВывод формулы фактора Ланде: по правилам векторной
модели рисуются вектора LL , LS , LJ ,
соответственно им
μL , μS , μJ.
L B L L 1 ;
s 2 B s s 1 ;
Из-за удвоенного магнетизма спина μJ
не коллинеарен LJ. Векторы LL , и LS
прецессируют вокруг направления LJ
и вокруг этого направления
прецессирует μJ.
25.
Векторная модель атомаСреднее значение: μJ направлено по линии LJ.
Его и нужно найти.
J L cos S cos ;
L2S LJ LL
2
L L 2 LJ LL cos ;
2
J
2
L
L2J L2L L2S
cos
2 LJ LL
J J 1 L L 1 S S 1
;
2 J J 1 L L 1
26.
Векторная модель атомаАналогично
L2L L2J L2S 2 LJ LS cos ;
L L L
J J 1 S S 1 L L 1
cos
;
2 LJ LS
2 J J 1 S S 1
2
J
J B
2
S
2
L
3J J 1 S S 1 L L 1
J J 1
2 J J 1
B g J J 1 ;
J J 1 S S 1 L L 1
g
1;
2 J J 1
27.
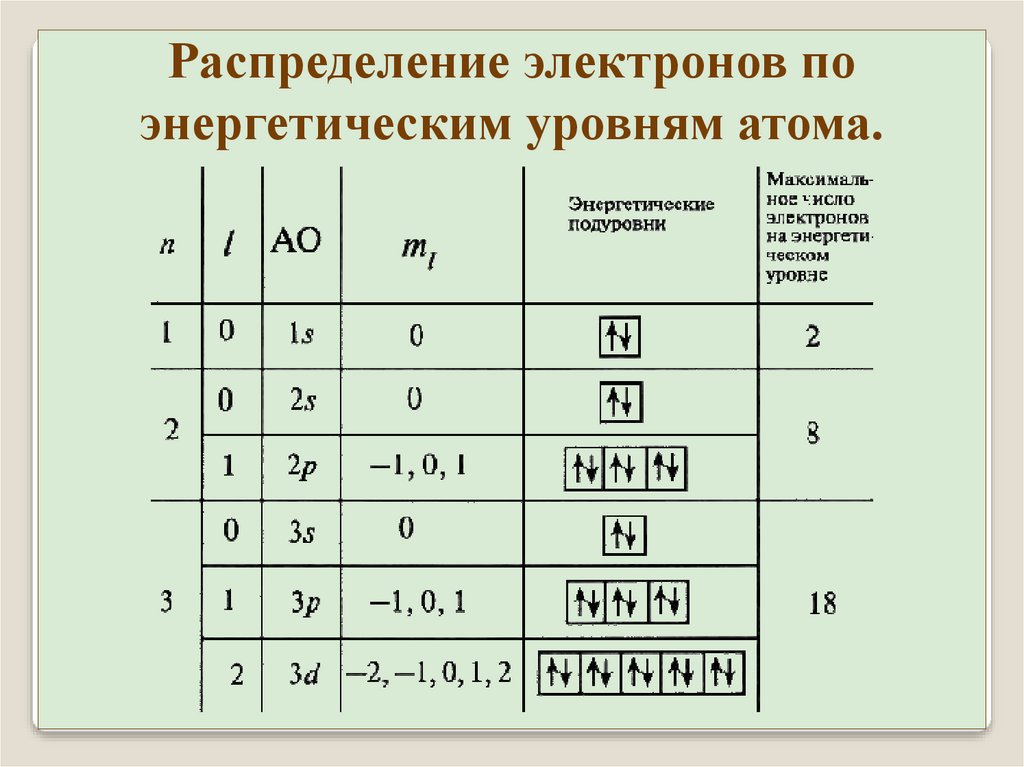
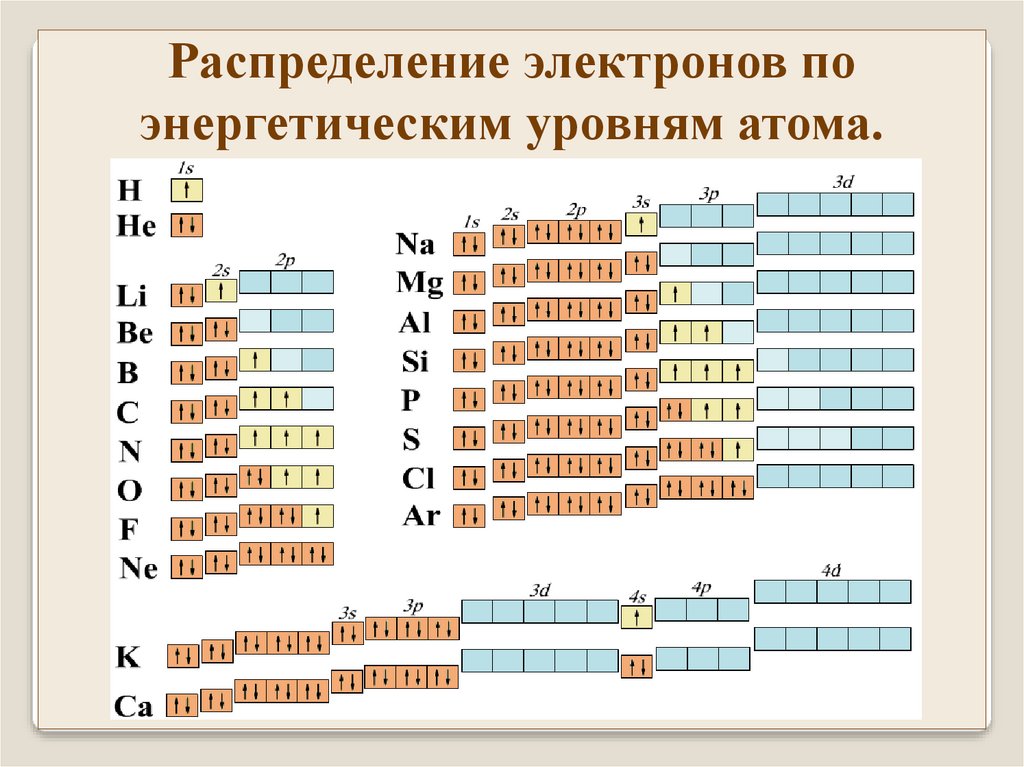
Распределение электронов поэнергетическим уровням атома.
В основном (невозбужденном) состоянии атома электроны
должны располагаться на самых низких доступных для них
энергетических уровнях (1s состояние).
Согласно принципу Паули в одном состоянии не может
находиться одновременно более одного электрона
последовательное заполнение уровней начиная с низших.
Состояние электрона в атоме характеризуется четырьмя
квантовыми числами: n, l, m, ms. В атоме не должно быть
двух электронов с одинаковым набором квантовых чисел.
Энергия состояния сильнее возрастает с увеличением n чем с
увеличением l. и слабо зависит от чисел m и ms.
28.
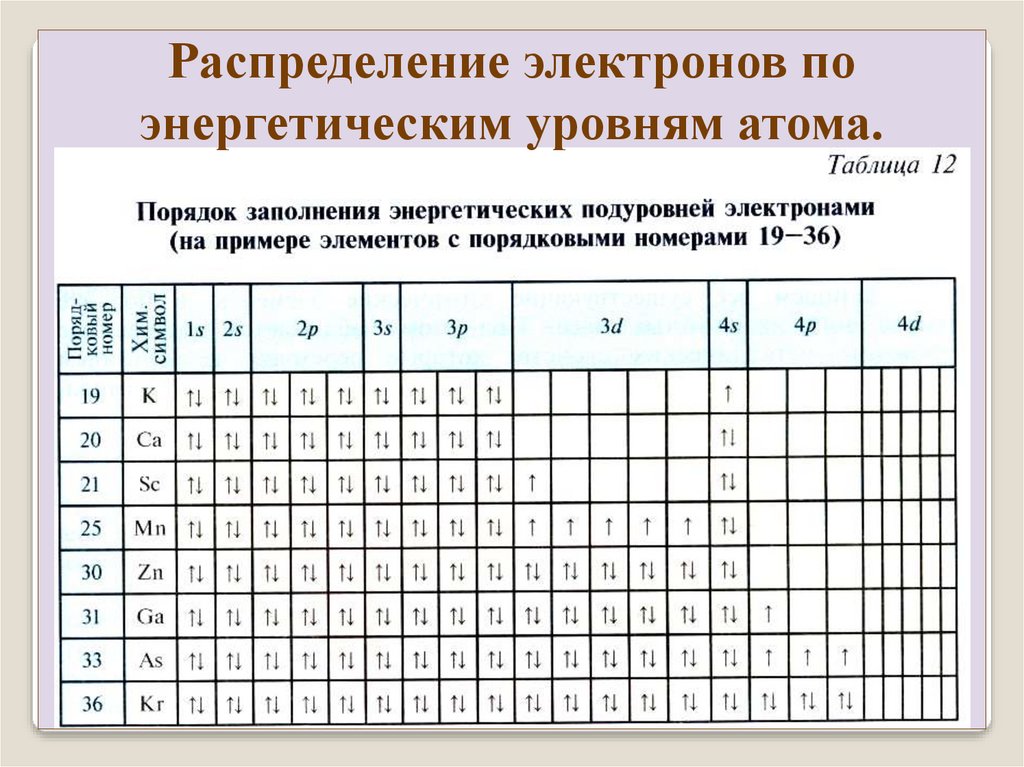
Распределение электронов поэнергетическим уровням атома.
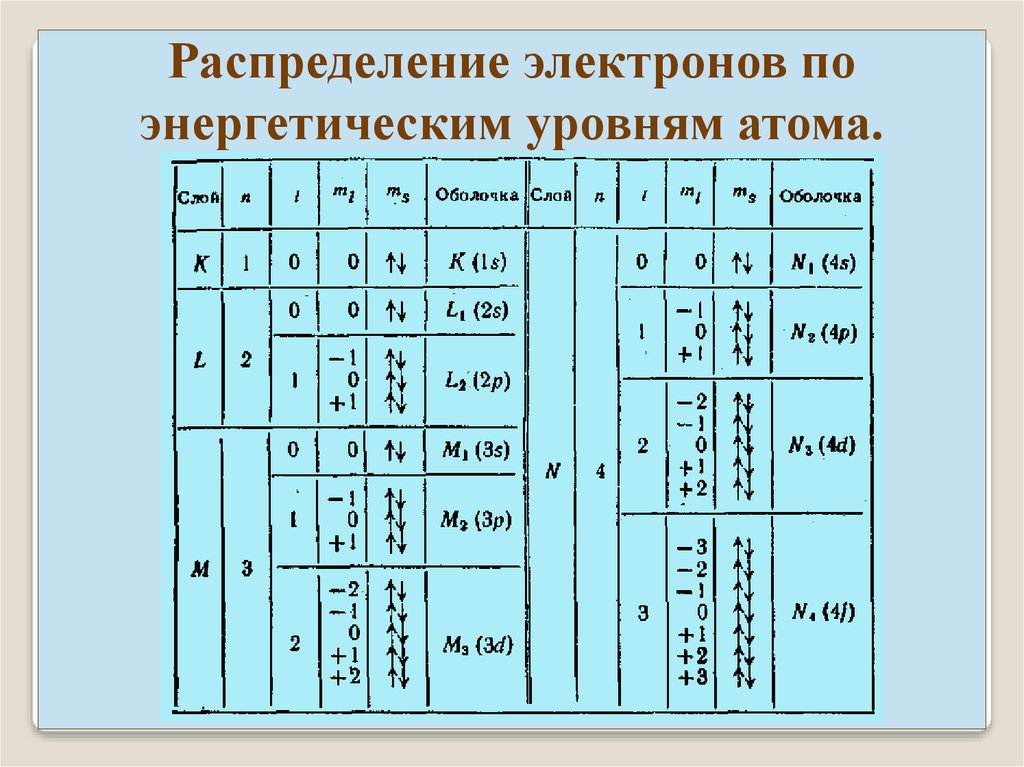
Совокупность электронов с одинаковым n образуют
оболочку. Разделяется на подоболочки, отличающиеся числом
l. На оболочке могут находится не более 2n2 электронов.
Названия оболочек из рентгеновской спектроскопии:
n=
обозначение
1 2 3
K L M
4
N
5 6 7
O P Q
Подоболочки обозначаются двумя способами:
Например:
M1 M2
M3
3s
3p
3d
29.
Распределение электронов поэнергетическим уровням атома.
30.
Распределение электронов поэнергетическим уровням атома.
31.
Распределение электронов поэнергетическим уровням атома.
По мере заполнения электронных уровней атомов
периодически повторяются сходные электронные
конфигурации сверх полностью заполненных подоболочек
периодическая повторяемость химических и оптических
свойств.
Для полностью заполненной оболочки характерно равенство
нулю суммарных моментов: и спинового и орбитального
(L = 0, S = 0, J = 0).
при определении момента атома, заполненные
подоболочки можно не принимать во внимание.
32.
Распределение электронов поэнергетическим уровням атома.
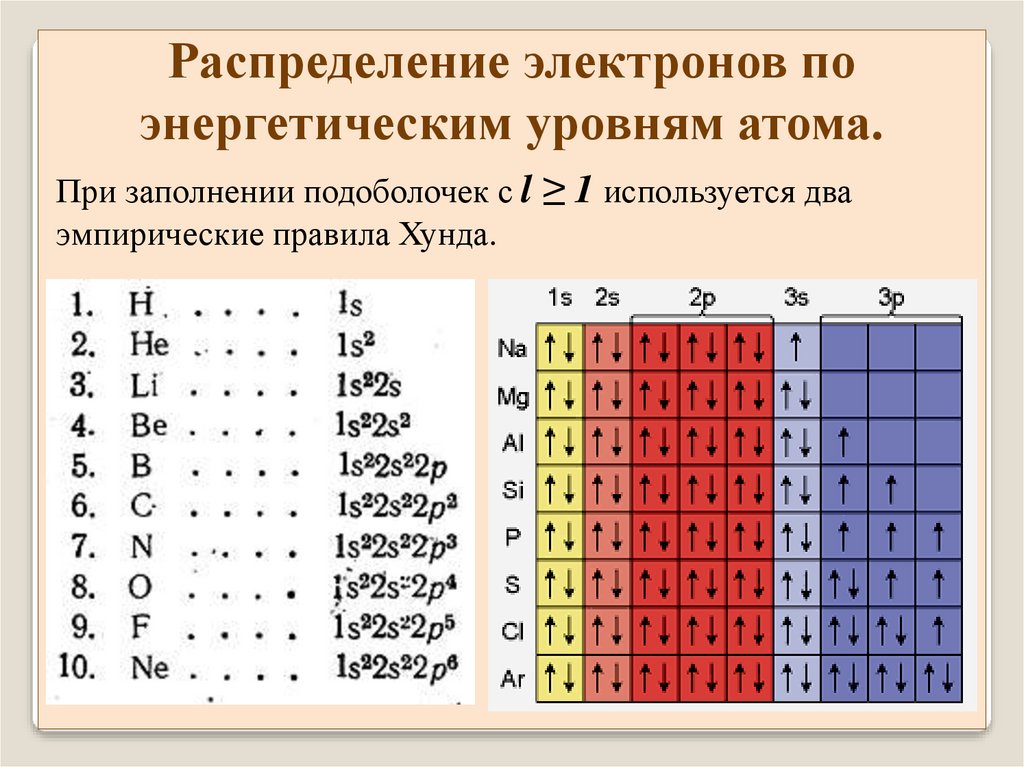
При заполнении подоболочек с l ≥ 1 используется два
эмпирические правила Хунда.
33.
Распределение электронов поэнергетическим уровням атома.
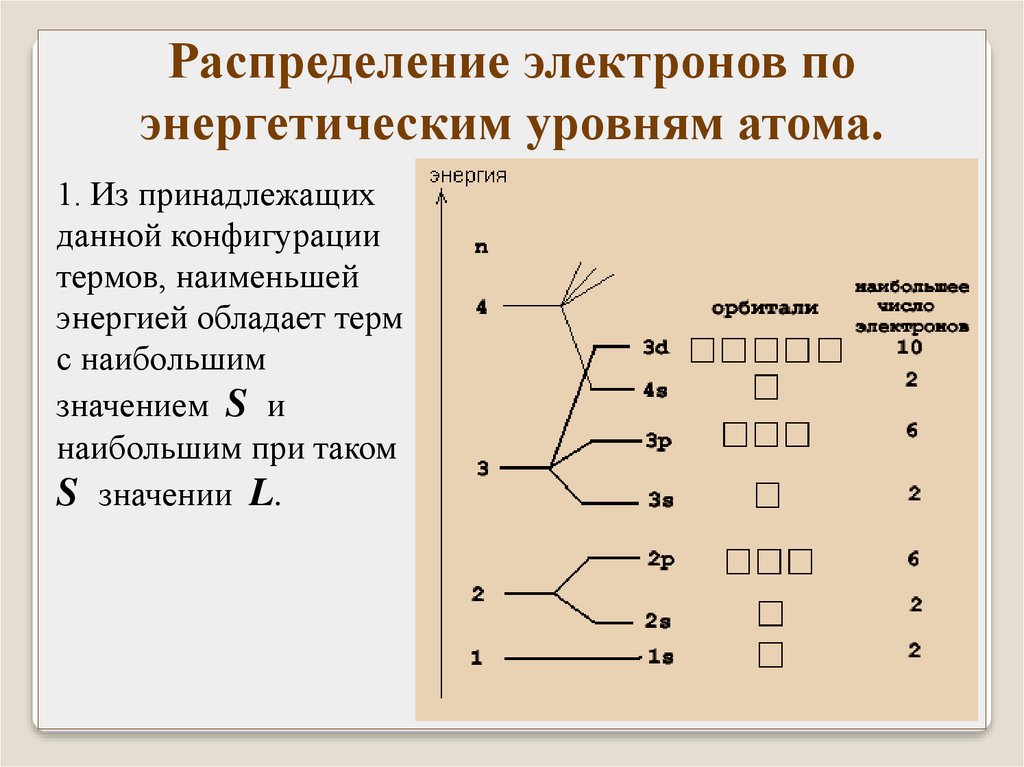
1. Из принадлежащих
данной конфигурации
термов, наименьшей
энергией обладает терм
с наибольшим
значением S и
наибольшим при таком
S значении L.
34.
Распределение электронов поэнергетическим уровням атома.
2. Если заполнено не более половины подоболочки то
J = L – S ,
в остальных случаях
J = L + S.
35.
Распределение электронов поэнергетическим уровням атома.
36.
Распределение электронов поэнергетическим уровням атома.
37.
Распределение электронов поэнергетическим уровням атома.
38.
Энергия молекулыСилы, удерживающие атомы в молекуле, вызваны действием
внешних электронов. Электроны внутренних оболочек при
объединении атомов в молекулу остаются в прежних
состояниях.
Ковалентная связь образуется парами электронов с
противоположно направленными спинами. В молекулах с
одинаковыми ядрами электроны распределены симметрично,
дипольный момент молекулы равен нулю. Молекулы с
разными ядрами имеют дипольный электрический момент изза несимметричного расположения электронов.
Ядра считаются неподвижными.
39.
Энергия молекулыДля молекулы водорода: Потенциальная энергия
2
2
2
2
2
2
ke ke ke ke ke ke
U r
;
r1a
r2 a
r1b
r2b
r12
R
Оператор Лапласа записывается для каждого электрона.
уравнение Шредингера для молекулы водорода.
40.
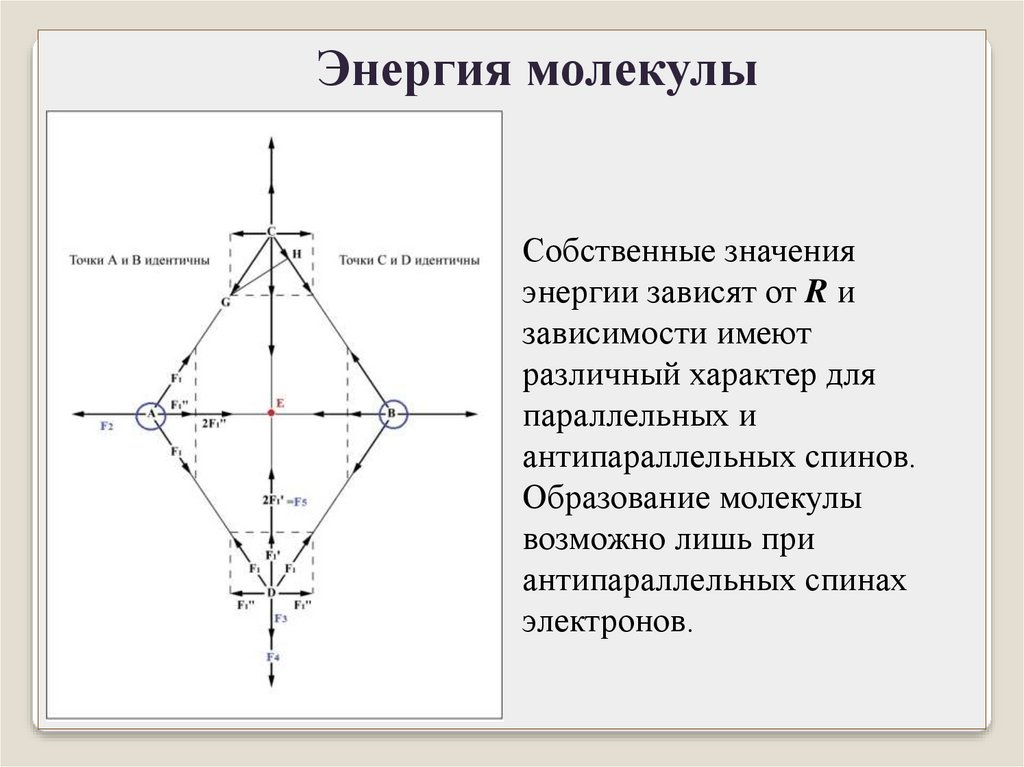
Энергия молекулыСобственные значения
энергии зависят от R и
зависимости имеют
различный характер для
параллельных и
антипараллельных спинов.
Образование молекулы
возможно лишь при
антипараллельных спинах
электронов.
41.
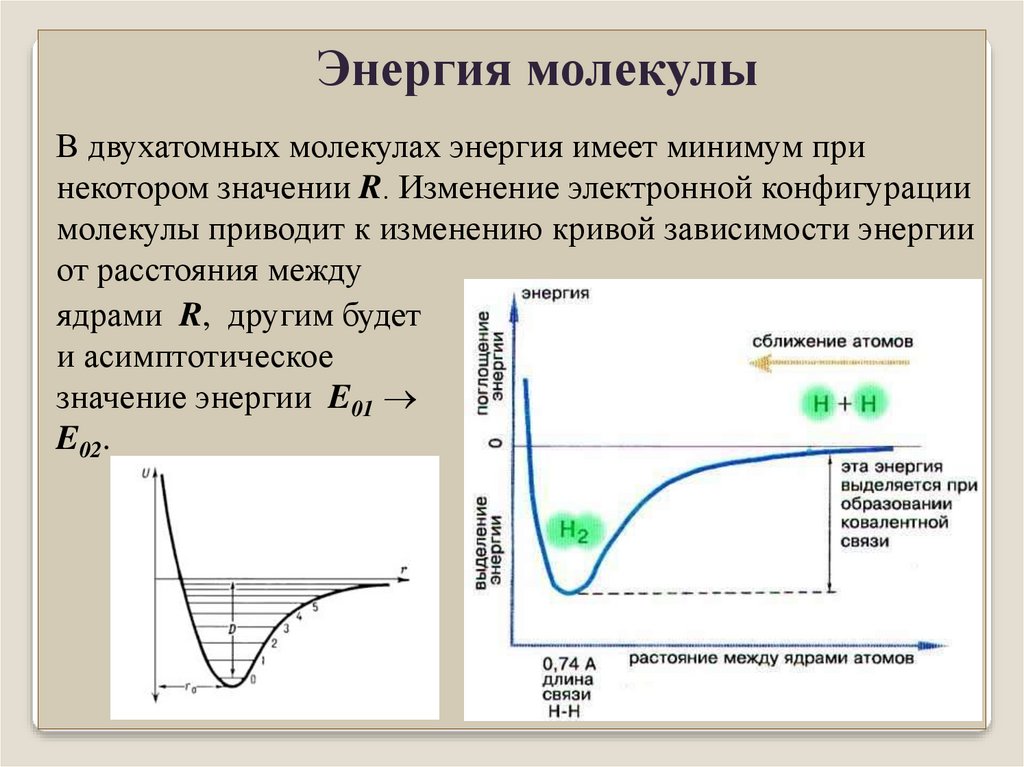
Энергия молекулыВ двухатомных молекулах энергия имеет минимум при
некотором значении R. Изменение электронной конфигурации
молекулы приводит к изменению кривой зависимости энергии
от расстояния между
ядрами R, другим будет
и асимптотическое
значение энергии E01
E02.
42.
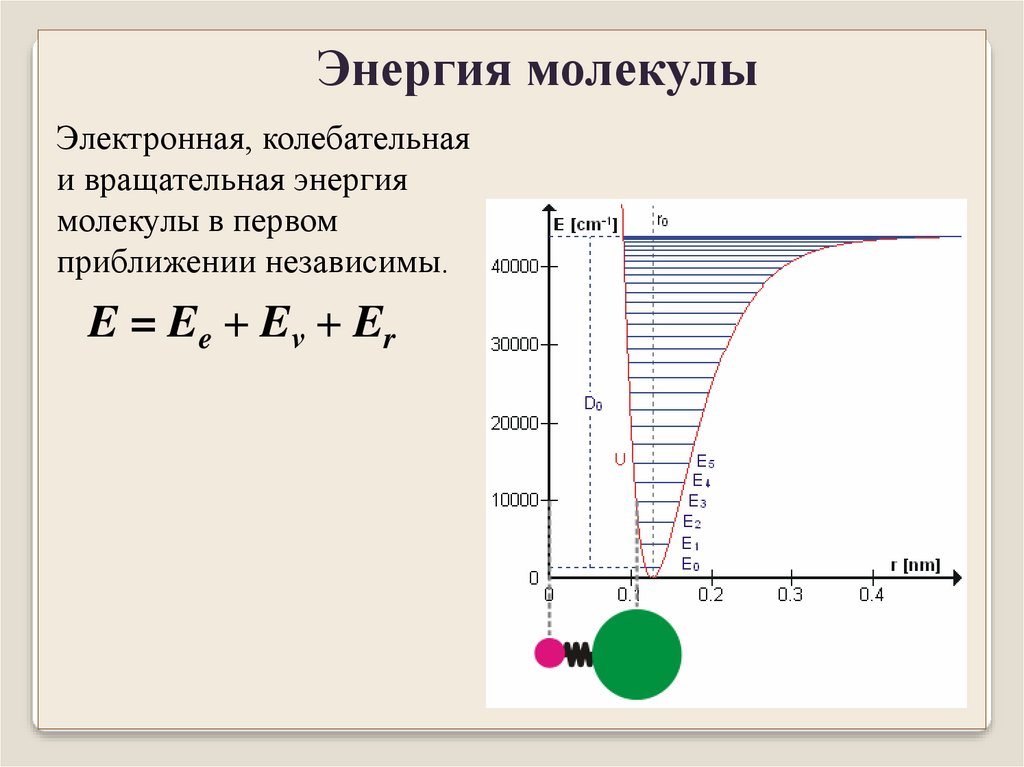
Энергия молекулыЭлектронная, колебательная
и вращательная энергия
молекулы в первом
приближении независимы.
E = Ee + Eν + Er
43.
Энергия молекулыПолосатые спектры из большого
числа близко расположенных
линий: вращательные,
колебательно-вращательные и
электронно-колебательные
полосы. Для последних
характерен кант с одной стороны.
Вращательные и колебательновращательные полосы
наблюдается только для
несимметричных молекул с
отличным от нуля дипольным
моментом, электронноколебательные для всех.


























 physics
physics








