Similar presentations:
Лекция 5. Коллигативные свойства растворов
1. Лекция 5 Коллигативные свойства растворов
2. План
5.1 Первый закон Рауля5.2 Эбулиоскопический закон
Рауля
5.3 Криоскопический закон
Рауля
5.4 Осмос. Осмотическое
давление
3.
Коллигативными (общими)называются свойства растворов,
зависящие только от их
концентрации, точнее от
соотношения числа частиц
растворителя и растворенного
вещества. Коллигативные
свойства не зависят от природы
веществ.
4.
Важнейшими коллигативнымисвойствами растворов являются:
1) Понижение давления пара над
раствором ;
2) Повышение температуры
кипения раствора;
3)
Понижение
температуры
замерзания раствора;
4)
Осмос
и
осмотическое
давление.
5.
Франсуа Мари Рауль,работавший в
университете в
Гренобле, был первым
ученымэкспериментатором,
сделавшим достаточно
точные измерения,
позволившие описать
влияние растворенного
вещества на физические
свойства растворителя.
Франсуа Мари Рауль
(1830-1901)
6.
5.1 Первый законРауля: давление пара
над раствором
нелетучего вещества
меньше давления пара
над чистым
растворителем.
7.
Это явление объясняетсятем, что нелетучее
растворенное вещество
связывает часть молекул
растворителя в виде
сольватов (гидратов),
тормозя процесс испарения.
8.
Площадь под кривой соответствуетобщему числу молекул в жидкости
Растворитель
Растворитель
Растворенное вещество
Молекулы,
способные
переходить
в газовую
фазу
9.
Математическое описаниепервого закона Рауля для
бинарной системы
Для неэлектролитов
Р0-Р
υ(X)
------ = ---------------Р0
υ(X) +υ(р-ль)
10.
ро – давление насыщенного паранад чистым растворителем,
р – давление пара над раствором
нелетучего вещества,
υ(X) – химическое количество
растворенного вещества
11.
Р0-Р------ Р0
относительное
понижения
давления пара
над раствором
12.
Для электролитовР0-Р
iυ(X)
------ = ---------------Р0
iυ(X) +υ(р-ль)
13.
i– изотоническийкоэффициент
(коэффициент ВантГоффа),
характеризующий
диссоциацию
электролита на ионы.
14.
Криоскопический("криос"–холод) и
эбулиоскопический
("эбулио"-кипение)
законы являются
следствием первого закона
Рауля.
15.
5.2Эбулиоскопический
закон Рауля: раствор
нелетучего вещества
кипит при более высокой
температуре, чем чистый
растворитель.
.
16.
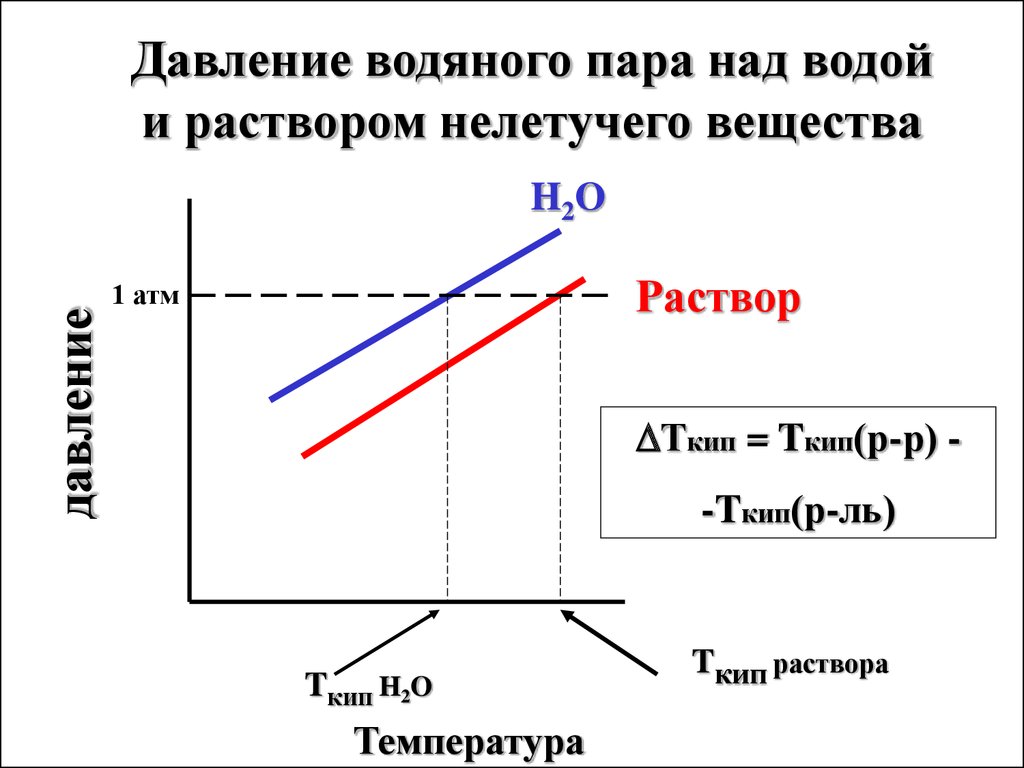
Температура кипения(Ткип) - это
температура, при
которой давление пара
над жидкостью равно
атмосферному
давлению.
17.
Давление водяного пара над водойи раствором нелетучего вещества
давление
H2O
Раствор
1 атм
Ткип = Tкип(р-р) -
-Tкип(р-ль)
Tкип H2O
Температура
Tкип раствора
18.
Математическое описаниеэбулиоскопического закона
Для неэлектролитов
Ткип = Е×Cm
m(X) 1000
Ткип = Е
-------------------------
М(X) m(р-ль)
19.
Для электролитовТкип = iЕCm
m(X) 1000
Ткип = i Е
-------------------------
М(X) m(р-ль)
20.
Е – эбулиоскопическаяконстанта
растворителя
Е (Н2О) = 0,52
21.
5.3 Криоскопическийзакон Рауля: раствор
нелетучего вещества
замерзает при более
низкой температуре,
чем чистый
растворитель.
22.
Температура замерзания(Тзам) - это
температура, при
которой давление пара
над жидкостью равно
давлению над твердым
растворителем.
23.
Математическое описаниекриоскопического закона
Для неэлектролитов
Тзам = К×Cm
m(X) ×1000
Тзам = К
-------------------------
М(X)×m(р-ль)
24.
Для электролитовТзам = i×К×Cm
m(X) ×1000
Тзам = i К
-------------------------
М(X)×m(р-ль)
25.
Тзам = Tзам(р-ль) - Tзам(р-р)Для плазмы крови человека
Тзам =
0
0,56
Для плазмы животных
Тзам =
0
0,58
26.
К – криоскопическаяконстанта
растворителя
К (Н2О) = 1,86
27.
Эбуллиоскопия икриоскопия - это методы,
позволяющие
экспериментально определить
молярные массы растворенных
веществ, а также некоторые
другие характеристики
растворов.
28.
Определение молярноймассы лекарственных
препаратов
криоскопическим методом
широко применяется в
фармакопейных анализах.
29.
5.4 Все растворы обладаютспособностью к диффузии.
Диффузия - это равномерное
распределение вещества по
всему объему раствора,
протекающая по всем
направлениям. Ее движущая
сила - стремление к
максимуму энтропии.
30.
Можно создать условие, прикотором диффузия протекает
только в одном направлении.
Для этого раствор и
растворитель разделяют
полупроницаемой мембраной,
через которую могут проходить
только молекулы (ионы)
небольшого размера.
31.
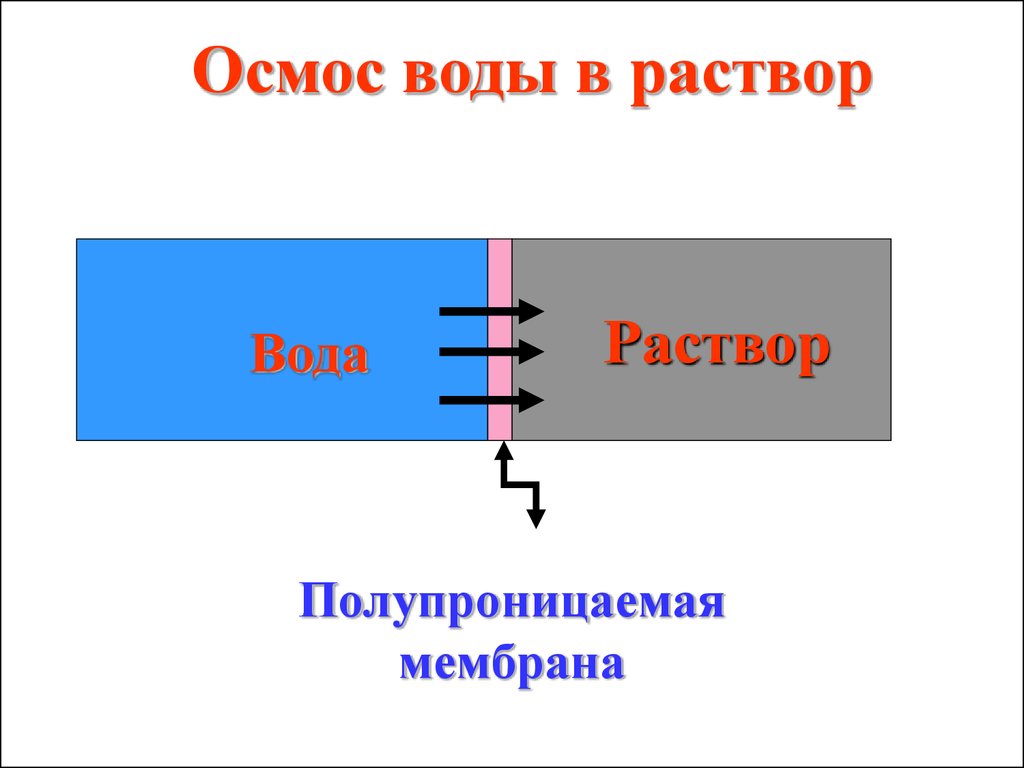
Осмос - односторонняядиффузия растворителя
через полупроницаемую
мембрану из растворителя
в раствор или из
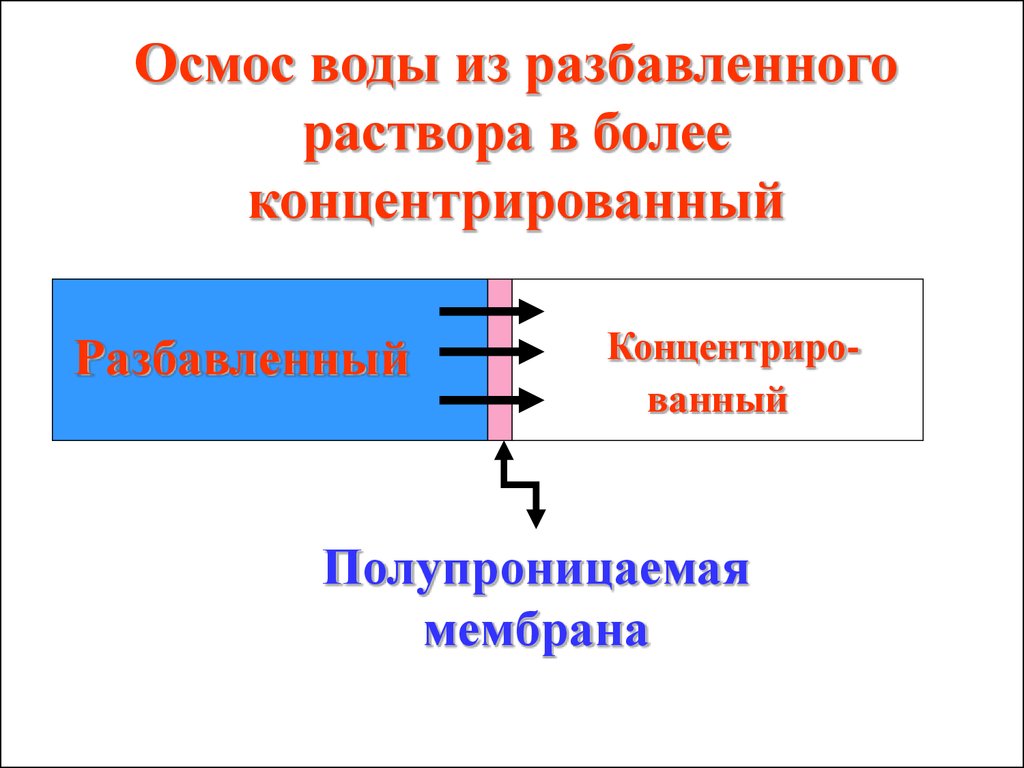
разбавленного раствора в
более концентрированный.
32.
Осмос воды в растворВода
Раствор
Полупроницаемая
мембрана
33.
Осмос воды из разбавленногораствора в более
концентрированный
Разбавленный
Концентрированный
Полупроницаемая
мембрана
34.
Движущей силой осмосаявляется стремление к
выравниванию
концентрации
растворенного вещества
по обе стороны
мембраны.
35.
Процесс протекает самопроизвольно исопровождается
увеличением энтропии.
Пределом его
протекания является
состояние равновесия.
36.
Давление, котороеоказывает
растворитель на
мембрану, называется
осмотическим
давлением (росм).
37.
Осмотическое давлениеописывается уравнением
Вант- Гоффа.
Для неэлектролитов:
росм= См ×R×T
Для электролитов:
росм= i ×См ×R×T
38.
Я.Х.Вант-Гоффявляется
одним из
основателей
физической
химии и
стереохимии.
Он заложил
основы теории
разбавленных Якоб Хендрик Вант-Гофф
растворов.
(1852-1911)
39.
Клеточные мембраныживотных и растительных
организмов являются
проницаемыми для воды и
небольших ионов. Проходя
через них вода создает
осмотическое давление.
Давление плазмы ~ 740 - 780
кПа (370C).
40.
Осмотическое давлениеплазмы и других
биологических
жидкостей обусловлено
главным образом
присутствием
электролитов.
41.
В меньшей степени давлениесоздается коллоидными
частицами белков, не проходящих через мембрану.
Осмотическое давление,
создаваемое белками,
называется онкотическим.
Оно составляет всего 3-4 кПа.
42.
Осмотическийгомеостаз обусловлен
работой почек, легких,
кожи. Работа по переносу
вещества против
градиента концентрации
называется осмотической.
43.
Осмос лежит в основецелого ряда
физиологических
процессов: усвоение пищи,
выделение продуктов
жизнедеятельности,
активный транспорт воды.
44.
В медицинской практикеиспользуют растворы,
изоосмотичные с кровью
(физиологические растворы).
Например, NaCl (0,9%),
глюкоза (4,5%)
45.
Введениефизиологических
растворов в кровь,
спинномозговую жидкость
и другие биологические
жидкости человека не
вызывает осмотического
конфликта.
46.
При введениигипотонического раствора в
кровяное русло
(росм<
740 кПа) наблюдается
набухание эритроцитов
вплоть до разрыва
клеточной оболочки
(гемолиз).
47.
Начальная стадия гемолизанаблюдается при
росм ~ 360 - 400 кПа,
полный гемолиз
наблюдается при
росм = 260 - 300 кПа.
48.
Плазмолиз (сморщиваниеэритроцитов) имеет
место при введении в
кровяное русло
гипертонического
раствора (росм > 780 кПа).
49.
(б)(а)
(в)
Клетка в растворе (a) изотоническом,
(б) гипотоническом,
(в) гипертоническом
50.
Применение гипертонических растворов вмедицине
*10 %-ный раствор NaCl используется
для лечения гнойных ран;
*25 %-ный раствор MgSO4
применяется как гипотензивное
средство;
*различные гипертонические
растворы используются для лечения
глаукомы
51.
Важной характеристикойрастворов, применяемых для
внутривенных инъекций,
является их осмолярность и
осмоляльность. Они
характеризуют содержание
частиц, не способных
диффундировать через
клеточную мембрану.
52.
Благодаримза
внимание!!!

















































 chemistry
chemistry








