Similar presentations:
Коллигативные свойства растворов
1.
"Коллигативные свойства растворов."1
2.
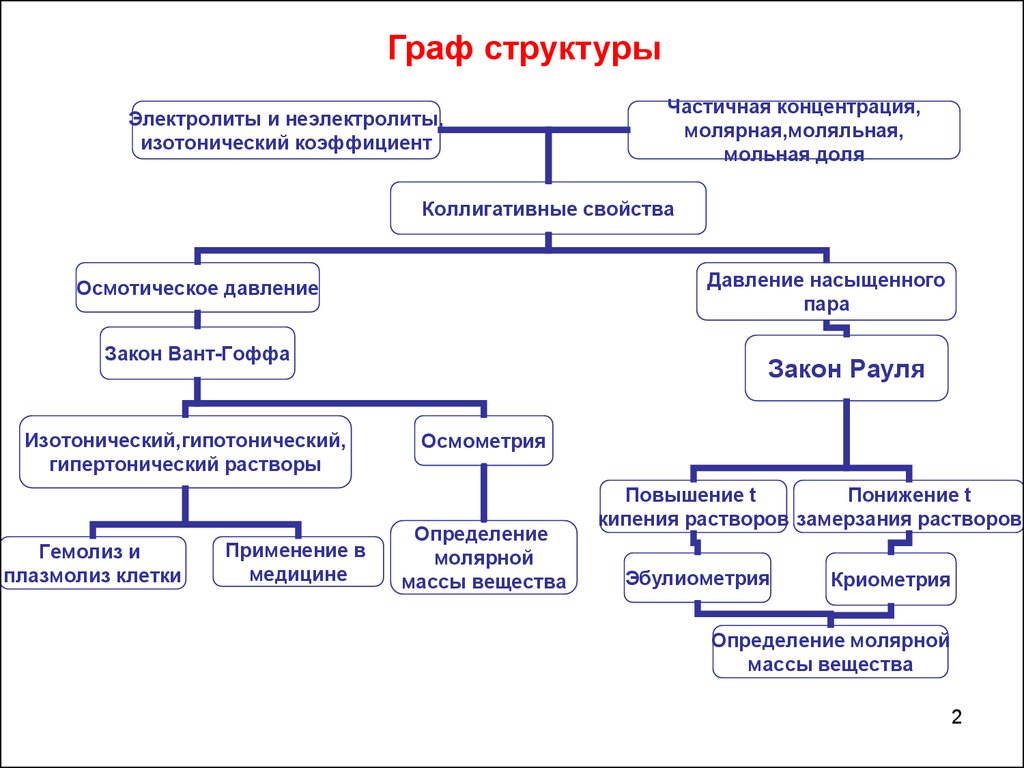
Граф структурыЭлектролиты и неэлектролиты,
изотонический коэффициент
Частичная концентрация,
молярная,моляльная,
мольная доля
Коллигативные свойства
Давление насыщенного
пара
Осмотическое давление
Закон Вант-Гоффа
Изотонический,гипотонический,
гипертонический растворы
Гемолиз и
плазмолиз клетки
Применение в
медицине
Закон Рауля
Осмометрия
Определение
молярной
массы вещества
Повышение t
Понижение t
кипения растворов замерзания растворов
Эбулиометрия
Криометрия
Определение молярной
массы вещества
2
3.
Коллигативные (коллективные) - зависят от количестваимеющихся молекул или ионов растворенного вещества, а не
от природы растворенных частиц
Понижение давления пара растворителя.
Повышение температуры кипения растворителя.
Понижение температуры замерзания растворителя.
Явление осмотического давления.
Коллигативные свойства позволили Аррениусу показать, что
молекулы растворенного вещества в растворе диссоциируют
на ионы.
Коллигативные свойства используются главным образом для
определения молекулярных масс неизвестных веществ.
3
4.
1. Понижение давления пара растворителя:(нелетучее вещество в летучем растворителе)
Закон Рауля:
а) Парциальное давление
насыщенного пара данного компонента
над раствором прямо пропорционально
его мольной доле:
P P
o
H 2O
Рауль Франсуа
(10.05.1830 – 1.06.1901)
Основное
направление
научных исследований – химия
растворов. Его имя связано
главным образом с созданием
основ
криоскопии.
Открыл
носящий его имя закон о
понижении
давления
пара
растворителя.
Сконструировал
газовую горелку.
·NH2O
б) Относительное понижение
давления растворителя равно мольной
доле растворенного вещества.
P
o
H 2O
o
H 2O
P
P
NA
4
5.
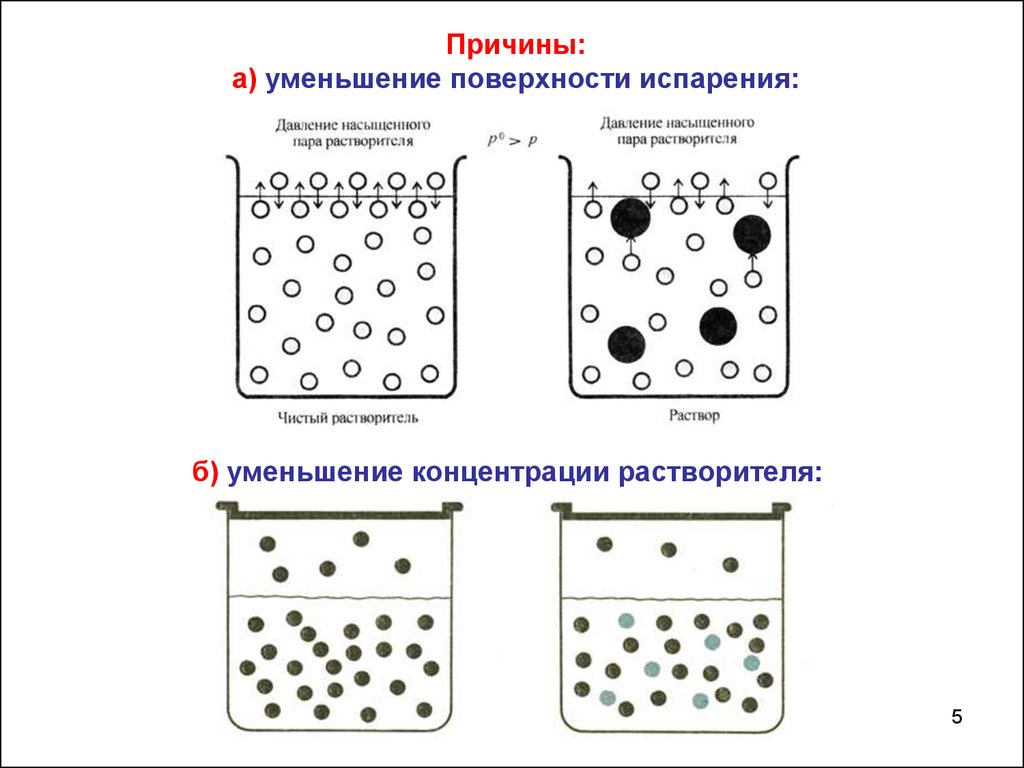
Причины:а) уменьшение поверхности испарения:
б) уменьшение концентрации растворителя:
5
6.
Для идеальных растворов понижение давления насыщенногопара растворителя не зависит от природы растворенного
нелетучего вещества.
Для реальных растворов, где имеют место межмолекулярные
взаимодействия, в это
уравнение необходимо ввести
изотонический коэффициент:
p p
iN A , причем :
0
p
0
i 1
i 1
i 1
для электролитов
для неэлектролитов
для веществ, склонных к
диссоциации
6
7.
2. Эбулиоскопия – повышение ТкипПрисутствие растворенного вещества повышает
температуру кипения раствора
7
8.
Ткип К э ·m,Кэ – эбулиоскопическая константа (град/моль·кг);
m – моляльность (число моль вещества в 1000 г растворителя;)
Т кип
mв ва ·1000
Кэ
M·m р ля
Эбулиоскопия - способ определения М вещества
8
9.
mв ва ·1000М Кэ
Т кип ·m р ля
Значения Кэ
Растворитель
Вода
Бензол
Анилин
Эбулиоскопическ
ая константа
Кэ, оС
0,516
2,57
3,69
Растворитель
Этиловый спирт
Уксусная кислота
CCl4
Эбулиоскопическ
ая константа Кэ,
оС
1,16
3,10
5,00
9
10.
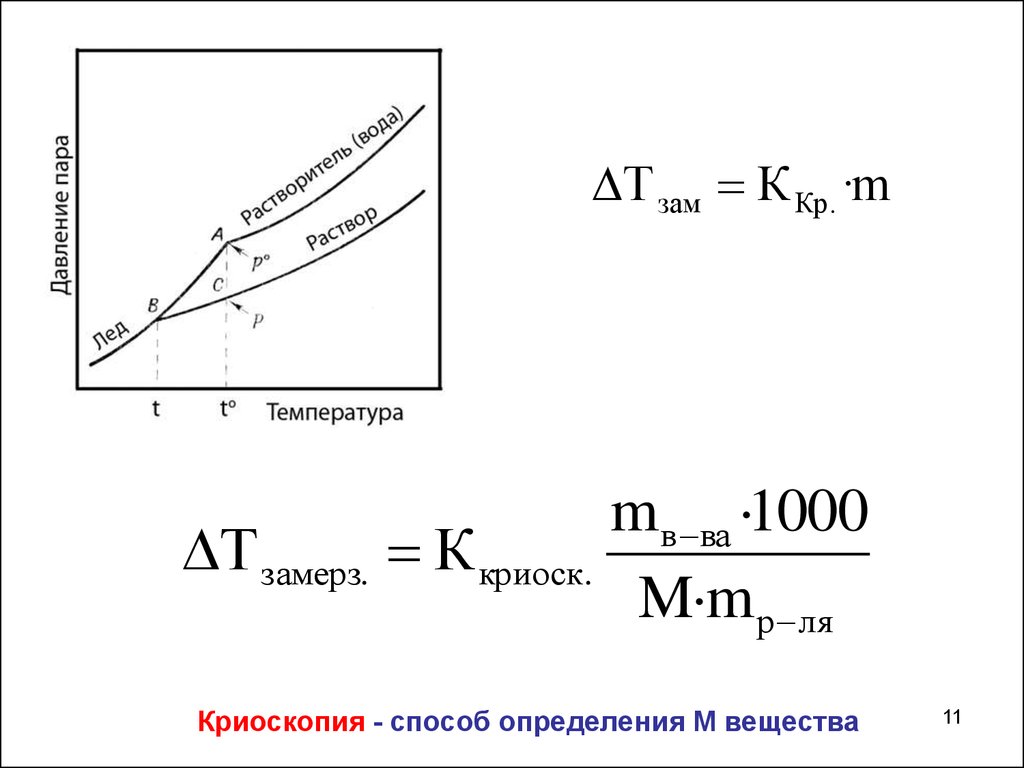
3. Криоскопия – понижение Т замерзанияПрисутствие растворенного вещества понижает
температуру замерзания раствора.
Причина - молекулам растворителя сложней образовать
гомогенные кристаллы твердой фазы.
10
11.
Т зам К Кр . ·mmв ва ·1000
Т замерз. К криоск.
M·m р ля
Криоскопия - способ определения М вещества
11
12.
mв ва ·1000М К криоск.
Т замерз. ·m р ля
Значения Ккр
Растворитель
Криоскопическая
константа Ккр, оС
Вода
Бензол
Анилин
Фенол
1,86
5,12
5,87
7,27
12
13.
Растворы различныхвеществ в воде замерзают
при температуре ниже 0oС
Одномоляльные растворы
различных веществ в воде
замерзают при температуре
13
-1.86oС
14.
1415.
Антифризы - вещества, понижающие температурузамерзания водных растворов
неорганические:
хлориды
аммония, натрия, магния, кальция, а
также карбонат калия.
органические: этиловый спирт,
глицерин и этиленгликоль.
Насыщенный раствор хлористого
кальция остается жидким до - 55 °С.
15
16.
4. Осмос. Осмотическое давление.Осмос - самопроизвольная диффузия молекул растворителя
через полупроницаемую мембрану
Мембрана пропускает молекулы растворителя,
но задерживает молекулы растворенного вещества.
16
17.
Причина осмоса - стремление вещества распределятьсяравномерно по всему объему растворителя.
Осмотическое давление – минимальное
гидравлическое давление, которое нужно
приложить к раствору, чтобы осмос прекратился
17
18.
В 1901 г. Вант-Гофф стал первым лауреатомНобелевской премии по химии, которая была ему
присуждена «в знак признания огромной важности
открытия им законов химической динамики и
осмотического давления в растворах».
Якоб Вант-Гофф
(30.08.1852 –
1.03.1911)
В отличие от большинства химиков своего времени
Вант-Гофф имел основательную математическую
подготовку. Она пригодилась ученому, когда он
взялся за сложную задачу изучения скорости
реакций и условий, влияющих на химическое
равновесие.
Его теоретические работы внесли существенный вклад в развитие
учения о химической кинетике, химическом равновесии, о свойствах
растворов. Создал оригинальный метод вычисления химического
сродства, разработал основы стереохимии.
18
19.
В 1845 году Георг Кольбесинтезировал уксусную кислоту
Невольно большую роль в популяризации новых взглядов Вант-Гоффа
принадлежала профессору Г. Кольбе из Лейпцига. В резкой форме он
высказал свои замечания по поводу статьи голландского ученого: "Какойто доктор Я.Г. Вант-Гофф из Ветеринарного института в Утрехте, видимо,
не имеет вкуса к точным химическим исследованиям. Ему значительно
удобнее воссесть на Пегаса (вероятно, взятого напрокат в Ветеринарном
институте) и провозгласить в своей "Химии в пространстве", что, как ему
показалось во время смелого полета к химическому Парнасу, атомы
расположены в межпланетном пространстве". Естественно, каждого, кто
прочел эту резкую отповедь, заинтересовала теория Вант-Гоффа. 19
Так
началось ее быстрое распространение в научном мире.
20.
Закон Вант-ГоффаP cМ RT
Вант-Гофф и Вильгельм
Оствальд в лаборатории
nRT
P
V
Осмотическое давление вещества в
растворе равно тому давлению,
которое оно оказывало, если бы
находилось в том же объеме, будучи в
газообразном состоянии.
Уравнение осмотического давления находит широкое
применение, при определении молекулярных весов
макромолекул (каучук, целлюлоза, белки)
20
21.
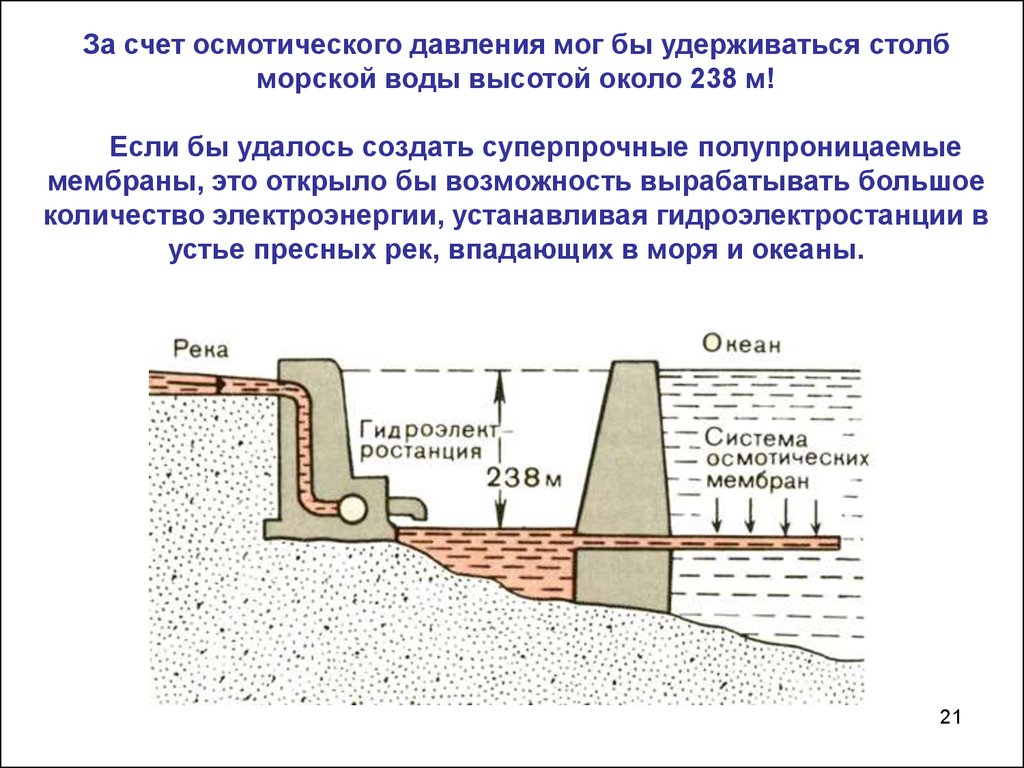
За счет осмотического давления мог бы удерживаться столбморской воды высотой около 238 м!
Если бы удалось создать суперпрочные полупроницаемые
мембраны, это открыло бы возможность вырабатывать большое
количество электроэнергии, устанавливая гидроэлектростанции в
устье пресных рек, впадающих в моря и океаны.
21
22.
Ученые предполагают, что египтяне откалывали гранитные глыбы,заливая помещенные в расщелины скал стволы деревьев
соленым раствором.
Для 1М раствора любого вещества при T = 273 К
Росм = 2270 кПа или 22,4 атм.
1 атм = 101.325 кПа
22
23.
Осмотическое давлениеплазмы крови человека - 7.4-7.8 атм
( 740 – 780 кПа)
рыб
до15 атм.
растений
до 100 атм.
прорастающих семян
до 400 атм.
23
24.
Для растворов электролитов в формулу вводитсякоэффициент Вант-Гоффа i
P ic М RT
i показывает, во сколько раз истинная концентрация
кинетически активных частиц в растворе электролита больше,
чем в растворе неэлектролита с той же концентрацией
Коэффициент Вант-Гоффа можно определить
вышеизложенными методами
C эл
π эл.
t зам. эл.
t кип . эл.
Pосм.эл.
i
C неэл π неэл. t зам. неэл. t кип . неэл. Pосм.неэл.
24
25.
Осмометрыа) с животной мембраной
б) с фарфоровой мембраной, пропитанной феррицианидом меди
в) для прямого измерения осмотического давления
25
26.
Онкотическое давление– осмотическое давление, создаваемое за счет наличия белков
в биожидкостях организма и составляет 0,5% от общего
осмотического давления плазмы ( 0.025 – 0.04 атм )
Разрушение белков при гнойных
процессах сильно увеличивает
величину онкотического давления.
При заболеваниях, сопровождающихся уменьшением
концентрации белков крови, онкотическое давление падает.
Возникают так называемые онкотические отеки подкожной
клетчатки.
Онкотическое давление играет важную роль в процессах
всасывания жидкости из тканей в кровеносные сосуды. 26
27.
--COO
Na+
Осмолярность
(осмолярная концентрация)
-NH3+
Pt-COOОсмолярная концентрация - суммарное
молярное количество всех кинетически
активных частиц, содержащихся в 1 литре
раствора, независимо от их формы,
размера и природы ( 0.29 – 0.30 моль/л)
Их суммарное осмотическое давление при
37°С составляет 7,7 атм.
Cl-
Ca2+
Fe3+
27
28.
Физиологические растворы0,9%-ный ( 0,15 М ) раствор NаСl и 5% - ный ( 0,3М ) раствор
глюкозы создают такое же давление являющиеся, следовательно,
изотоническими по отношению к крови.
Истинно физиологическими !!!
считаются растворы, включающие соли, белки и другие вещества в
пропорциях, соответствующих их содержанию в крови человека и
используемые в аппарате «искусственная почка»
28
29.
ИзоосмияИзоосмия
постоянство
осмотического
давления
физиологических сред (фундаментальное физико-химическое
требование гомеостаза).
Нарушение изоосмии оказывается губительным для организма
гораздо раньше, чем наступает плазмолиз или лизис клеток.
Понижение осмотического давления (избыток воды, потеря
солей) вызывает рвоту, судороги, затемнение сознания, вплоть до
гибели организма.
Повышение же осмотического давления (потеря воды, избыток
солей) вызывает их отеки, в первую очередь подкожной клетчатке.
29
30.
Изо-, гипер- и гипотонические растворыИзотонические - с одинаковым осмотическим давлением (0.9%)
Гипертонические - с большим осмотическим давлением (>0.9%)
Гипотонические - с меньшим осмотическим давлением (<0.9%)
Во всех случаях, когда в кровяное русло, мышечную ткань,
спинномозговой канал в терапевтических целях вводят растворы,
необходимо избегать «осмотического конфликта».
30
31.
Осмотический конфликт: внезапное изменениеконцентрации растворенных солей - например, если рыбу
без постепенной акклиматизации пересаживают из воды,
бедной минеральными солями, в воду, богатую
минеральными солями ( в гипертонический раствор!). Это
приводит к смерти рыбы в течение 2-3 суток и часто
является причиной высокой смертности среди недавно
приобретенных рыб у невежественных или равнодушных
аквариумистов.
Лечение. Приведите содержание минеральных солей в воде к уровню,
приемлемому для данного вида рыб.
В случае осмотического шока это соответствие должно быть полным, а
установить его нужно немедленно. Недавно приобретенных рыб, если они
явно поражены, лучше перевести в другой аквариум с подходящим
химическим составом воды (например, в карантинный аквариум, где они в
любом случае должны какое-то время находиться!), вместо того чтобы
изменять химический состав воды в основном аквариуме, так как это может
вызвать осмотический шок у рыб, уже живущих там. Потом воду в
карантинном аквариуме можно постепенно, в течение 2-3 недель, привести в
соответствие с водой в основном аквариуме и тогда перевести новых рыб в
их постоянное жилище.
31
32.
Осмотический шок: пребывание в воде, которая либо неестественно богатаминеральными веществами, либо, наоборот, неестественно бедна ими.
Осмотический стресс имеет более серьезные последствия для рыб тех
видов, которые в природе обитают в водоемах, богатых минеральными
веществами, а в аквариуме их держат в воде, крайне бедной этими
веществами (гипотонический раствор!).Такие рыбы имеют менее
эффективную систему осмотической регуляции, чем те, которые
физиологически адаптированы к жизни в воде, бедной минеральными
веществами. Поэтому они не способны справиться с возникающими в
результате подобных условий перегрузками осморегулирующей системы.
В случае осмотического стресса концентрацию растворенных солей следует
изменять постепенно в течение 1-2 недель, чтобы избежать осмотического
32
шока.
33.
Изменения, происходящие с кровяными тельцами в растворахNaCl различной концентрации
При введении гипертонических наблюдается:
1) осмотический шок
2) осмотический конфликт
3) флуороз
4) ацидоз
При введении гипотонических растворов наблюдается:
1) осмотический шок
2) осмотический конфликт
3) ацидоз
4) алкалоз
33
34.
Рабочие «горячих» цехов должны пить подсоленную воду, таккак в результате повышенного потоотделения
осмотическое давление у них понижается !
34
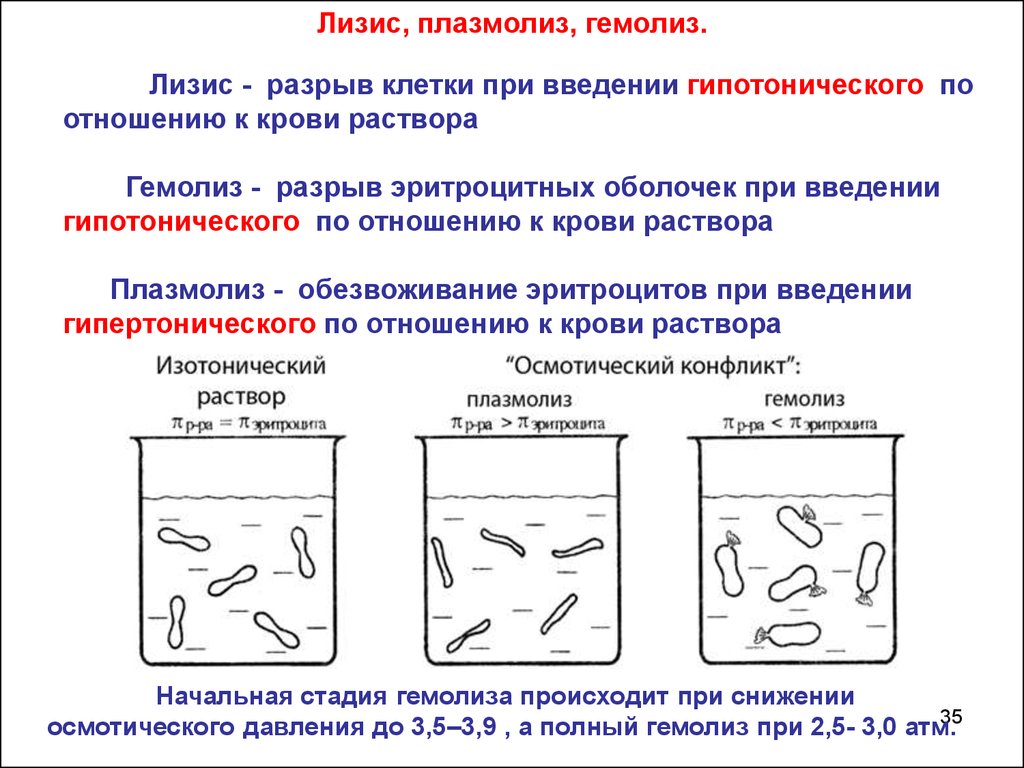
35.
Лизис, плазмолиз, гемолиз.Лизис - разрыв клетки при введении гипотонического по
отношению к крови раствора
Гемолиз - разрыв эритроцитных оболочек при введении
гипотонического по отношению к крови раствора
Плазмолиз - обезвоживание эритроцитов при введении
гипертонического по отношению к крови раствора
Начальная стадия гемолиза происходит при снижении
35
осмотического давления до 3,5–3,9 , а полный гемолиз при 2,5- 3,0 атм.
36.
Изменения, происходящие с кровяными тельцами в растворахNaCl различной концентрации
норма
0,9 % NaCl
изотонический
раствор
плазмолиз
0,3 % NaCl
гипотонический
раствор
гемолиз
(лизис)
1.2 % NaCl
гипертонический
раствор
36
37.
Консервированиепродуктов питания
происходит благодаря
уничтожению
микроорганизмов
вследствие их
плазмолиза.
Плазмолиз также
наблюдается при
посыпании ягод или
фруктов сахаром, а
овощей, мяса или
рыбы - солью.
37
38.
Тургор– осмотическое набухание клетки с появлением сильного
внутреннего давления
Тургор определяет объем и форму клеток (эритроцитов).
Для нормального функционирования тургорное давление
должно быть ниже осмотического - только в этих условиях
наблюдается активный транспорт в клетку.
Испарение воды листьями в
окружающую среду (транспирация)
поддерживается накоплением воды
через ствол и ветви за счет
осмотического давления.
38
39.
Нарушения водного обменаГипергидратация – избыточное поступление воды в организм
либо недостаточное ее выведение
39
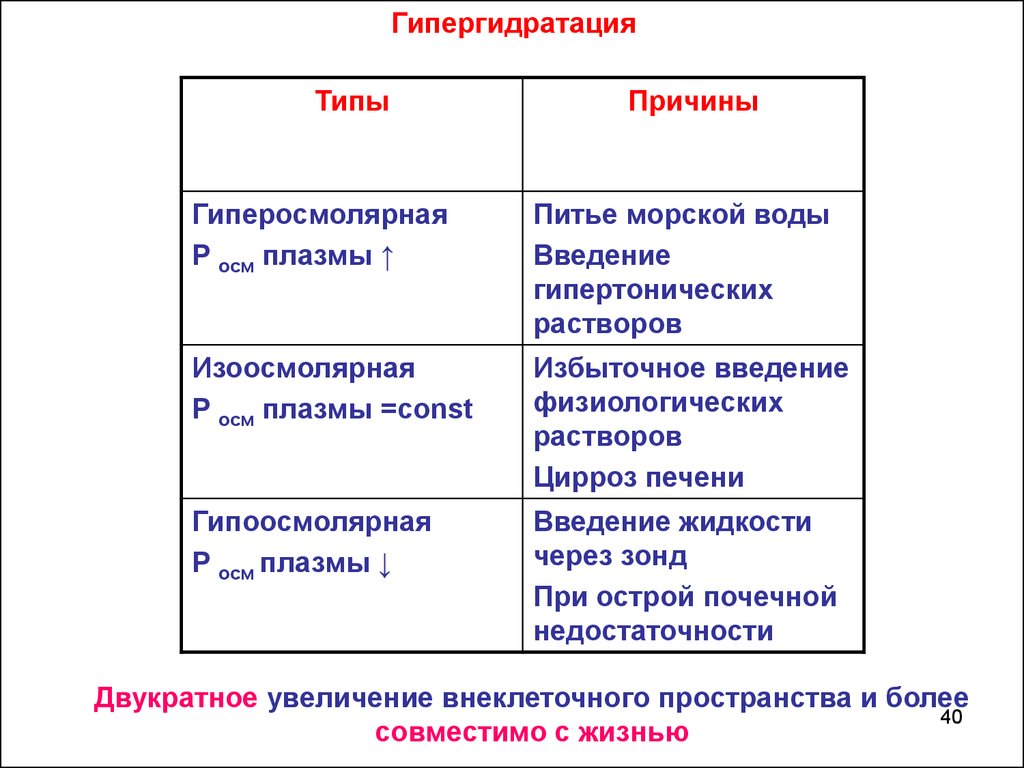
40.
ГипергидратацияТипы
Причины
Гиперосмолярная
Р осм плазмы ↑
Питье морской воды
Введение
гипертонических
растворов
Изоосмолярная
Р осм плазмы =const
Избыточное введение
физиологических
растворов
Цирроз печени
Гипоосмолярная
Р осм плазмы ↓
Введение жидкости
через зонд
При острой почечной
недостаточности
Двукратное увеличение внеклеточного пространства и более
40
совместимо с жизнью
41.
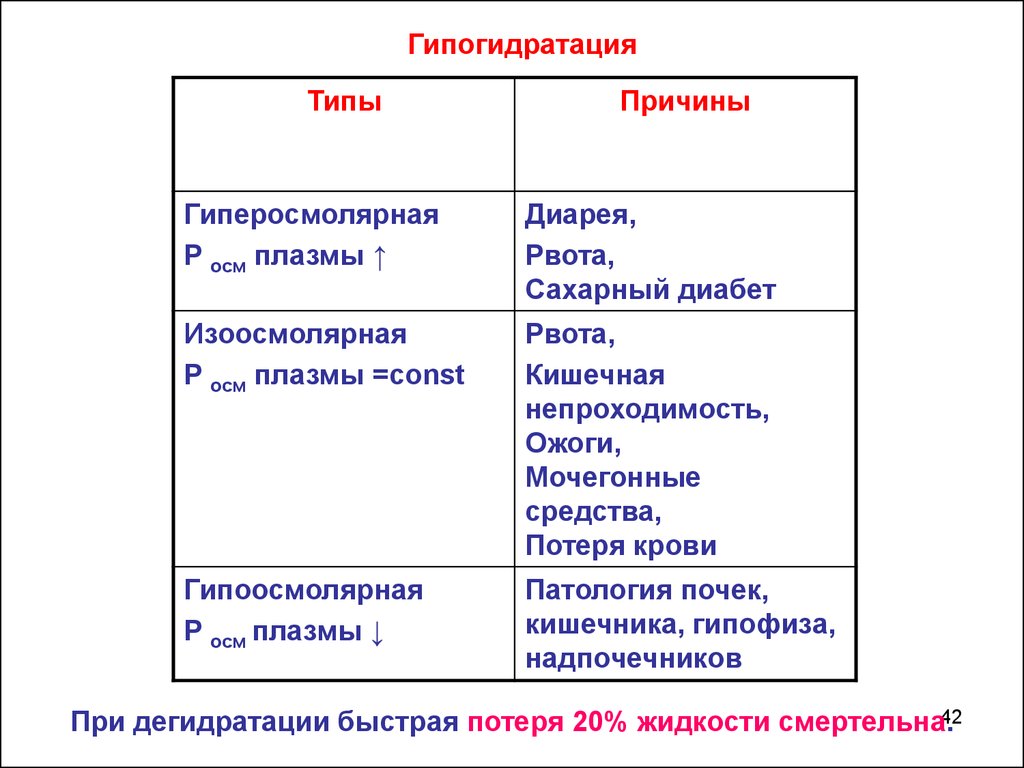
Гипогидратация – обезвоживание организма вследствиезначительного снижения поступления воды в организм,
либо чрезмерные её потери.
41
42.
ГипогидратацияТипы
Причины
Гиперосмолярная
Р осм плазмы ↑
Диарея,
Рвота,
Сахарный диабет
Изоосмолярная
Р осм плазмы =const
Рвота,
Кишечная
непроходимость,
Ожоги,
Мочегонные
средства,
Потеря крови
Гипоосмолярная
Р осм плазмы ↓
Патология почек,
кишечника, гипофиза,
надпочечников
При дегидратации быстрая потеря 20% жидкости смертельна.42
43.
Значение осмотического давления1. Слабительное действие глауберовой соли Na2SO4·10H2O и
горькой соли MgSO4·7H2O.
Плохая всасываемость стенками желудка вызывает интенсивный
переход воды внутрь кишечника, способствуя послабляющему
действию.
43
44.
2. Осмотическая очистка морской воды44
45.
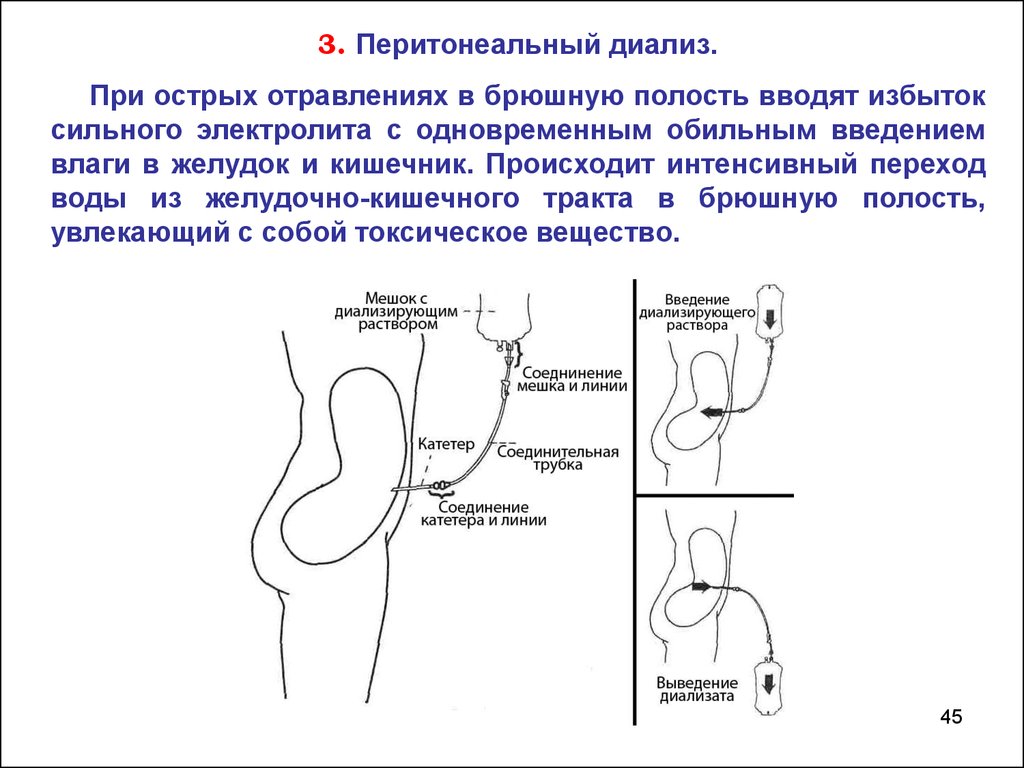
3. Перитонеальный диализ.При острых отравлениях в брюшную полость вводят избыток
сильного электролита с одновременным обильным введением
влаги в желудок и кишечник. Происходит интенсивный переход
воды из желудочно-кишечного тракта в брюшную полость,
увлекающий с собой токсическое вещество.
45
46.
4. При очистке ран от гноя и носителей инфекции используютгипертонические марлевые повязки, пропитанные 10%-ным
раствором NaCI или этанолом .
5. При глаукоме гипертонические растворы вводят внутривенно
чтобы снизить внутриглазное давление.
46
47.
6. Осмос и диализ - основа ряда физиологических процессов:усвоение пищи, окислительные процессы связанные с
дыхательной цепи, распределение питательных веществ,
жидкостной
обмен
в
тканях,
выделение
продуктов
жизнедеятельности.
7. Осмос при купании
В пресной воде болевые ощущения, резь в глазах более
заметны (осмос воды направлен внутрь глазного яблока).
В
морской
воде
замечается
покраснение
глаз
с
незначительными болевыми ощущениями (осмос воды направлен
из глазного яблока в морскую воду)
47








































 chemistry
chemistry








