Similar presentations:
Коллигативные свойства растворов неэлектролитов
1.
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЛекция 6
КОЛЛИГАТИВНЫЕ СВОЙСТВА
РАСТВОРОВ НЕЭЛЕКТРОЛИТОВ
2. Содержание
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСодержание
Общие понятия
Понижение давления насыщенного пара
растворителя над раствором. Закон Рауля
Температуры кипения и кристаллизации растворов
Осмотическое давление
Модуль 2. Лекция 6. Коллигативные свойства растворов неэлектролитов
3. Основные понятия
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАОсновные понятия
Коллигативные свойства - свойства растворов,
которые зависят от концентрации и практически не
зависят от природы растворенных веществ. Такие
свойства в полной мере проявляются в идеальных
растворах
Идеальный раствор – раствор, в котором химическое
взаимодействие между компонентами отсутствует, а
силы межмолекулярного взаимодействия между
компонентами одинаковы
К идеальным растворам по своим свойствам
приближаются очень разбавленные растворы
Модуль 2. Лекция 6. Коллигативные свойства растворов неэлектролитов
4. Понижение давления насыщенного пара растворителя над раствором. Закон Рауля
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАПонижение давления насыщенного пара
растворителя над раствором. Закон Рауля
Насыщенный пар находится в равновесии с жидкостью
H2O(ж)
H2O(пар)
Давление насыщенного пара любого чистого вещества при
данной температуре постоянно
Закон Рауля:
относительное понижение давления насыщенного пара
растворителя над раствором равно молярной доле
растворенного нелетучего вещества
p0 p
p0
0
р0 и p - давление насыщенного пара растворителя над
чистым растворителем и раствором
0 и - количество растворенного вещества и растворителя
Модуль 2. Лекция 6. Коллигативные свойства растворов неэлектролитов
5. Расчеты по закону Рауля
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАРасчеты по закону Рауля
Задача. Рассчитайте давление насыщенного пара воды над
раствором, в 450 г которого содержится 90 г глюкозы С6Н12О6,
при 250С. Давление насыщенного пара воды при этой
температуре равно 3167 Па
p0 p
p0
0
p p 0 (1
0 H2O
mp mгл
MH
гл mгл
Мгл
2
O
)
0
450 90
20 моль
18
90
0,5 моль
180
0,5
p 3167(1
) 3090 Па
20 0,5
Модуль 2. Лекция 6. Коллигативные свойства растворов неэлектролитов
р0 = 3167 Па
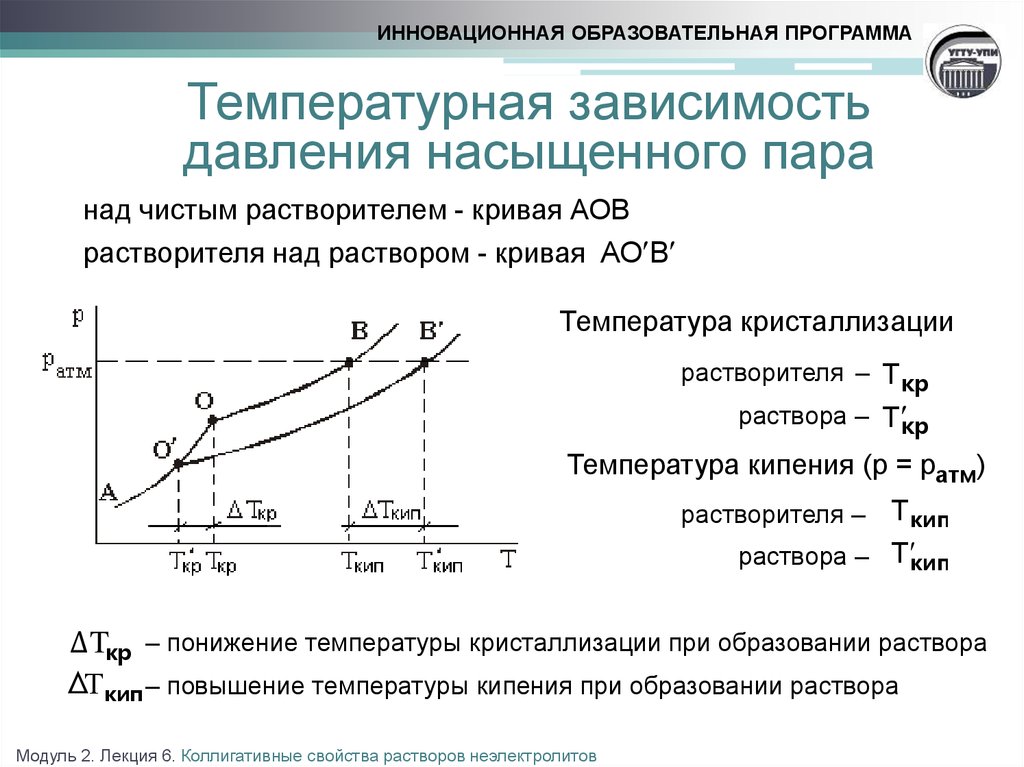
6. Температурная зависимость давления насыщенного пара
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАТемпературная зависимость
давления насыщенного пара
над чистым растворителем - кривая АОВ
растворителя над раствором - кривая АО В
Температура кристаллизации
растворителя – Т кр
раствора – Т кр
Температура кипения (р = ратм)
растворителя – Т кип
раствора – Т кип
Δ Tкр – понижение температуры кристаллизации при образовании раствора
ΔТ кип – повышение температуры кипения при образовании раствора
Модуль 2. Лекция 6. Коллигативные свойства растворов неэлектролитов
7. Температура кристаллизации растворов
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАТемпература кристаллизации растворов
Жидкость кристаллизуется при температуре, которой соответствует
одинаковое давление насыщенного пара над твердой и жидкой
фазами
Температура кристаллизации раствора ниже температуры
кристаллизации чистого растворителя
Понижение температуры замерзания раствора по сравнению с
температурой замерзания чистого растворителя
ΔTкр Kк Cm
Кк - криоскопическая постоянная
Сm - моляльная концентрация
Cm
m0
- количество растворенного вещества
m - масса растворителя
Модуль 2. Лекция 6. Коллигативные свойства растворов неэлектролитов
8. Температура кипения растворов
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАТемпература кипения растворов
Жидкость кипит при температуре, которой соответствуют
равные значения давления насыщенного пара и атмосферного
давления
При постоянном атмосферном давлении температура кипения
раствора выше температуры кипения чистого растворителя
Повышение температуры кипения раствора по сравнению с
температурой кипения чистого растворителя
ΔTкип KэCm
КЭ - эбулиоскопическая постоянная
Сm - моляльная концентрация раствора
Модуль 2. Лекция 6. Коллигативные свойства растворов неэлектролитов
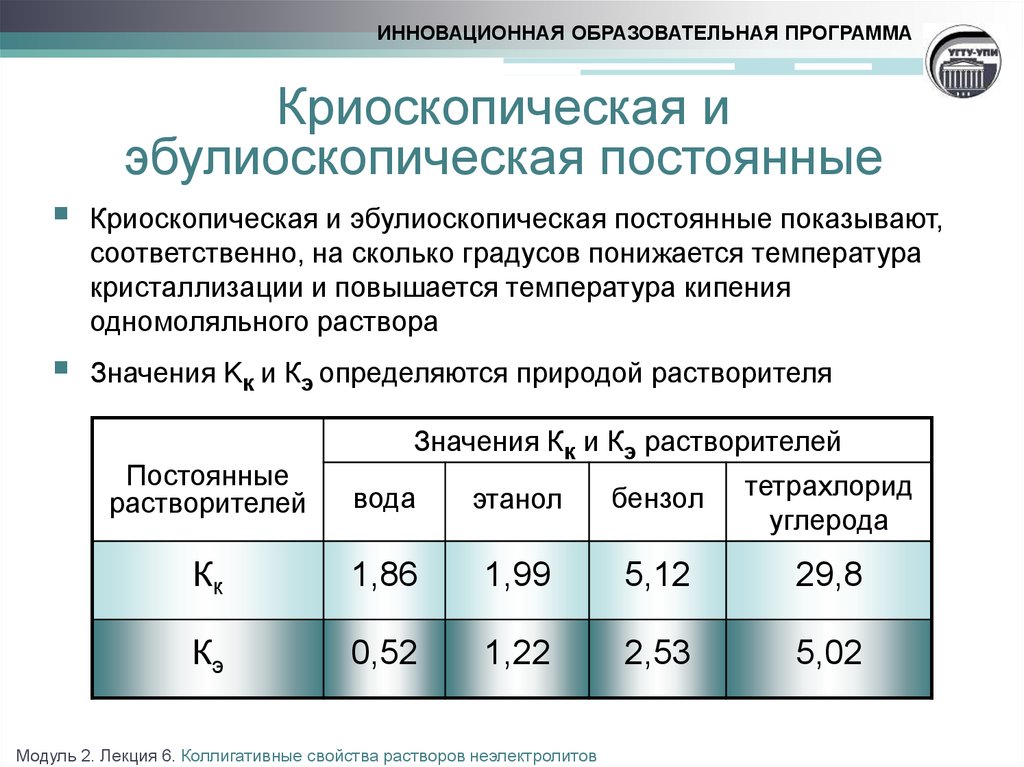
9. Криоскопическая и эбулиоскопическая постоянные
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАКриоскопическая и
эбулиоскопическая постоянные
Криоскопическая и эбулиоскопическая постоянные показывают,
соответственно, на сколько градусов понижается температура
кристаллизации и повышается температура кипения
одномоляльного раствора
Значения Kк и Кэ определяются природой растворителя
Значения Кк и Кэ растворителей
Постоянные
растворителей
вода
этанол
бензол
тетрахлорид
углерода
Кк
1,86
1,99
5,12
29,8
Кэ
0,52
1,22
2,53
5,02
Модуль 2. Лекция 6. Коллигативные свойства растворов неэлектролитов
10. Определение молярной массы криоскопическим методом
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАОпределение молярной массы
криоскопическим методом
Т кр К к Cm К к
m
Кк
m0
Mm 0
M
K кm
m0 Δ Tкр
– количество растворенного вещества, моль
m0– масса растворителя, кг
m – масса растворенного вещества, г
M – молярная масса растворенного вещества, г/моль
Пример. Температура кристаллизации раствора, содержащего 6,15 г
нитробензола в 400 г бензола, равна 4,860С. Определите молярную
массу нитробензола. Температура кристаллизации бензола 5,50С,
-1
криоскопическая постоянная бензола 5,12 ( К моль кг )
ΔTкр tкр 5,5 4,86 0,64 K
5,12 6,15
M
123 г/моль
0,4 0,64
Модуль 2. Лекция 6. Коллигативные свойства растворов неэлектролитов
11. Определение молярной массы эбулиоскопическим методом
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАОпределение молярной массы
эбулиоскопическим методом
Ткип К эCm К э
m
Кэ
m0
Mm0
M
K эm
m0 Δ Tкип
– количество растворенного вещества, моль
m0– масса растворителя, кг
m – масса растворенного вещества, г
M – молярная масса растворенного вещества, г/моль
Пример. Температура кипения 5%-го раствора бензойной кислоты в
эфире равна 35,53оС. Определите молярную массу бензойной
кислоты. Температура кипения эфира 34,6оС, эбулиоскопическая
-1
постоянная эфира 2,16 ( К моль кг )
Δ Tкип tкип 35,53 34,6 0,93 K
2,16 5
M
122 г/моль
0,095 0,93
Модуль 2. Лекция 6. Коллигативные свойства растворов неэлектролитов
12. Осмотическое давление
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАОсмотическое давление
Осмос - самопроизвольный процесс перехода растворителя через
полупроницаемую мембрану, разделяющую раствор и растворитель
или два раствора различной концентрации
Осмотическое давление - равновесное давление раствора,
препятствующее диффузии растворителя через полупроницаемую
мембрану
Осмотическое давление в растворе неэлектролита
пропорционально молярной концентрации растворенного вещества
pосм CRT
Закон Вант-Гоффа: осмотическое давление идеального раствора
равно тому давлению, которое оказывало бы растворенное
вещество, если бы оно, находясь в газообразном состоянии при
данной температуре, занимало объем раствора
Модуль 2. Лекция 6. Коллигативные свойства растворов неэлектролитов
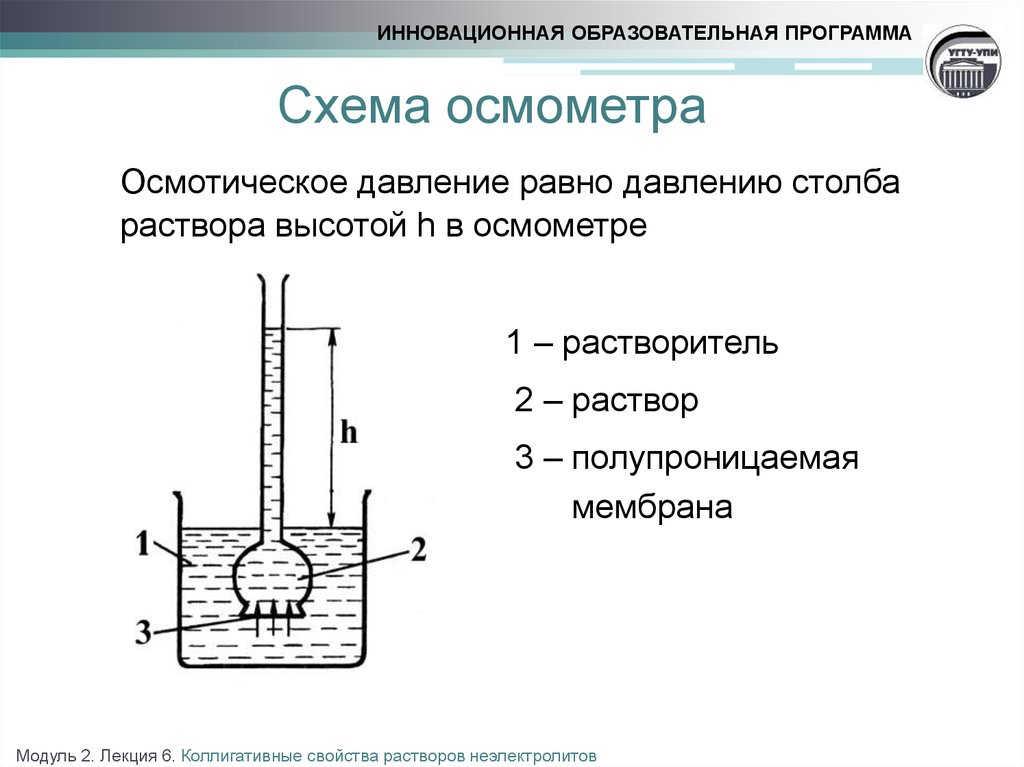
13. Схема осмометра Осмотическое давление равно давлению столба раствора высотой h в осмометре
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСхема осмометра
Осмотическое давление равно давлению столба
раствора высотой h в осмометре
1 – растворитель
2 – раствор
3 – полупроницаемая
мембрана
Модуль 2. Лекция 6. Коллигативные свойства растворов неэлектролитов
14. Расчет осмотического давления
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАРасчет осмотического давления
Задача. Рассчитайте осмотическое давление при
270С раствора сахара С12Н22О11, в 1,5 л которого
содержится 136,5 г растворенного вещества
pосм CRT
mRT
pосм
MV
m
C
MV
m = 136,5 г
М = 342 г/моль
R 8,31 Дж /(моль К )
V 1,5 л 1,5 10 3 м3
Т = 27 + 273 = 300 К
pосм
136,5 8,31 300
342 1,5 10 3
663,3 103 Па 663,3 кПа
Модуль 2. Лекция 6. Коллигативные свойства растворов неэлектролитов
15. Заключение
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЗаключение
Свойства растворов, которые зависят от концентрации и практически не
зависят от природы растворенных веществ, называют коллигативными
Давление насыщенного пара любого чистого вещества при данной
температуре постоянно и определяется природой этого вещества.
Относительное понижение давления насыщенного пара растворителя над
раствором равно молярной доле растворенного нелетучего вещества
Температура кристаллизации раствора ниже температуры
кристаллизации растворителя, а температура кипения раствора при
ратм=const выше температуры кипения растворителя. Изменение
температуры кристаллизации и кипения при образовании раствора
пропорционально моляльной концентрации раствора
Самопроизвольный процесс перехода растворителя через
полупроницаемую мембрану, разделяющую растворитель и раствор или
два раствора, называют осмосом. Равновесное давление раствора,
препятствующее диффузии растворителя - осмотическое давление
Осмотическое давление в растворе пропорционально молярной
концентрации растворенного вещества
Модуль 2. Лекция 6. Коллигативные свойства растворов неэлектролитов
16. Рекомендуемая литература
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАРекомендуемая литература
Никольский А.Б., Суворов А.В. Химия. - СПб: Химиздат, 2001
Карапетьянц М.Х. Общая и неорганическая химия. - М.: Химия,
2000
Угай Я.А. Общая и неорганическая химия. - М.: Высш. шк., 2007
Гаршин А.П. Неорганическая химия в схемах, рисунках,
таблицах, формулах, химических реакциях. - СПб.: Лань, 2000
Степин Б.Д., Цветков А.А. Неорганическая химия. - М.: Высш.
шк., 1994
Неорганическая химия. В 3 т. Т. 1: Физико-химические основы
неорганической химии. Под ред. Ю. Д. Третьякова. - М.:
Академия, 2004
Модуль 2. Лекция 6. Коллигативные свойства растворов неэлектролитов













 chemistry
chemistry








