Similar presentations:
Растворы. Коллигативные свойства разбавленных растворов неэлектролитов и электролитов. Лекция №2
1. Лекция №2
Тема:Растворы. Коллигативные
свойства разбавленных растворов
неэлектролитов и электролитов
Дисциплина «Химия»
Для студентов 1 курса специальности: “Общая
медицина”, “Стоматология”
Лектор: ассоциированный профессор кафедры
биохимии и химических дисциплин, кандидат
химических наук
Болысбекова Салтанат Манарбековна
2. Цель и задачи:
Сформировать знания свойствжидких растворов, зависящих от
числа частиц растворенного
вещества.
3. Актуальность:
знание основ современного учения орастворах необходимо будущему
врачу, поскольку биологические
жидкости (кровь, моча, лимфа и др.)
представляют собой очень сложные
смеси белков, липидов, углеводов,
солей, растворенных в воде.
4. План лекции:
Растворы.Коллигативные свойства растворов
Понижение давления насыщенного пара
(ДНП) над раствором. I закон Рауля
II закон Рауля
Осмос. Осмотическое давление.
Закон Вант-Гоффа.
Коллигативные свойства растворов
электролитов
Обратная связь.
Великая тайна воды.
5.
Как называется гомогенная система,состоящая из растворителя, растворенного
вещества и продуктов их взаимодействия
6. раствор
7.
Растворами называют однородныесистемы переменного состава.
По агрегатному состоянию растворы
могут быть жидкими, газообразными
или твёрдыми.
8. Коллигативные свойства растворов – это свойства, которые зависят от числа частиц растворенного в веществе и не зависят от его
природы:1. Понижение давления насыщенного пара
(ДНП) над раствором
2. Понижение температуры замерзания раствора
(Δtз) и повышение температуры кипения
раствора (Δ t к)
3. Осмотическое давление (π).
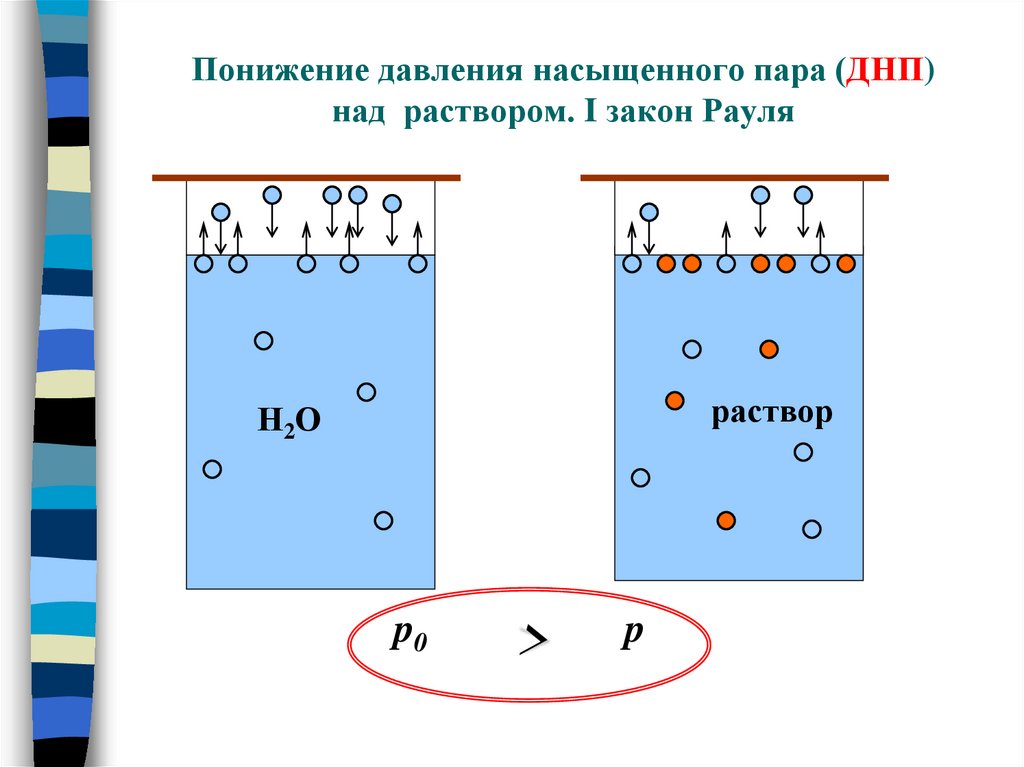
9. Понижение давления насыщенного пара (ДНП) над раствором. I закон Рауля
Н2Оp0
10. Понижение давления насыщенного пара (ДНП) над раствором. I закон Рауля
↑t ↑p0H2O:
00C – 4,6 мм рт. ст.
200C – 17,4 мм рт. ст.
1000C – 760 мм рт. ст.
p0= pатм. жидкость закипает
11. Понижение давления насыщенного пара (ДНП) над раствором. I закон Рауля
растворН2О
p0
>
p
12. Франсуа Мари Рауль (фр. François-Marie Raoult; 10 мая 1830, Фурн-ан-Веп, Нор, — 1 апреля 1901, Гренобль) — французский химик и
Франсуа Мари Рауль (фр. François-MarieRaoult; 10 мая 1830, Фурн-ан-Веп, Нор, — 1
апреля 1901, Гренобль) — французский
химик и физик, член-корреспондент
Парижской академии наук (1890).
С 1867 — в Гренобльском университете
(профессор с 1870). Член-корреспондент
Петербургской АН (1899). Исследуя в
1882—88 понижение температуры
кристаллизации, а также понижение
давления пара (или повышение
температуры кипения) растворителя при
введении в него растворённого вещества,
открыл закон Рауля, применяемый для
определения молекулярных масс веществ в
растворённом состоянии.
13. Понижение давления насыщенного пара (ДНП) над раствором. I закон Рауля
Относительное понижение ДНП растворителя надраствором нелетучего неэлектролита равно молярной доле
растворенного вещества.
РО – Р = N(x ); N(x ) =
n(x2)
m
;
n
=
2
2
PO
n(x2) + n(x1)
M
PO – ДНП над чистым растворителем (Па, атм, мм рт.ст.);
Р – ДНП над раствором;
N(x2) – молярная доля растворенного вещества;
n(x2) – количество растворенного вещества (моль);
n(x1) – количество растворителя (моль);
m – масса вещества (г);
М – молярная масса вещества (г/моль);
Чем больше концентрация растворенного вещества, тем ниже ДНП над
раствором
чем С, тем ↓ ДНП
14. II закон Рауля
Δtк = Кэ·Сm;Δtз = Кз·Сm;
Повышение температуры кипения (Δtк) и
понижение температуры замерзания (Δtз)
разбавленных растворов неэлектролитов
прямо пропорционально моляльной
концентрации раствора.
Δt замерзания = tзамерзания р-ля – tзамерзания р-ра
Δt кипения = t кипения р-ра – t кипения р-ля
15. II закон Рауля Δtк = Кэ·Сm; Δtз = Кз·Сm;
Сm – моляльная концентрация – количество растворенноговещества в 1 кг растворителя (моль/кг):
m вещ-ва
Cm = ————————
M · m раств-ля (кг)
Кэ – эбулиометрическая const, (от лат. ebullire — «кипеть»
и др.-греч. σκοπέω — «наблюдаю») ;
Кз (КК) – криометрическая const, ;
Эти константы зависят от природы растворителя.
Чем больше концентрация растворенного вещества,
тем выше Тк и ниже Тз раствора.
16. Криометрия –метод определения молярной массы вещества (М) по температуре замерзания: Кз · m вещ-ва М вещ-ва = —————— (г/моль)
Δtз·m раств-ля (кг)17.
18.
19. объяснение происхождению осмотического давления.
20. Осмос. Осмотическое давление
Осмос – это односторонняя диффузия воды через полупроницаемоюмембрану из растворителя в раствор или из раствора с меньшей концентрацией в
раствор с большей концентрацией.
Вода из сосуда переходит через
полупроницаемую мембрану (целлофан,
h
оболочка мочевого пузыря) в сосуд
с более концентрированным раствором.
Уровень жидкости в этом сосуде поднимается
на высоту h.
Осмотическое давление π – это сила, вызывающая ОСМОС или
гидростатическое давление столба жидкости, высотой h , от которого
прекращается осмос.
21. Якоб Хендрик Вант-Гофф (нидерл. Jacobus Henricus (Henry) van 't Hoff; 30 августа 1852, Роттердам — 1 марта 1911, Берлин) —
Якоб Хендрик Вант-Гофф(нидерл. Jacobus Henricus
(Henry) van 't Hoff; 30 августа
1852, Роттердам — 1 марта
1911, Берлин) — голландский
химик, первый лауреат
Нобелевской премии по химии
(1901 год) «В знак признания
огромной важности открытия
законов химической динамики и
осмотического давления в
растворах».
22.
Закон Вант-Гоффа – для определения π :Осмотическое давление прямо пропорционально молярной
концентрации раствора и абсолютной температуре:
π = R* C(x)* T
R – газовая постоянная = 8,31 кПа * л/моль * К или 0,083 атм * л/моль *К
Т – абсолютная температура по К (СО + 273);
С(х) – молярная концентрация (моль/л) – количество моль растворенного
вещества в 1 л раствора.
m вещ-ва
C(x) = (моль/л)
M вещ-ва * V р-ра (л)
На практике π определяют по Δtз раствора (C(x)≈Cm):
R * T * Δtз
π =
Кз
23. Значение осмоса
упругость, тургор клетокэластичность тканей, форма органов
усвоение пищи, образование лимфы, мочи, кала
действие лекарств
За счет осмоса вода в организме распределяется между
кровью, тканями, клетками.
24. Приблизительные величины вкладов компонентов плазмы крови в поддержании ее осмоляльности
Осмоляльность % отобщей
ммоль/кг
компоненты
Na+ и анионы
К+ и анионы
I
НМС
Элты
Са2+ и анионы
Мg2+ и анионы
Мочевина
II
Глюкоза
ВМС II белок
I
всего
Не
эл.
270
7
3
1
5
5
~1
~292
92
8
25. Осмотическое давление крови
Состав плазмы крови:90 % Н2О,
7 % белков,
0,9 % эл-тов (> NaCl),
≈ 2 % (лип., а/к, глюкозы, органических кислот).
π = π НМС + π ВМС
(эл. + неэл.) (белки)
ΔТз·R·T
По ΔТз крови =0,56 Сº определяют π плазмы = ———— =
Кз
0,56·0,083·(273+37º)
= ————————— = 7,65 атм
1,86
π пл вмс (белки) = 0,04 – 0,03 атм
π плазмы = π НМС + π ВМС = 7,65 + 0,03(0,04) ≈ 7,7 – 8,1 атм
26. Осмотическое давление, которое зависит от белков называется онкотическим (0,03 – 0,04 атм.). При длительном голодании, болезни
почек концентрация белков в крови уменьшается,онкотическое давление в крови снижается и возникают
онкотические отеки: вода переходит из сосудов в ткани, где
πОНК больше. При гнойных процессах πОНК возрастает в 2–3
раза в очаге воспаления, так как увеличивается число частиц
из-за разрушения белков.
В организме осмотическое давление должно быть постоянным
(≈ 7,7 атм.). При болезнях больным вводят изотонические
растворы.
Это растворы, осмотическое давление которых равно π ПЛАЗМЫ
≈ 7,7 атм. (0,9 % NaCl – физиологический раствор, 5 % раствор
глюкозы). Растворы, у которых π больше, чем у π ПЛАЗМЫ,
называются гипертоническими. В медицине они применяются
для очистки ран от гноя (10 % NaCl), для удаления
аллергических отеков (10 % CaCl2, 20 % – глюкоза), в качестве
слабительных лекарств (Na2SO4∙10H2O, MgSO4∙7H2O).
27. Гемолиз эритроцитов
С1С1
С1
С2
С2
С2
С1 = С2
С1 > С2
С1 < С2
изо-
гипо-
гипер-
гемолиз
плазмолиз
28. Плазмолиз – явление сжатия, высушивания клеток в гипертоническом растворе. Идет осмос воды из клетки в раствор, где π больше.
Гемолиз – явление набухания и разрыва клетокэритроцитов в гипотоническом растворе. Идет осмос
воды в клетки. Клетка набухает, оболочка разрывается.
Растворы, у которых π меньше, чем у π ПЛАЗМЫ,
называются гипотоническими.
Плазмолиз – явление сжатия, высушивания клеток в
гипертоническом растворе. Идет осмос воды из клетки в
раствор, где π больше. Растворы, у которых π больше,
чем у π ПЛАЗМЫ, называются гипертоническими.
29. Коллигативные свойства растворов электролитов
В растворах электролитов число частиц больше из-за диссоциации.Вант-Гофф дал поправочный изотонический коэффициент i,
который учитывает диссоциацию электролитов.
i = 1+ α (n – 1)
/
\
степень
число частиц
диссоциации
из 1 молекулы
На практике i определяют по Δtз, Δtк, π.
Δtз пр
Δtк пр
π пр
i = ———— = ————— = —————
Δtз теор
Δtк теор
π теор
С учетом i формулы для определения коллигативных свойств имеют
вид:
РО – Р
——— = i · N(x2); Δtз = i · Кз· Сm; Δtк = i · Кэ · Cm; π = i · C(x) · R ·T
РО
30. Для сильных электролитов (α≈1):
i = 1+ α (n – 1)NaCl ↔ Na+ + Cl2 иона => n=2, i=2
при α=1
CaCl2 ↔ Ca2+ + 2Cl3 иона => n=3, i=3
при α=1
31. Обратная связь:
Для обеззараживания медицинскихинструментов можно использовать
солевые растворы. Объясните
механизм этого действия. Какой
раствор более эффективен: хлорид
натрия или хлорид кальция?
32. Обратная связь:
У здорового человека температуразамерзания плазмы крови = -0,5 С.
Измеряя температуру замерзания
плазмы крови больного, в
реаниматологии оценивают
возможность его отравления. С точки
зрения законов Рауля, что при этом
должно наблюдаться и почему?

































 chemistry
chemistry








