Similar presentations:
Физико- химические свойства растворов
1. Лекция 6 Физико-химические свойства растворов: коллигативные свойства
Коллигативные свойства– это свойства дисперсных систем, которые
зависят от концентрации, величины и
формы частиц, но не зависят от природы
частиц дисперсной фазы
2. План лекции
1. Броуновское движение и диффузия2. Явление осмоса в ДС
3. Особенности свойств водных растворов
биополимеров. Осмометрия. Мембранное
равновесие Доннана
4. Кипение и замерзание растворов. Закон
Рауля. Следствия из закона Рауля
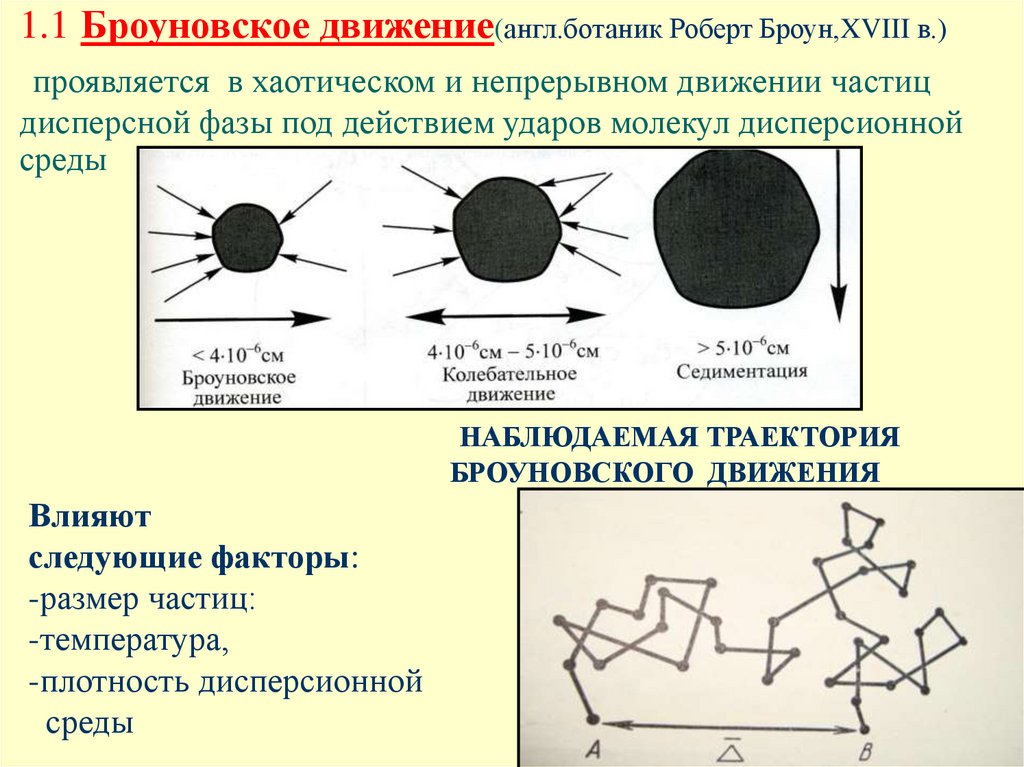
3. 1.1 Броуновское движение(англ.ботаник Роберт Броун,XVIII в.) проявляется в хаотическом и непрерывном движении частиц дисперсной
фазы под действием ударов молекул дисперсионнойсреды
НАБЛЮДАЕМАЯ ТРАЕКТОРИЯ
БРОУНОВСКОГО ДВИЖЕНИЯ
Влияют
следующие факторы:
-размер частиц:
-температура,
-плотность дисперсионной
среды
4. 1.2 Диффузия – самопроизвольный процесс выравнивания концентрации вещества в растворе
D – коэффициент диффузии,м2/с
Закон Фика: скорость диффузии вещества пропорциональна площади
поверхности, через которую переносится вещество, и градиенту концентрации
этого вещества
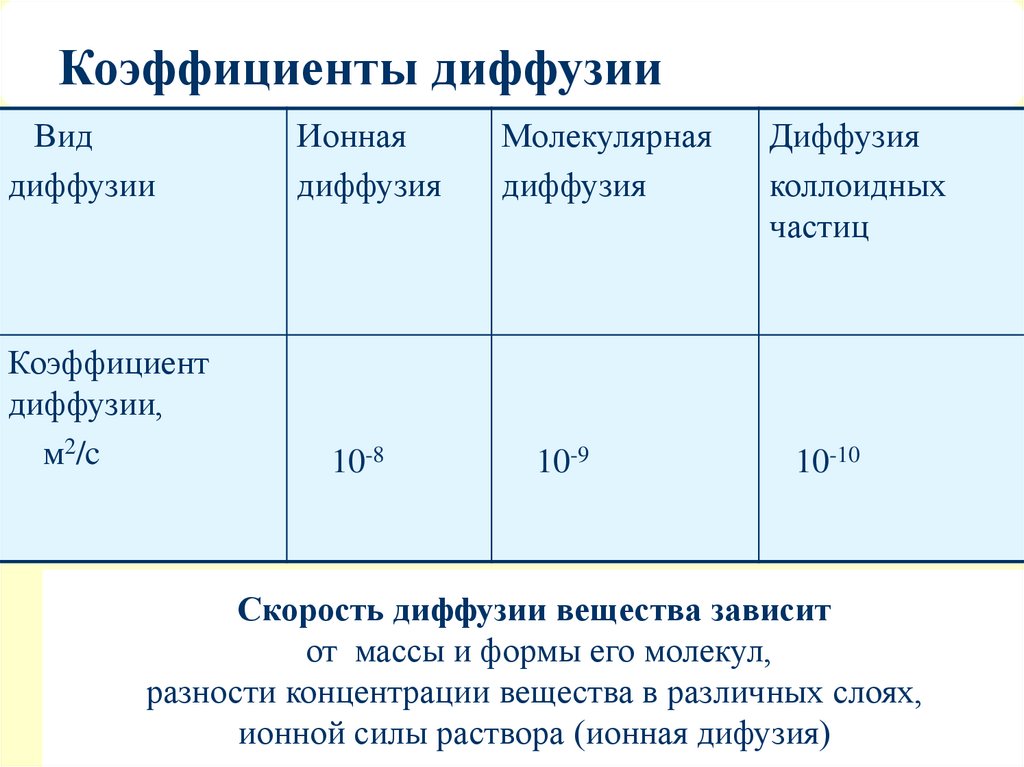
5. Коэффициенты диффузии
Виддиффузии
Коэффициент
диффузии,
м2/c
Ионная
диффузия
10-8
Молекулярная
диффузия
10-9
Диффузия
коллоидных
частиц
10-10
Скорость диффузии вещества зависит
от массы и формы его молекул,
разности концентрации вещества в различных слоях,
ионной силы раствора (ионная дифузия)
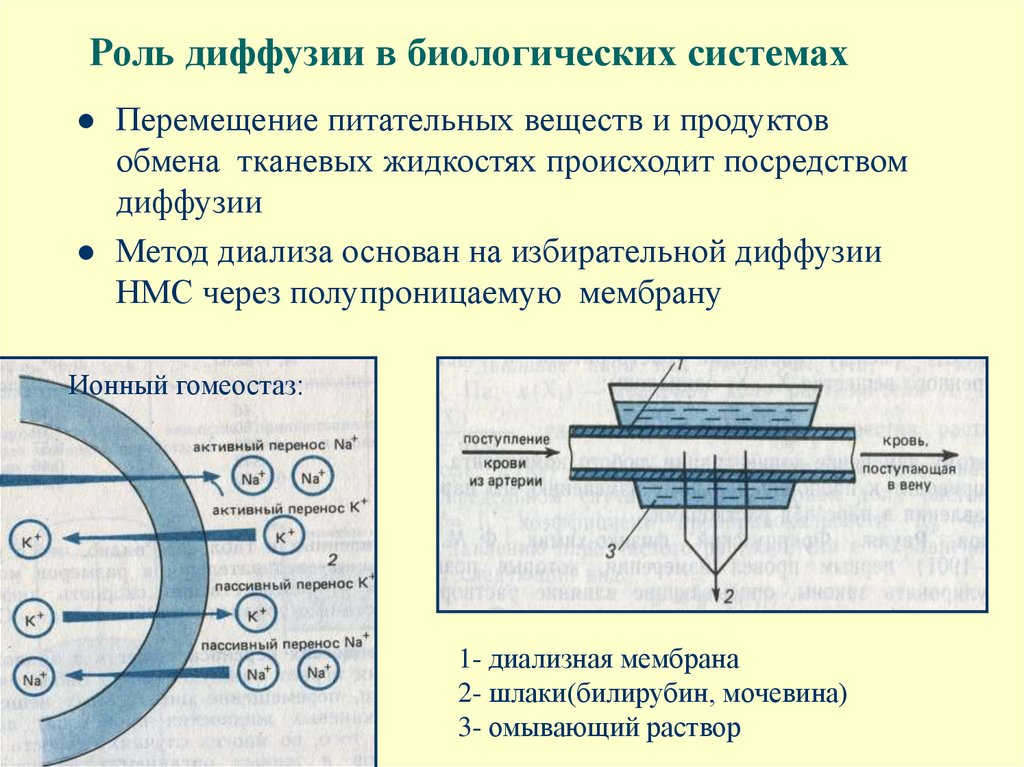
6. Роль диффузии в биологических системах
Перемещение питательных веществ и продуктовобмена тканевых жидкостях происходит посредством
диффузии
Метод диализа основан на избирательной диффузии
НМС через полупроницаемую мембрану
Ионный гомеостаз:
1- диализная мембрана
2- шлаки(билирубин, мочевина)
3- омывающий раствор
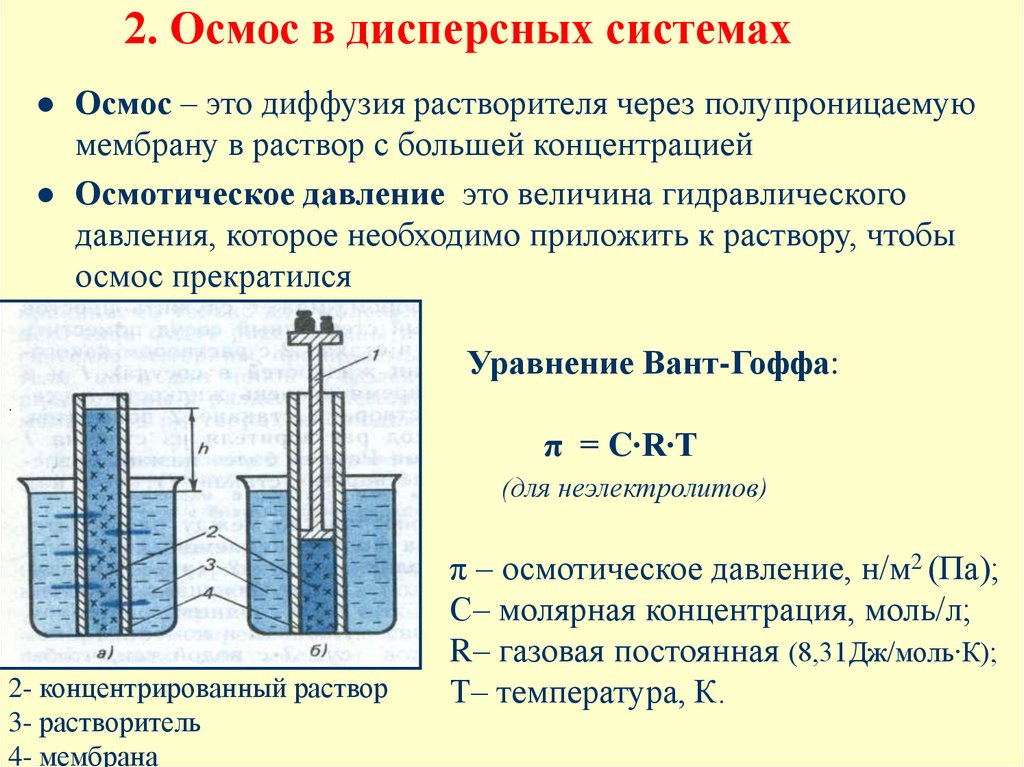
7. 2. Осмос в дисперсных системах
Осмос – это диффузия растворителя через полупроницаемуюмембрану в раствор с большей концентрацией
Осмотическое давление это величина гидравлического
давления, которое необходимо приложить к раствору, чтобы
осмос прекратился
Уравнение Вант-Гоффа:
.
π = C∙R∙T
(для неэлектролитов)
2- концентрированный раствор
3- растворитель
4- мембрана
π – осмотическое давление, н/м2 (Па);
С– молярная концентрация, моль/л;
R– газовая постоянная (8,31Дж/моль∙К);
Т– температура, К.
8.
Для электролитов:π = i∙C∙R∙T
i - изотонический коэффициент
эл.
i
неэл.
i = 1 + α(n – 1)
α – кажущаяся степень ионизации электролита
n – число частиц, которые образуются при ионизации
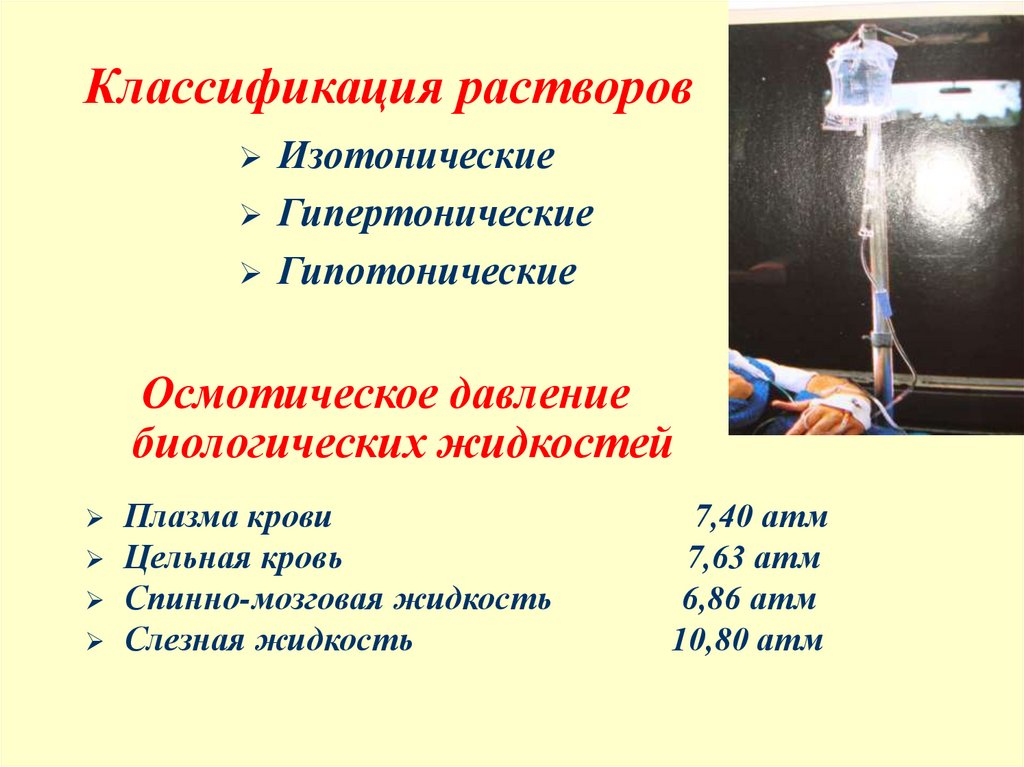
9. Классификация растворов
ИзотоническиеГипертонические
Гипотонические
Осмотическое давление
биологических жидкостей
Плазма крови
Цельная кровь
Спинно-мозговая жидкость
Слезная жидкость
7,40 атм
7,63 атм
6,86 атм
10,80 атм
10. Задача 1
Какое осмотическое давление будут иметьрастворы глюкозы, хлорида и сульфата натрия с
концентрацией 0,3 М?
Чему равно число осмолярно-активных частиц?
Универсальная газовая постоянная:
R = 8,31 Дж/(моль∙К)
R = 0,082 л∙атм/(моль∙К)
R = 82,4 л∙мм рт ст/(моль∙К)
Па = Н/м2; Дж = Н∙м;
1 атм = 101,3 кПа = 101300 Па = 760 мм рт.ст.
11. Применение гипертонических растворов:
Гипертонические повязки в гнойнойхирургии
Слабительные средства
Для внутривенного введения при
глаукоме для снижения ВГД(25% MgSO4)
Для консервирования продуктов (сиро
и рассолы)
12. Роль осмоса в биологических системах
13.
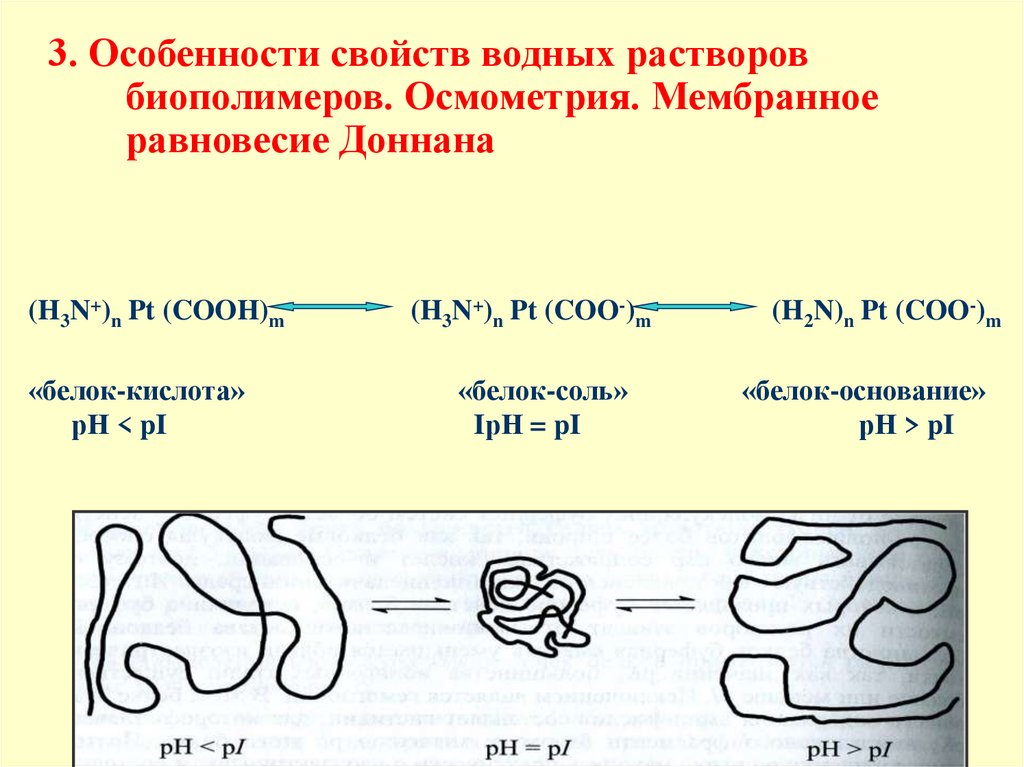
3. Особенности свойств водных растворовбиополимеров. Осмометрия. Мембранное
равновесие Доннана
(H3N+)n Pt (COOH)m
«белок-кислота»
рН < pI
(H3N+)n Pt (COO-)m
«белок-соль»
IрН = pI
(H2N)n Pt (COO-)m
«белок-основание»
рН > pI
14. Для ВМС ( уравнение Галлера):
Онкотическое давление –это осмотическое давление,создаваемое за счет наличия белков в биожидкостях организма
Для ВМС
( уравнение Галлера):
С
2
RT вC
М
С – концентрация ВМС, г/л;
М – молекулярная масса ВМС, г/моль;
в – константа Галлера;
R – универсальная газовая постоянная;
Т – температура, К.
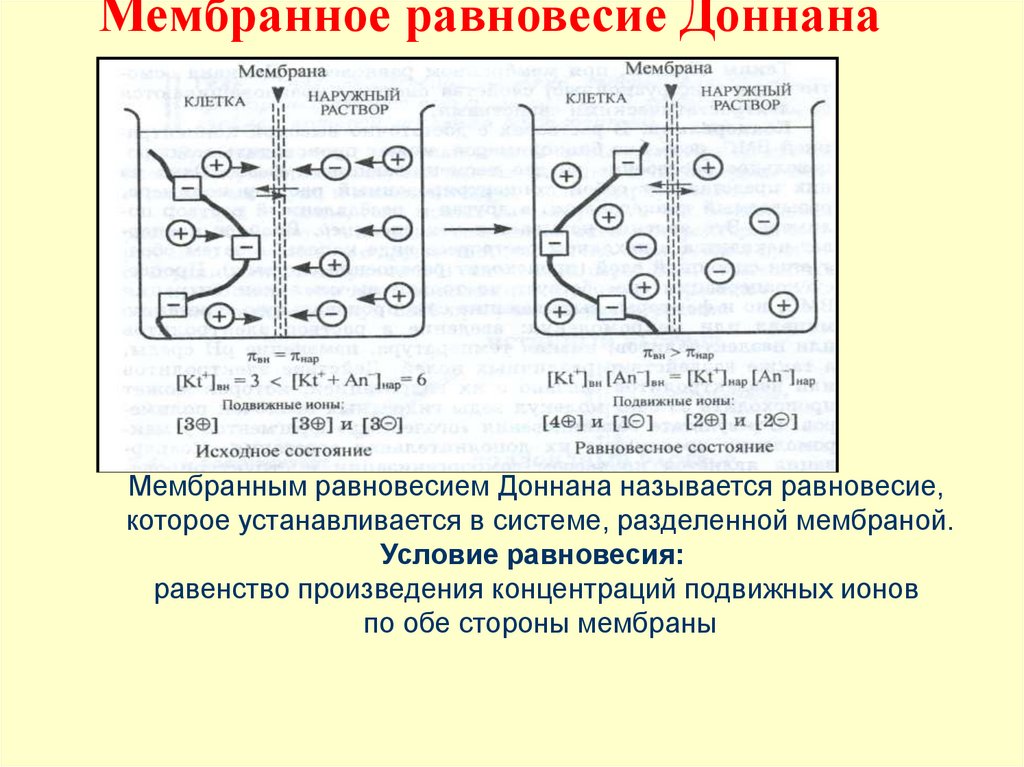
15. Мембранное равновесие Доннана
Мембранным равновесием Доннана называется равновесие,которое устанавливается в системе, разделенной мембраной.
Условие равновесия:
равенство произведения концентраций подвижных ионов
по обе стороны мембраны
16. Закон Рауля: относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного
4. Кипение и замерзание растворов.Закон Рауля. Следствия из закона Рауля
Ро > Р
Закон Рауля: относительное понижение давления
насыщенного пара растворителя над раствором равно
мольной доле растворенного вещества
Ро Р
Ро
хi ;
i
xi
i
ΔР = Ро - Р
17. Первое следствие из закона Рауля: температура кипения раствора выше, чем чистого растворителя. Повышение температуры кипения
раствора прямо пропорциональномоляльной концентрации раствора
Для неэлектролитов:
для электролитов:
Δtкип. = Кэб∙b,
Δtкип. = i Kэб.∙b,
b – моляльная концентрация растворенного
вещества, моль/кг;
i – изотонический коэффициент,
Kэб. – эбулиоскопическая константа,К∙кг∙моль-1
18. Второе следствие из закона Рауля: понижение температуры замерзания раствора прямо пропорционально моляльной концентрации
раствораДля неэлектролитов:
для электролитов:
Δtзам. = Ккр. ∙b,
Δtзам. = i∙Kкр. ∙b,
Δtзам. – понижение температуры замерзания
(иногда называют депрессией);
i – изотонический коэффициент;
Ккр. – криоскопическая константа, К∙кг∙моль-1
19. Задачи
1а) Какой из растворов (с концентрацией 0,3 Мбудет иметь более низкую температуру
замерзания : глюкозы, хлорида и
сульфата натрия?
2а) Какой из растворов (с концентрацией 0,3 М )
будет иметь более низкую температуру
кипения : глюкозы, хлорида и сульфата
натрия?
20.
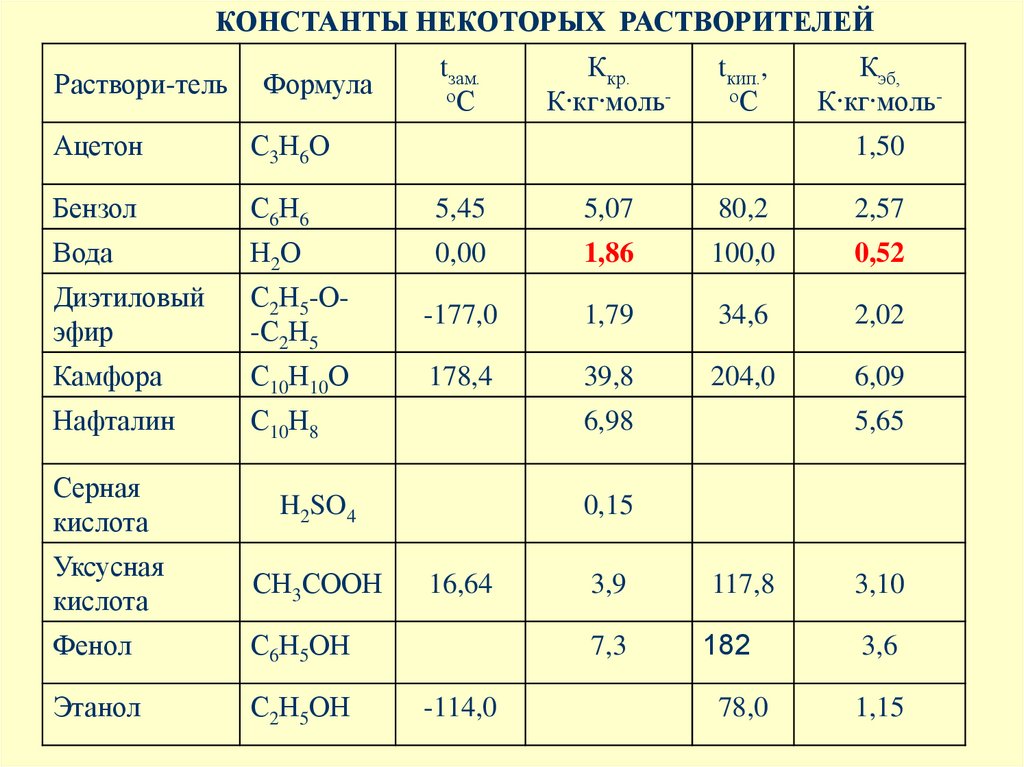
КОНСТАНТЫ НЕКОТОРЫХ РАСТВОРИТЕЛЕЙtзам.
оС
Ккр.
К∙кг∙моль-
tкип.,
оС
Кэб,
К∙кг∙моль-
Раствори-тель
Формула
Ацетон
С3Н6О
Бензол
С6Н6
5,45
5,07
80,2
2,57
Вода
Н2О
0,00
1,86
100,0
0,52
Диэтиловый
эфир
С2Н5-О-С2Н5
-177,0
1,79
34,6
2,02
Камфора
С10Н10О
178,4
39,8
204,0
6,09
Нафталин
С10Н8
Серная
кислота
H2SO4
Уксусная
кислота
СН3СООН
Фенол
С6Н5ОН
Этанол
С2Н5ОН
1,50
6,98
5,65
0,15
16,64
-114,0
3,9
117,8
3,10
7,3
182
3,6
78,0
1,15
21.
Задача 2При растворении 0,94 г фенола в 50 г
этанола температура кипения последнего
повысилась на 0,232оС. Рассчитайте
молярную массу фенола.













 chemistry
chemistry








