Similar presentations:
Обмен простых белков. Образование биологически активных аминов
1.
Лекция №16Профессор Грашин Р.А.
2.
R-CH-COOHNH2
декарбоксилаза
ПФ
R-CH2-NH2 + CO2
(БА)
Биогенные амины (БА) - вещества, которые малыми дозами
оказывают выраженный биологический эффект.
COOH
CO2
CHNH2
(CH2)2
COOH
ГЛУ
CH2-NH2
(CH2)2
Декарбоксилаза
ПФ
COOH
-аминомаслянная кислота
(ГАМК)
3.
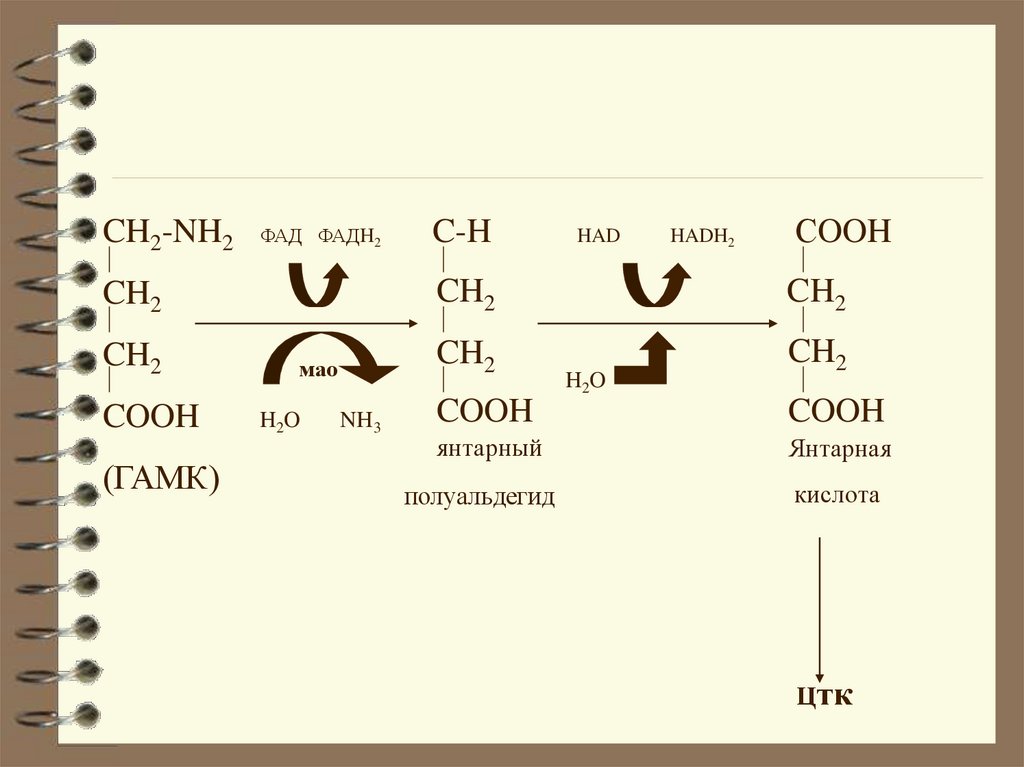
CH2-NH2ФАД ФАДH2
CH2
CH2
COOH
(ГАМК)
мао
H2O
NH3
C-H
HAD
HADH2
СOOH
CH2
CH2
CH2
CH2
H2O
COOH
COOH
янтарный
Янтарная
полуальдегид
кислота
Цтк
4.
NCH2-CH-COOH
декарбоксилаза
NH2
NH
NH
CO2
ГИС
ГИСТАМИН
ДАО
NH3
HN
CH2 - CH2 - NH2
N
HADH2
ПФ,Сu+2
HAD
CH2-C=O
CH2-COOH
H
ДГ
NH
Имидазол-уксусная кислота
NH
МОЧА
5.
CH2-CH-COOHCH2-CH-COOH
OH
NH2
триптофанмонооксидаза
NH
ТРИПТОФАН
Тетрагидро
птеридин
NH
дегидро
птеридин
5’ОКСИТРИПТОФАН
СO2
декарбоксилаза
CH2-CH-NH2
HO
NH
NH
серотонин
6.
CH2-CH-NH2COOH
ФЕН
CH2-CH-NH2
CH2-CH-NH2
COOH
COOH
тирозинмоно
оксигеназа
НО
фенилмоно
оксигеназа
HO
ДОФА
HO
ТИР
Co2
CH2-CH-NH2
Дофамин-гидроксилаза
норадреналин
Фенилэтаноламин-Nметилтрансфераза
ФNМТ
адреналин
ДОФАМИН
HO
OH
7.
NH2-CH-COOHNH2 - CH - COOH
Цистеиндиоксигеназа (НАДФ)
О2
CH2-SH
ЦИС
NH2 - CH - COOH
CH2-SO2H
ЦИСТЕИН СУЛЬФИНОВАЯ
КИСЛОТА
CH2-SO3H
ЦИСТЕИНОВАЯ КИСЛОТА
СО2
NH2-CH2-CH2-SO3H
ТАУРИН
8.
Способ инактвации биогенных аминов окислительное дезаминирование.R-CH2-NH2 + O2 + H2O
аминооксидаза
R-C-H + NH3 + H2O2
O
МАО (моноаминооксидаза), митохондрия, ФАД
ДАО(диаминооксидаза), цитоплазма, ПФ, Сu+2
альдегидДГ
R-C-H
R-C-OOH
H2O
O
HAD
HADH2
(органическая кислота)
9.
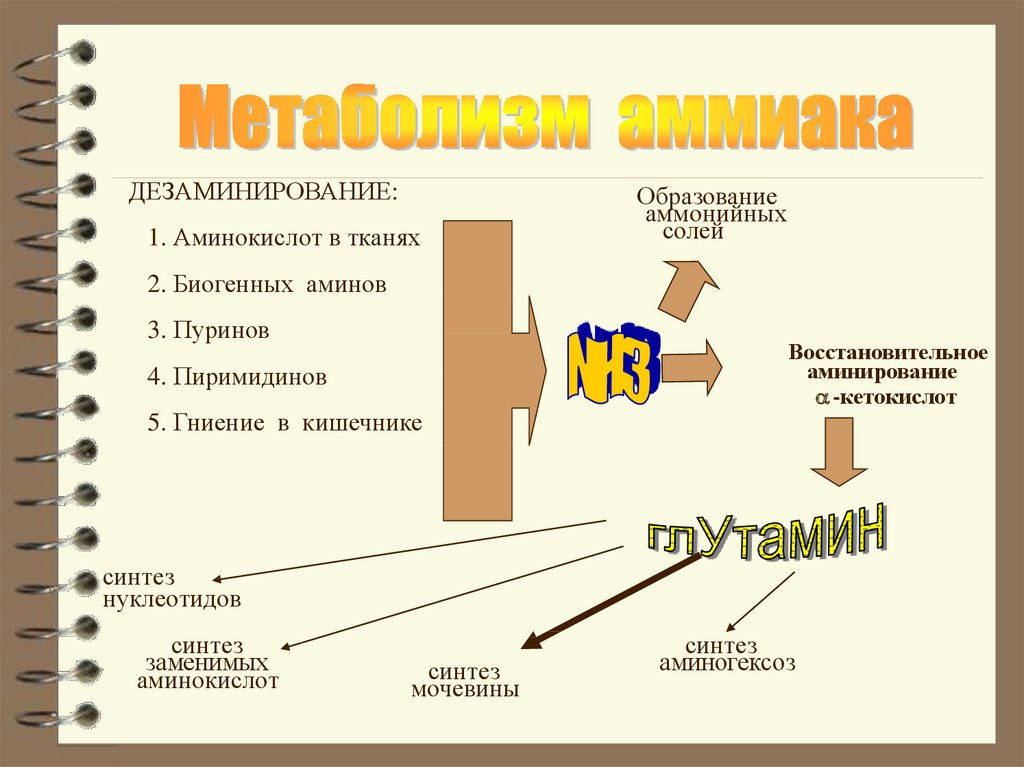
ДЕЗАМИНИРОВАНИЕ:1. Аминокислот в тканях
Образование
аммонийных
солей
2. Биогенных аминов
3. Пуринов
4. Пиримидинов
5. Гниение в кишечнике
Восстановительное
аминирование
-кетокислот
синтез
нуклеотидов
синтез
заменимых
аминокислот
синтез
мочевины
синтез
аминогексоз
10.
Восстановительное аминирование- кетокислот
COОН
COOH
НАДФН2
(CH2)2
(CH2)2
C=O
НАДФ
+
COOH
-кетоглутарат
NH3
+ H2O
ГлДГ
CHNH2
COOH
глу
11.
Образование глутамина (аспарагина)СOOH
(CH2)2
CHNH2
АТФ
+
NH3
АДФ+Фн
ГЛУТАМИНСИНТАЗА
CONH2
(CH2)2
CHNH2
COOH
COOH
глу
глн
1.Форма обезвреживания аммиака
2.Коллектор аммиака
3.Форма транспорта аммиака
Основной путь выведения
аммиака-мочевина
12.
Кребс Х.А., Ненский, Салазкин С.С., ГензлейтГлутамин
печень
NH4+
ГЛУ
1. Синтез
карбомоилфосфата - активной формы NH3
2АТФ
NH4+CO2
2АДФ+Фн
карбомоилфосфатсинтаза
МТХ Mg+2
NH2
C
O
O~ P
13.
Кребс Ханс Адольф (Krebs) (1900—1981), английский биохимик.Родился в Германии, с 1933 в Великобритании. Труды по обмену
углеводов. Описал основные реакции аэробного окисления —
трикарбоновых кислот цикл (цикл Кребса) и орнитиновый цикл синтеза
мочевины. Нобелевская премия (1953).
14.
NH2NH4+ +CO2
C=NH
O
карбомоилфос СH2NH2
фатсинтаза
NH
NH2-C-NH2
мочевина
CH2
CH2
CHNH2
H2 N C O ~ P
CH2
COOH
аргиназа
орнитин
O
Орнитилкарбомоил
трансфераза МТХ
Фн
CH2 NH
C O
CH2
NH2
МТХ
CH2
CH
CHNH2
CH
аргинин COOH
NH2
COOH
C=N CH
CHNH2
аргининсукцинат
синтаза
цит
COOH
CH2 NH
CH2
CH2
COOH
CHN- Н2
МТХ
Mg+2
аргининосукцинат
COOH
аспаратат
АТФ
COOH
фумарат
CH2
Цитрулин
COOH
АМФ+РР
СO2 + NH3 + 3АТФ + 2H2O + АСПАРАТАТ
МОЧЕВИНА + 2АДФ + АМФ + 2Фн + ФФ + фУМАРАТ
аргининосукцинат
лиаза
15.
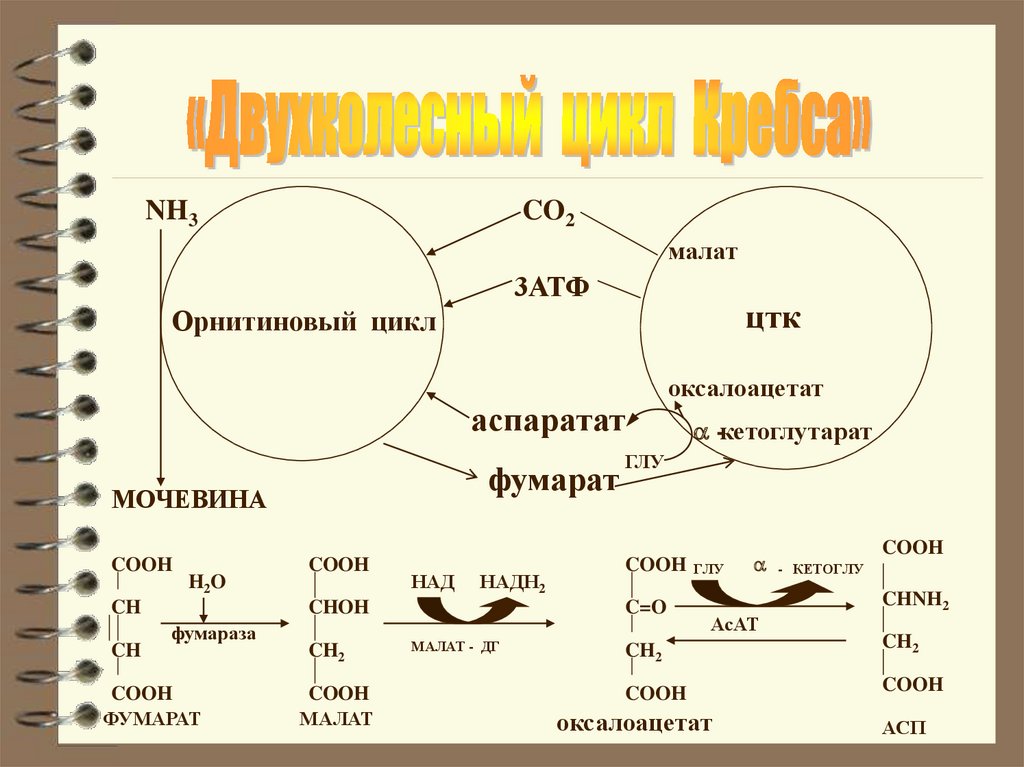
NH3CO2
малат
3АТФ
цтк
Орнитиновый цикл
аспаратат
фумарат
МОЧЕВИНА
COOH
H2O
CH
CH
COOH
НАД
НАДН2
CHOH
фумараза
COOH
ФУМАРАТ
CH2
COOH
МАЛАТ
оксалоацетат
ГЛУ
COOH
C=O
МАЛАТ - ДГ
-кетоглутарат
ГЛУ
COOH
- КЕТОГЛУ
CHNH2
АсАТ
CH2
CH2
COOH
COOH
оксалоацетат
АСП
16.
CH2OHАТФ
О
ОН
СН2O ~ P
АДФ
O
ОН
ГК
НО
ОН
ОН
ГЛЮКОЗА
ГЛН
НО
ОН
ОН
ГЛЮКОЗА - 6 - ФОСФАТ
CH2 - O ~ P
ГЛУ
O
HO
OH
OH
NH
2
Глюкозамин
(Галактозамин)
17.
1 Восстановительное аминированиеНАДФН2
- Кето - глу
- кетокислот
НАДФ
ГЛУ
ГлДГ
NH3
2 Трансаминирование
H2 O
Глу + - кето - кислота
- Кетоглутарат
+
аминокислота
3 Трансреанимирование
1+3
AK
4 глутамин + кетокислота
Глу +
5 Исходными для синтеза могут служить метаболиты распада
углеводов, цикла Кребса, незаменимые аминокислот
А) ПВК
АЛА
Б) 3 - фосфоглицерат
В)
Г)
Д)
Е)
серин + ТГФК
рибозо - 5 -фосфат
оксалоацетат + ГЛУ
незаменимые
ФА + НАДФН2 + О2
метионин
орнитин
3 - фосфосерин
серин
глицин + N5, N10,ТГФК
фосфорибозил - пирофосфат
гистидин
аспарагин + Кетоглу + АК
цистеин
аргинин
Тирозин + НАДФ + Н2О
18.
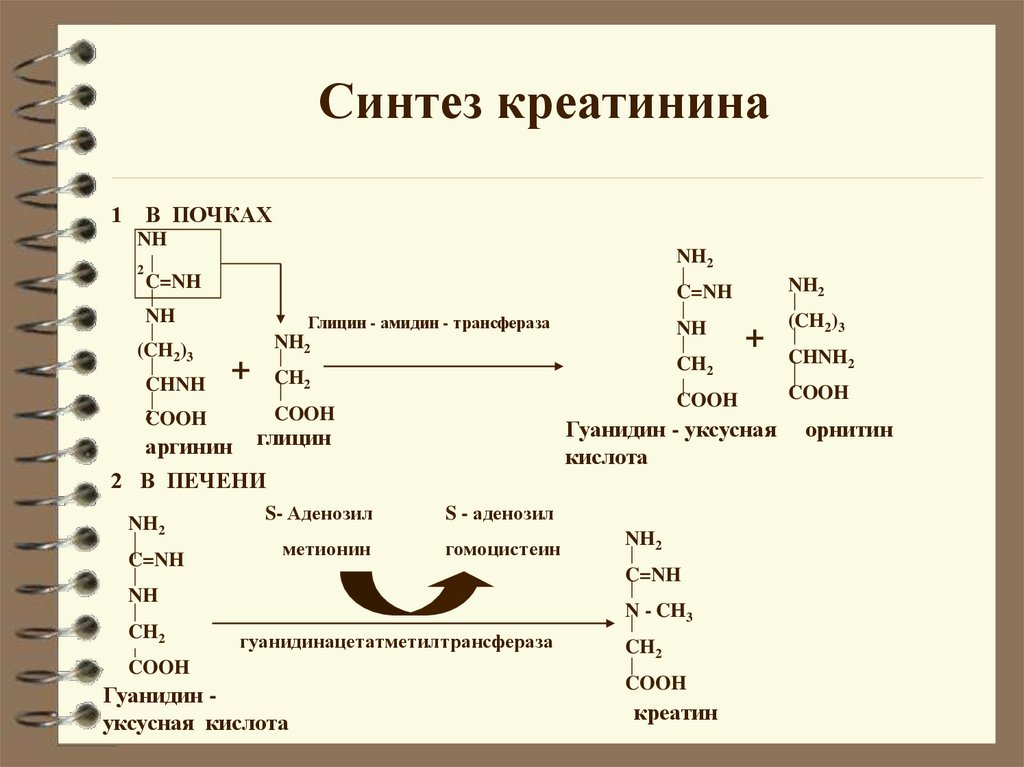
Синтез креатинина1
В ПОЧКАХ
NH
2
NH2
C=NH
NH
(CH2)3
CHNH
Глицин - амидин - трансфераза
NH2
+
2
COOH
аргинин
CH2
COOH
C=NH
S- Аденозил
метионин
NH
(CH2)3
CHNH2
COOH
COOH
гомоцистеин
NH2
C=NH
N - CH3
гуанидинацетатметилтрансфераза
COOH
Гуанидин уксусная кислота
+
CH2
S - аденозил
NH
CH2
NH2
Гуанидин - уксусная
кислота
глицин
2 В ПЕЧЕНИ
NH2
C=NH
CH2
COOH
креатин
орнитин
19.
3В МЫШЦАХ
АТФ
NH2
АДФ
C=NH
N - CH3
КК
CH2
COOH
креатин
Фн
NH
NH ~ P
C=NH
C=NH
N - CH3
N - CH3
CH2
CH2COOH
CO
креатин ~P
Креатинфосфат - форма депонирования и транспорта энергии
Креатинин
моча
В диагностике используются :
1) Определение креатина в моче при патологии мышц.
2) Определение креатинина в моче и крови (клиренс, проба Реберга,
выделительгая функция почек.
3) Определение активности КК и ее изоферментов в крови (диагностика ИМ)
20.
Аммониогенз протекает в проксимальных и дистальных канальцах,почек. Один из механизмов поддержания постоянства рН
Просвет
дистального
канальца
клетка
H+ + HCO3-
NaA
Na+
кровь
[HCO3-]
pH=pK+lg [H CO ]
2
3
CO2 + H2O
A-
H2CO3
KА
H2CO3
H
NH3
NH4+
В результате в
H+
HCO3
NH3
ГЛУ
-
HCO3
ГЛН
Na+
NH4A
МОЧА
крови
восстанавливается
концентрация
бикарбоната, а
«расплатой» за
этоявляется выведение
протонов с мочей в
виде аммонийных солей.
















 biology
biology








