Similar presentations:
Общие пути обмена аминокислот. Лекция №11
1. ЛЕКЦИЯ № 11
ФГБОУ ВО УГМУ Минздрава РоссииКафедра биохимии
Дисциплина: Биохимия
ЛЕКЦИЯ № 11
Общие пути обмена
аминокислот
Лектор: Гаврилов И.В.
Факультет: лечебно-профилактический,
Курс: 2
Екатеринбург, 2017г
2. П Л А Н
ПЛАНКлассификация, строение, свойства аминокислот.
Пути образования пула аминокислот в крови и его
использование в организме (схема).
Общие реакции обмена аминокислот: реакции
переаминирования, прямого и непрямого
дезаминирования, декарбоксилирования, тканевые
особенности. Роль витамина В6.
Использование безазотистого остатка аминокислот:
глюконеогенез, кетогенез, пути вступления в ЦТК.
3.
• Реакции использования и обезвреживания аммиака:образование глутамина, аспарагина, мочевины.
Тканевые особенности.
• Связь орнитинового цикла с обменом аминокислот и
энергетическим обменом.
• Недостаточность ферментов орнитинового цикла, ее
причины и последствия. Механизмы о. и хр.
токсичности аммиака, метаболические и клинические
последствия.
• для педиатрического факультета.
Особенности реакций образования и утилизации
аммиака у детей.
4.
АминокислотыАминокислоты (АК) – органические
соединения, содержащие –СООН и -NH2.
Почти все АК имеют хиральный атом и
обладают оптической изомерией. У человека
присутствуют L-аминокислоты.
Всего известно около 300 видов АК,
человека в организме - 70,
а в составе белков - 20.
H2N
COOH
H
R
5.
Аминокислоты классифицируютсяПо количеству карбоксильных и аминогрупп
По функциональным группам в радикале
По способности к синтезу
По природе радикала
6. Классификация АК по
• природе радикала:1). алифатические (гли, ала, вал, лей, иле и.т.д.);
2). Ароматические карбо- (фен, тир) и
гетероциклические (три, гис);
3). гетероциклические (про, оксипро).
• количеству карбоксильных и аминогрупп:
1). Нейтральные (гли, вал, лей,…);
2). кислые (глу, асп);
3) основные (арг, лиз).
• функциональным группам в радикале:
1). содержащие –ОН (сер, тре);
2). содержащие –SH (цис, мет);
3). содержащие –СОNH2 (глн, асн);
7. Классификация АК по способности к синтезу
• Заменимые - синтезируются в организме (глицин,аспарагиновая кислота, аспарагин, глутаминовая
кислота, глутамин, серии, пролин, аланин).
• Незаменимые - не синтезируются в организме, но
для него необходимы, (фенилаланин, метионин,
треонин, триптофан, валин, лизин, лейцин,
изолейцин).
• Частично заменимые - у взрослых они образуются в
достаточных количествах, у детей – нет,- необходимо
дополнительное поступление этих АК с пищей
(Аргинин и гистидин).
• Условно заменимые - для их синтеза необходимы
незаменимые АК (фенилаланин и метионин) Тирозин и цистеин.
8. ФУНКЦИИ АК
• Используются для синтеза белков, углеводов,липидов, нуклеиновых кислот, биогенных
аминов (гормонов, нейромедиаторов), других
АК
• Источник азота при синтезе азотсодержащих
небелковых соединений (нуклеотиды, гем,
креатин, холин и др);
• Регуляторная (гли, глу - нейромедиаторы);
• Источник энергии для синтеза АТФ.
9.
Метаболизм аминокислот• Гликогенные аминокислоты - превращаются в ПВК и
промежуточные продукты ЦТК (а-КГ, сукцинил-КоА,
фумарат, ЩУК). через ЩУК, используются в
глюконеогенезе (ала, асн, асп, гли, глу, глн, про, сер,
цис, арг, гис, вал, мет, тре).
• Кетогенные аминокислоты – в процессе катаболизма
превращаются в ацетоацетат (Лиз, Лей) или ацетилКоА (Лей) и могут использоваться в синтезе
кетоновых тел.
• Смешанные (глико-кетогенными) аминокислоты –
при их катаболизме образуются метаболит
цитратного цикла и ацетоацетат (Три, Фен, Тир) или
ацетил-КоА (Иле). Используются для синтеза
глюкозы и кетоновых тел.
10.
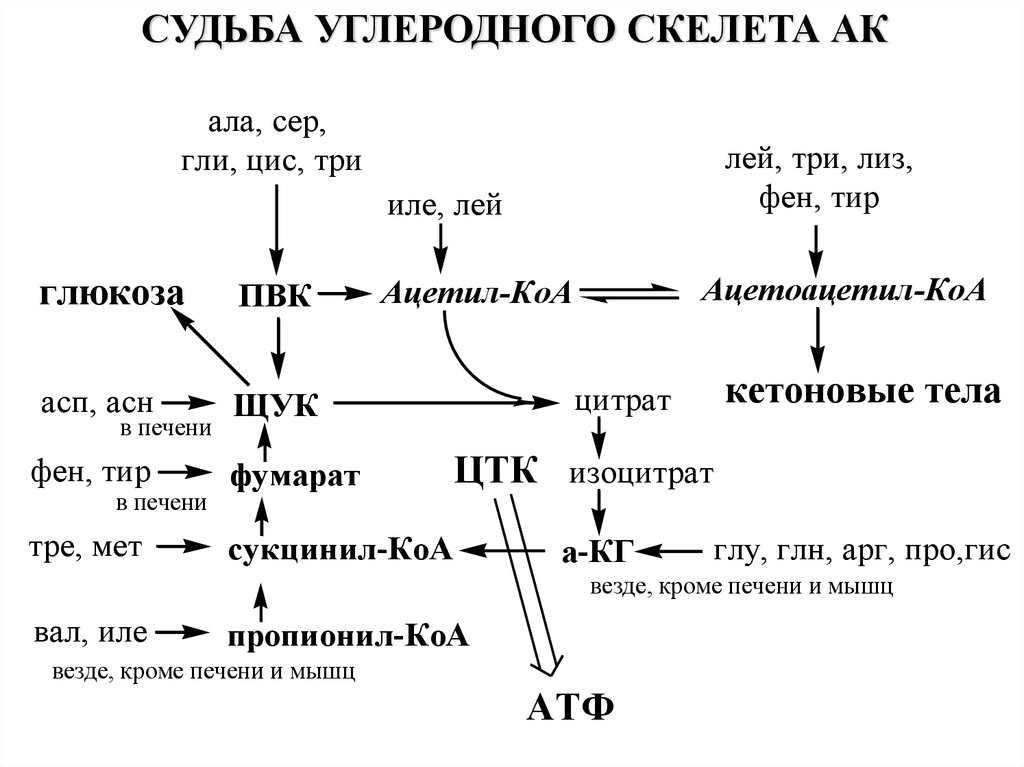
СУДЬБА УГЛЕРОДНОГО СКЕЛЕТА АКала, сер,
гли, цис, три
иле, лей
лей, три, лиз,
фен, тир
Ацетил-КоА
Ацетоацетил-КоА
глюкоза
ПВК
асп, асн
ЩУК
фен, тир
фумарат
тре, мет
сукцинил-КоА
в печени
в печени
кетоновые тела
цитрат
ЦТК изоцитрат
а-КГ
глу, глн, арг, про,гис
везде, кроме печени и мышц
вал, иле
пропионил-КоА
везде, кроме печени и мышц
АТФ
11.
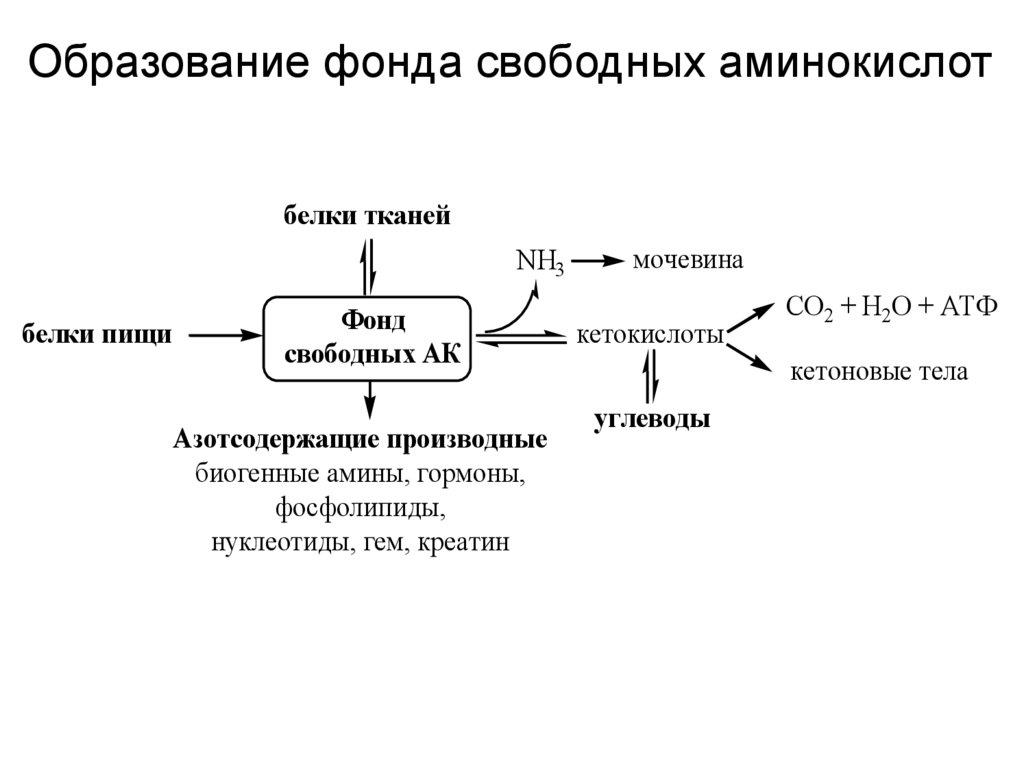
Образование фонда свободных аминокислотбелки тканей
NH3
белки пищи
Фонд
свободных АК
Азотсодержащие производные
биогенные амины, гормоны,
фосфолипиды,
нуклеотиды, гем, креатин
мочевина
кетокислоты
СО2 + Н2О + АТФ
кетоновые тела
углеводы
12. Общие реакции обмена аминокислот
1. Биосинтез белка2. Трансаминирование
3. Дезаминирование
4. Декарбоксилирование
5. Изомеризация
6. Образование оснований Шиффа
(при гликозилировании белков).
13. 1. Биосинтез белка
14. 2. Трансаминирование
• Трансаминирование — реакция переноса αаминогруппы с АК на α-кетокислоту, врезультате чего образуются новая αкетокислота и новая АК.
COOH
H2N
C
R1
H
COOH
+ O
C
R2
B6
COOH
H2N
C
H
COOH
+ O
аминотрансфераза R2
Процесс трансаминирования легко обратим, при
нем общее количество АК в клетке не меняется.
C
R1
15.
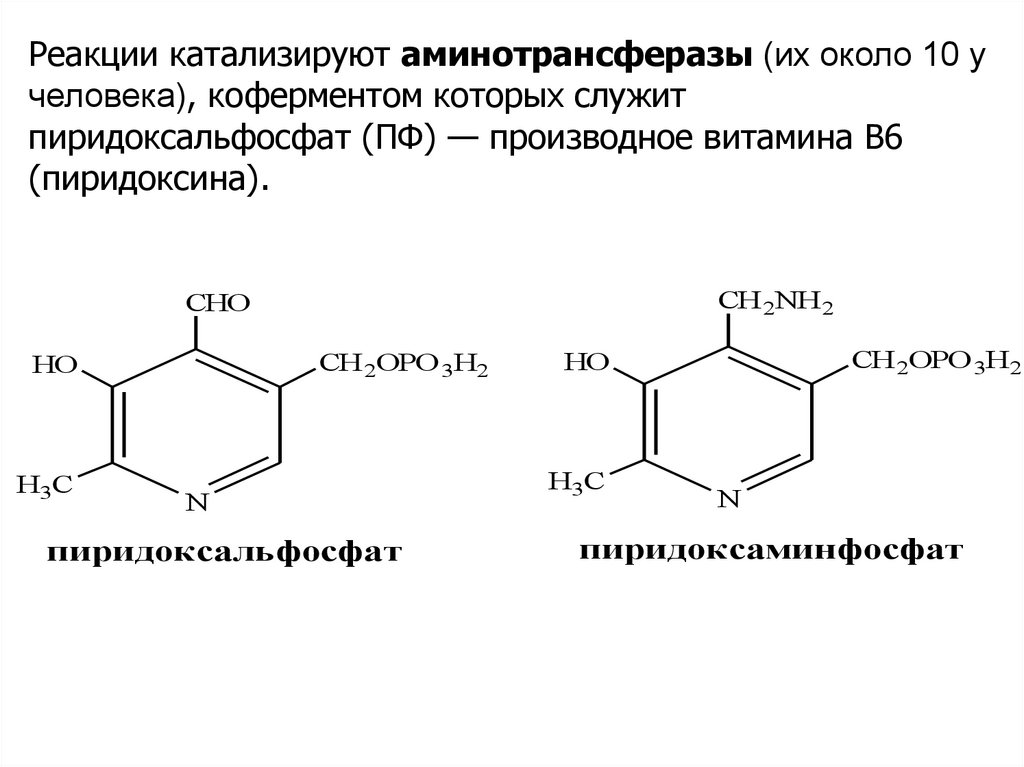
Реакции катализируют аминотрансферазы (их около 10 учеловека), коферментом которых служит
пиридоксальфосфат (ПФ) — производное витамина В6
(пиридоксина).
CH 2NH 2
CHO
CH 2OPO 3H2
HO
H3C
N
пиридоксальфосфат
CH 2OPO 3H2
HO
H3C
N
пиридоксаминфосфат
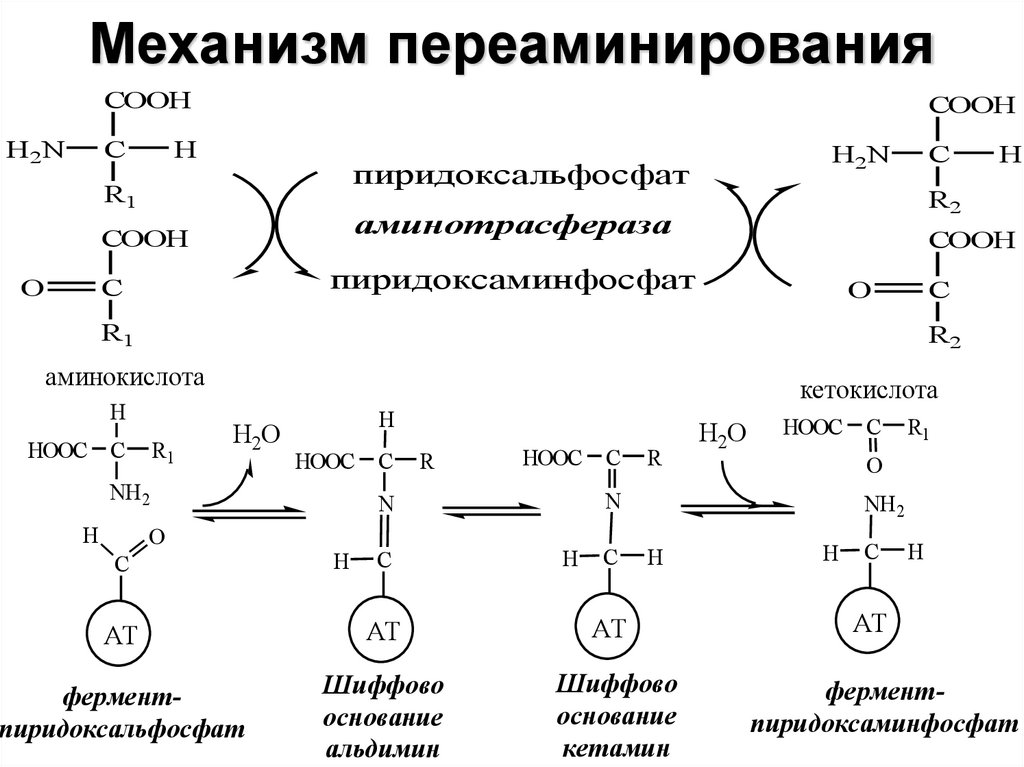
16. Механизм переаминирования
COOHH2N
C
COOH
H
пиридоксальфосфат
R1
C
COOH
пиридоксаминфосфат
C
O
C
R1
R2
аминокислота
H
HOOC C
R1
кетокислота
H2O
H
HOOC
NH 2
H
H
R2
аминотрасфераза
COOH
O
H2N
О
С
C
R
HOOC
С
R
HOOC
H
С
C
R1
O
N
N
H
C
H2O
NH2
H
H
С
H
АТ
АТ
АТ
АТ
ферментпиридоксальфосфат
Шиффово
основание
альдимин
Шиффово
основание
кетамин
ферментпиридоксаминфосфат
17. 3. ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ
— реакция отщепления α-аминогруппыот АК, в результате чего образуется
соответствующая α-кетокислота и
выделяется молекула аммиака.
Дезаминирование бывает:
А. прямым
Б непрямым
18. А. виды прямого дезаминирования АК
• Окислительное (самое активное);• неокислительное;
• внутримолекулярное;
• восстановительное;
• гидролитическое.
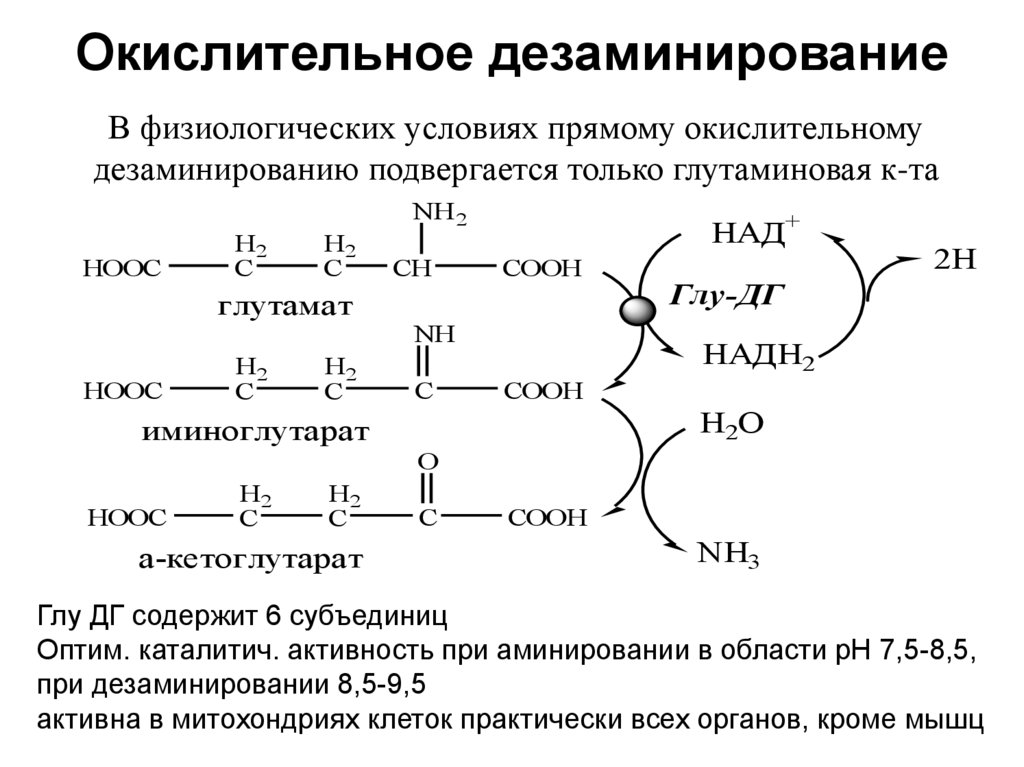
19. Окислительное дезаминирование
В физиологических условиях прямому окислительномудезаминированию подвергается только глутаминовая к-та
NH 2
HOOC
H2
C
H2
C
глутамат
HOOC
H2
C
H2
C
CH
НАД+
COOH
NH
C
2H
Глу-ДГ
НАДH2
COOH
H2O
иминоглутарат
O
HOOC
H2
C
H2
C
а-кетоглутарат
C
COOH
NH3
Глу ДГ содержит 6 субъединиц
Оптим. каталитич. активность при аминировании в области рН 7,5-8,5,
при дезаминировании 8,5-9,5
активна в митохондриях клеток практически всех органов, кроме мышц
20.
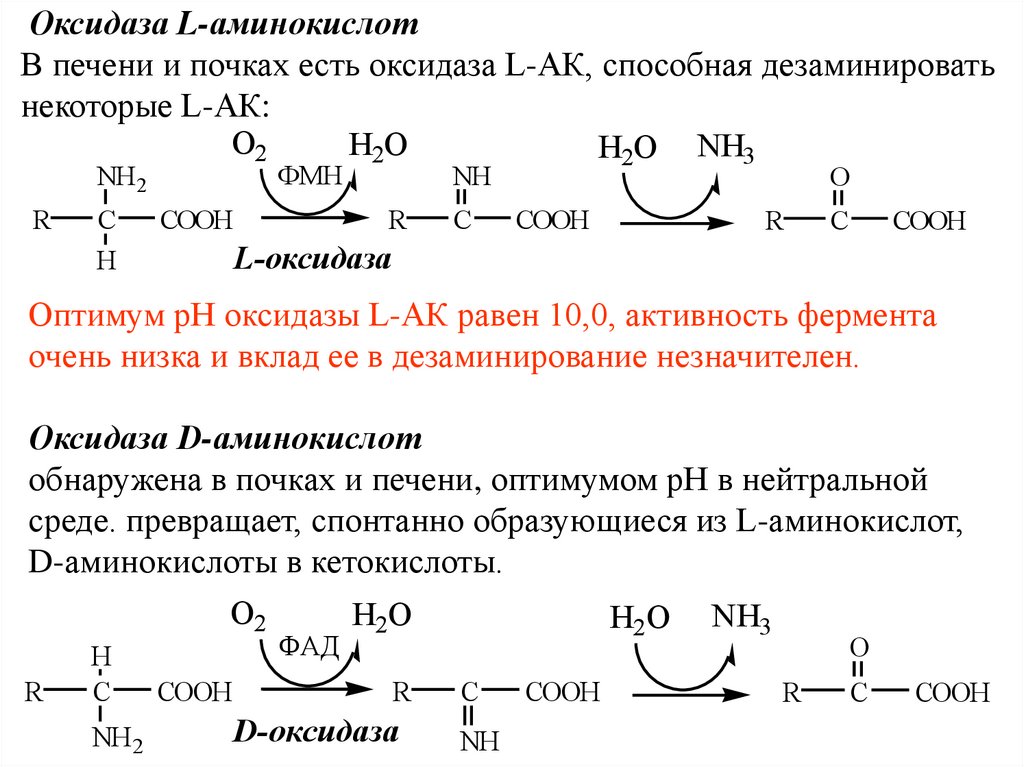
Оксидаза L-аминокислотВ печени и почках есть оксидаза L-АК, способная дезаминировать
некоторые L-АК:
O2
H2O
H2O NH3
ФМН
NH2
R
C
H
COOH
NH
R
C
O
COOH
R
C
COOH
L-оксидаза
Оптимум рН оксидазы L-АК равен 10,0, активность фермента
очень низка и вклад ее в дезаминирование незначителен.
Оксидаза D-аминокислот
обнаружена в почках и печени, оптимумом рН в нейтральной
среде. превращает, спонтанно образующиеся из L-аминокислот,
D-аминокислоты в кетокислоты.
O2
H2O
H2O NH3
R
H
C
NH 2
ФАД
COOH
O
R
D-оксидаза
C
NH
COOH
R
C
COOH
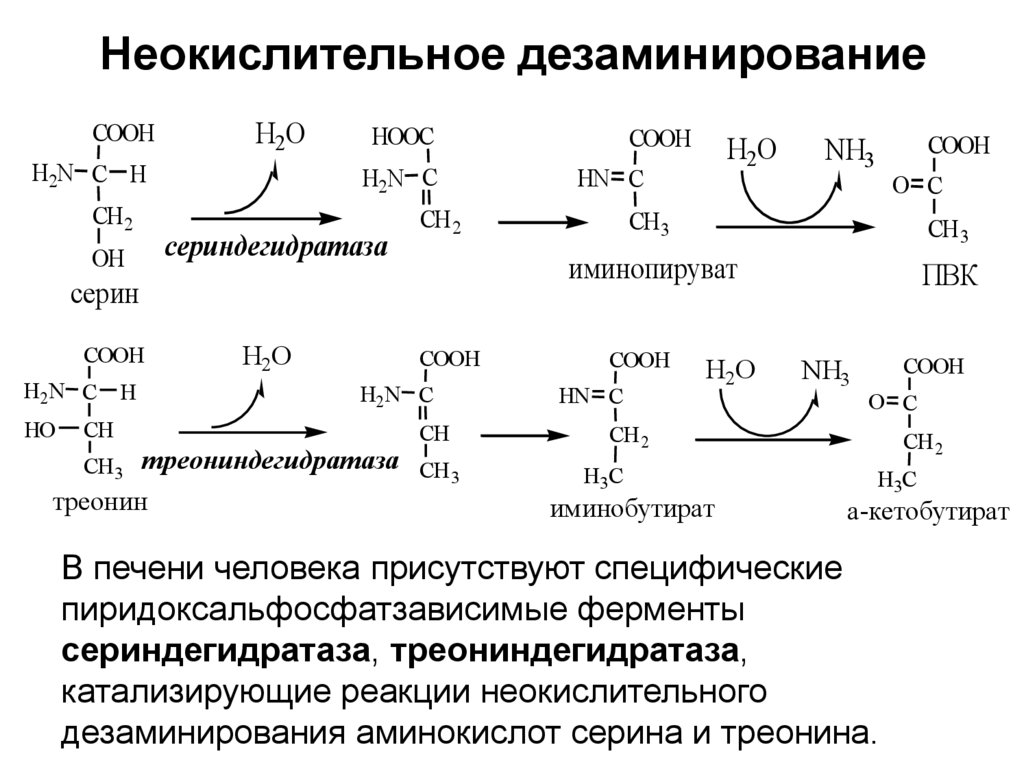
21. Неокислительное дезаминирование
COOHH2O
H2N C H
CH 2
OH
HOOC
H2N C
сериндегидратаза
H2N C H
HO
CH
H2O
COOH
H2N C
CH
треониндегидратаза СH
3
треонин
СH 3
H2O
HN C
CH 2
серин
COOH
COOH
COOH
NH3
O C
CH 3
CH 3
иминопируват
ПВК
COOH
HN C
H2O
NH3
COOH
O C
CH 2
H3С
иминобутират
CH 2
H3С
а-кетобутират
В печени человека присутствуют специфические
пиридоксальфосфатзависимые ферменты
сериндегидратаза, треониндегидратаза,
катализирующие реакции неокислительного
дезаминирования аминокислот серина и треонина.
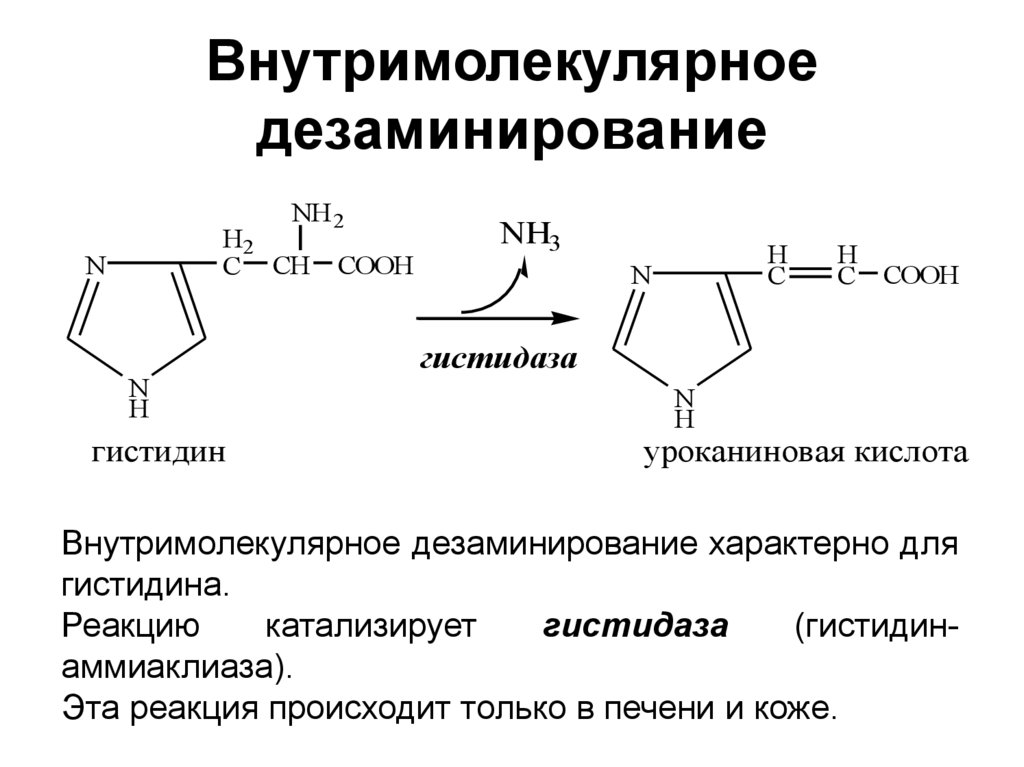
22. Внутримолекулярное дезаминирование
NH 2H2
C CH
N
N
H
гистидин
COOH
NH3
H
C
N
H
C COOH
гистидаза
N
H
уроканиновая кислота
Внутримолекулярное дезаминирование характерно для
гистидина.
Реакцию
катализирует
гистидаза
(гистидинаммиаклиаза).
Эта реакция происходит только в печени и коже.
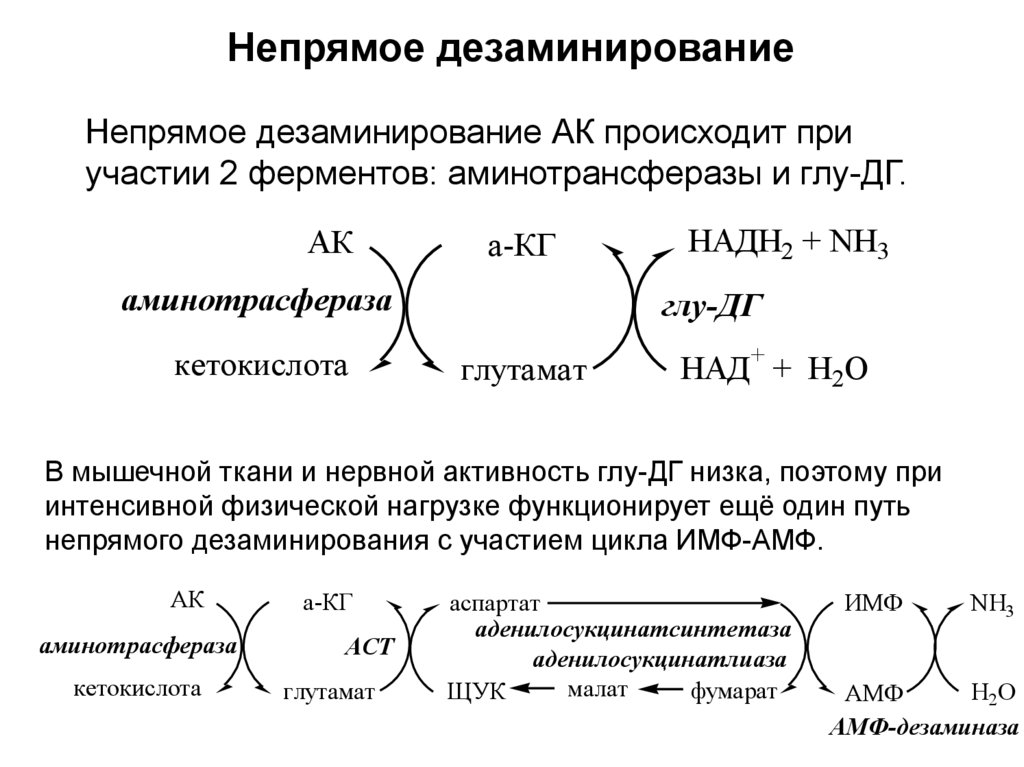
23. Б. Непрямое дезаминирование АК
• происходит в 2 стадии с участием несколькихферментов.
• характерно для большинства АК, так как они
не способны к прямому дезаминированию
(нет ферментов).
• На первой стадии происходит одна или
несколько реакций переаминирования с
участием аминотрансфераз, в результате
аминогруппа АК переходит на
кетосоединение (α-КГ, ИМФ).
• На второй стадии происходит реакция
дезаминирования аминосоединения (глу,
АМФ), в результате чего образуется аммиак.
24.
Непрямое дезаминированиеНепрямое дезаминирование АК происходит при
участии 2 ферментов: аминотрансферазы и глу-ДГ.
АК
а-КГ
аминотрасфераза
кетокислота
НАДН2 + NH3
глу-ДГ
глутамат
НАД+ + H2O
В мышечной ткани и нервной активность глу-ДГ низка, поэтому при
интенсивной физической нагрузке функционирует ещё один путь
непрямого дезаминирования с участием цикла ИМФ-АМФ.
АК
аминотрасфераза
кетокислота
а-КГ
АСТ
глутамат
аспартат
аденилосукцинатсинтетаза
аденилосукцинатлиаза
малат
фумарат
ЩУК
ИМФ
NH3
H2O
АМФ
АМФ-дезаминаза
25. Органоспецифичные ферменты
• АЛТ: ала + α-КГ↔ ПВК + глу
• локализуется в цитозоле в клеток печени и миокарда.
• ACT: асп + α-КГ
↔ ЩУК + глу
• имеет цитоплазматическую и митохондриальную формы.
Содержится в миокарде и печени.
• коэффициент де Ритиса = АСТ/АЛТ = 1,33 ± 0,42
• При инфаркте миокарда активность ACT в крови
увеличивается в 8—10 раз, а АЛТ — в 1,5—2,0 раза,
коэффициент де Ритиса резко возрастает.
• При гепатитах активность АЛТ в сыворотке крови
увеличивается в - 8—10 раз, a ACT — в 2—4 раза.
Коэффициент де Ритиса снижается до 0,6.
26.
БИОЛОГИЧЕСКАЯ РОЛЬ АМИНОТРАНСФЕРАЗ1. Очень активные и распространенные в тканях
ферменты, особенно АсАТ и АлАТ
2. В результате их действия образуются заменимые
аминокислоты ала, асп, и - глутаминовая,
единственная, которая подвергается прямому
окислительному дезаминированию
3. Способ образования -кетокислот из АК без
продукции аммиака
4. Определение активности АсАТ и АлАТ в крови имеет
диагностическое значение
27. 4. Декарбоксилирование
• Декарбоксилирование –это процессотщепления карбоксильной группы от
аминокислот.
Реакцию катализируют лиазы, которые в
качестве кофермента содержат
активные формы витамина В6.
Наибольшее значение имеют реакции
образования биогенных аминов.
28. типы декарбоксилирования аминокислот
• α-Декарбоксилирование,• ω-Декарбоксилирование
• Декарбоксилирование, связанное с
реакцией трансаминирования,
• Декарбоксилирование связанное с
реакцией конденсации двух молекул.
29.
Реакции образованиябиогенных аминов
Серотонин образуется из триптофана в
надпочечниках, ЦНС и тучных клетках.
NH 2
H2
HO
C CH COOH
N
H
триптофан
O2
H2O
НАДФН2 НАДФ+
фен-гидроксилаза
NH 2
H2
C CH COOH
N
H
H2
C
HO
CO2
NH 2
CH 2
N
H
серотонин
5-окситриптофан
Декарбоксилаза
Серотонин – возбуждающий нейромедиатор средних отделов
мозга (проводящих путей) и гормон. Стимулирует сокращение
гладкой мускулатуры, вазоконстриктор, регулирует АД,
температуру тела, дыхание, антидепрессант.
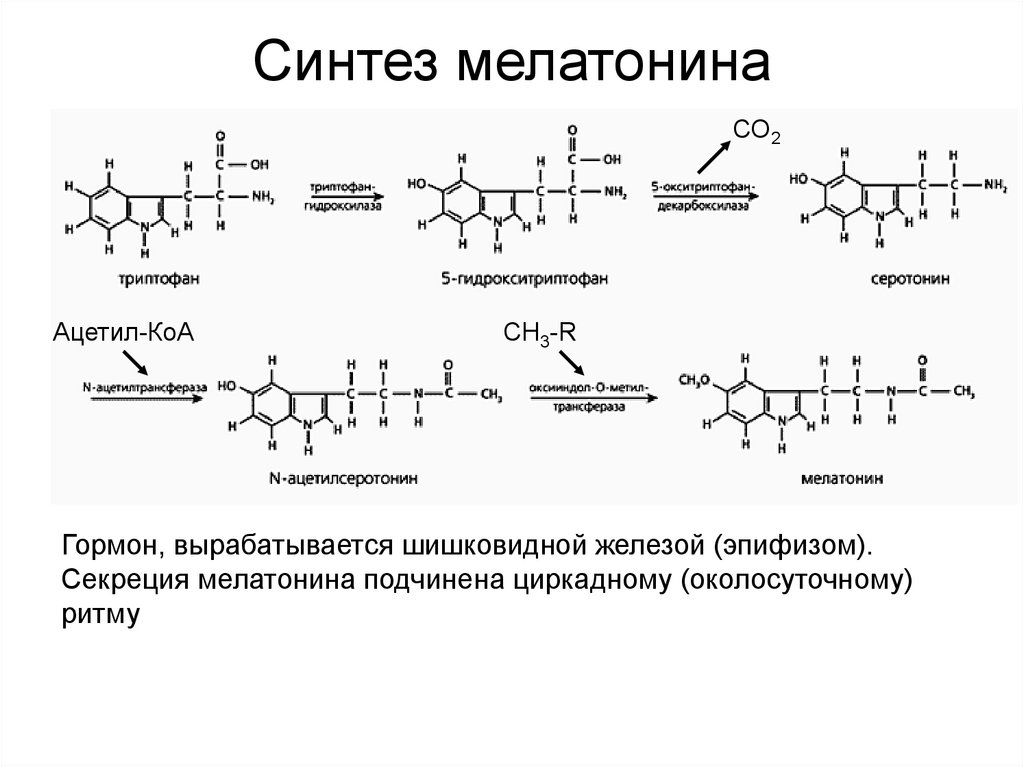
30. Синтез мелатонина
СО2Ацетил-КоА
СН3-R
Гормон, вырабатывается шишковидной железой (эпифизом).
Секреция мелатонина подчинена циркадному (околосуточному)
ритму
31.
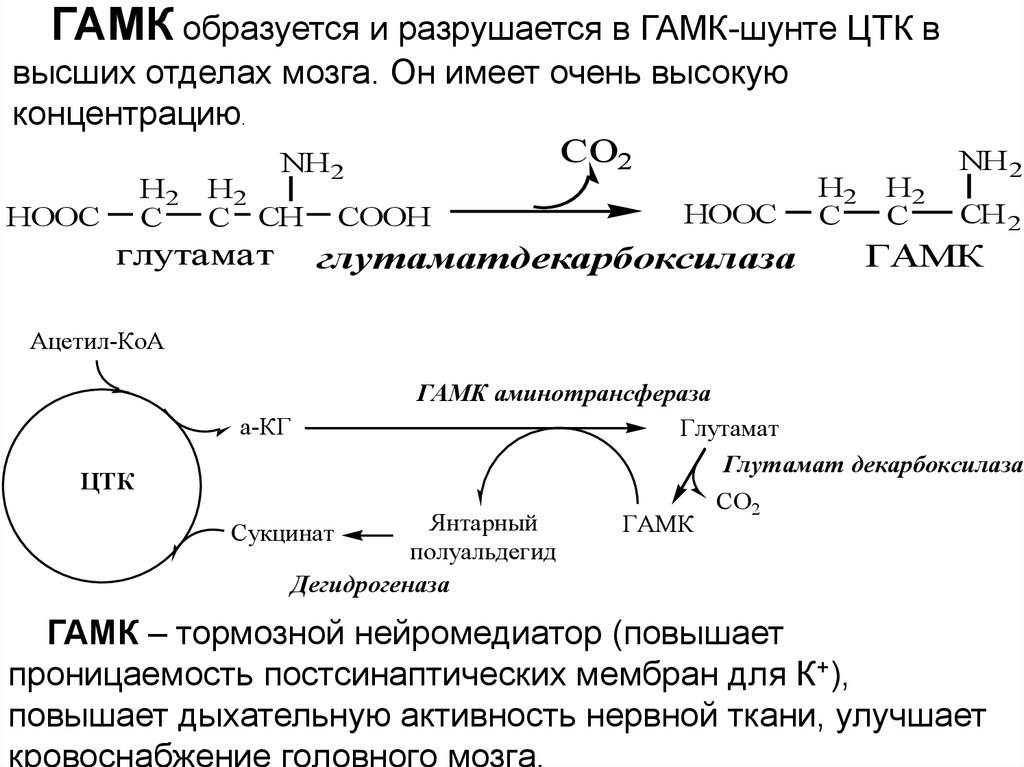
ГАМК образуется и разрушается в ГАМК-шунте ЦТК ввысших отделах мозга. Он имеет очень высокую
концентрацию.
CO2
NH
H2
C
HOOC
H2
C CH
глутамат
2
COOH
HOOC
глутаматдекарбоксилаза
H2
C
H2
C
NH 2
CH 2
ГАМК
Ацетил-КоА
ЦТК
ГАМК аминотрансфераза
а-КГ
Глутамат
Глутамат декарбоксилаза
СО2
Янтарный
ГАМК
Сукцинат
полуальдегид
Дегидрогеназа
ГАМК – тормозной нейромедиатор (повышает
проницаемость постсинаптических мембран для К+),
повышает дыхательную активность нервной ткани, улучшает
кровоснабжение головного мозга.
32.
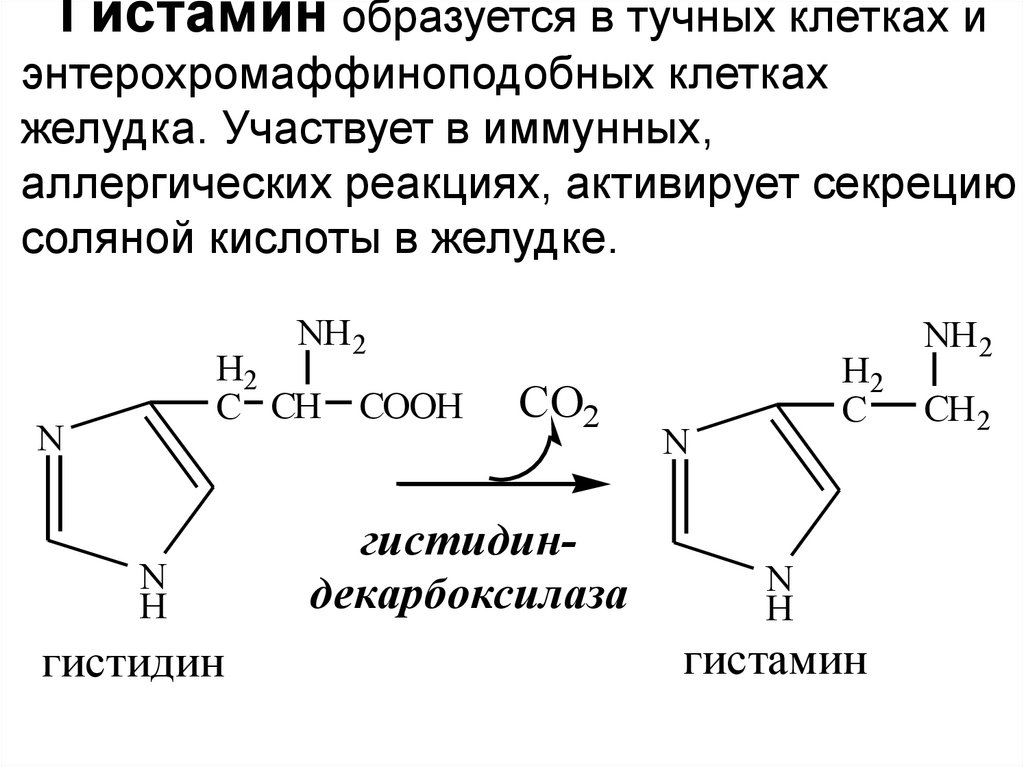
Гистамин образуется в тучных клетках иэнтерохромаффиноподобных клетках
желудка. Участвует в иммунных,
аллергических реакциях, активирует секрецию
соляной кислоты в желудке.
NH 2
H2
C CH COOH
N
N
H
гистидин
CO2
гистидиндекарбоксилаза
H2
C
N
N
H
гистамин
NH 2
CH 2
33.
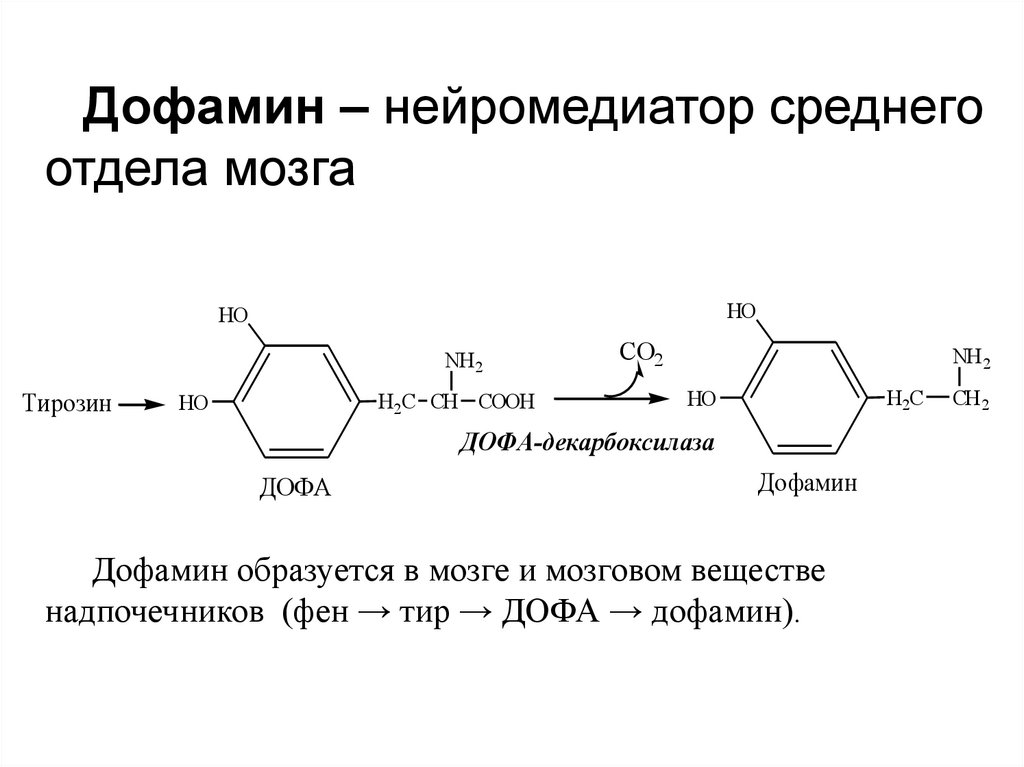
Дофамин – нейромедиатор среднегоотдела мозга
HO
HO
NH 2
Тирозин
H2C CH COOH
HO
CO2
NH 2
H2C
HO
ДОФА-декарбоксилаза
ДОФА
Дофамин
Дофамин образуется в мозге и мозговом веществе
надпочечников (фен → тир → ДОФА → дофамин).
CH 2
34. 5. Изомеризация аминокислот
COOHH2N
H
R
L - АК
Спонтанно
D - АК
35. 6. Гликозилирование АК в составе белков
36. ОБМЕН АММИАКА
NH3образуется при:
• дезаминировании АК во всех тканях (много)
• дезаминировании биогенных аминов и
нуклеотидов во всех тканях (мало)
• дезаминировании АМФ в интенсивно
работающей мышце;
• гниении белков в кишечнике.
37. Концентрация аммиака в норме
ВозрастСодержание аммиака
в сыворотке крови
мкг/дл
мкМоль/л
Новорожденные
0-2 недель
Старше 1 месяца
Взрослые
90-150
79-129
29-70
15-45
64-107
56-92
21-50
11-35
• 99% - в виде иона аммония NH4+
• 1% - неионизированного NH3
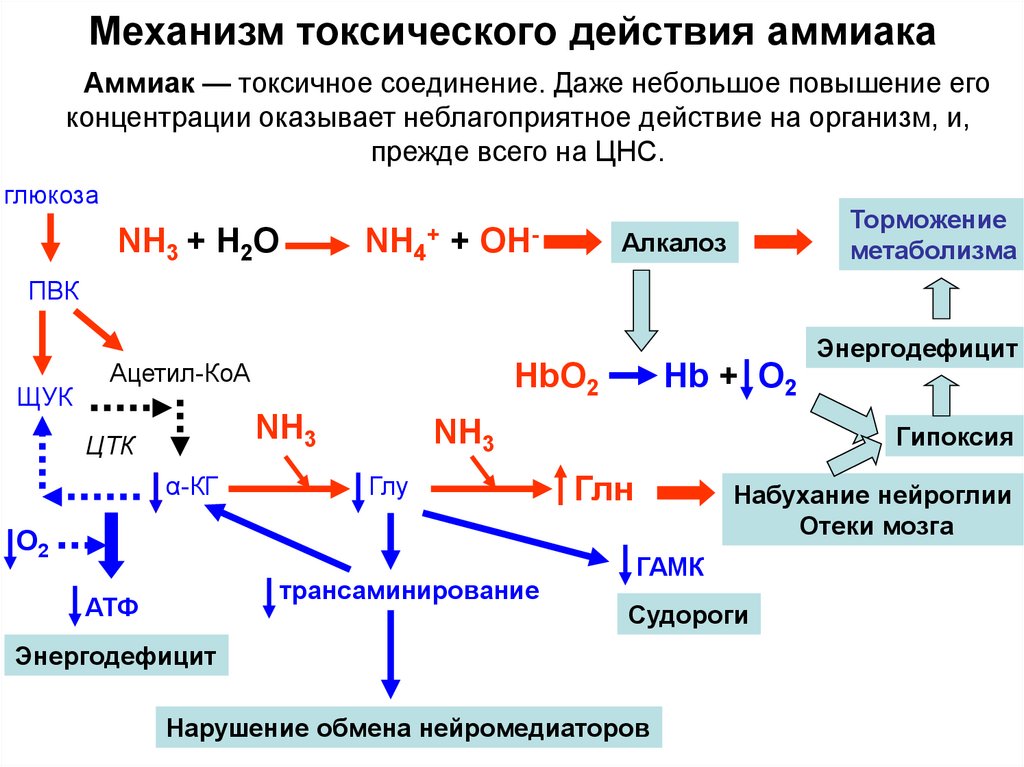
38. Механизм токсического действия аммиака
Аммиак — токсичное соединение. Даже небольшое повышение егоконцентрации оказывает неблагоприятное действие на организм, и,
прежде всего на ЦНС.
глюкоза
NH3 + Н2О
NH4+ + ОН-
Торможение
метаболизма
Алкалоз
ПВК
ЩУК
Энергодефицит
Ацетил-КоА
HbO2
NH3
ЦТК
α-КГ
NH3
Глу
О2
трансаминирование
АТФ
Hb + O2
Гипоксия
Глн
Набухание нейроглии
Отеки мозга
ГАМК
Судороги
Энергодефицит
Нарушение обмена нейромедиаторов
39.
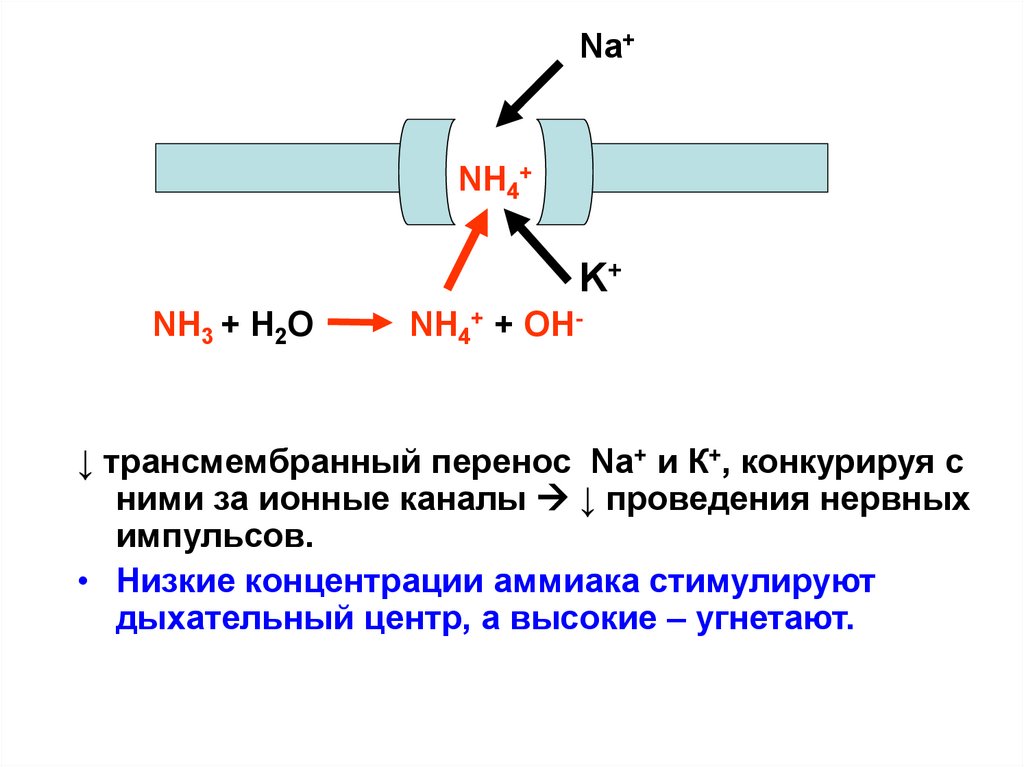
Na+NH4+
K+
NH3 + Н2О
NH4+ + ОН-
↓ трансмембранный перенос Na+ и К+, конкурируя с
ними за ионные каналы ↓ проведения нервных
импульсов.
• Низкие концентрации аммиака стимулируют
дыхательный центр, а высокие – угнетают.
40. Клинические признаки острого отравления парами аммиака
Головокружение
Потеря памяти
Потеря сознания
Бред
Возбужденное состояние
Судороги
Удушье
Учащение дыхания
Рвота
Боль за грудиной
Ларингоспазм, кашель, насморк, слезотечение,
слюнотечение, чихание, Повышенное потоотделение
41.
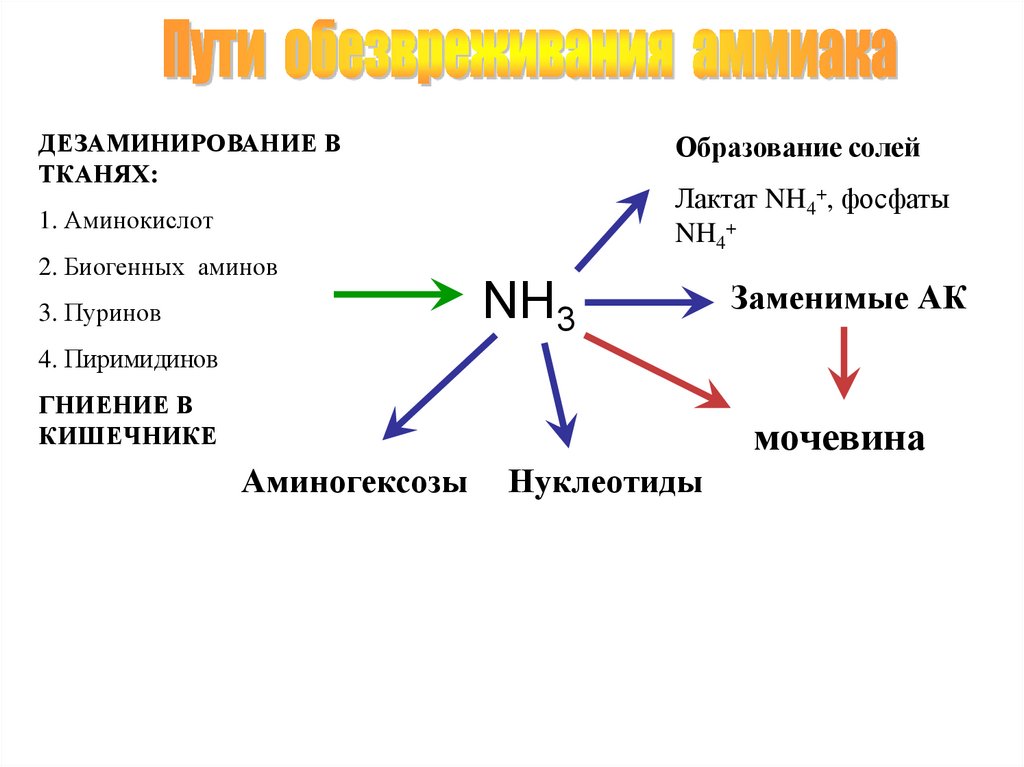
ДЕЗАМИНИРОВАНИЕ ВТКАНЯХ:
Образование солей
Лактат NH4+, фосфаты
NH4+
1. Аминокислот
2. Биогенных аминов
NH3
3. Пуринов
Заменимые АК
4. Пиримидинов
ГНИЕНИЕ В
КИШЕЧНИКЕ
мочевина
Аминогексозы
Нуклеотиды
42.
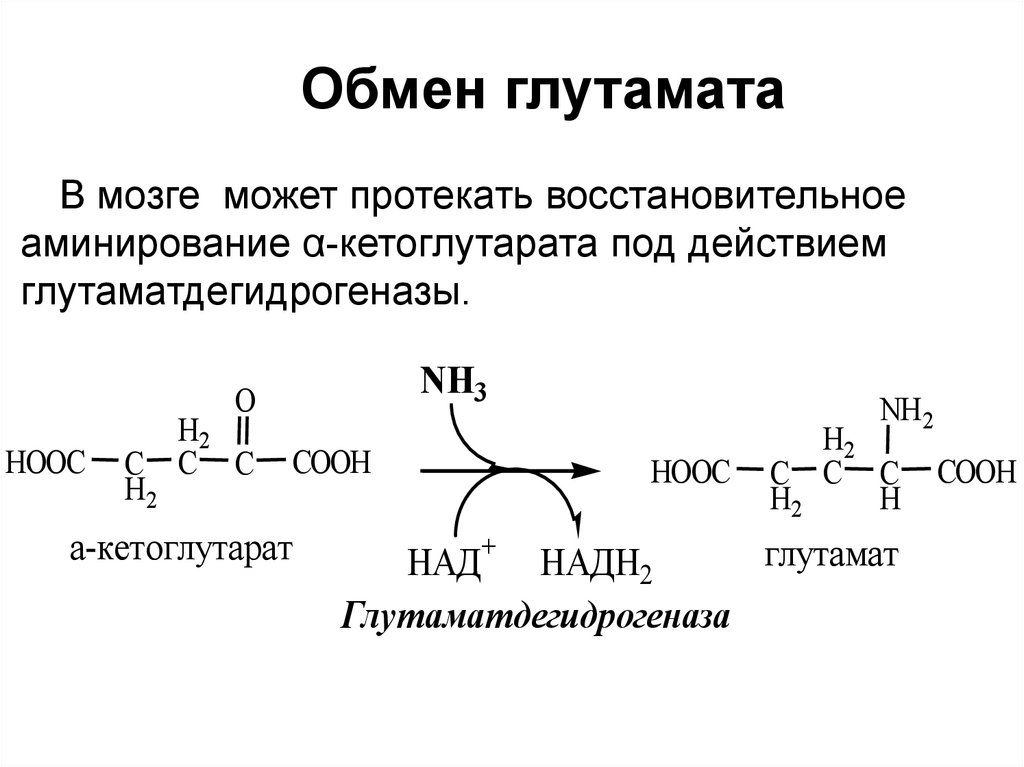
Обмен глутаматаВ мозге может протекать восстановительное
аминирование α-кетоглутарата под действием
глутаматдегидрогеназы.
NH3
O
HOOC
C
H2
H2
C C
COOH
а-кетоглутарат
NH2
HOOC
H2
C C C
H2
H
глутамат
НАД+ НАДН2
Глутаматдегидрогеназа
COOH
43.
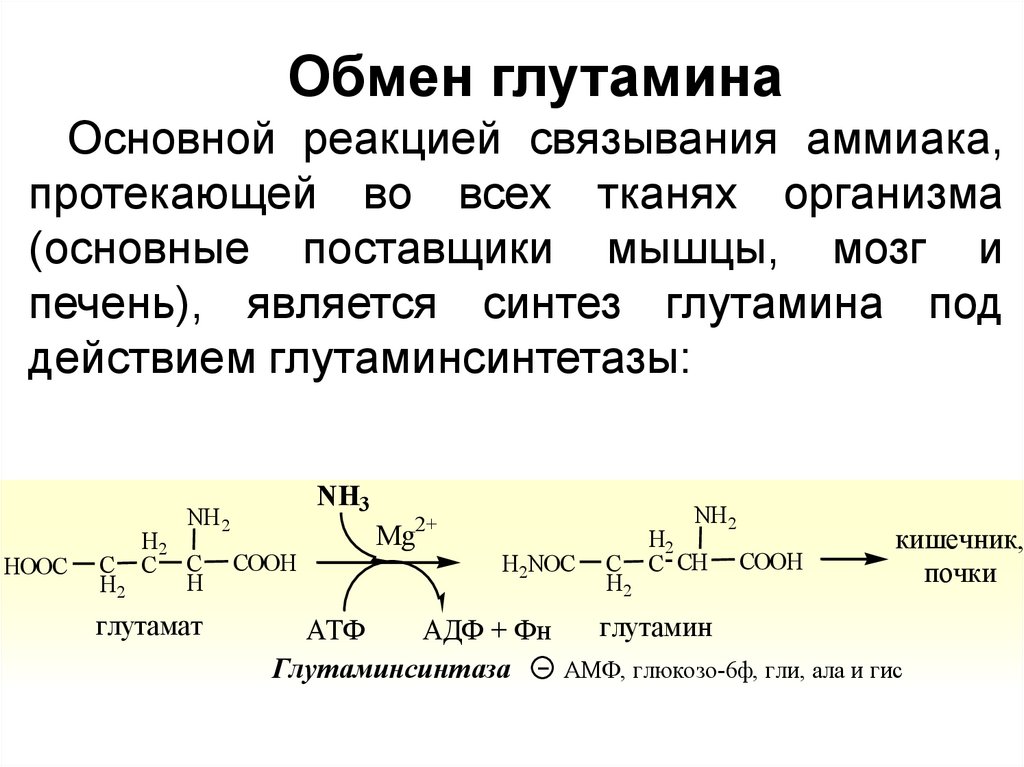
Обмен глутаминаОсновной реакцией связывания аммиака,
протекающей во всех тканях организма
(основные поставщики мышцы, мозг и
печень), является синтез глутамина под
действием глутаминсинтетазы:
NH3
NH 2
HOOC
H2
C C C
H
H2
глутамат
COOH
NH 2
2+
Mg
H2NOC
C
H2
H2
C CH
COOH
кишечник,
почки
глутамин
АТФ
АДФ + Фн
Глутаминсинтаза
АМФ, глюкозо-6ф, гли, ала и гис
44.
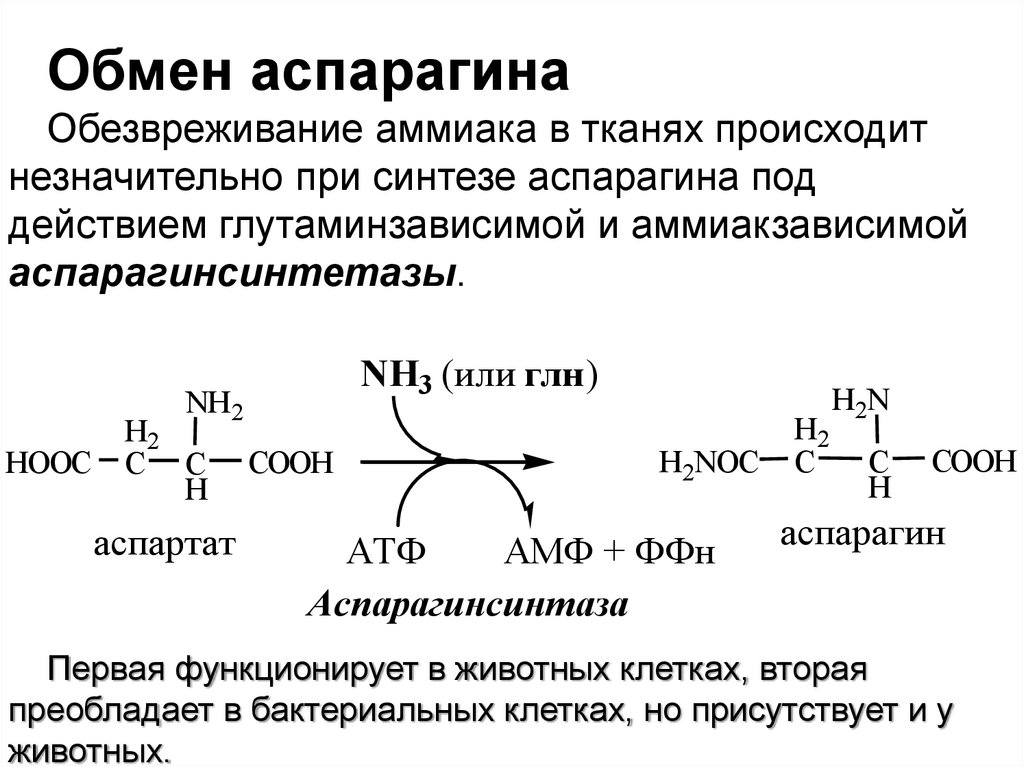
Обмен аспарагинаОбезвреживание аммиака в тканях происходит
незначительно при синтезе аспарагина под
действием глутаминзависимой и аммиакзависимой
аспарагинсинтетазы.
NH3 (или глн)
NH 2
HOOC
H2
C C
H
аспартат
COOH
H2NOC
АТФ
АМФ + ФФн
Аспарагинсинтаза
H2
C
H2N
C
H
COOH
аспарагин
Первая функционирует в животных клетках, вторая
преобладает в бактериальных клетках, но присутствует и у
животных.
45.
OH3C
HOOC
H2
C
NH 2
C
COOH
ПВК
H2N
H2
C
C
H
H3C CH
ала
COOH
глутамат
COOH
O
HOOC
АЛТ
Мышца
АК
белки
КК
аланин
СО2 Н2О
COOH
в кишечнике
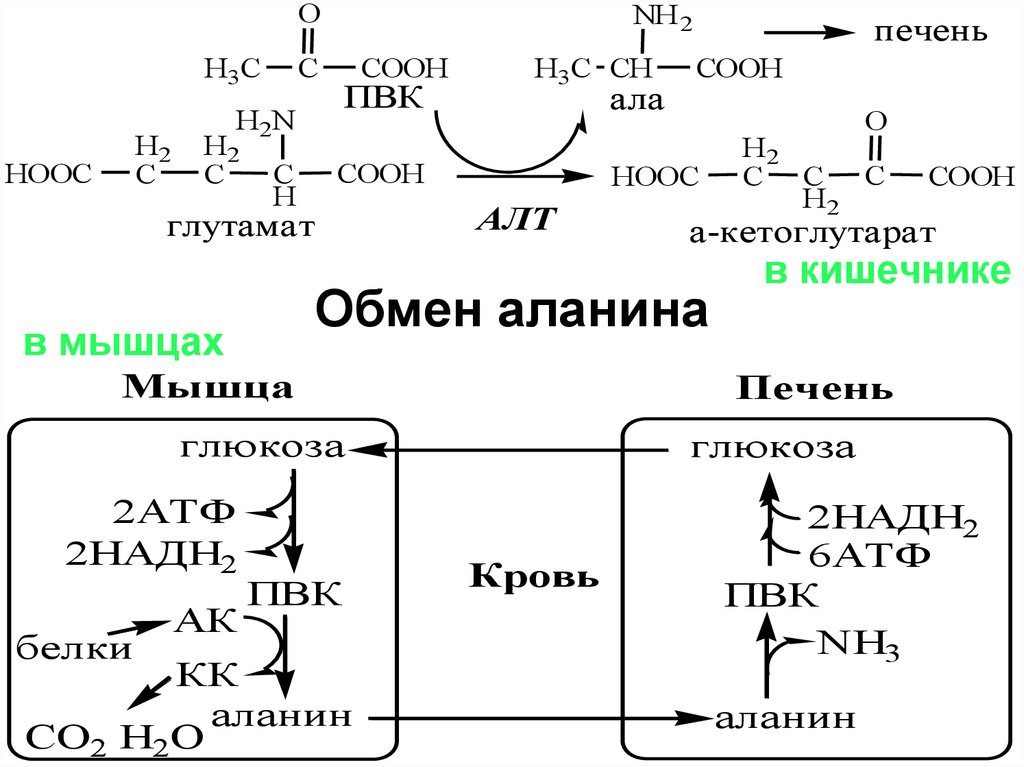
Печень
глюкоза
ПВК
H2
C C C
H2
а-кетоглутарат
Обмен аланина
в мышцах
2АТФ
2НАДН2
печень
глюкоза
Кровь
2НАДН2
6АТФ
ПВК
NH3
аланин
46.
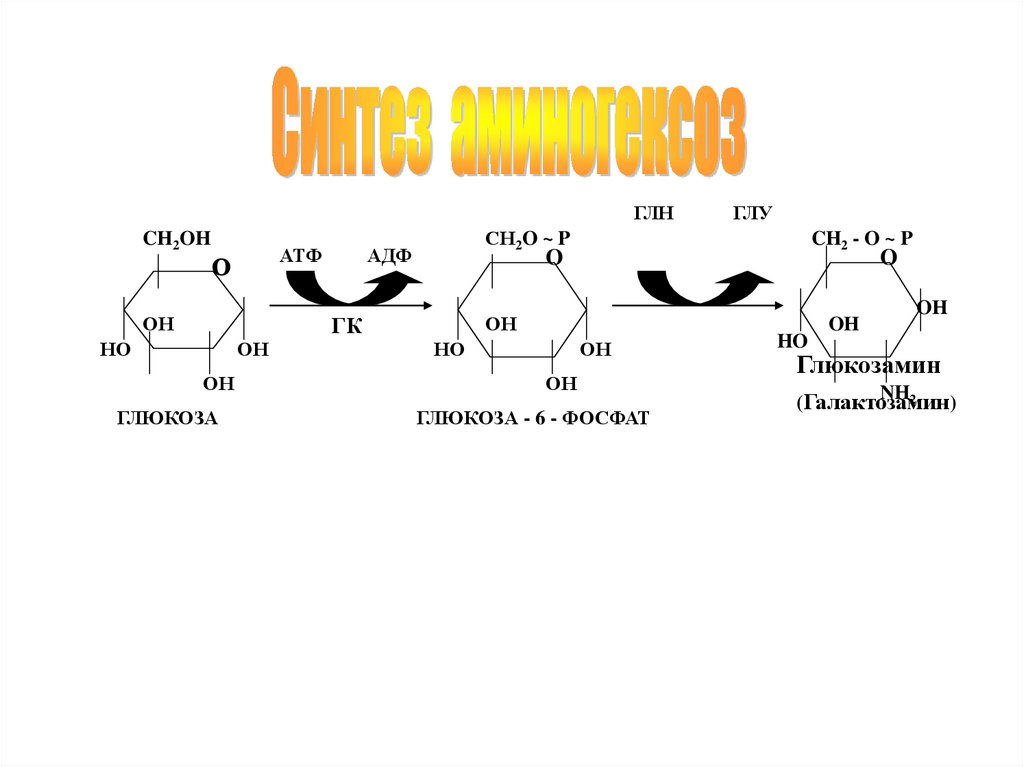
ГЛНCH2OH
АТФ
О
ОН
СН2O ~ P
АДФ
ОН
ОН
ГЛЮКОЗА
CH2 - O ~ P
O
O
ОН
ГК
НО
ГЛУ
НО
ОН
ОН
ГЛЮКОЗА - 6 - ФОСФАТ
HO
OH
OH
Глюкозамин
NH2
(Галактозамин
)
47.
Аммониогенз протекает в почках и дистальном канальце,механизм поддержания постоянства рН
Просвет
дистального
канальца
клетка
H+ + HCO3-
NaA
Na+
кровь
[HCO3-]
pH=pK+lg [H CO ]
2
3
CO2 + H2O
A-
H2CO3
KА
H2CO3
В результате в
H
H+
HCO3-
NH3
NH3
ГЛУ
NH4+
HCO3
ГЛН
Na+
NH4A
МОЧА
крови
восстанавливается
концентрация
бикарбоната, а
«расплатой» за
этоявляется выведение
протонов с мочей в
виде аммонийных солей.
48.
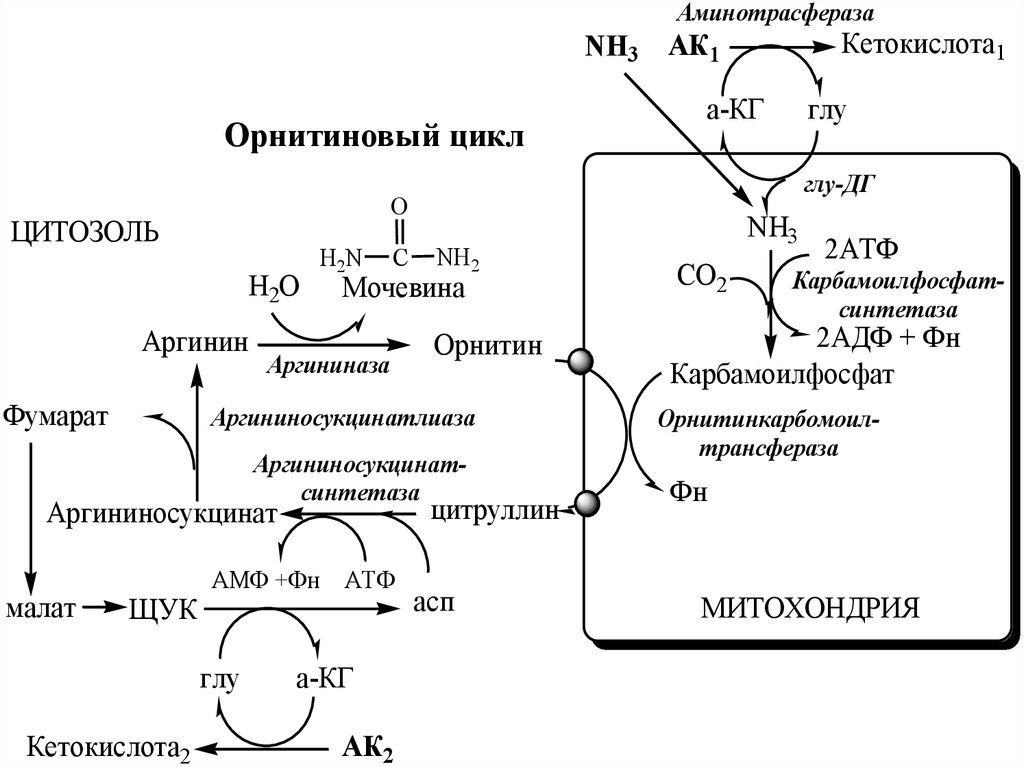
Реакции орнитинового циклаВ митохондриях под действием
карбамоилфосфатсинтетазы I с затратой 2
АТФ аммиак связывается с СО2 с образованием
карбамоилфосфата:
NH2
2АТФ
2АДФ+Фн
C
O
NH3 + CO 2 + H2O
OPO 3H2
Карбомоилфосфатсинтетаза карбомоилфосфат
Карбамоилфосфатсинтетаза II локализована
в цитозоле клеток всех тканей и участвует в
синтезе пиримидиновых нуклеотидов.
49.
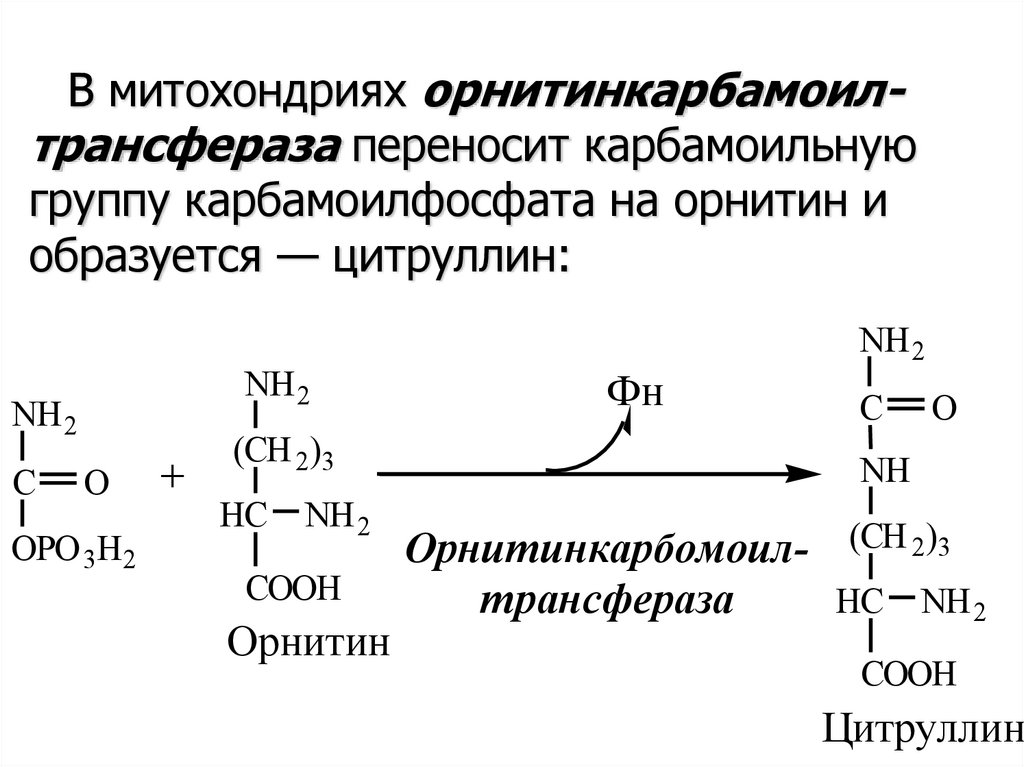
В митохондриях орнитинкарбамоилтрансфераза переносит карбамоильнуюгруппу карбамоилфосфата на орнитин и
образуется — цитруллин:
NH2
NH2
C
O
OPO 3H2
+
(CH 2)3
HC
NH2
COOH
Орнитин
NH2
Фн
C
O
NH
Орнитинкарбомоил- (CH 2)3
трансфераза
HC NH 2
COOH
Цитруллин
50.
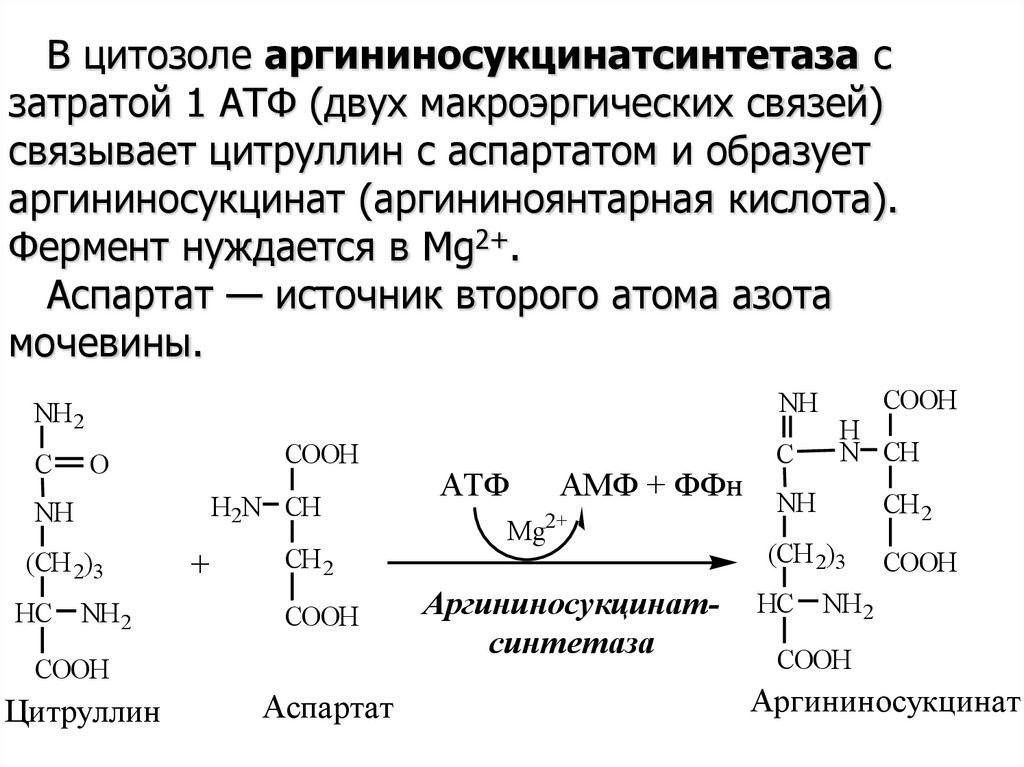
В цитозоле аргининосукцинатсинтетаза сзатратой 1 АТФ (двух макроэргических связей)
связывает цитруллин с аспартатом и образует
аргининосукцинат (аргининоянтарная кислота).
Фермент нуждается в Mg2+.
Аспартат — источник второго атома азота
мочевины.
NH
NH 2
C
COOH
O
H2N CH
NH
(CH 2)3
HC
NH 2
+
CH 2
COOH
COOH
Цитруллин
Аспартат
АТФ
C
АМФ + ФФн NH
2+
Mg
Аргининосукцинатсинтетаза
COOH
H
N CH
CH 2
(CH 2)3
HC
COOH
NH 2
COOH
Аргининосукцинат
51.
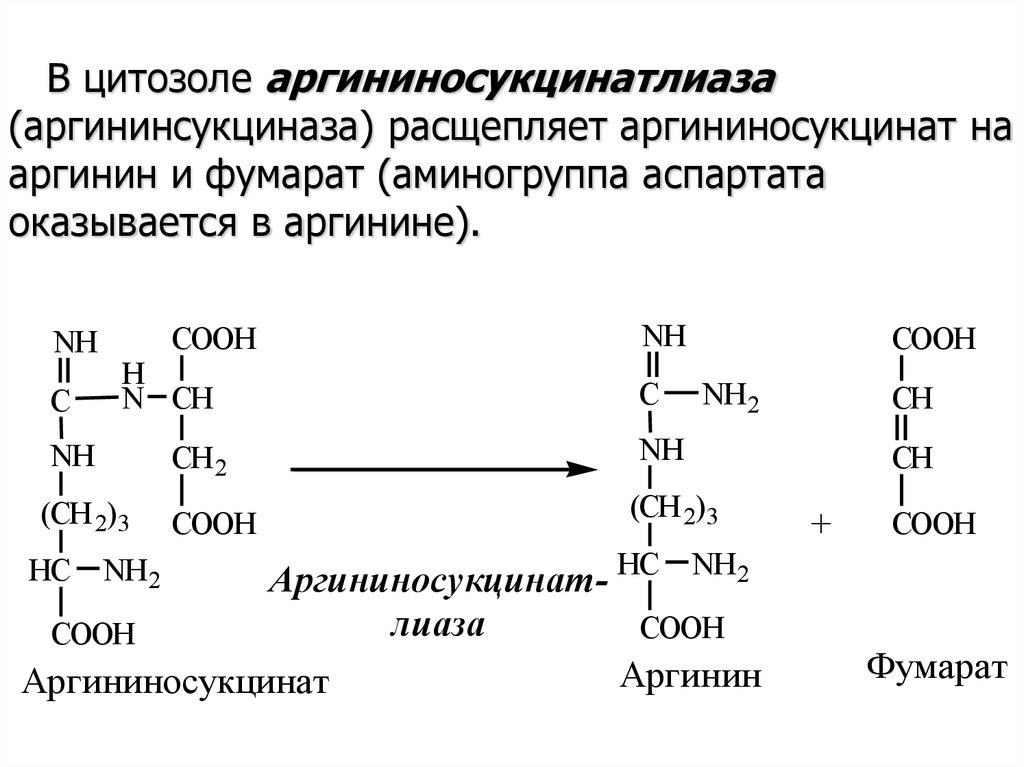
В цитозоле аргининосукцинатлиаза(аргининсукциназа) расщепляет аргининосукцинат на
аргинин и фумарат (аминогруппа аспартата
оказывается в аргинине).
NH
C
COOH
H
N CH
NH
C
COOH
NH 2
NH
CH 2
NH
(CH 2)3
COOH
(CH 2)3
Аргининосукцинат- HC NH 2
лиаза
COOH
COOH
Аргинин
Аргининосукцинат
HC
CH
CH
+
COOH
NH 2
Фумарат
52.
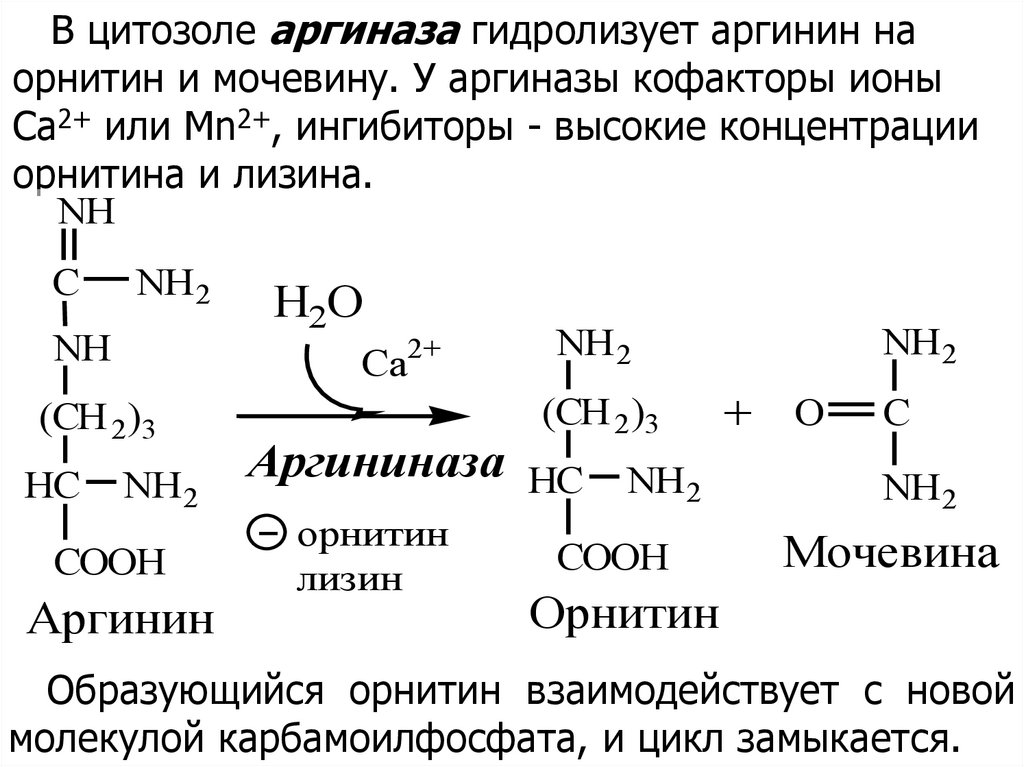
В цитозоле аргиназа гидролизует аргинин наорнитин и мочевину. У аргиназы кофакторы ионы
Са2+ или Мn2+, ингибиторы - высокие концентрации
орнитина и лизина.
NH
C
NH 2
NH
2+
Са
(CH 2)3
HC
Н2О
NH 2
COOH
Аргинин
(CH 2)3
Аргининаза HC NH
2
орнитин
лизин
NH 2
NH 2
COOH
+ O
C
NH 2
Мочевина
Орнитин
Образующийся орнитин взаимодействует с новой
молекулой карбамоилфосфата, и цикл замыкается.
53.
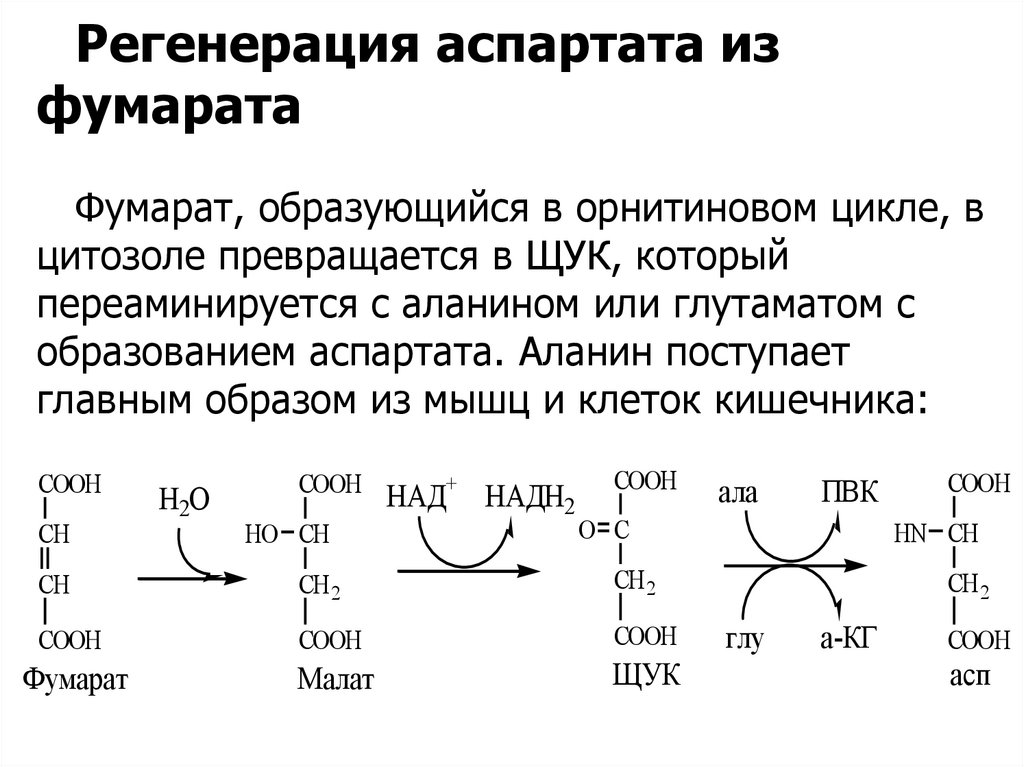
Регенерация аспартата изфумарата
Фумарат, образующийся в орнитиновом цикле, в
цитозоле превращается в ЩУК, который
переаминируется с аланином или глутаматом с
образованием аспартата. Аланин поступает
главным образом из мышц и клеток кишечника:
COOH
CH
Н2О
COOH
НО CH
+
НАД
НАДН2
COOH
ала
ПВК
О C
CH
CH 2
CH 2
COOH
COOH
COOH
Фумарат
Малат
ЩУК
COOH
HN CH
CH 2
глу
а-КГ
COOH
асп
54.
АминотрасферазаNH3
Орнитиновый цикл
Н2О
Аргинин
Фумарат
H2N
C
NH 2
Мочевина
Аргининаза
Орнитин
Аргининосукцинатлиаза
цитруллин
Аргининосукцинат
ЩУК
АМФ +Фн
глу
Кетокислота2
АТФ
а-КГ
АК2
глу
глу-ДГ
Аргининосукцинатсинтетаза
малат
а-КГ
O
ЦИТОЗОЛЬ
Кетокислота1
АК1
асп
NH3
СО2
2АТФ
Карбамоилфосфатсинтетаза
2АДФ + Фн
Карбамоилфосфат
Орнитинкарбомоилтрансфераза
Фн
МИТОХОНДРИЯ
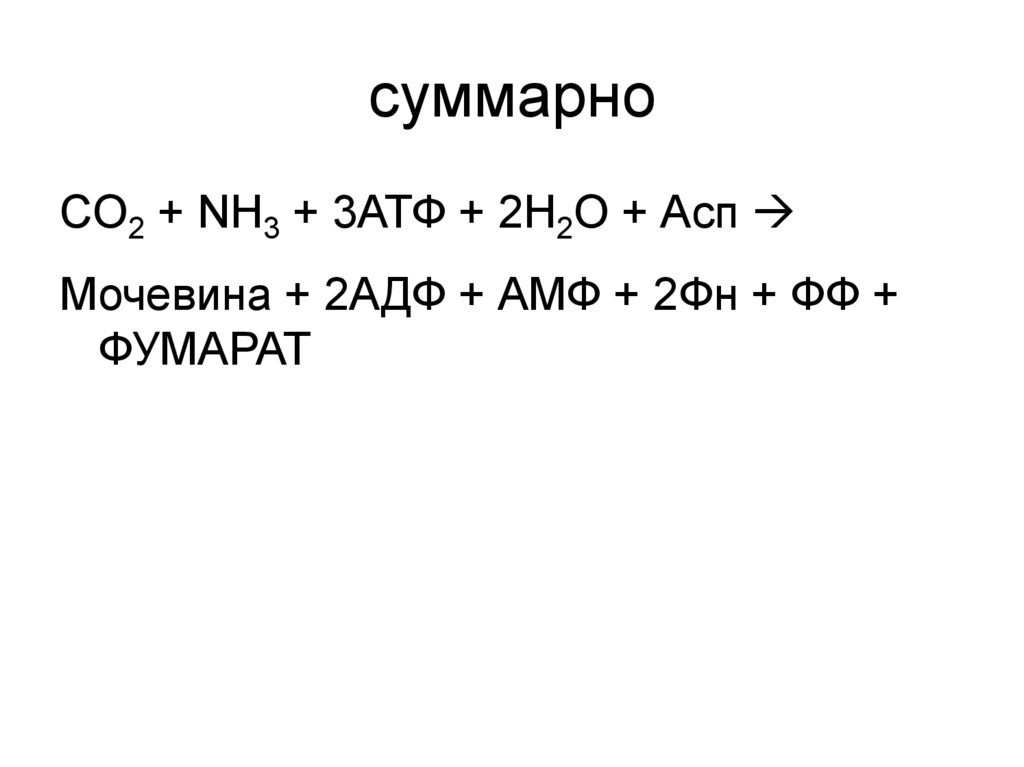
55. суммарно
СO2 + NH3 + 3АТФ + 2H2O + АспМочевина + 2АДФ + АМФ + 2Фн + ФФ +
ФУМАРАТ
56.
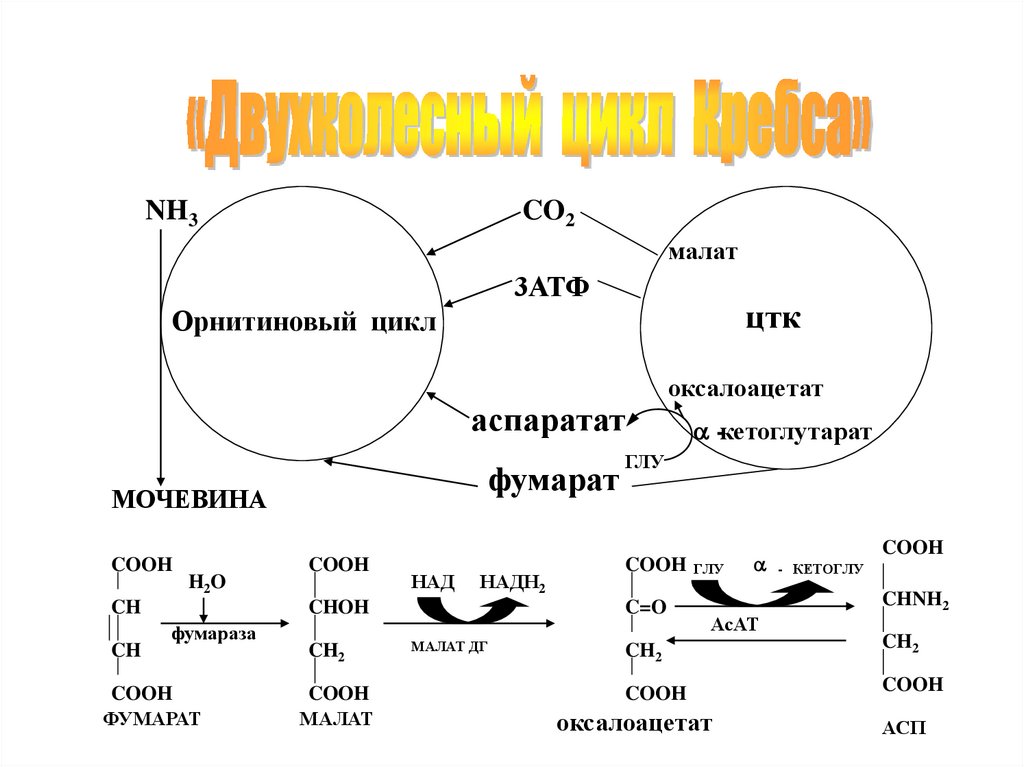
Взаимосвязь орнитинового цикла с ЦТКДля аминирования необходима доступность
кислот цикла Кребса. Глутамат, образуемый
при переаминировании, в печеночных
митохондриях может либо окисляться через
дезаминирование, либо переаминируется с
оксалоацетатом, давая аспарагиновую
кислоту – донора аминного азота для
производства мочевины.
57.
NH3CO2
малат
3АТФ
цтк
Орнитиновый цикл
аспаратат
фумарат
МОЧЕВИНА
COOH
H2O
CH
CH
COOH
НАД
НАДН2
CHOH
фумараза
COOH
ФУМАРАТ
CH2
COOH
МАЛАТ
оксалоацетат
ГЛУ
COOH ГЛУ
C=O
МАЛАТ ДГ
-кетоглутарат
- КЕТОГЛУ
COOH
CHNH2
АсАТ
CH2
CH2
COOH
COOH
оксалоацетат
АСП
58. Выделение азота из организма
C мочойC калом
Азот
C выдыхаемым воздухом
C потом
59.
Спасибоза внимание!




























 biology
biology chemistry
chemistry








