Similar presentations:
Обмен белков и аминокислот. Азотистый баланс. (Лекция 14)
1.
Обмен белков иаминокислот
2. Азотистый баланс
РавновесиеПоложительный
Отрицательный
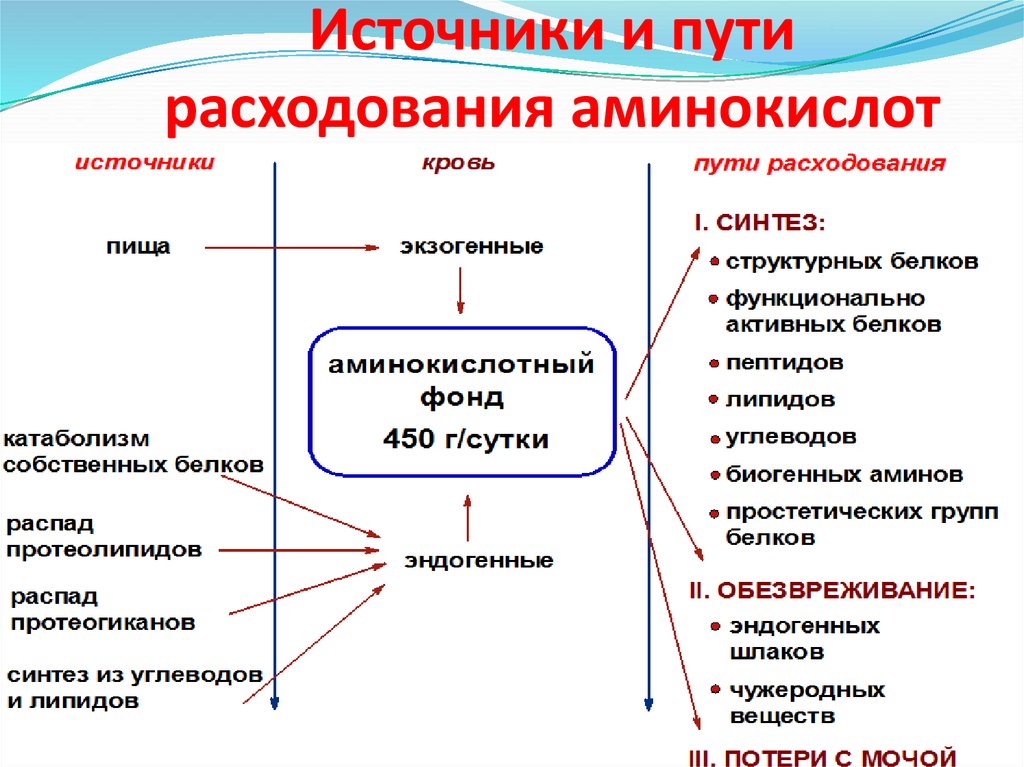
3. Источники и пути расходования аминокислот
источникипища
кровь
экзогенные
пути расходования
I. CИНТЕЗ:
структурных белков
функционально
активных белков
катаболизм
собственных белков
распад
протеолипидов
распад
протеогиканов
синтез из углеводов
и липидов
аминокислотный
фонд
пептидов
450 г/сутки
углеводов
липидов
биогенных аминов
эндогенные
простетических групп
белков
II. ОБЕЗВРЕЖИВАНИЕ:
эндогенных
шлаков
чужеродных
веществ
III. ПОТЕРИ С МОЧОЙ
4.
5.
6. Заменимые и незаменимые аминокислоты
заменимыенезаменимые
заменимые
незаменимые
Аланин
Аргинин*
Глутамин
Лизин
Аспарагиновая кислота
Валин
Пролин
Метионин
Аспарагин
Гистидин*
Серин
Треонин
Глицин
Изолейцин
Тирозин
Триптофан
Глутамино-вая
кислота
Лейцин
Цистеин
Фенилаланин
* - частично заменимые аминокислоты
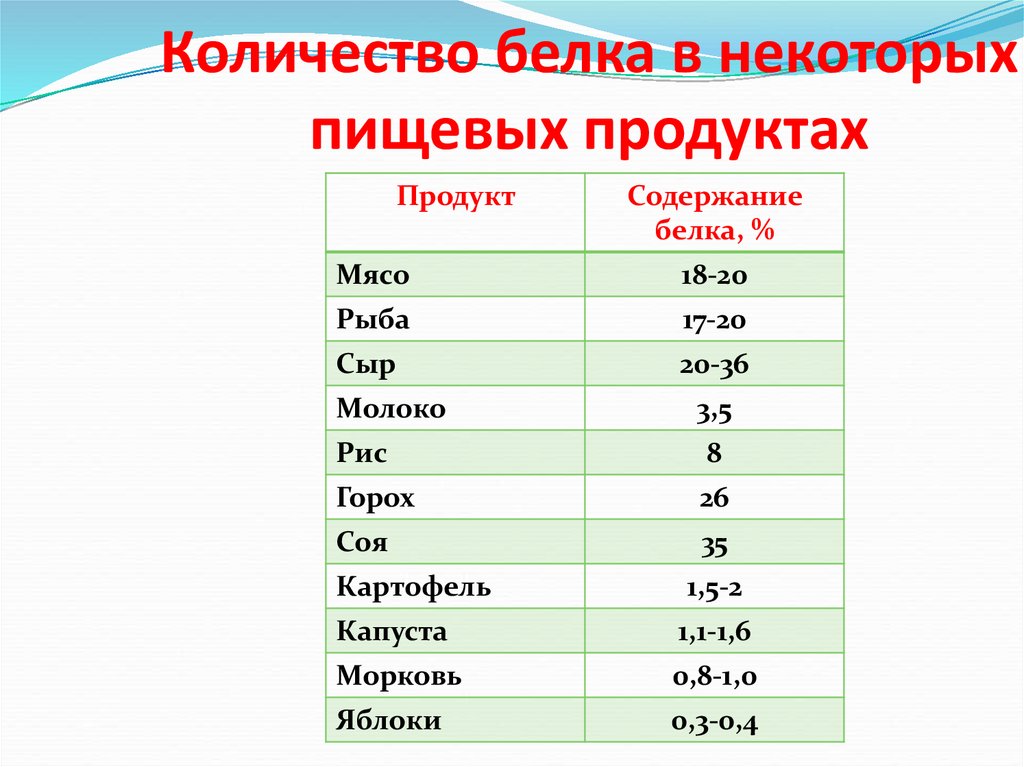
7. Количество белка в некоторых пищевых продуктах
ПродуктСодержание
белка, %
Мясо
18-20
Рыба
17-20
Сыр
20-36
Молоко
3,5
Рис
8
Горох
26
Соя
35
Картофель
1,5-2
Капуста
1,1-1,6
Морковь
0,8-1,0
Яблоки
0,3-0,4
8. Содержание незаменимых аминокислот в белках различного происхождения
9. Протеиназы ЖКТ
Эндопептидазы ЭкзопептидазыПепсин;
Карбоксипептидазы А
Реннин;
и В;
Аминопептидазы;
Дипептидазы;
Трипептидазы.
Гастриксин;
Трипсин;
Химотрипсин;
Эластаза.
10. Схема действия эндопептидаз
11. Схема действия эндопептидаз
NН 2...
Н2О
Белок
NН 2
NН 2
COOH
...
COOH
COOH
NН 2
Смесь полипептидов
COOH
12. Схема действия экзопептидаз
NН 2...
аминопептидаза
COOH
Белок
карбоксипептидаза
Н2О
NН 2
...
COOH
NН 2
COOH
Свободные
аминокислоты
NН 2
COOH
13. Схема действия протеиназ
14. Протеиназы желудочно-кишечного тракта
ИсточникФермент
Субстратная
специфичность
Желудочный пепсин
сок
реннин
гастриксин
Панкреатический сок
трипсин
эндопептидазы
химотрипсин
коллагеназа
эластаза
карбоксипептидаза
Кишечный
сок
аминопептидаза
трипептидазы
дипептидазы
экзопептидазы
15. Активация пепсиногена
16. Секреция соляной кислоты в желудке
просветжелудка
обкладочная
клетка
сосуд
СО2 + Н2О
карбоангидраза
Н2СО3
+
H Cl
+
Н + НСО3
НСО3
Na+Cl
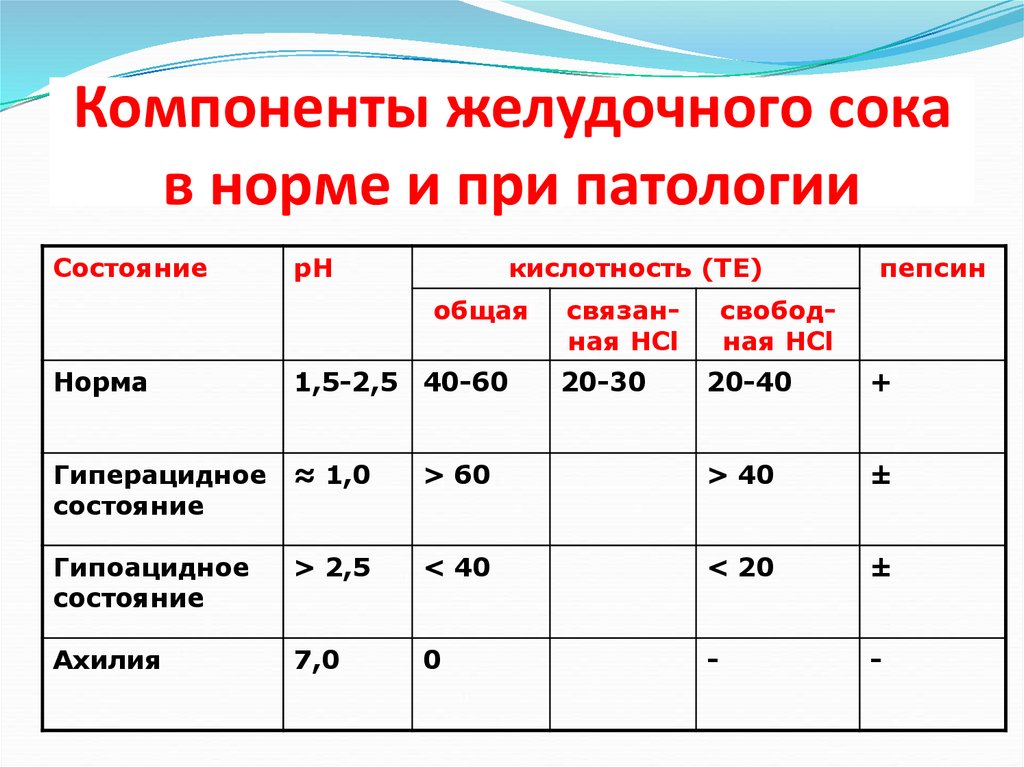
17. Компоненты желудочного сока в норме и при патологии
СостояниерН
кислотность (ТЕ)
общая
Норма
1,5-2,5 40-60
Гиперацидное
состояние
≈ 1,0
Гипоацидное
состояние
Ахилия
связанная НСl
20-30
пепсин
свободная HCl
20-40
+
> 60
> 40
±
> 2,5
< 40
< 20
±
7,0
0
-
-
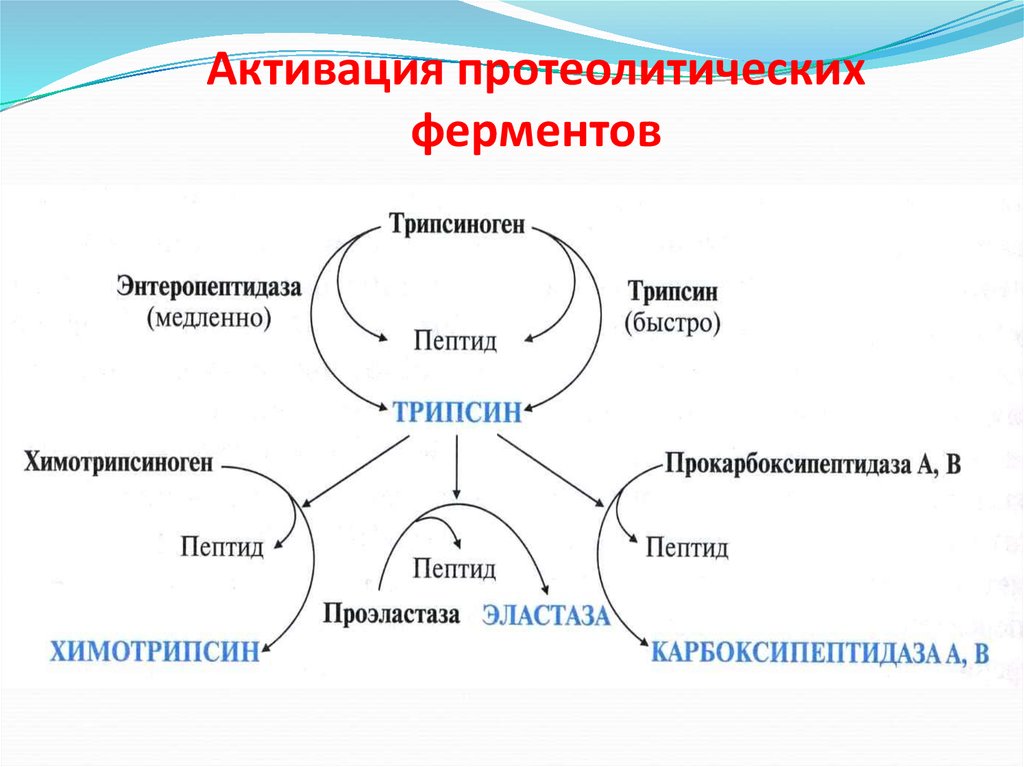
18. Активация трипсиногена
ЭнтеропептидазаТрипсиноген
неактивный
Трипсин
активный
19. Активация протеолитических ферментов
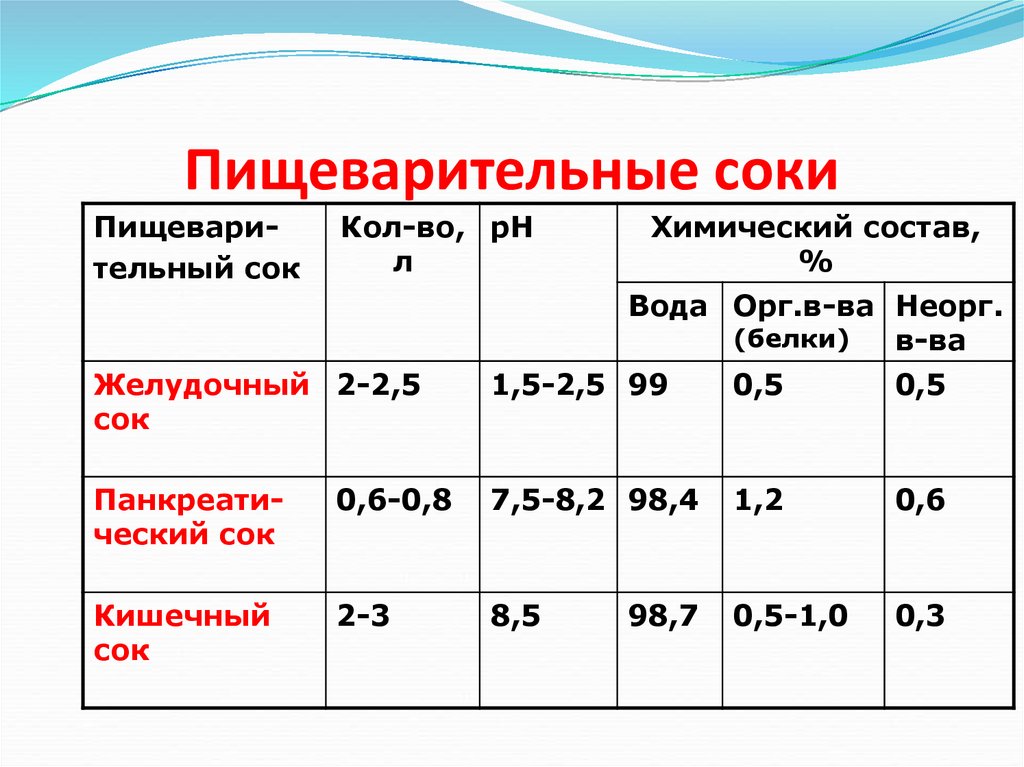
20. Пищеварительные соки
Пищеварительный сокКол-во, рН
л
Химический состав,
%
Вода Орг.в-ва Неорг.
(белки)
в-ва
Желудочный 2-2,5
сок
1,5-2,5 99
0,5
0,5
Панкреатический сок
0,6-0,8
7,5-8,2 98,4
1,2
0,6
Кишечный
сок
2-3
8,5
0,5-1,0
0,3
98,7
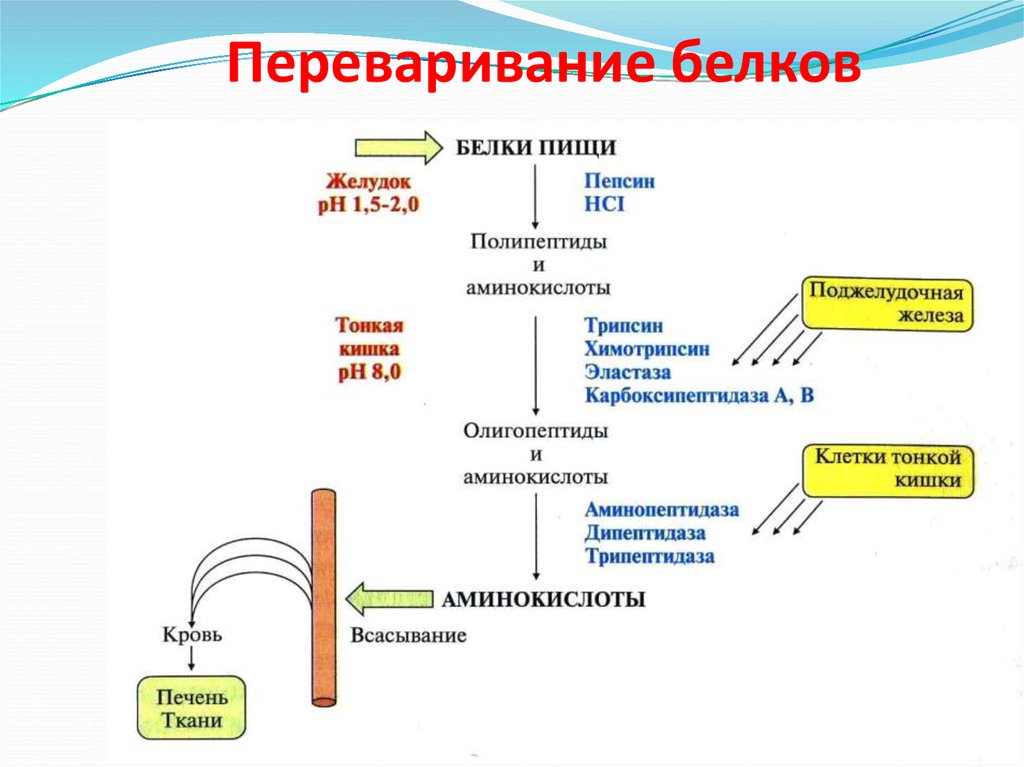
21. Переваривание белков
22.
23.
РЕГУЛЯЦИЯ ПРОЦЕССОВПЕРЕВАРИВАНИЯ БЕЛКОВ
ГОРМОН
ГАСТРИН
ЭНТЕРОГАСТРОН
СЕКРЕТИН
МЕСТО
ВЫРАБОТКИ
ПИЛОРИЧЕСКАЯ
ЧАСТЬ ЖЕЛУДКА
12-ПЕРСТНАЯ
КИШКА
12-ПЕРСТНАЯ
КИШКА, ТОЩАЯ
ХОЛЕЦИСТОКИНИН
ТОНКИЙ
КИШЕЧНИК
ВАЗОАКТИВНЫЙ
ИНТЕСТЕНАЛЬНЫЙ ПЕПТИД
(ВИП)
ПАНКРЕОТИЧЕС КИЙ ПОЛИПЕПТИД
(ПП)
ТОНКИЙ
КИШЕЧНИК
ТОНКИЙ
КИШЕЧНИК
БИОЛОГИЧЕСКОЕ ДЕЙСТВИЕ
УСИЛИВАЕТ СИНТЕЗ СОЛЯНОЙ
КИСЛОТЫ
ТОРМОЗИТ ВЫРАБОТКУ НСI И
ПЕПСИНА
УСИЛИВАЕТ СИНТЕЗ
БИКАРБОНАТОВ И ЖИДКОЙ
ЧАСТИ ПАНКРЕАТИЧЕСКОГО
СОКА
УСИЛИВАЕТ СИНТЕЗ
ПАНКРЕОТИЧЕСКИХ
ФЕРМЕНТОВ
СТИМУЛИРУЕТ СИНТЕЗ
БИКАРБОНАТОВ ВЫРАБОТКУ
ЖЕЛЧИ, ТОРМОЗИТ ДЕЯТЕЛЬНОСТЬ ЖЕЛУДОЧНЫХ ЖЕЛЕЗ
ТОРМОЗИТ ВЫРАБОТКУ ПАНКРЕАТИЧЕСКИХ
ФЕРМЕНТОВ
24. Механизм всасывания аминокислот в кишечнике
симпортаминокислота
Na+/K+-АТФаза
аминокислота
АТФ
Na+
K+
Na
+
высокая
концентрация
Na+
низкая
концентрация
АДФ + НР
Na+
K+
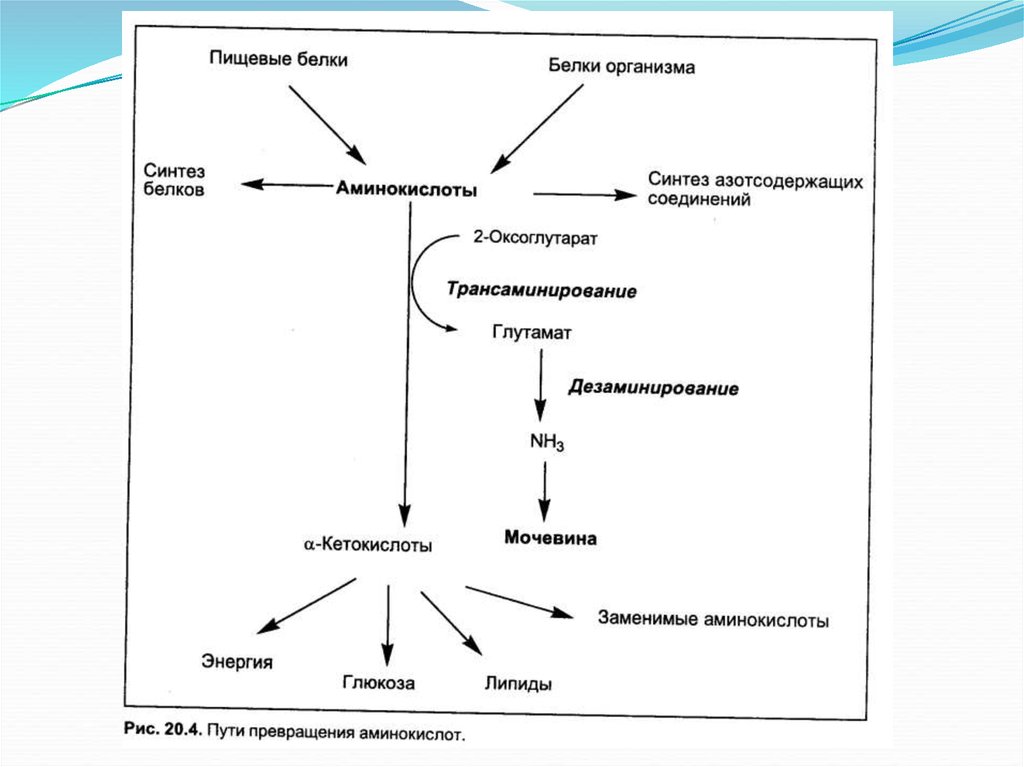
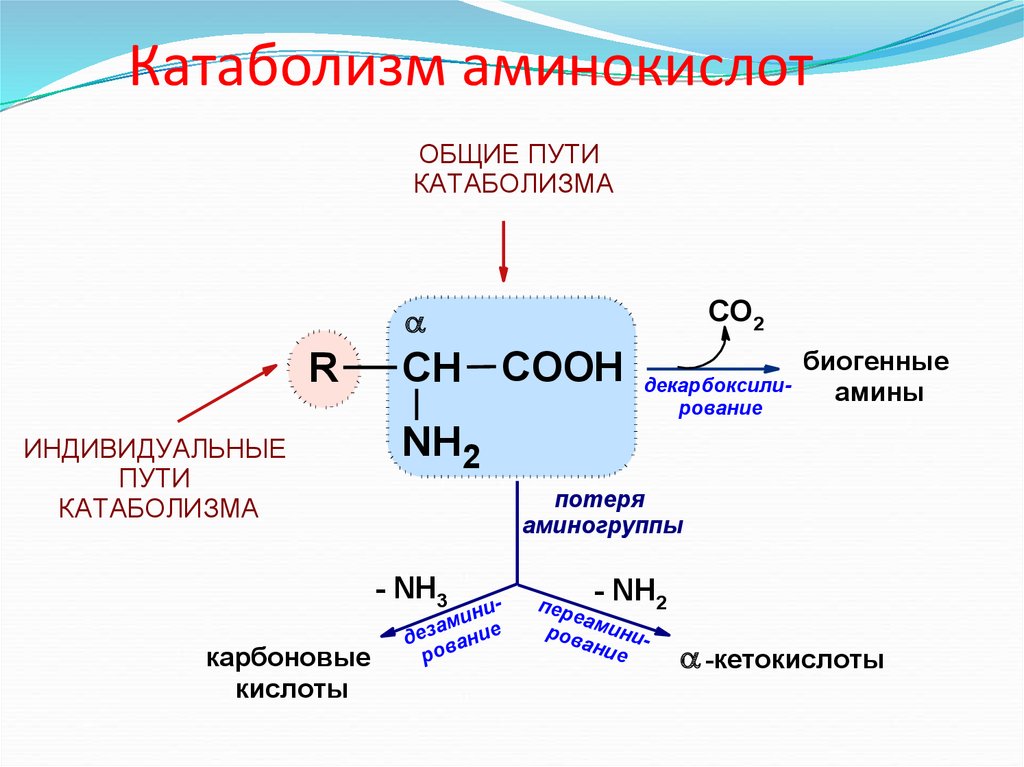
25. Катаболизм аминокислот
ОБЩИЕ ПУТИКАТАБОЛИЗМА
СО2
R
ИНДИВИДУАЛЬНЫЕ
ПУТИ
КАТАБОЛИЗМА
СН COOH
биогенные
амины
NH2
потеря
аминогруппы
- NH3
карбоновые
кислоты
декарбоксилирование
нии
м
а
дез вание
ро
- NH2
п ер
еа
ров миниани
е
-кетокислоты
26. Реакции декарбоксилирования
СО2R СН COO H
NH2
декарбоксилаза
ПФ (vit B6)
аминоксилота
COOH
СН2
СН2
СН NH2
COOH
глу
R СН2 NH2
биогенный амин
СО 2
декарбоксилаза
ПФ (vit B6)
COOH
СН2
СН2
СН2 NH2
-аминомасляная к-та
(ГАМК)
27.
Реакции декарбоксилированияCO 2
СН 2 СН
N
NH
гистидин
NH2
COO H
декарбоксилаза
ПФ (vit B6)
СН 2 СН 2
N
NH
гистамин
NH2
28. Реакции декарбоксилирования
OHOH
СО2
HO
декарбоксилаза
СН2
СН
NH2
ПФ (vit B6)
HO
СН2
СН2 NH2
COOH
диоксифенилаланин
дофамин
29.
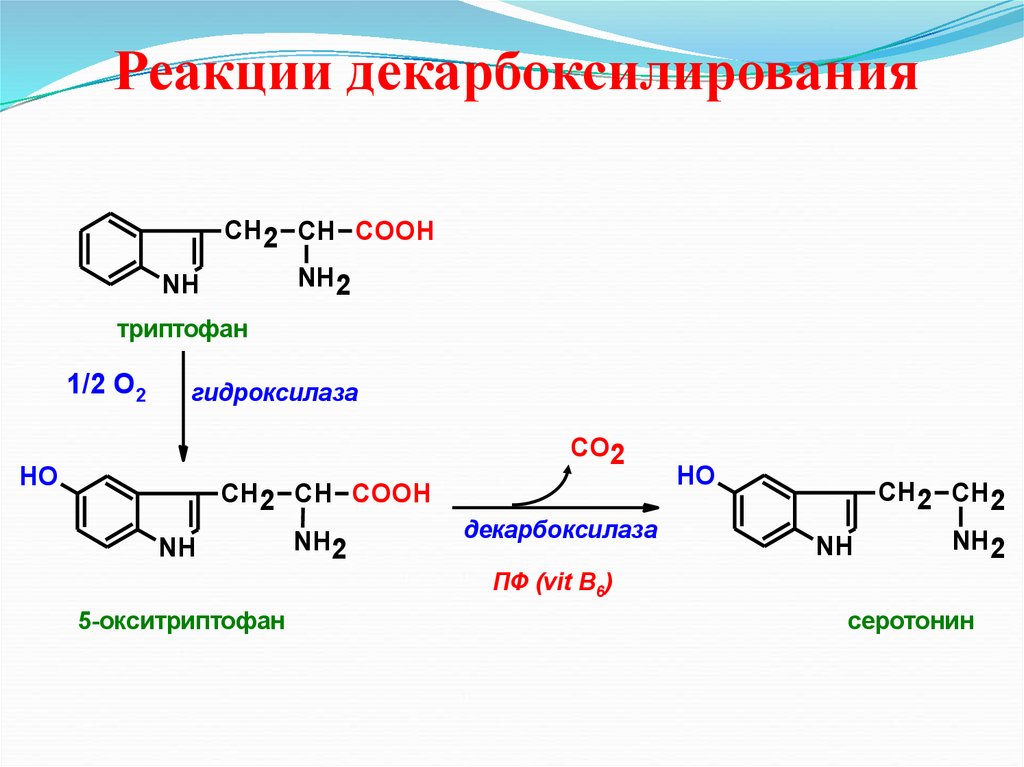
Реакции декарбоксилированияСН2 СН COOH
NH2
NH
триптофан
1/2 О2
гидроксилаза
СО2
HO
СН2 СН COOH
NH
NH2
декарбоксилаза
HO
СН2 СН2
NH2
NH
ПФ (vit B6)
5-окситриптофан
серотонин
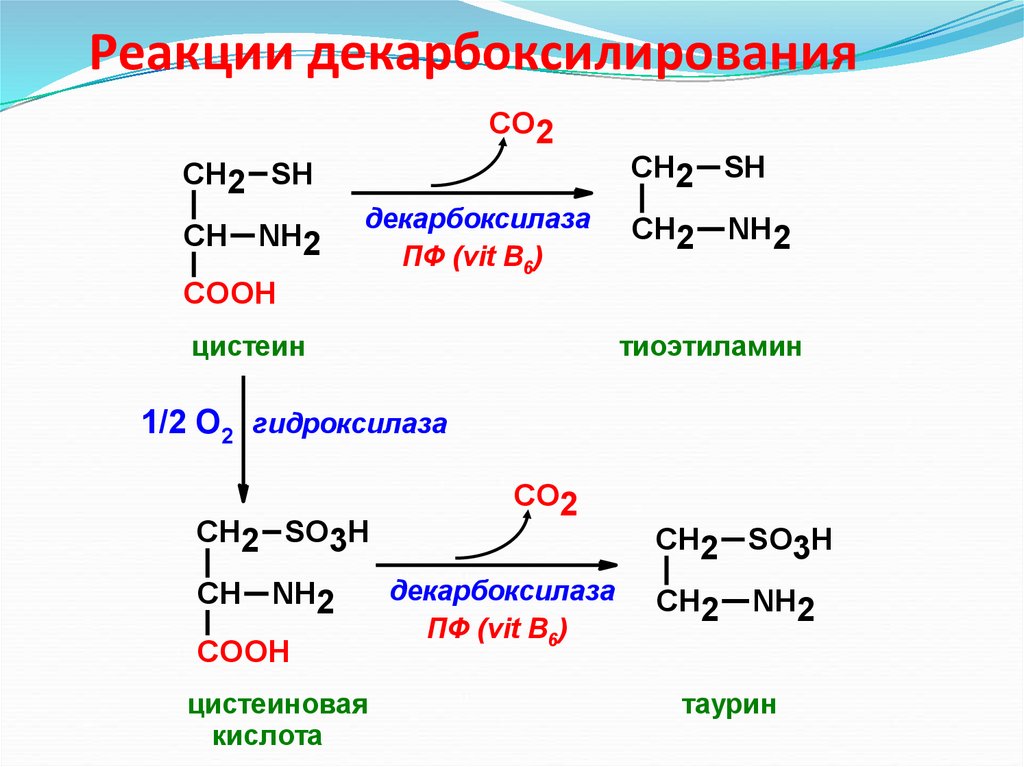
30. Реакции декарбоксилирования
СО2СН2 SH
СН NH2
декарбоксилаза
ПФ (vit B6)
СН2 SH
СН2
NH2
COOH
цистеин
тиоэтиламин
1/2 О2 гидроксилаза
СН2 SO3H
СН NH2
COOH
цистеиновая
кислота
СО2
декарбоксилаза
ПФ (vit B6)
СН2 SO3H
СН2
NH2
таурин
31.
32. Реакции декарбоксилирования
Обезвреживание биогенных аминовФАД
R СН2 NH2
амин
аминоксидаза
NH3 + R С
Н2О
ФАДН2
O
1/2 О2
H
альдегид
+Н
R СН2 OH
спирт
R СН
NH
имин
спонтанно
O
R С
ОН
кислота
33.
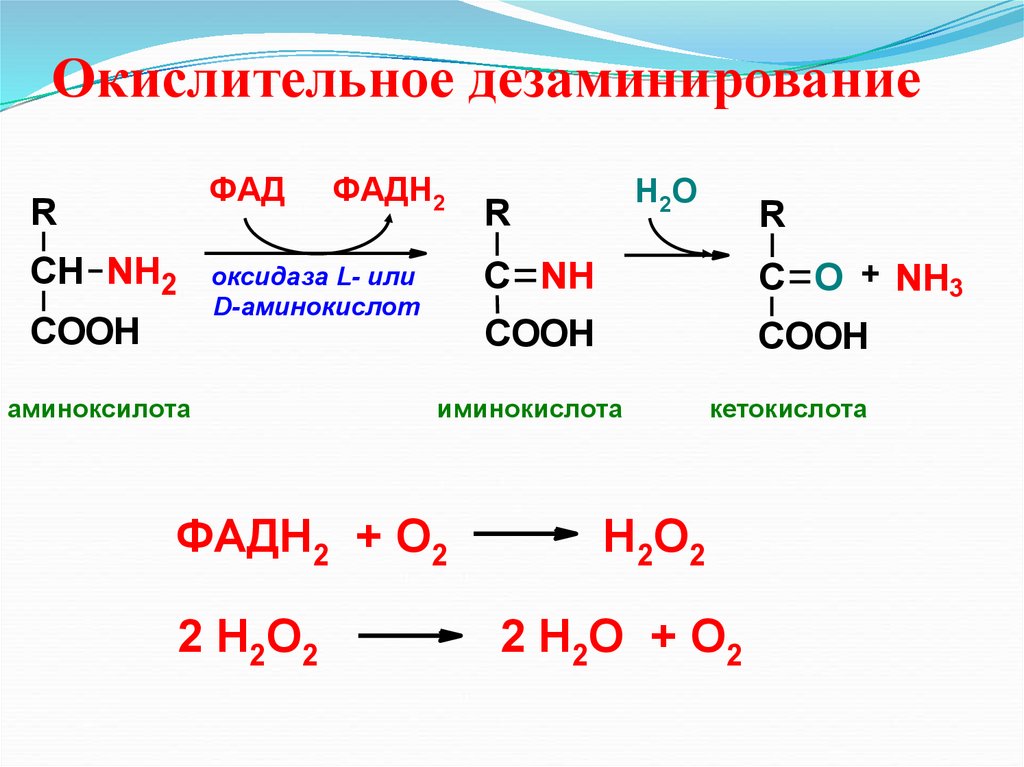
Окислительное дезаминированиеФАД
R
СН NH2
COOH
ФАДН2
оксидаза L- или
D-аминокислот
аминоксилота
R
R
С NH
С O + NH3
COOH
COOH
иминокислота
ФАДН2 + О2
2 Н2О2
Н2О
кетокислота
Н2О2
2 Н2О + О2
34.
35.
Окислительное дезаминированиеглутамата
COOH
CH2
CH2
СН NH2
COOH
глутамат
+
НАД
НАДН + Н
глутаматдегидрогеназа
+
COOH
Н2О
CH2
CH2
С
COOH
NH
Н2О
COOH
-иминоглутарат
НАДН+Н+ ----→ 3 АТФ
CH2
+ NH3
CH2
С
O
COOH
-кетоглутарат
36. Обезвреживание биогенных аминов
Реакции трансаминированияR1
R1
R2
O аминотранс- С O +
фераза
COOH
COOH
R2
СН NH2 + С
СН NH2
COOH
COOH
ак1
ПФ (vit B6)
-кетокислота
-кетокислота
ак2
37.
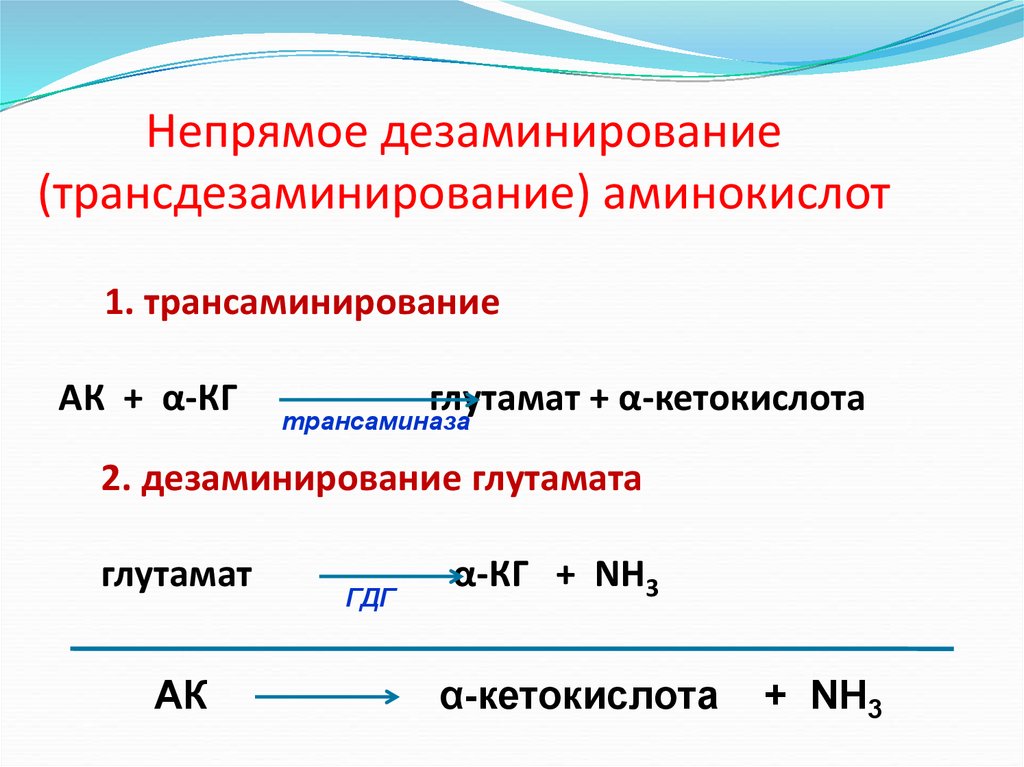
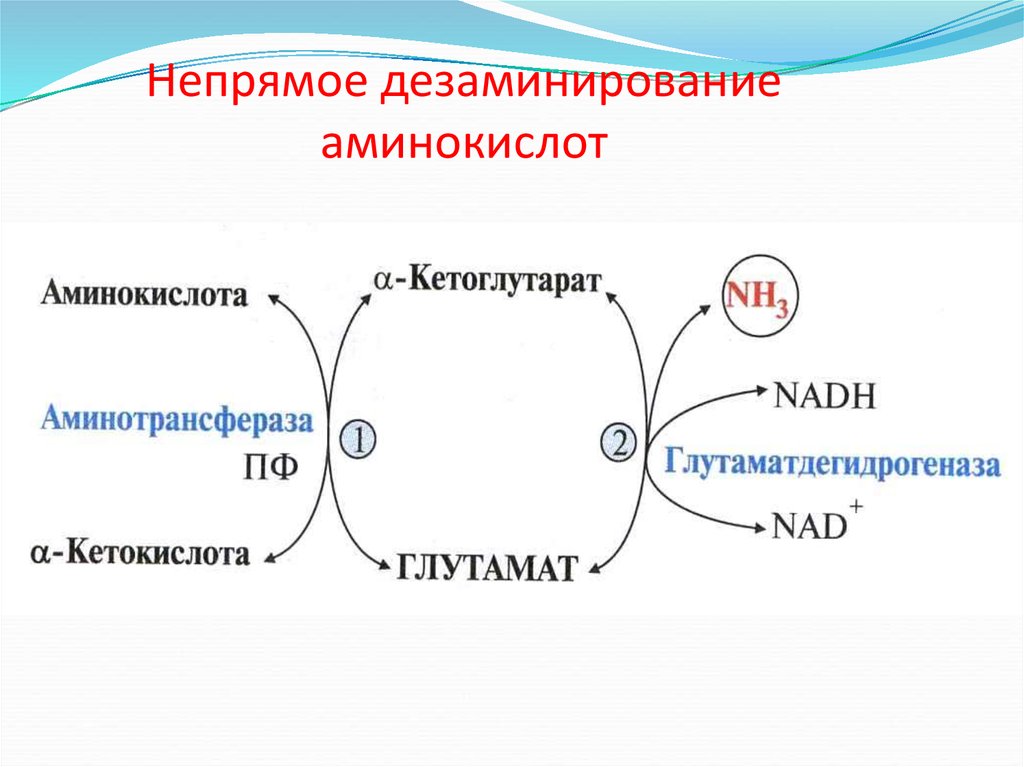
Непрямое дезаминирование(трансдезаминирование) аминокислот
1. трансаминирование
АК + α-КГ
глутамат + α-кетокислота
трансаминаза
2. дезаминирование глутамата
глутамат
АК
ГДГ
α-КГ + NH3
α-кетокислота
+ NH3
38. Окислительное дезаминирование
Непрямое дезаминированиеаминокислот
39.
Обмен отдельныхаминокислот
40. Окислительное дезаминирование глутамата
41.
Катаболизм аминокислотОБЩИЕ ПУТИ
КАТАБОЛИЗМА
СО2
R
ИНДИВИДУАЛЬНЫЕ
ПУТИ
КАТАБОЛИЗМА
СН COOH
NH2
потеря
аминогруппы
- NH3
карбоновые
кислоты
декарбоксилирование
биогенные
амины
нии
м
а
дез вание
ро
- NH2
п ер
еа
ров миниани
е
-кетокислоты
42. Реакции трансаминирования
Метионин43. Непрямое дезаминирование (трансдезаминирование) аминокислот
Обмен метионинаОбмен метионина
44. Непрямое дезаминирование аминокислот
S-аденозилметионин (SAМ)45.
ИСПОЛЬЗОВАНИЕ СН3-РАДИКАЛОВсинтез
СН3
- адреналина
- креатина
- холина
- пиримидинов
- пуринов
обезвреживание
- эндогенных шлаков
- ксенобиотиков
- биологически активных веществ
46.
Синтез креатинаNH2
NH2
С=NH
NH
+
(СН2) 3
СН
С=NH
NH2
NH2
COOH
СН2
COOH
глицинамидинотрансфераза
глицин
+
NH
(СН2) 3
СН2
СН
COOH
COOH
гуанидинацетат
аргинин
NH2
SAМ
орнитин
метилтрансфераза
SAГ
NH2
С=NH
N
CH3
СН2
COOH
креатин
NH2
47. Катаболизм аминокислот
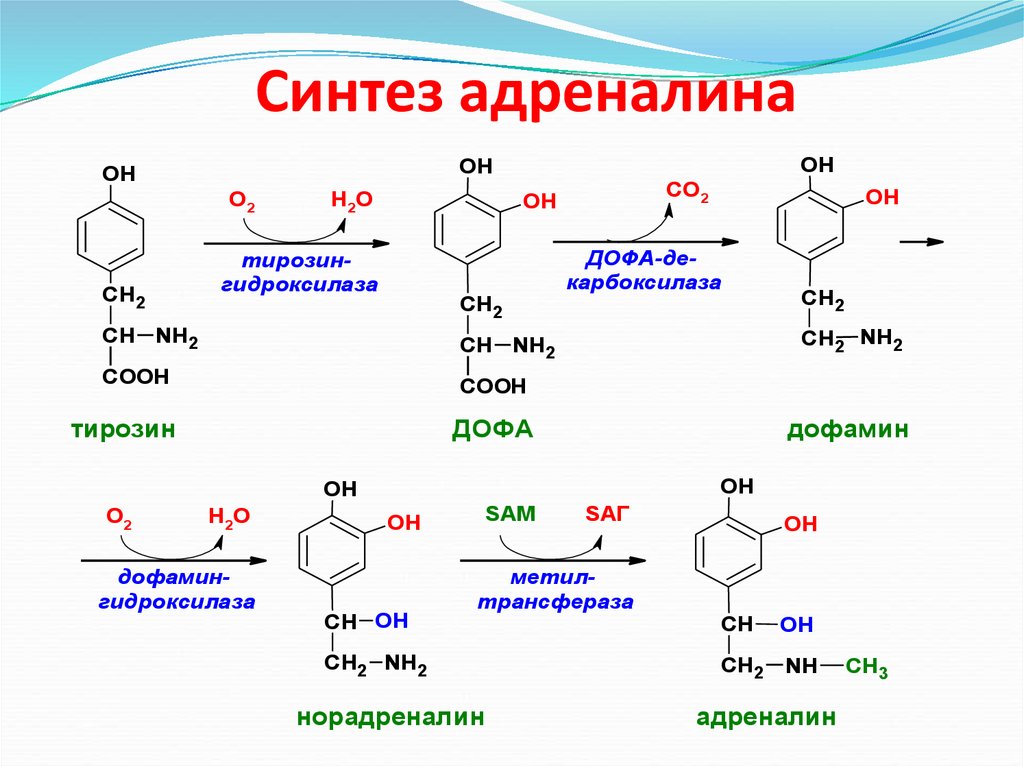
Синтез адреналинаО2
СН2
OH
OH
OH
Н 2О
СО2
OH
тирозингидроксилаза
СН2
СН NH2
СН NH2
COOH
COOH
тирозин
ДОФА-декарбоксилаза
ДОФА
Н2О
дофамингидроксилаза
СН2
СН2 NH2
дофамин
OH
OH
О2
OH
SАМ
OH
СН OH
SАГ
метилтрансфераза
СН2 NH2
норадреналин
OH
СН
OH
СН2
NH
адреналин
CH3
48. Метионин
Синтез холинаСН2 OH
СО2
СН2 OH
СН NH2 декарбоксилаза
СН2 NH2
COOH
серин
этаноламин
SAМ
SAГ
метилтрансфераза
СН2 OH
СН2 N
холин
+
CH3
CH3
CH3
49. Обмен метионина
Синтез фосфотидилхолина50. S-аденозилметионин (SAМ)
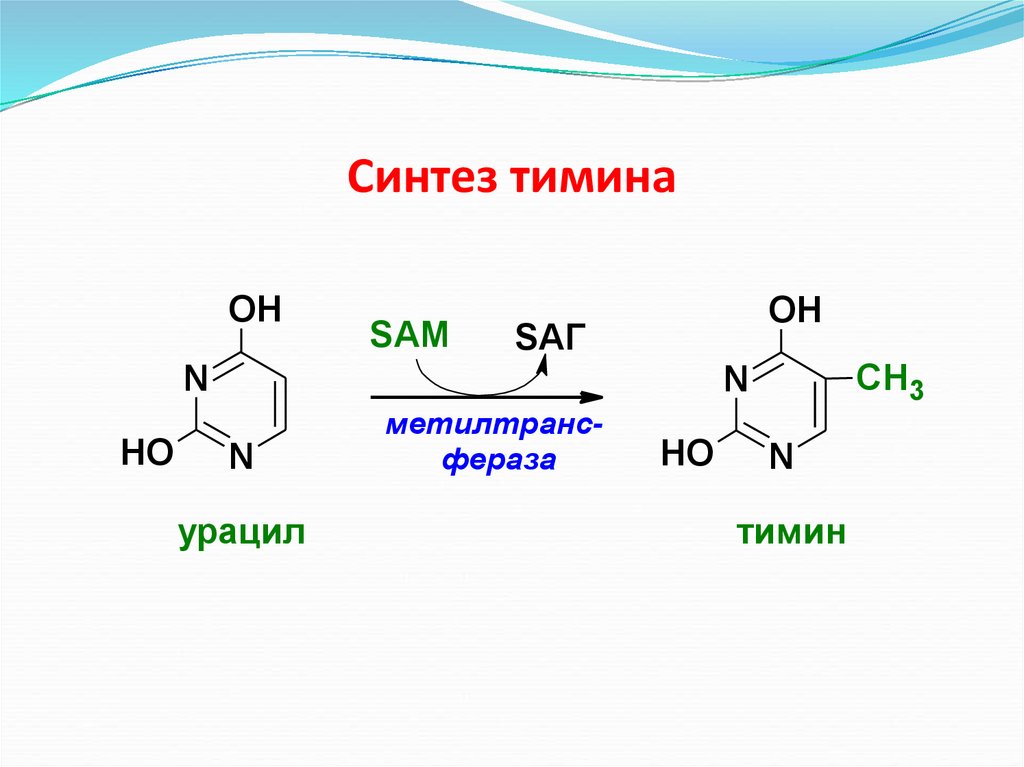
Синтез тиминаOH
SAМ
OH
SAГ
N
HO
CH3
N
N
урацил
метилтрансфераза
HO
N
тимин
51. ИСПОЛЬЗОВАНИЕ СН3-РАДИКАЛОВ
Инактивация гистаминаSAМ
СН2 СН2
N
N
H
гистамин
NH2
SAГ
метилтрансфераза
СН2 СН2
N
N
NH2
CH3
метилгистамин
52. Синтез креатина
Обезвреживание никотинамидаСО NH2
N
никотинамид
SAM
SАГ
метилтрансфераза
СО NH2
+
N
CH3
метилникотинамид
53. Синтез адреналина
Обезвреживание ксенобиотиковSAМ
H3C СН 2 SH
этилмеркаптан
SAГ
метилтрансфераза
H3C СН 2 S CH3
метилэтилмеркаптан
54. Синтез холина
Превращения S-аденозилметионина55.
Синтез цистеина56. Синтез тимина
Обмен цистеина57. Инактивация гистамина
Тетрагидрофолиевая кислота(ТГФК - Н4-фолат)
58. Обезвреживание никотинамида
Одноуглеродные радикалыСН3
СН2ОН
оксиметил
СН2
метилен
СН
метенил
О
С
Н
формил
59. Обезвреживание ксенобиотиков
Доноры одноуглеродных группСН 2 OH
СН
NH2
NH2 + H4-фолат
COOH
серин
5
10
СН 2 + N ,N -метилен-H4-фолат +
серингидроксиметилтрансCOOH
фераза
глицин
НАД+
+ H2О
НАДН+Н+
NH2
СН 2 + H4-фолат глицинсинтаза
COOH
глицин
СО2 + NH3 + N5,N10-метилен-H4-фолат
60. Превращения S-аденозилметионина
Антивитамины фолиевойкислоты
H2N
COOH
H2 N
п-аминобензойная
кислота
SO2 NH R
общая формула
сульфаниламидов
где R:
Н
- стрептоцид
СОСН3 - сульфацил-натрий
(альбуцид)
N
H2N
N
H3C
CH3 - сульфадимезин
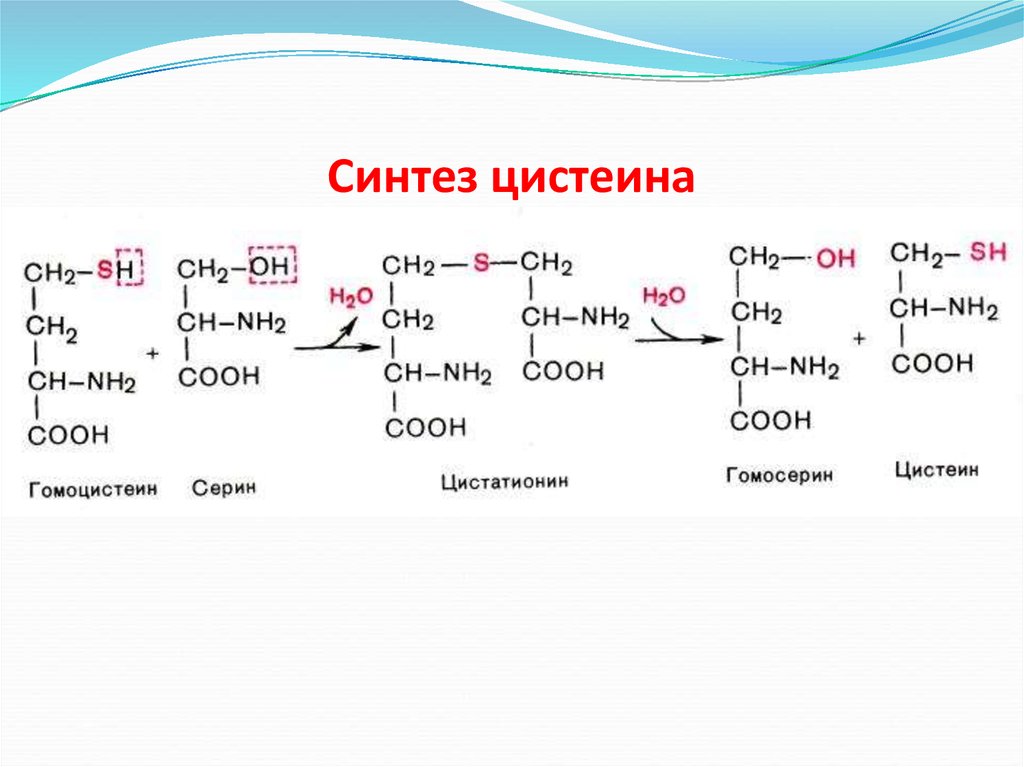
61. Синтез цистеина
Обмен ароматических аминокислотфумарат
ацетоацетат
СО2 + Н2О + Q
62. Обмен цистеина
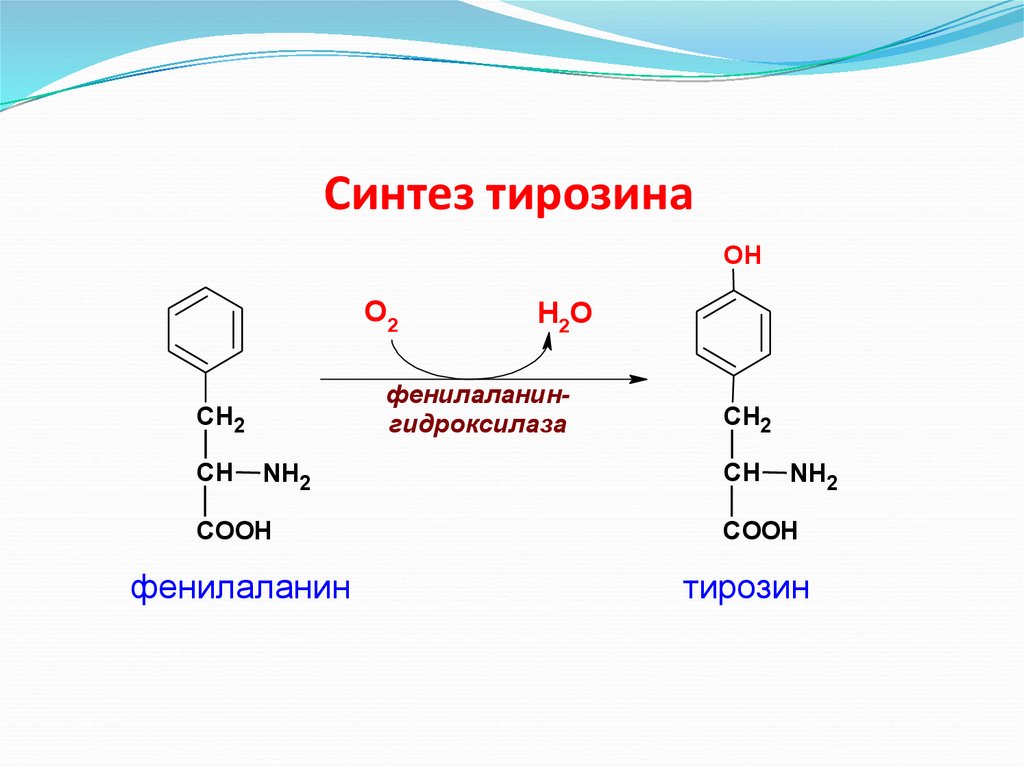
Синтез тирозинаOH
О2
фенилаланингидроксилаза
СН2
СН
Н2О
NH2
COOH
фенилаланин
СН2
СН
NH2
COOH
тирозин
63. Тетрагидрофолиевая кислота (ТГФК - Н4-фолат)
Нарушения обмена фенилаланина-КГ
СН2
глу
СН COOH
NH2
СН2
трансаминаза
фенилаланин
С
COOH
O
фенилпируват
НАД
НАДН+Н+
+
НАДН+Н+
Н2 О
НАД+
СО2
СН2
COOH
фенилацетат
СН2
СН COOH
OH
фениллактат
64. Одноуглеродные радикалы
Синтез катехоламиновО2
СН2
OH
OH
OH
Н 2О
СО2
OH
тирозингидроксилаза
СН2
СН NH2
СН NH2
COOH
COOH
тирозин
ДОФА
ДОФА-декарбоксилаза
Н2О
дофамингидроксилаза
СН2
СН2 NH2
дофамин
OH
OH
О2
OH
SАМ
OH
СН OH
SАГ
метилтрансфераза
СН2 NH2
норадреналин
OH
СН
OH
СН2 NH
адреналин
CH3
65. Доноры одноуглеродных групп
ЙодтирониныOH
I
OH
I
I
O
I
O
I
I
I
СН2
СН2
СН NH2
СН NH2
COOH
COOH
тироксин
(тетрайодтиронин)
трийодтиронин
66. Антивитамины фолиевой кислоты
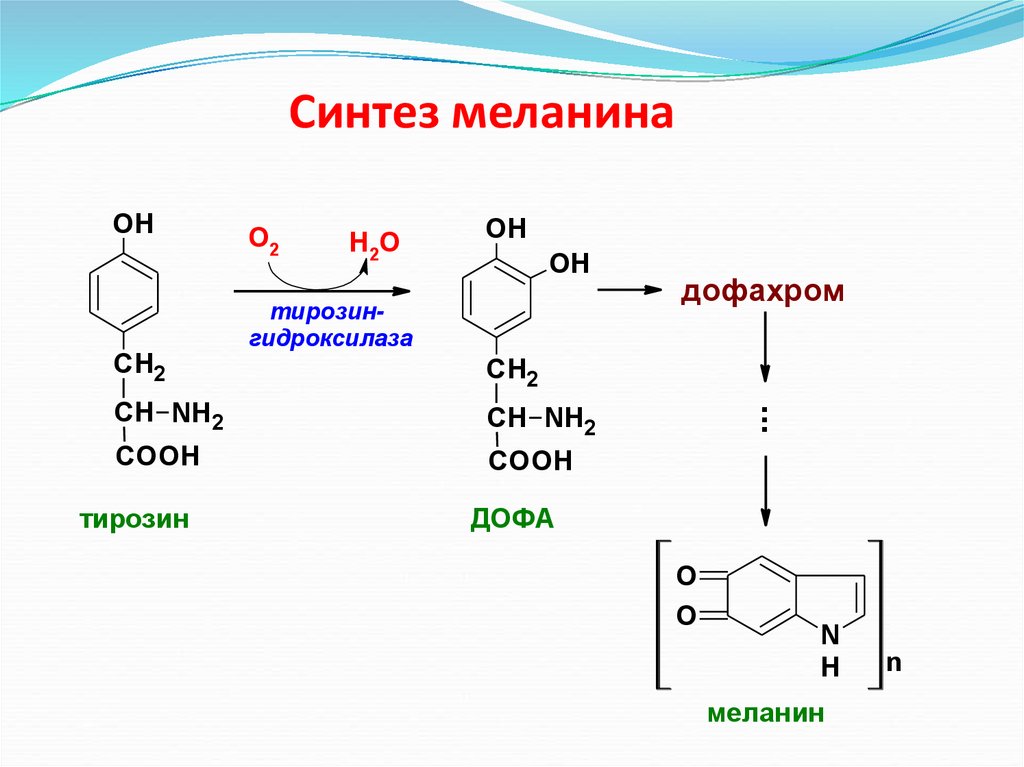
Синтез меланинаСН2
О2
Н2О
OH
OH
тирозингидроксилаза
СН2
СН NH2
СН NH2
COOH
COOH
тирозин
дофахром
...
OH
ДОФА
O
O
N
H
меланин
n
67. Обмен ароматических аминокислот
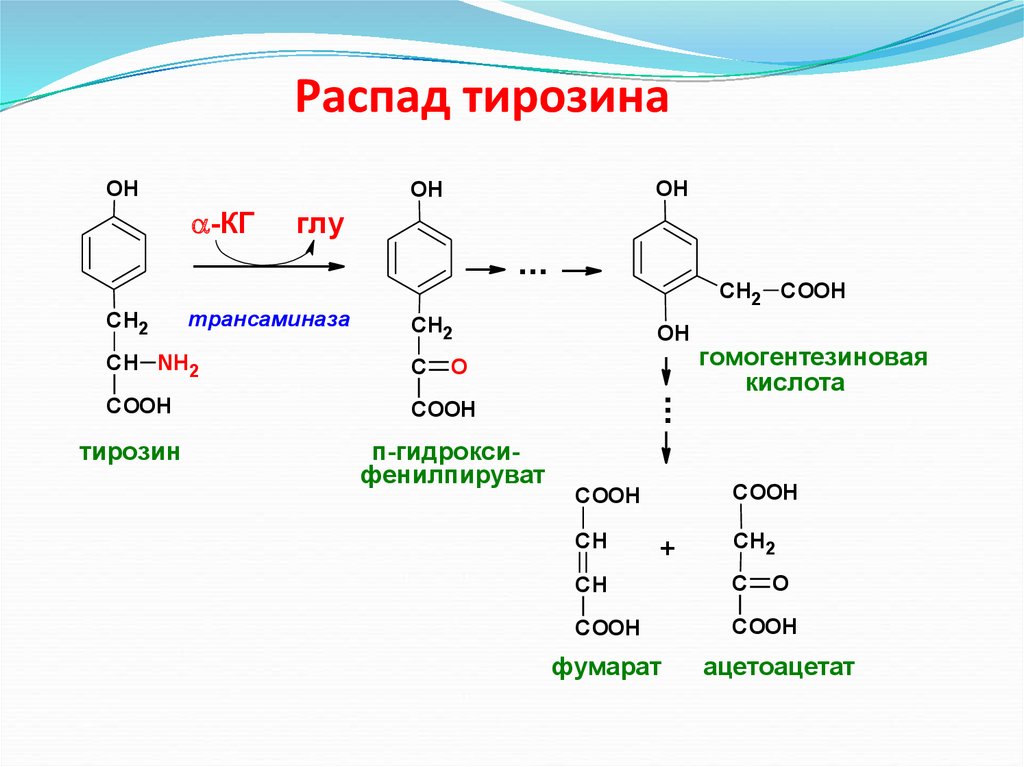
Распад тирозинаOH
OH
OH
-КГ
глу
...
трансаминаза
СН2
СН NH2
С
COOH
COOH
тирозин
OH
O
п-гидроксифенилпируват
...
СН2
СН2 COOH
COOH
COOH
СН
гомогентезиновая
кислота
+
СН2
СН
С
COOH
COOH
фумарат
O
ацетоацетат
68. Синтез тирозина
НАРУШЕНИЯ ОБМЕНА АРОМАТИЧЕСКИХ АМИНОКИСЛОТфенилаланин
гидроксилаза
ФЕНИЛКЕТОНУРИЯ
тирозин
пероксидаза
КРЕТИНИЗМ
тироксин
гидроксилаза
п-оксифенилпируват
ДОФА
ДОФА
декарбоксилаза
диоксигеназа
ТИРОЗИНОЗ
ПАРКИНСОНИЗМ
гомогентезиновая
кислота
дофахром
дофамин
оксидаза
АЛКАПТОНУРИЯ
ацетоацетат
фумарат
АЛЬБИНИЗМ
меланины
катехоламины
69. Нарушения обмена фенилаланина
70. Синтез катехоламинов
71. Йодтиронины
Обмен отдельныхаминокислот
72. Синтез меланина
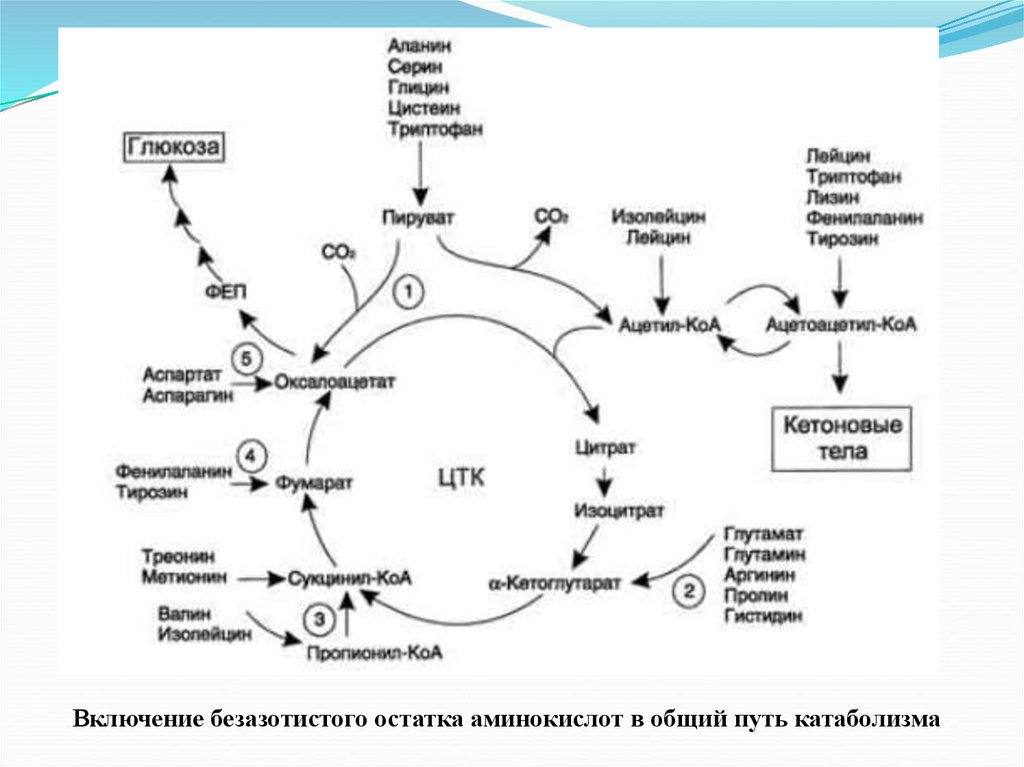
Включение безазотистого остатка аминокислот в общий путь катаболизма73. Распад тирозина
Гликогенныеаминокислоты
Алании
Аспарагин
Аспартат
Глицин
Глутамат
Глутамин
Пролин
Серии
Цистеин
Аргинин
Гистидин
Валин
Метионин
Треонин
Гликокетогенные
Кетогенные
аминокислоты
аминокислоты
Тирозин
Лейцин
Изолейцин
Лизин
Фенилаланин
Триптофан
74. НАРУШЕНИЯ ОБМЕНА АРОМАТИЧЕСКИХ АМИНОКИСЛОТ
Безазотистые остатки аминокислот используются для восполнения тогоколичества метаболитов общего пути катаболизма, которое затрачивается на
синтез биологически активных веществ. Такие реакции называют
анаплеротическими.
Выделены пять анаплеротических реакций:
1
2. Аминокислоты → Глутамат → α-Кетоглутарат
3
4. Аминокислоты → Фумарат
5. Аминокислоты → Оксалоацетат
75.
Пути биосинтеза заменимых аминокислот.76.
77.
78.
Существует 2 пути синтеза глицина:1) из серина с участием производного фолиевой кислоты
в результате действия сериноксиметилтрансферазы:
2) в результате действия фермента глицинсинтазы в
реакции:
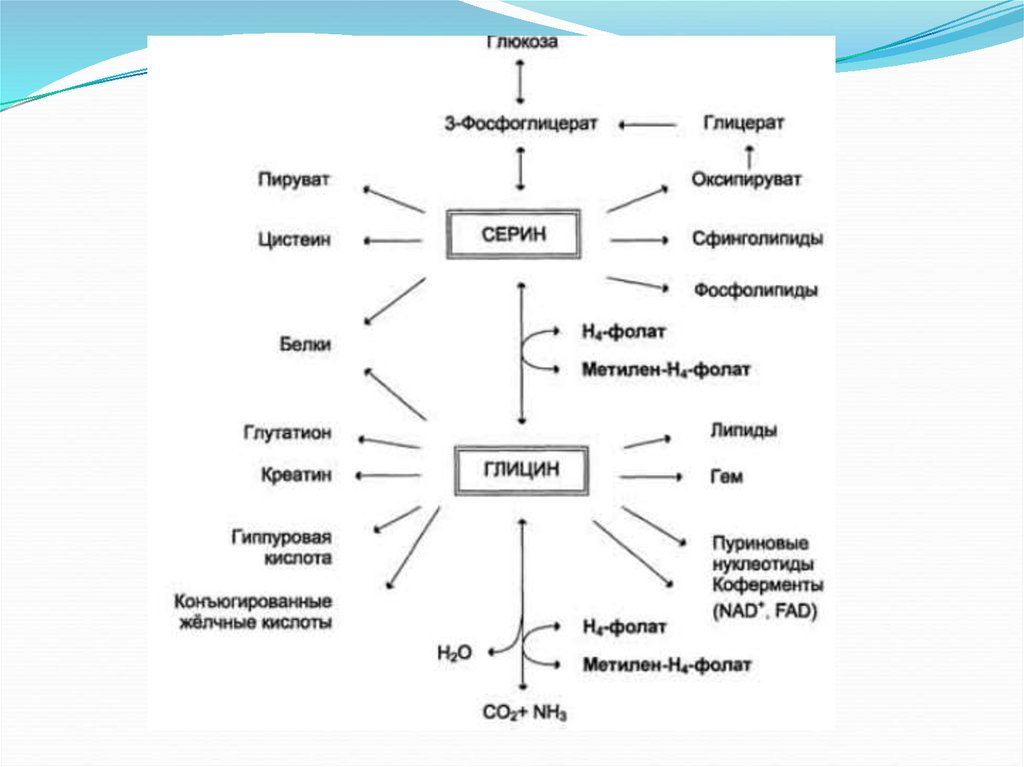
79.
Обмен серина и глицинаСерин - заменимая аминокислота, синтезируется из промежуточного продукта
гликолиза - 3-фосфоглицерата, а аминогруппу получает от глутаминовой кислоты.
Глицин - также заменимая аминокислота, основным источником которой служит
серии. Реакцию синтеза глицина из серина катализирует фермент сериноксиметилтрансфераза, коферментом которой является Н4-фолат.
80.
81.
Обмен серосодержащих аминокислотВ состав белков человека входят 2
аминокислоты, содержащие серу, - метионин и
цистеин. Эти аминокислоты метаболически
тесно связаны между собой
82.
Метионин - незаменимая аминокислота. Она необходима для синтеза белковорганизма, участвует в реакциях дезаминирования, является источником атома серы для
синтеза цистеина. Метионил-тРНК участвует в инициации процесса трансляции.
Метальная группа метионина - мобильный одноуглеродный фрагмент, используемый
для синтеза ряда соединений. Перенос метильной группы метионина на
соответствующий акцептор называют реакцией трансметилирования, имеющей
важное метаболическое значение.
83.
84.
85.
86.
87.
Метаболизм метионина. 1 - реакции трансметилирования; 2 - синтез цистеина; 3 регенерация метионина.88.
Ещё одним важным путём использования цис-теина можносчитать синтез таурина в животных тканях, который
происходит путём декарбоксилирования производных
цистеина - цистеиновой и цистеинсульфиновой кислот:
Таурин необходим для синтеза парных жёлчных кислот в
печени. Кроме того, он очень важен в клетках как
антиоксидант и используется для снижения ПОЛ и
связывания гипохлоританиона (в форме хлораминового
комплекса).
89.
Цистеин также служит предшественником тиоэтаноламинового фрагментаHS-KoA (кофермента А).
Катаболизм цистеина происходит окислительным путём.
Сульфит, который получается в реакции, превращается в сульфат и
выводится с мочой, либо превращается в эфиросерные кислоты, которые
также экскретируются почками. Цистеин - практически единственный
источник сульфатов мочи.
90.
Метаболизмфенилаланина и
тирозина









































































 biology
biology chemistry
chemistry








