Similar presentations:
Белковый обмен
1. Белковый обмен
2. Функции белков
- ферментативная- структурообразовательная
- защитная (иммунная)
- опорная
- сократительная
3. Функции белков
- регуляторная (гормоны,рецепторы)
- энергетическая
- транспортная (белки плазмы
крови, белки мембран, белки
плазматических мембран, белки
каналов)
- специфические функции
4. Нормы белка в питании
Для взрослых при средней физическойнагрузке – 100 -120 г белков в сутки.
При тяжелой мышечной работе – 130 –
150 г в сутки.
Детям до 12 лет – 50 – 70 г в сутки.
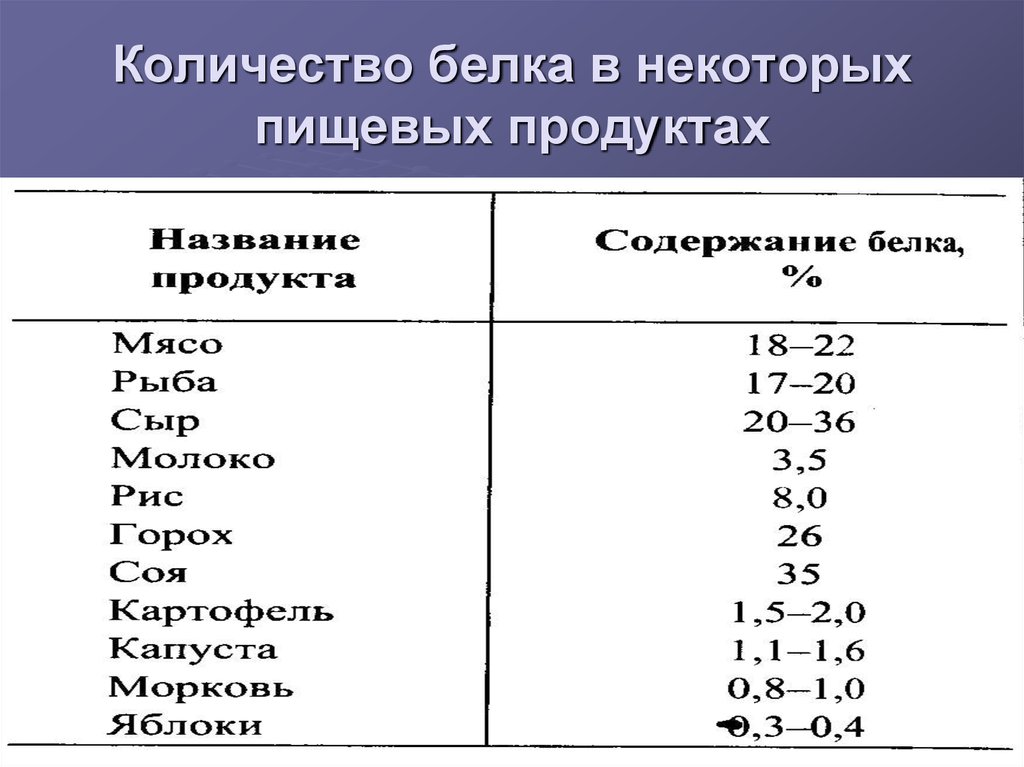
5. Количество белка в некоторых пищевых продуктах
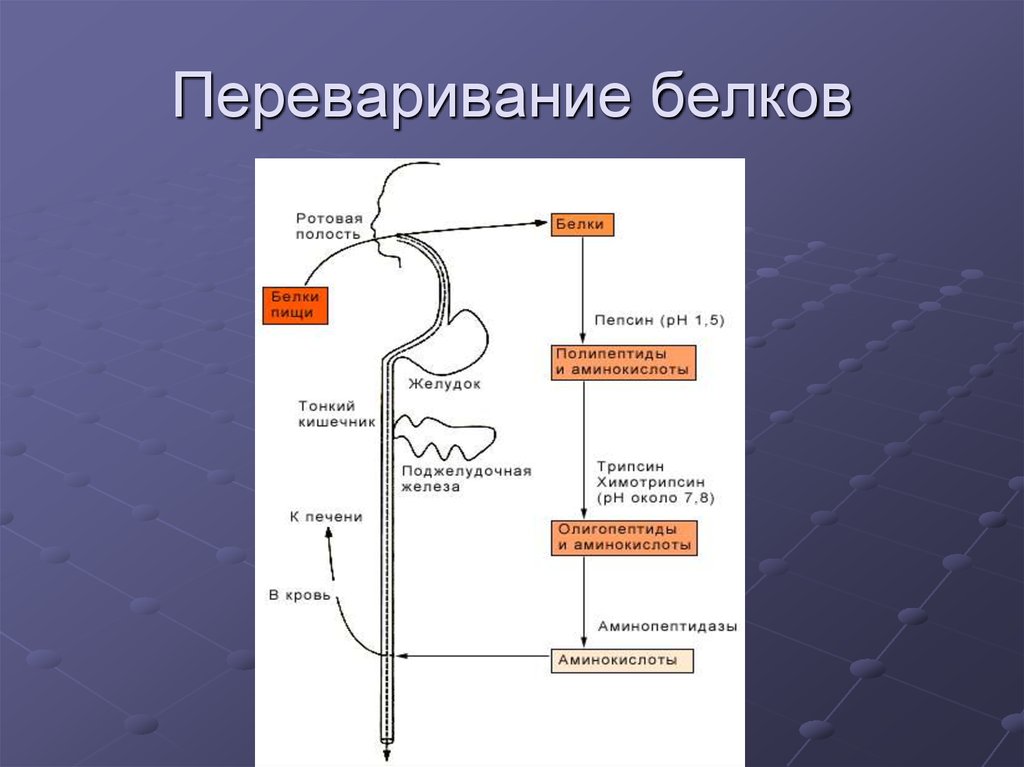
6. Переваривание белков
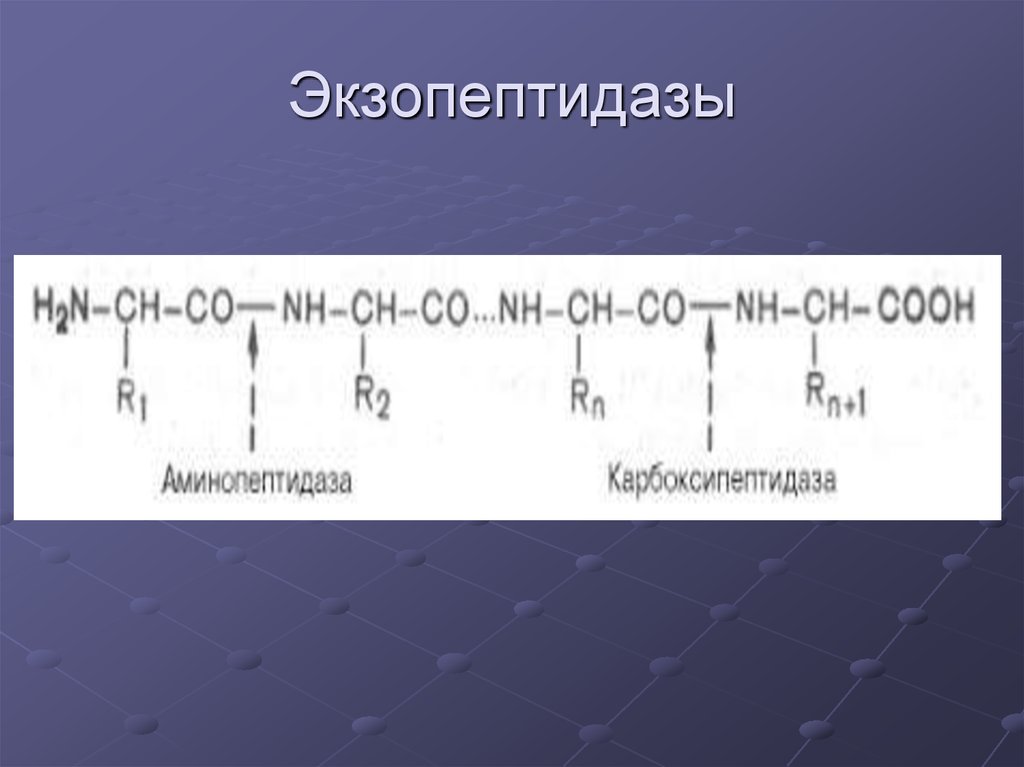
7. Экзопептидазы
8. Характеристика пептидаз желудка
Пепсин:- расщепляет связи, образованные карбоксильными
группами ароматических аминокислот (фен, тир и трп);
- действует в сильно кислой среде при рН 1,5 - 2,5.
Гастриксин:
- расщепляет связи, образованные карбоксильными
группами дикарбоновых аминокислот (глу и асп);
- действует при рН 3,5.
Реннин:
- створаживает белки молока.
9. Характеристика пептидаз поджелудочной железы
Трипсин:- расщепляет связи, образованные СООН группами
арг или лиз;
- активирует другие пептидазы поджелудочной
железы.
Химотрипсин:
- расщепляет связи, образованные СООН группами
ароматических аминокислот.
Эластаза:
- расщепляет связи образованные про.
Карбоксипептидаза:
- отщепляет аминокислоты с С-конца.
10. Характеристика пептидаз кишечного сока
Аминопептидаза:- отщепляет аминокислоты с N-конца.
Дипептидазы и трипептидазы:
- расщепляют дипептиды или
трипептиды соответственно.
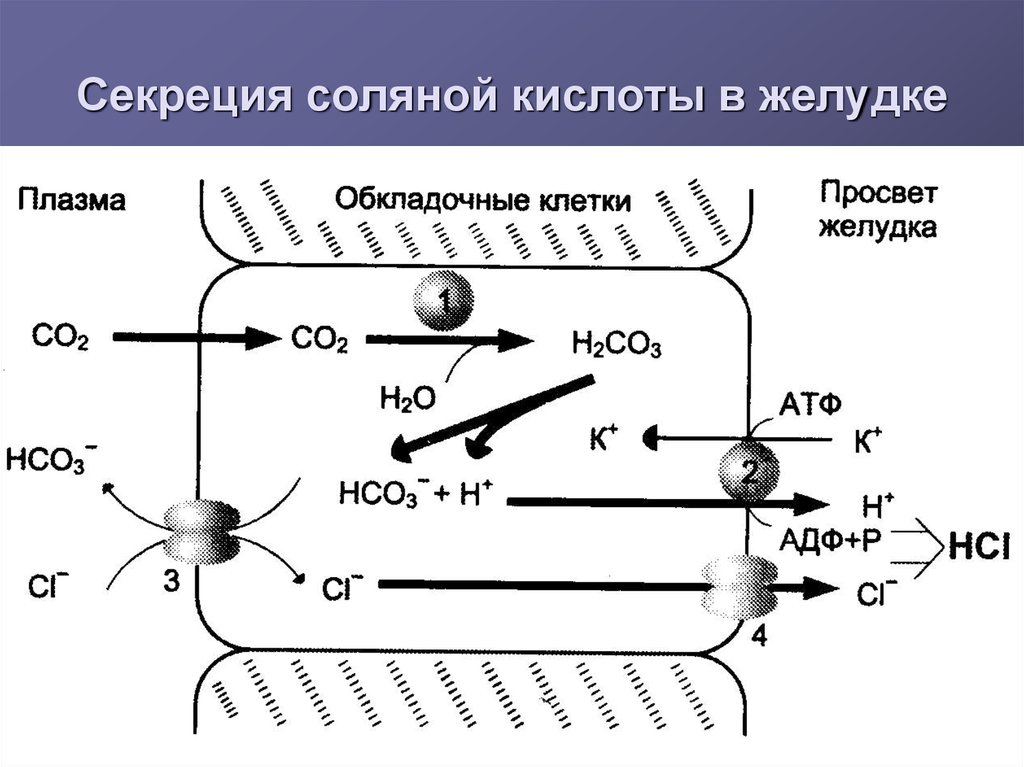
11. Секреция соляной кислоты в желудке
12. Роль НСl
Превращение препепсина впепсин
Оптимум рН для работы пепсина
Денатурация и набухание пищевых
белков
Бактерицидное действие
13. Источники аминокислот
Переваривание пищевых белков вЖКТ
Расщепление клеточных белков
лизосомальными пептидазами
(катепсинами)
Синтез из других аминокислот
Образование из безазотистых
соединений (прежде всего из
кетокислот)
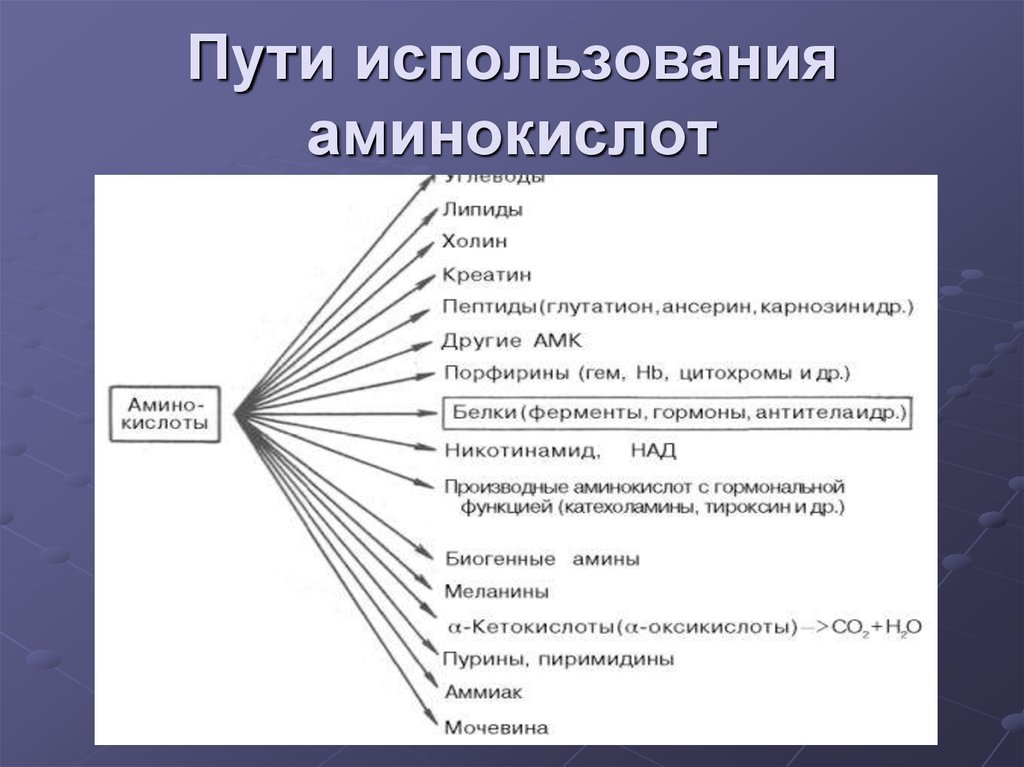
14. Пути использования аминокислот
Синтез белковСинтез биологически важных
соединений (пуринов, пиримидинов,
гормонов, порфиринов и др.)
Дезаминирование аминокислот с
образованием кетокислот которые идут:
1) в цикл Кребса
2) в ГНГ на синтез глюкозы
3) на синтез кетоновых тел
15. Пути использования аминокислот
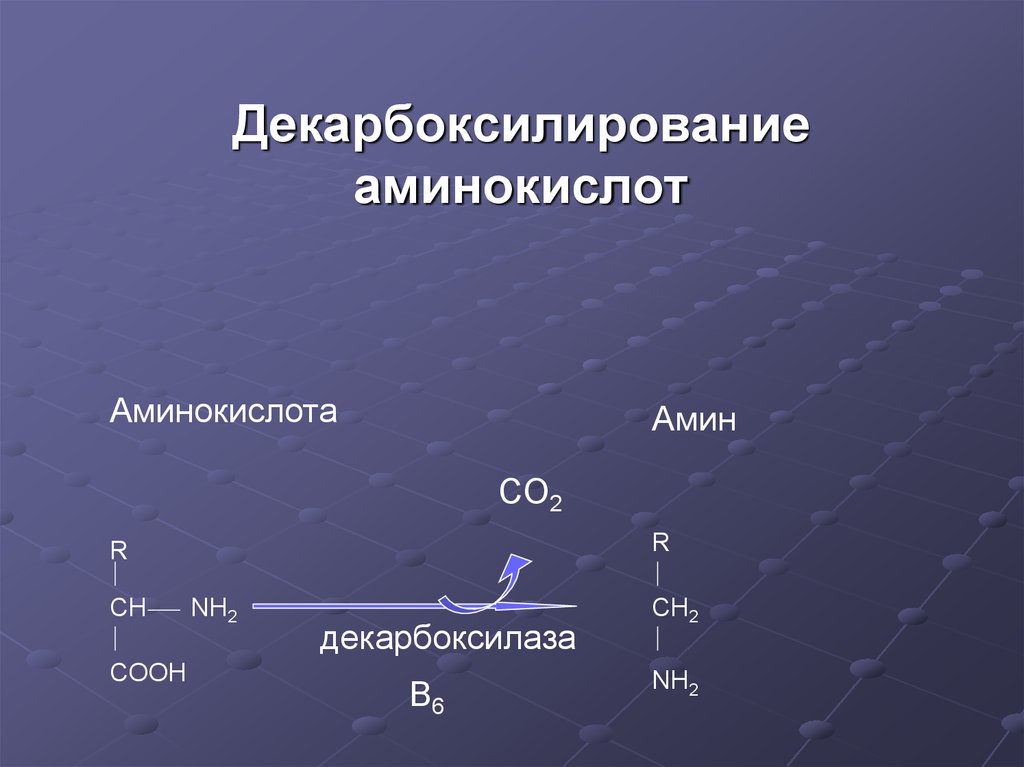
16. Декарбоксилирование аминокислот
АминокислотаАмин
CO2
R
R
CH
COOH
NH2
декарбоксилаза
B6
CH2
NH2
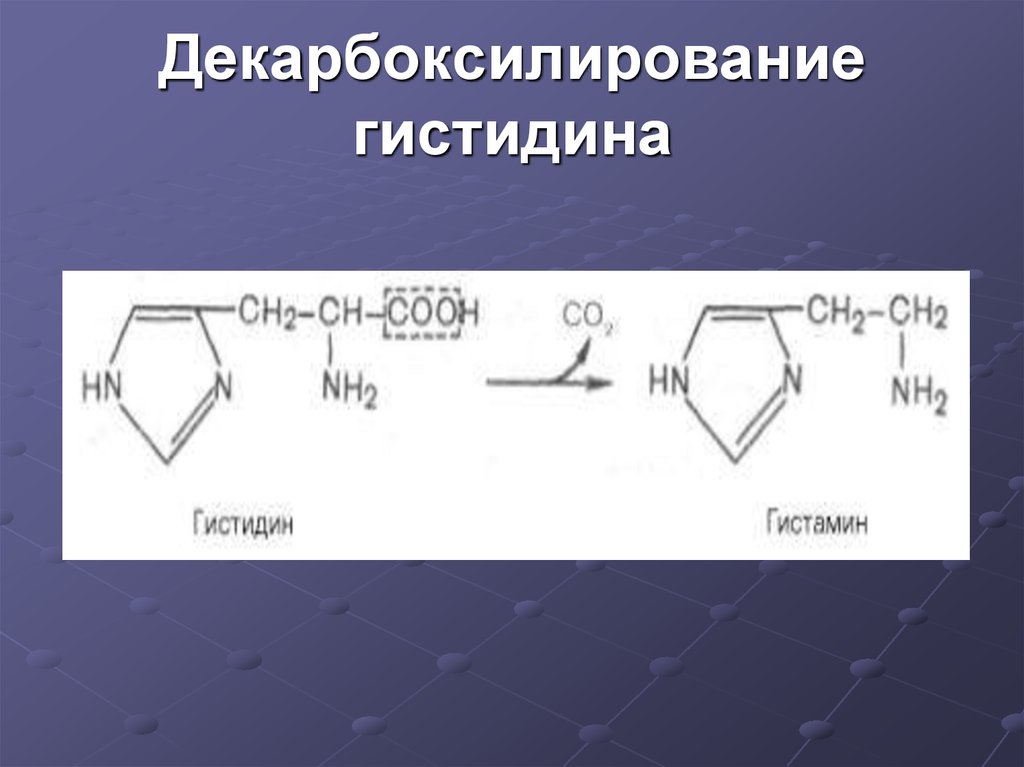
17. Декарбоксилирование гистидина
18. Функции гистамина
- через Н2-рецепторы стимулируетсекрецию желудочного сока, слюны
- через Н1-рецепторы повышает
проницаемость капилляров, вызывает отеки,
снижает АД
19. Функции гистамина
- сокращает гладкую мускулатурулегких, вызывает удушье
- участвует в формировании
воспалительной реакции
- вызывает аллергическую
реакцию
- исполняет роль нейромедиатора
- является медиатором боли
20. Декарбоксилирование орнитина и лизина
При декарбоксилировании орнитинаобразуется путресцин,
лизина - кадаверин, которые относятся к
диаминам.
Из путресцина образуются спермин и
спермидин, которые обнаружены в ядрах
клеток всех органов человека.
21. Декарбоксилирование глутамата
COOHCH2
CH2
COOH
CO2
Декарбоксилаза
CHNH2
B6
COOH
Глутамат
CH2
CH2
CH2
NH2
γ- аминомасляная
кислота
22. Декарбоксилирование глутамата
γ- аминомасляная кислота (ГАМК):1. служит основным тормозным
модулятором высших отделов мозга
2. повышает дыхательную активность
нервной ткани
3. улучшает кровоснабжение головного
мозга
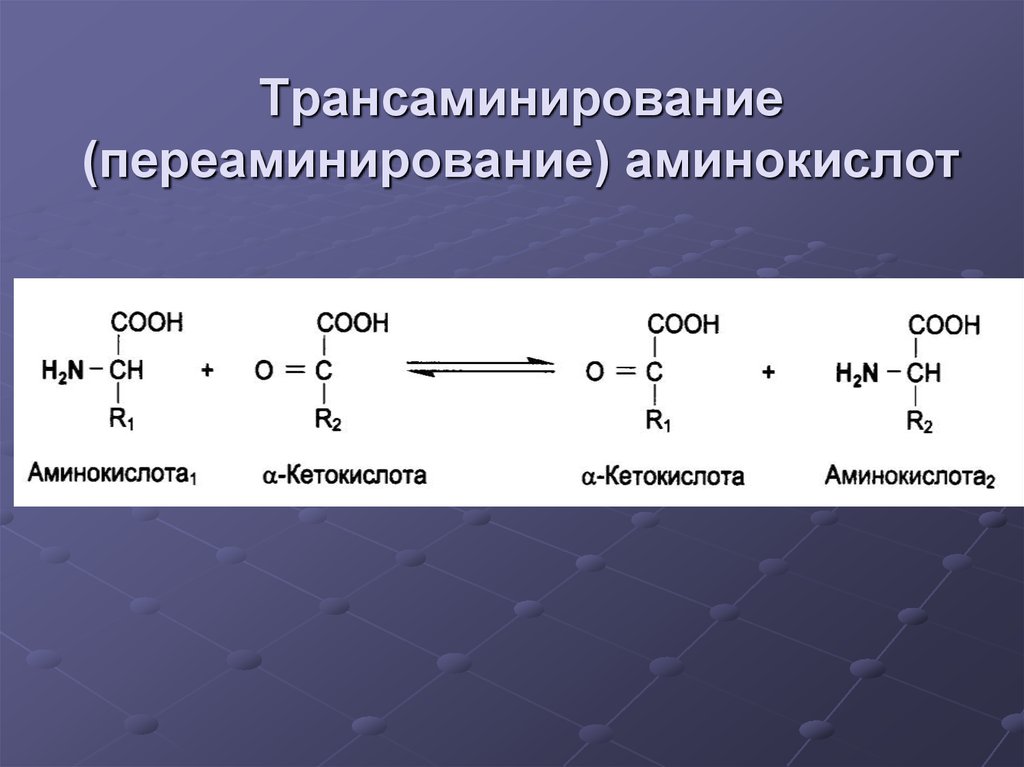
23. Трансаминирование (переаминирование) аминокислот
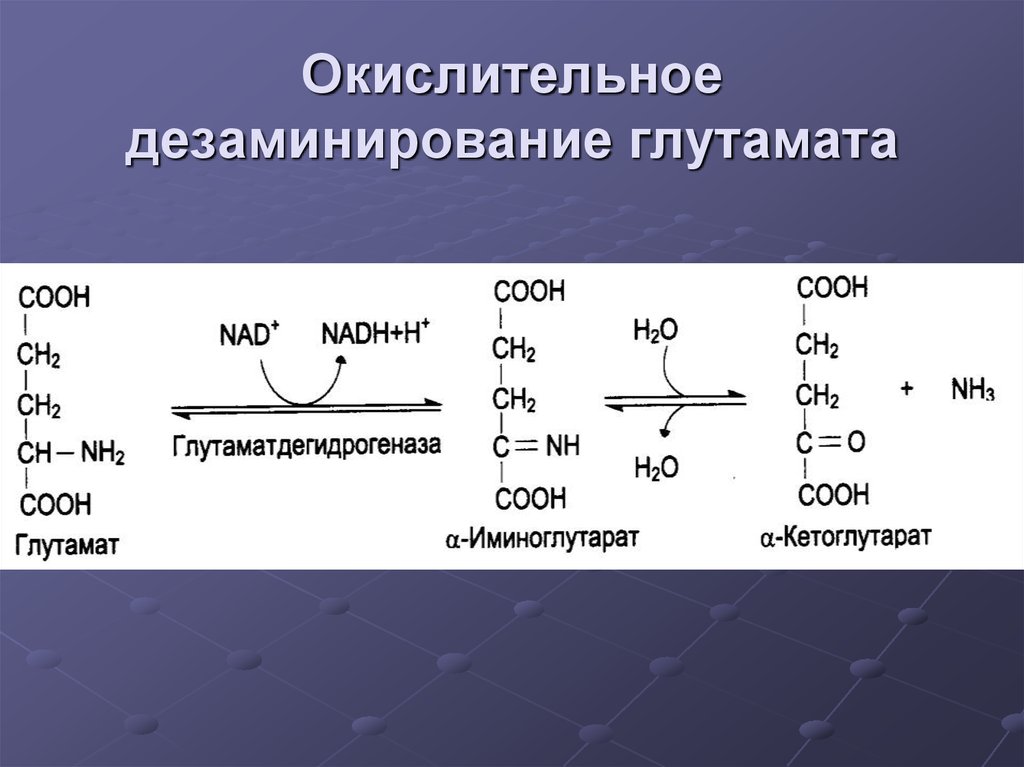
24. Окислительное дезаминирование глутамата
.25. Регуляция ГДГ
Активируют:АДФ
Ингибируют:
АТФ, НАДН
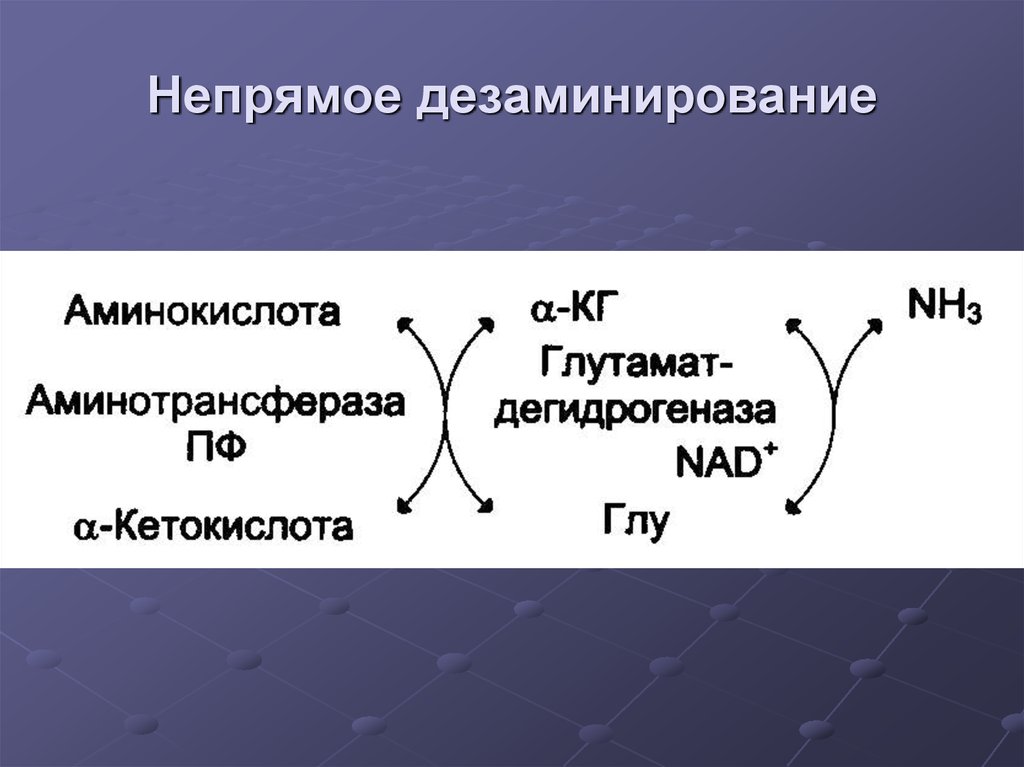
26. Непрямое дезаминирование
27. Непрямое дезаминирование
Продукты непрямогодезаминирования:
α-кетокислота
НАДН
NН3
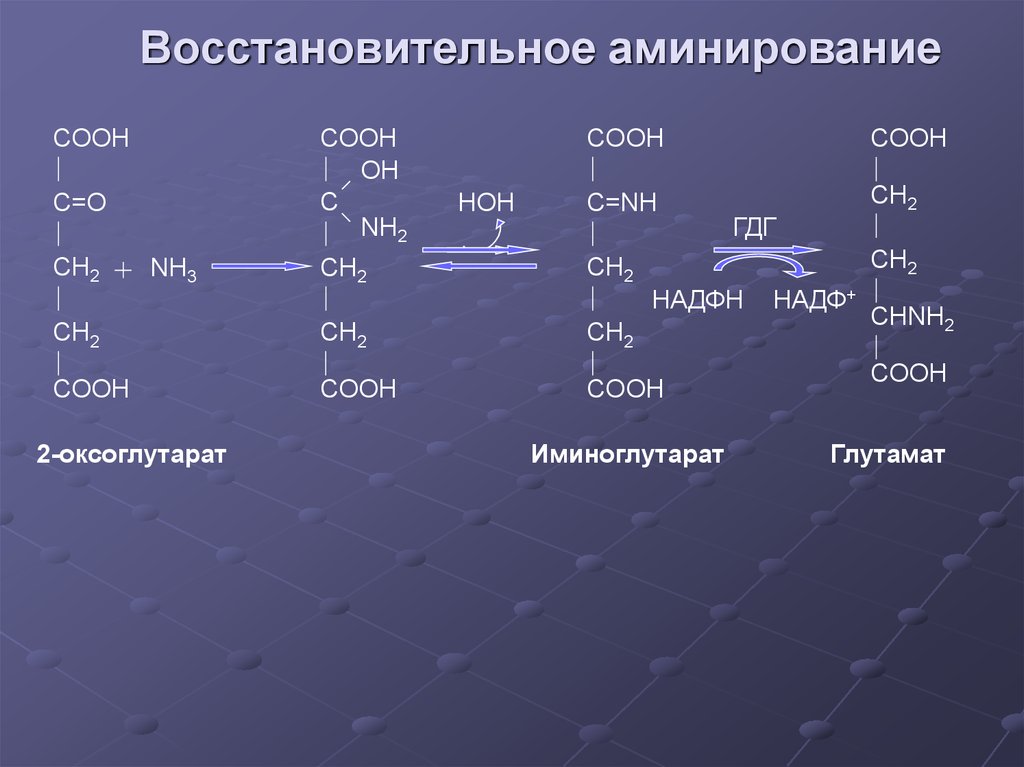
28. Восстановительное аминирование
COOHCOOH
OH
C
NH2
C=O
CH2
HOH
COOH
COOH
C=NH
CH2
CH2
CH2
CH2
CH2
CH2
CH2
COOH
COOH
COOH
NH3
2-оксоглутарат
ГДГ
НАДФH
Иминоглутарат
НАДФ+
CHNH2
COOH
Глутамат
29. Значение восстановительного аминирования:
глутамат является источникомаминогрупп для синтеза заменимых
аминокислот
служит одним из способов
связывания аммиака в клетке
30. Источники аммиака :
1. Реакции дезаминирования2. Образование в кишечнике в результате
деятельности микрофлоры (гниение белков)
Содержание аммиака в крови в норме 25-40
мкмоль/л.
31. Причины токсичности аммиака
1) Легко проникает через клеточныемембраны
2) Связывается с 2-оксоглутаратом, что
вызывает угнетение обмена аминокислот и
гипоэнергетическое состояние (угнетение цикла
Кребса)
3) Усиливает синтез глн из глу в нервной
ткани, что снижает синтез ГАМК. Это нарушает
проведение нервного импульса и вызывает
судороги
32. Причины токсичности аммиака
4) образует ион NH4+, накоплениекоторого нарушает проведение
нервного импульса
5) сдвигает рН в щелочную сторону,
вызывая метаболический алкалоз
33. Обезвреживание аммиака
1. Восстановительное аминирование (имеетнебольшое значение)
2. Образование амидов (глн и асн).
COOH
NH3
CO
CH2
CH2
CH2
CH2
CHNH2
АТФ
COOH
глутаминсинтетаза
Глутамат
АДФ+Pн
NH2
CHNH2
COOH
глутамин
3. Образование аланина в мышцах
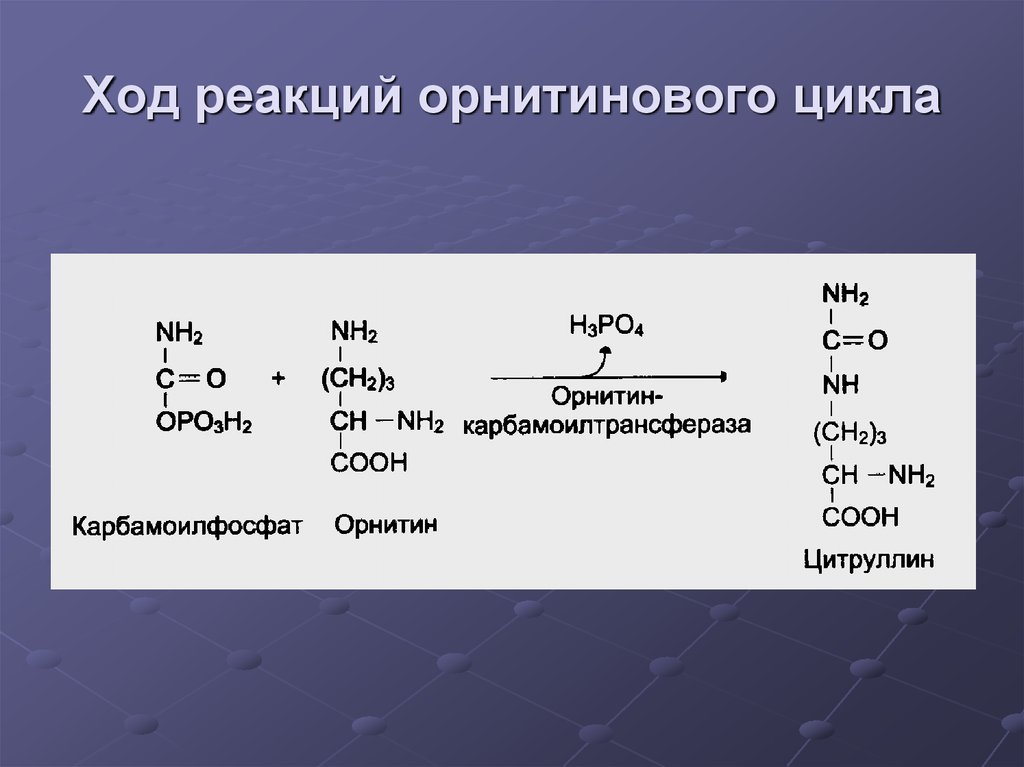
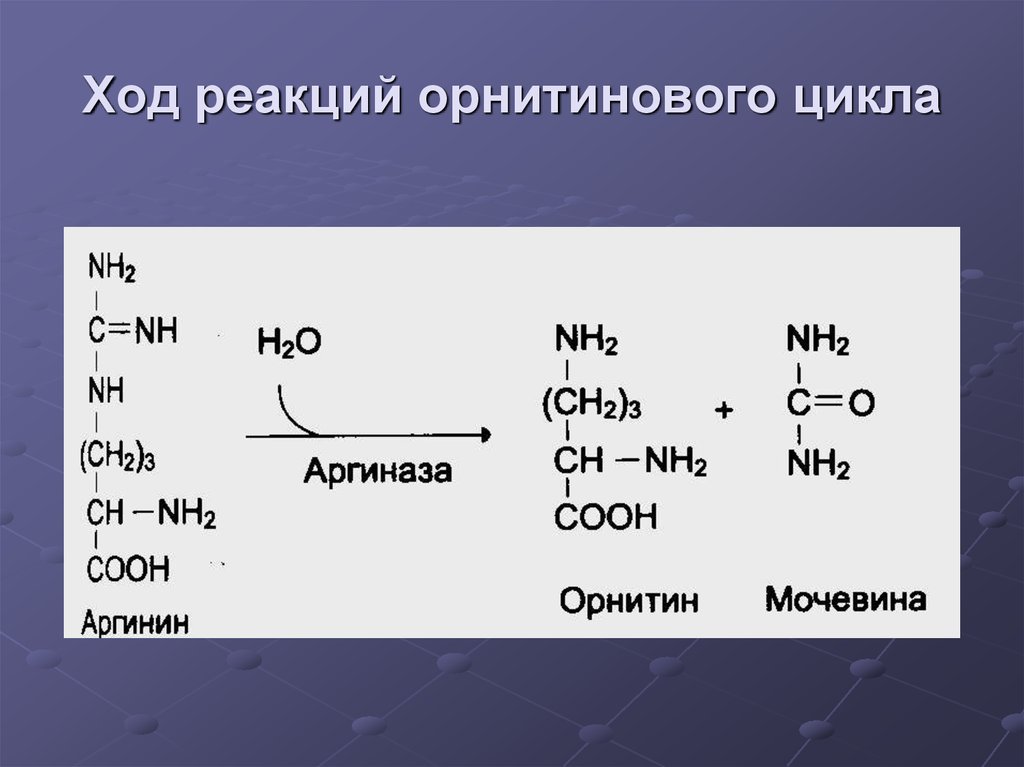
34. Ход реакций орнитинового цикла
35. Ход реакций орнитинового цикла
36. Ход реакций орнитинового цикла
37. Ход реакций орнитинового цикла
38. Ход реакций орнитинового цикла
39. Суммарное уравнение синтеза мочевины:
CO2 + NH3 + Аспартат + 3 АТФ + 2H2O =Мочевина + Фумарат + 2(АДФ + H3PO4)
+ АМФ + H4P2O7
40.
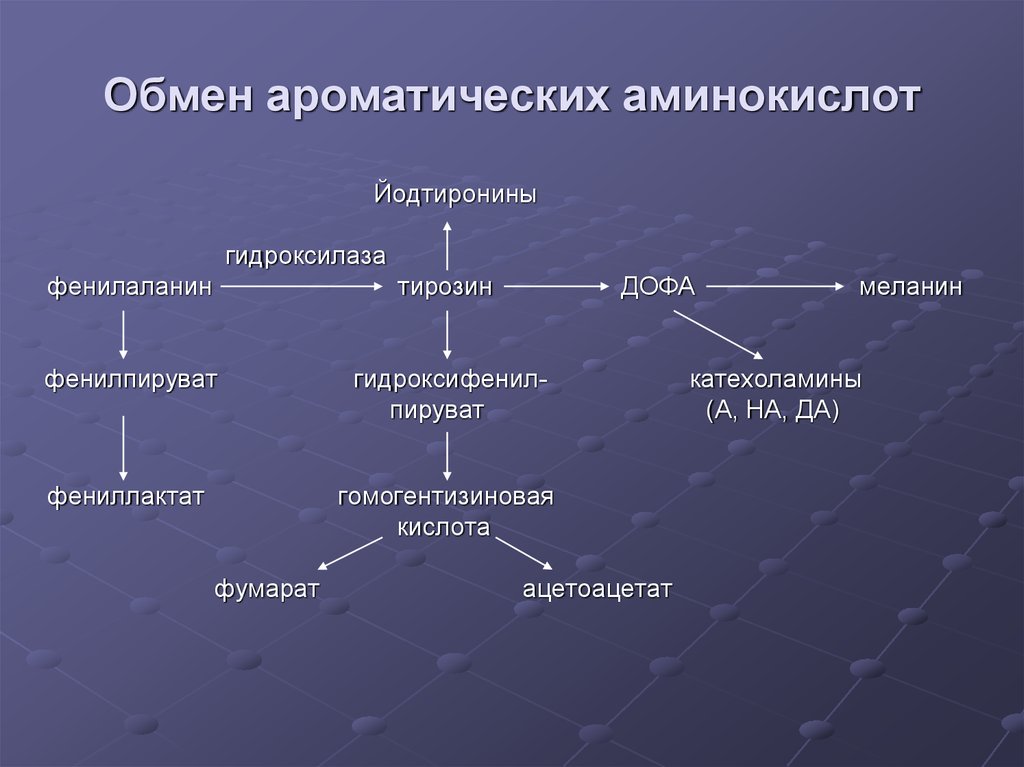
Классификация аминокислот по судьбе безазотистого остатка41. Обмен ароматических аминокислот
Йодтирониныгидроксилаза
фенилаланин
тирозин
фенилпируват
гидроксифенилпируват
фениллактат
гомогентизиновая
кислота
фумарат
ДОФА
ацетоацетат
меланин
катехоламины
(А, НА, ДА)
42. Синтез креатина
В почках:Глицинамидинотрансфераза
Аргинин + Глицин
Орнитин + Гликоциамин
43. Синтез креатина
В печени:Метилтрансфераза
Гликоциамин
Креатин
S-AM
S-АГ
44. Синтез креатина
В мышцах:в покое
Креатин + АТФ креатинкиназа
при сокращении
Креатинфосфат + АДФ
45. Метаболизм креатинфосфата
КреатинфосфатКреатинин
- H3PO4
46. Диагностическое значение:
1. Определение содержания креатина икреатинина в крови и моче используется
для характеристики:
а) интенсивности работы мышц в
спортивной медицине
б) для диагностики заболеваний почек:
Креатинин мочи
Клиренс = ------------------------- х диурез (мин)
Креатинин крови
47. Диагностическое значение:
2. Определение активностикреатинкиназы и ее изоферментов в
крови используется для диагностики
инфаркта миокарда, миопатий,
мышечных дистрофий и др.

































 biology
biology








