Similar presentations:
Обмен простых белков. Дезаминирование и трансаминирование аминокислот. (Лекция 15)
1.
Лекция №15ТЕМА:
ОБМЕН ПРОСТЫХ БЕЛКОВ.
ДЕЗАМИНИРОВАНИЕ И
ТРАНСАМИНИРОВАНИЕ
АМИНОКИСЛОТ
Лектор: доцент
Самоданова Галина Ивановна
2.
Сгорание 1 грамма белка - 16,8 кДж энергии8 дней безбелковой диеты - выделение
азота - 53 мг/сут/кг
53*70=3.71 г азота/сут
6.25*3.71=23.2 г белка/сут
23.2 г белка/сут - коэффициент
изнашивания (Рубнера)
3.
Азот вводимый в организм (пища)Азотистый =
баланс
Азот выводимый из организма (моча, кал, пот)
N ввод > N вывод
+
Nввод < Nвывод
-
Nввод = Nвывод
Азотистое равновесие
4.
ЭНДОЭКЗО
Пепсин
реннин
гастриксин
Желудочный сок
трипсин
Панкреатический
химотрипсин
сок
эластаза
карбоксипептидаза
аминопептидаза
Кишечный сок
пептидазы
5.
трипсиногенэнтерокиназа
трипсин
Химотрипсиноген
аутокатализ
N-гексопептид
прокарбокси
пептидаза
химотрипсин карбоксипепти
даза
проэластаза
эластаза
Способ активации - частичный (ограниченный) протеолиз
6.
1. Активация пепсиногена2. Создание рН оптимума для пепсина
3. Набухание и денатурация белков пищи
4. Бактерицидное действие
5. Стимуляция образования секретина
7.
Специфичность протеиназ ЖКТАминопеппепсин
тидаза
Карбоксипептрипсин эластаза
эластаза
тидаза
Химотрипсин
CO-NH-CH-CO-NH-CH-CO-NH-CH-CO-NH-CH-CO-NH-CH-CO-NH-CH-CO-NH
CH-R
CH2
R1
NH2
фен
тир
N-конец
конец
три
лиз
арг
R2
ала
про
сер
Тканевые протеиназы - катепсины
R3
COOH
C-
8.
а) NH2-CH-COOH(CH2)4
NH2
лиз
H2N-CH2-CH2-CH2-CH2-CH2-NH2
кадаверин
CO2
Орнитин
путресцин
CO2
б) Серосодержащие
H2S сероводород
CO2 CH SH - метил
3
CH3CH2SH - этил
меркаптаны
9.
в) ароматическиеNH2-CH-COOH
CH
CH3
v. Porta
CO2
печень
OH
крезол
OH
CO2
тирозин
фенолглюкуроновая
к-та
O
OH
фенол
=
=
O CH -O-P-OH
2
O
HO-P-O
O
COOH
-
N
моча
O
= -
HN
O=
обезвреживание УДФГК
O
OH
OH
OH
УДФГК
10.
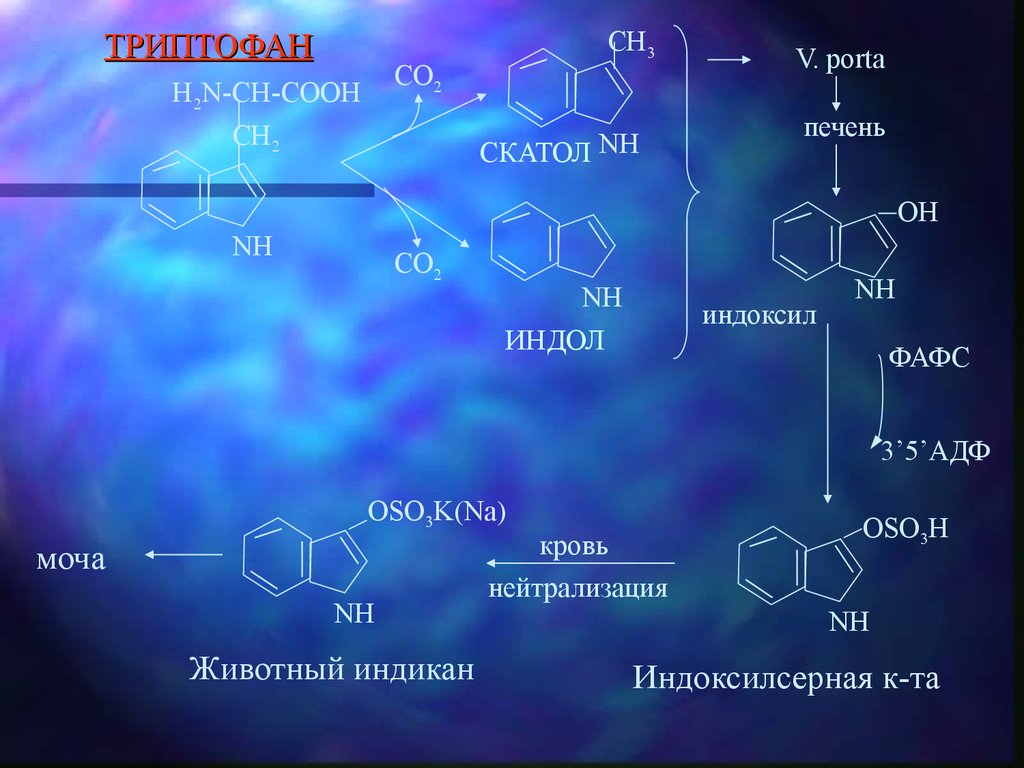
ТРИПТОФАНCH3
CO2
H2N-CH-COOH
CH2
СКАТОЛ NH
V. porta
печень
OH
NH
CO2
NH
ИНДОЛ
индоксил
NH
ФАФС
3’5’АДФ
OSO3K(Na)
моча
NH
Животный индикан
кровь
нейтрализация
OSO3H
NH
Индоксилсерная к-та
11.
NO
O
O
=
N
N
=
N
NH2
3’
OH
=
CH2-O-P-O-S-OH
O
O
OH
O=P
OH
ФАФС
ПРОБА КВИКА
H2 O
COOH + H2N-CH2-COOH
Бензойная к-та
4 г.
глицин
CO-NH-CH2-COOH
в печени
Гиппуровая к-та
Моча (4 г)
12.
Участие -ГТферазы во всасывании аминокислотАК
клеточная
мембрана
глутамил
Внеклеточное пространство
трансфераза
Цистеинилглицин
глутамил АК
гли
внутри
АК
клетки
Глутатион ( –
глутамилцистеинилглицин)
глутамилцистеин
цис
5-оксопролин
глу
13.
Превращение АК в тканяхСинтез спецефических
белков и пептидов
Синтез гормонов - производны
АК (катехоламины, тироксин)
ЭКЗОГЕННЫЕ АК
Всосавшиеся из
кишечника
ЭНДОГЕННЫЕ АК
Образовавшиеся в клетках
под влиянием катепсинов
ЗАМЕНИМЫЕ АК
Синтезировавшиеся в
клетках
ВНУТРИ
КЛЕТОЧНЫЙ
ФОНД
(ПУЛ)
АК
Образование биогенных
аминов
Образование н/белковых
азотсодержащих веществ
(креатин, гем, пурин)
Превращение в другие АК
Специфический метаболизм
Синтез углеводов и
липидов
окисление
14.
Прямое окислительное дезаминированиеNH2
1/2 O2
аминооксидаза
AK
R
ФМН
ФМНН2
L
CHNH2
R
C=NH
D
COOH
R-C-COOH + NH3
O
a-кето кислота
=
R-CH-COOH
R
H2O
COOH
ФАД
ФАДН2
H2O2
O2
C=O
+ NH3
COOH
Имино
кислота
ОКСИДАЗЫ L-АМИНОКИСЛОТ имеют pH оптимум = 10
15.
В физиологических условиях прямомуокислительному дезаминированию подвергается
только глутаминовая к-та
COOH
CHNH2
CH2
CH2
COOH
глу
НАД(Ф)
НАД(Ф)Н2
Глутаматдегидрогеназа
(ГлДГ)
COOH
COOH
C=NH2
C=O
Н2 О
CH2
CH2 + NH3
CH2
CH2
COOH
COOH
Имино к-та
-кетоглу
16.
R1R2
CHNH2
+
C=O
COOH
COOH
АК
a - кето к-та
Амино
транс
фераза
ПФ (В6)
R1
R2
C=O
+
COOH
a-кето к-та
CHNH2
COOH
АК
Механизм трансаминирования АК
O
CH
-H2O
=
R1
CH-NH2
+
COOH
R1
-кето
к-та C=O
COOH
ПФ
+H2O
Пиридоксальфосфат
+H2O
NH2
Пиридок
+
самин CH2
фосфат
ПФ
R1
CH-N=CH-ПФ
COOH
альдимин
Шиффовы
основания
R1
C=N-CH2-ПФ
COOH
кетимин
17.
R2NH2
+
CH2
COOH
a - кето к-та
ПФ
C=O
-H2O
R2
R2
CH=N-CH2-ПФ
CH-N=CH-ПФ
COOH
COOH
O
CH
=
R2
+H2O
CHNH2
+
COOH
АК
суммарно
ПФ
R1-CH(NH2)-COOH
O=CH-ПФ
R2-CH(NH2)-COOH
R1-CO-COOH
H2N-CH2-ПФ
R2-CO-COOH
Браунштейн и Крицман
1937 год
18.
Из кето-кислот в реакциях трансаминирования чащевсего участвуют: ПВК, оксалоацетат, -кетоглутарат
R
CH3
CHNH2 +
C=O
COOH
АК
COOH
ПВК
COOH
R
CHNH2
COOH
АК
R
CHNH2 +
COOH
АК
Амино
трансфераза
ПФ
R
C=O
CH3
+
COOH
-кето к-та
R
Амино
+
трансфераза C=O
CH2
ПФ
COOH
Оксало
-кето к-та
COOH ацетат
COOH
R
C=O
Амино
трансфераза C=O
+
(CH2)2 кето
ПФ
глу
COOH
-кето
к-та
COOH
+ C=O
CHNH2
COOH
ала
COOH
CHNH2
CH2
COOH
COOH
асп
CHNH2
(CH2)2
глу
19.
Аланин и аспартат в свою очередь могут вступить вреакцию трансаминированияс -кетоглутаратом
CH3
CHNH2 +
COOH
ала
COOH
COOH
CH3
АлАТ
C=O
CH2
+
C=O
ПФ
COOH
CH2
ПВК
COOH
CHNH2
C=O
CH2
COOH
асп
+
CH2
CH2
COOH
-кето-глу
CH2
CH2
COOH
глу
COOH
-кето-глу
COOH
CHNH2
COOH
COOH
АсАТ
ПФ
CHNH2
C=O
CH2
COOH
оксалоацетат
+
CH2
CH2
COOH
глу
20.
ЗНАЧЕНИЕ АМИНОТРАНСФЕРАЗ1. Очень активные и распространенные в тканях
ферменты, особенно АсАТ и АлАТ
2. В результате их действия образуются заменимые
аминокислоты ала, асп, и особенно важно глутаминовая, единственная, которая подвергается
прямому окислительному дезаминированию
3. Способ образования -кетокислот из АК без продукции
аммиака
4. Определение активности АсАТ и АлАТ в крови имеет
диагностическое значение: определяют отношение
АсАТ/АлАТ=1.33 у здоровых людей;
при инфаркте оно увеличивается
21.
Все АК, кроме глутаминовой окисляются путем непрямогоокислительного дезаминирования
Непрямое
окислительное
дезаминирование
=
трансдезаминирование
АК
-кетокислота
I трансаминирование
-кетоглутарат
L-глутамат
II прямое окислительное
дезаминирование глутамата
H2 O
NH3
Т.е. Непрямое окислительное дезаминирование проходит в 2 этапа:
трансаминирование с выходом на глутаминовую к-ту и
прямое окислительное дезаминирование глутаминовой кислоты.
1.
2.
22.
СУДЬБА -КЕТОКИСЛОТХС, кетоновые
тела
глюкоза
Ала, гли, сер,
тре, цис
ПВ
К
Жирные к-ты
Фен, лей, три
Ацетил
Асп, асм
Оксало
КоА
ацетат
Арг, гис, про,
-кето
глн, глу
глу
ЦТ
К
Ацетоаце
тил-КоА
Фен, лиз, иле,
лей, тир
Иле, вал, мет
Глюкогенные АК
CO2 + H2O
Сукцинил
КоА
ЭНЕРГИЯ
Кетогенные
АК





















 biology
biology chemistry
chemistry








