Similar presentations:
Компоненты нефти, газов и нефтепродуктов. Состав, строение, свойства. Насыщенные углеводороды
1. Химия нефти и газа
Лекция №4Компоненты нефти, газов и нефтепродуктов.
Состав, строение, свойства.
Насыщенные углеводороды.
02.02.2019
2.
1.Насыщенные углеводороды. Алканы (парафины).Алканами или предельными углеводородами
называются соединения, в молекулах которых каждый
углеродный атом затрачивает на соединение с соседним
углеродом одну валентность, остальные валентности
насыщены атомами водорода, поэтому данный класс
соединений называется насыщенным или предельным.
СnH2n+2 – общая формула
2
02.02.2019
3.
Реакции определения качественного составапредельных углеводородов
t
1. С18Н38
+ 55CuO
парафин
= 18 CO2 + 19H2O + 55 Cu
2. CuSO4 +
5H2O
3. Ca(OH)2
+ CO2 =
безводный
сульфат меди
(белого цвета)
= CuSO4
5H2O
медный купорос
(синего цвета)
CaCO3
+ H2O
Предельные углеводороды состоят из
углерода С и водорода Н
3
02.02.2019
4.
5.
Природными источниками алканов являютсянефть и природный газ.
Природный газ на 75 – 85% состоит из метана.
Перегонка нефти позволяет получить смеси
насыщенных углеводородов с различной длиной
цепи:
5
02.02.2019
6.
ФракцияПриродный газ
Состав
С1 – С4
Т кипения, oC
Ниже 20
Петролейный
эфир
С5 – С6
20 – 60
Бензин
С4 – С8
40 – 200
Керосин
С10 – С16
175 – 275
Мазут (диз.
топливо)
С15 – С16
250 – 400
Смазочные масла
С18 – С22
Выше 300
Сложная смесь
углеводородов
(С20 и выше
–
Асфальт
7.
I. Способы получения алкановПромышленные методы получения алканов
1. Метод Бергиуса (гидрогенизация бурых углей):
H2, Fe
n C + (n+1) H2
CnH2n+2 (газ, бензин, смазочные масла)
450– 500 C, 200 – 300 атм
o
2. Метод Фишера-Тропша:
Ni, Co
n CO + (n+1) H2
o
400 C
CnH2n+2 + n H2O
синтин
Синтин – смесь углеводородов
3. Крекинг нефти:
C12H26
7
CН3 – ( СН2 )4 – CH3 + CН2 = СН – (СН2 )3 – CH3
гексан
гексен
02.02.2019
8.
III. Химические свойства предельных углеводородовРеакции алканов
Замещения (S)
окисления
расщепления
8
02.02.2019
9.
1. Реакции замещенияК
реакциям
замещения
галогенирования,
нитрования,
сульфоокисления.
относятся
реакции
сульфогалогенирования,
1) Галогенирование – реакция замещения атома водорода
на галоген . Основным условием протекания реакции
является УФ – излучение или температура (250о – 400оС)
(инициирование).
По реакционной способности галогены располагаются в
следующем порядке:
Сl2 > Br2 > I2
CH4
9
+
Cl2
CH3Cl
+
HCl
02.02.2019
10.
Механизм реакции галогенирования:Стадия 1 – зарождение цепи (инициирование):
Cl2
2 Cl
Стадия 2 – рост цепи:
СН 4 +
Cl
CH3
CH3
Cl2
CH3Cl + Cl
+
+
НCl
Стадия 3 - обрыв цепи:
Cl
10
+
Cl
Cl2
CH3• +
Cl
CH3Cl
CH3• +
CH3
CH3 – CH3
02.02.2019
11.
Сульфирование2)
Предельные углеводороды при нормальной
температуре с кислотами не реагируют. Если
нагреть предельные углеводороды с H2SO4 (конц),
произойдет окисление. Поэтому сульфокислоты из
предельных углеводородов можно получить при
помощи реакции сульфохлорирования.
11
02.02.2019
12.
3) СульфохлорированиеR – H + SO2 + Cl2
O
||
R – S – Cl + HCl
||
O
алкансульфохлорид
4
H3C – CH – CH2 – СН3 + SO2 + Cl2
|
CH3
3
2
1
H3C – CН – CH – СН3 + HCl
|
|
CH3 SO2Cl
3-метилбутансульфохлорид-2
12
02.02.2019
13.
Алкансульфокислоты образуют со щелочамисоли – сульфонаты:
Сульфонаты и сульфамиды с 12-18 и выше
атомами углерода, получаемые на основе
жидких парафинов, выделяемых из дизельных
фракций, служат в качестве поверхностноактивных и моющих веществ, эмульгаторов
нефти и флотационных реагентов.
13
02.02.2019
14.
4) НитрованиеСуществует два типа реакций:
а) нитрование HNO3
(реакция Коновалова).
(разб)
– жидкофазное нитрование
Концентрация HNO3 – 6÷12%. Температура процесса –
110÷140 ºC. Температура в зависимости от количества
углеродных атомов меняется.
110÷140 ºC
R – H +HNO3 (разб)
14
R – NO2 + H2O
02.02.2019
15.
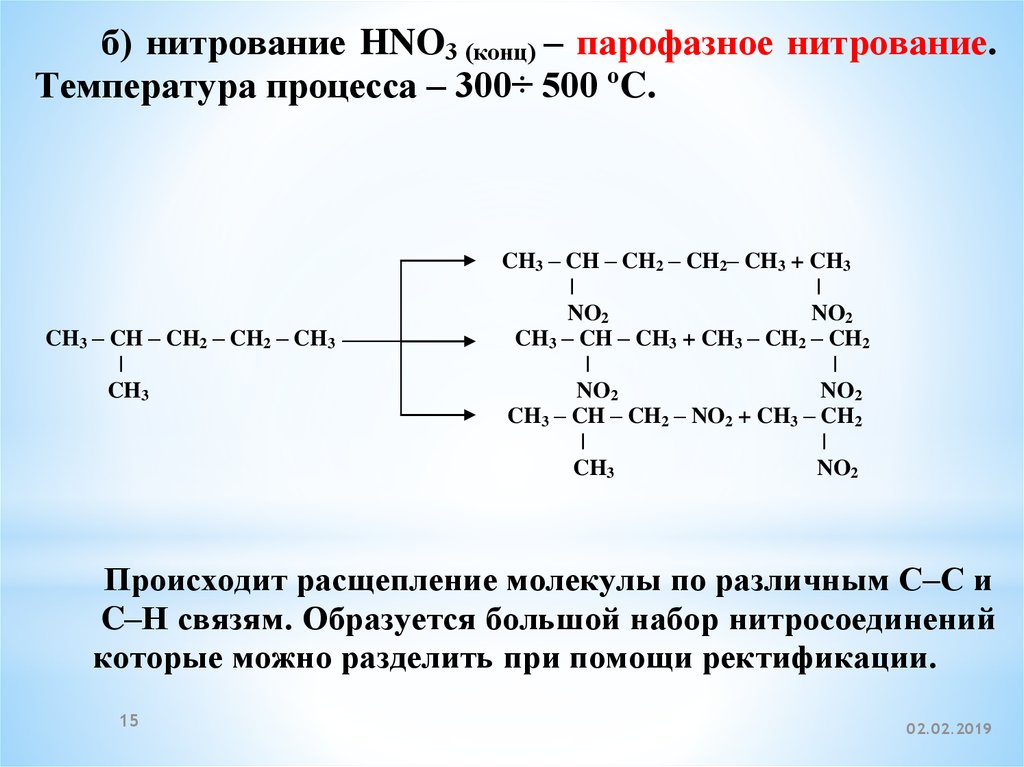
б) нитрование HNO3 (конц) – парофазное нитрование.Температура процесса – 300÷ 500 ºC.
CH3 – CH – CH2 – CH2 – CH3
|
CH3
CH3 – CH – CH2 – CH2– CH3 + CH3
|
|
NO2
NO2
CH3 – CH – CH3 + CH3 – CH2 – CH2
|
|
NO2
NO2
CH3 – CH – CH2 – NO2 + CH3 – CH2
|
|
CH3
NO2
Происходит расщепление молекулы по различным C–C и
C–H связям. Образуется большой набор нитросоединений,
которые можно разделить при помощи ректификации.
15
02.02.2019
16.
2. Реакции ращепления1) Крекинг
При температурах выше 400-450 С алканы (за
исключением метана, этана, пропана) неустойчивы и
подвергаются расщеплению в основном по связям
С-С с образованием молекулы алкана и алкена
меньшей молекулярной массы.
На этом основаны процессы крекинга, с помощью
которых в промышленности из
высокомолекулярных нефтяных продуктов,
кипящих при температурах выше 300°С (например,
мазут) получают низкомолекулярные продукты,
такие как газ, бензин.
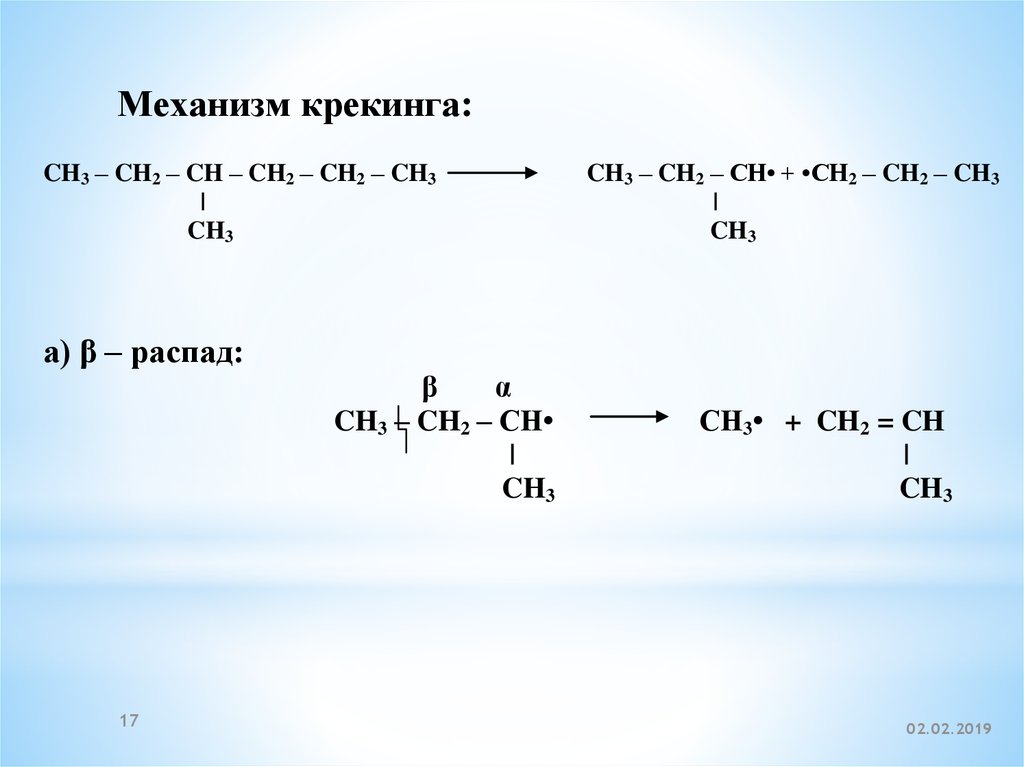
17.
Механизм крекинга:CH3 – CH2 – CH – CH2 – CH2 – CH3
|
CH3
CH3 – CH2 – CH• + •CH2 – CH2 – CH3
|
CH3
а) β – распад:
β
α
CH3 – CH2 – CH
|
CH3
17
CH3• + CH2 = CH
|
CH3
02.02.2019
18.
б) pеакция диспропорционирования:H
β|
CH3 – CН – CH
2
β| β
Н–C–H
β|
H
1
CH3 – CH2 – CH
|
CH3
+
1
CH3 – CH = CH – CH3
2
CH3 – CH2 – CH = CH2
3
CH3 – CH2 – CH2 – CH3
02.02.2019
19.
в) cоединение (рекомбинация):CH3 – CH2 – CH• + CH3 – CH2 – CH
|
|
CH3
CH3
19
CH3 – CH2 – CH – CH3
|
CH3 – CH2 – CH – CH3
02.02.2019
20.
3.Окисление
углеводородов)
(образование
toC
CH3 – CH2 – CH2 – CH – CH3
|
CH3
CH – CH3 + O2
|
CH3
-OH
кислородосодержащих
CH3 – CH2 – CH2 +
CH3 – CH – O – O
|
CH3
CH – CH3
|
CH3
Н
CH3 – CH – O – O – H
|
CH3
гидроперекись (неустойчивое соединение)
CH3 – CH – O
|
CH3
+Н
H
| β1
CH3 – C – O
β2 |
CH3
20
CH3 – CH – OH
|
CH3
β2
спирт
CH3• + CH3 – CH = O
альдегид
β1
H• +
CH3 – C – CH3
||
O
02.02.2019
21.
Так в промышленности осуществляется окислениетвердых парафиновых
углеводородов, выделенных из керосино-газойлевых
фракций нефтей. Окисление проводят кислородом
воздуха при температуре 100-150°С на
катализаторах. При этом получают высшие
жирные кислоты (с числом атомов углерода C10С20), которые далее используются для получения
мыла и других поверхностно-активных веществ.
22.
В присутствии большого избыткакислорода (или воздуха) при высокой
температуре алканы сгорают полностью
до воды и диоксида углерода, например:
CnH2n+2 + (3n+1)O2 → nCO2 + (n+1)H2O .
Эта реакция используется, главным
образом, при получении из природного
газа и нефтепродуктов тепловой энергии.
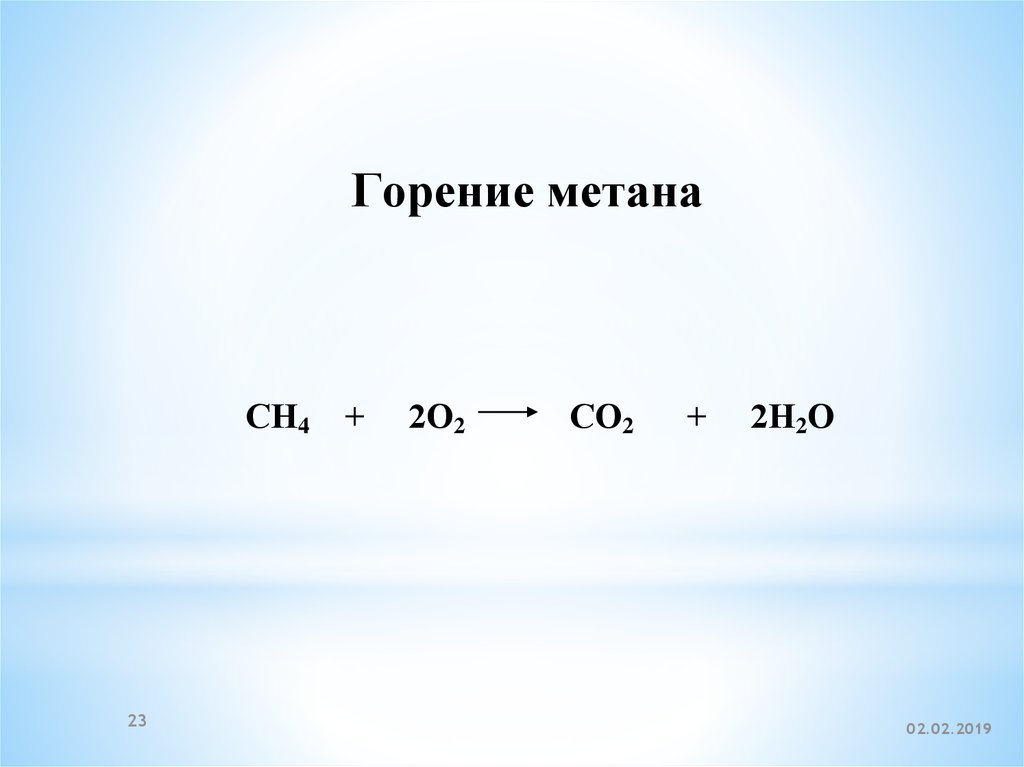
23.
Горение метанаСН4 +
23
2О2
СО2
+
2Н2О
02.02.2019
24.
25.
Горение жидких алкановКеросин (фракция С12 – С18) + О2
СО2 + Н2О
коптящее пламя
2С6Н14
+ 19О2
12СО2
+ 14Н2О
гексан
25
02.02.2019
26.
27.
Горение твёрдых алкановС17Н36
27
+ 26О2
17СО2
+ 18Н2О
02.02.2019
28.
29.
Неполное окисление метана кислородомвоздуха приводит к образованию смеси оксида
углерода и водорода, называемой синтез-газом:
CH4 + 0,5O2
800-9000
CO + 2H2 .
Синтез-газ используют для получения многих
органических продуктов.
29
02.02.2019
30.
Алканы нефтиАлканы занимают исключительно важное место среди
углеводородов нефти. Так, природные газы
представлены почти исключительно алканами.
Общее содержание алканов в нефтях составляет 40-50%
(об.), а в некоторых нефтях оно достигает 50-70%.
Однако есть нефти, в которых содержание алканов
составляет всего 10-15%.
Лёгкие фракции любых нефтей почти целиком состоят из
алканов. С повышением средней молекулярной массы
фракций нефти содержание в них алканов уменьшается.
В средних фракциях, выкипающих в пределах 200-300
0С, их содержится обычно не более 55-61%, а к 500 0С
количество этих углеводородов снижается до 19-5% и
менее.
31.
Природные газы - газы чисто газовыхместорождений. Они состоят, в основном, из
метана (93-99%) с небольшой примесью этана,
пропана, бутанов, пентанов.
Попутные газы. Так принято называть
газообразные углеводороды, сопровождающие
сырую нефть. Для этих газов характерно высокое
содержание метана и наличие значительных
количеств этана, пропана, бутанов и высших
углеводородов вплоть до октана. Такие газы
принято называть жирными или богатыми.
Попутные газы служат источником извлечения из
них лёгкого бензина.
32.
Газы газоконденсатных месторождений.Некоторые газовые месторождения насыщены
жидкими нефтяными углеводородами. При
разработке этих месторождений, жидкие
углеводороды конденсируются и могут быть
отделены от газа в виде жидкого конденсата.
После отделения конденсата газ приближается
по составу к сухим газам, а конденсат содержит
бензиновые и керосиновые фракции.
33. Спасибо за Ваше внимание!
3302.02.2019






























 chemistry
chemistry








