Similar presentations:
Химические свойства насыщенных углеводородов
1.
1 .2 :ХИ М И Ч ЕС КИ Е С В О Й С ТВ А Н АС Ы Щ ЕН НЫ Х
УГЛ ЕВ О Д О РО Д О В .
Учебные вопросы:
1. Реакции, в которых участвуют алканы:
-замещения (галогенирование, нитрование, сульфирование и т.д.);
-окисления (неполное окисление, горение, склонность к
самовозгоранию в атмосфере фтора и хлора);
-расщепления (крекинг, пиролиз).
2. Термическая устойчивость алканов. Оценка антидетонационных свойств топлив. Октановое и цетановое число.
3. Способы получения насыщенных углеводородов. Промышленные методы получения алканов.
4. Нефть и способы ее переработки. Метан и способы его
получения.
1
2.
Насыщенные(предельные)
углеводороды
–
это
вещества,
трудно вступающие
реакции при
обычных температурах.
Для
всех
углеводородов
гомологического
ряда
метана
характерна
несклонность
к
реакциям присоединения.
При
энергичном
воздействии
температур
или
химических
реагентов молекулы углеводородов
разлагаются
с
разрушением
углеродного скелета.
2
3.
Малополярные связи C-H в алканахотносительно
легко
подвергаются
гомолитическому разрыву по механизму
радикального
замещения
(галогенирования,
нитрования.
сульфирования).
При определенных условиях (концентрация
реагента
и
растворитель,
давление,
специфический катализатор) они вступают в
реакции замещения, в результате которых
атомы водорода их молекул замещаются
другими атомами или группами и образуются
производные углеводородов.
3
4.
Взаимодействие с галогенамиВ обычных условиях хлор и бром практически не
реагируют с насыщенными углеводородами. Так, бром
лучше растворим в углеводороде, чем в воде и переходит
в него из водного слоя; однако окраска брома не исчезает, т.к. он практически не вступает в реакцию.
Взаимодействие насыщенных углеводородов с хлором или бромом ускоряется при нагревании и, особенно,
при действии света.
Атомы галогена постепенно замещают в углеродных
молекулах атомы водорода. При этом образуются смеси
галогенпроизводных углеводородов; реакция сопровождается выделением галогенводорода.
4
5.
При действии хлора на метан происходит постепенноезамещение всех атомов водорода.
СН4
+ Сl2
свет
СН3Cl + Cl2
свет
CH2Cl2 + Cl2
свет
СНCl3 + Cl2
свет
СН3Cl + HCl
хлористый метил
CH2Cl2 + HCl
дихлорметан
CHCl3 + HCl
трихлорметан (хлороформ)
CCl4
+ HCl
тетрахлорметан
(четыреххлористый углерод)
Смесь хлора и метана взрывоопасна, хранение
совместно баллонов хлора и метана недопустимо!
5
6.
Реакция протекает по цепному механизму: Cl2 поддействием света 2Cl
Атомарный хлор отщепляет водород от метана,
образуя метильный радикал, и т.д.
В.В. Марковников установил, что после
замещения одного атома водорода хлором
облегчается замещение оставшихся водородных
атомов.
Обычно образуется смесь различных продуктов.
В промышленности разработаны методы
синтеза
преимущественно
одного
из
соединений.
6
7.
Припрямом
галогенировании
более
сложных
углеводородов замещение водорода может происходить у
различных углеродных атомов. При хлорировании пропана
реакция протекает по двум направлениям – образуется
смесь двух галогеналкилов:
СH3—CH2—CH2Cl + HCl
перв-хлоритый пропил
CH3—CH2—CH3 + Cl2
свет СH3—CHCl—CH3
+ HCl
втор-хлористый пропил
Галогеналканы
очень
хорошо
растворяют жиры и масла, и являются
фреонами
(хладагентами).
Легко
сжижаемые
смешанные
галогеналканы
(CCl3F,
CCl2F2)
используются в холодильных машинах,
аэрозольных дезодорантах и.т.д.
7
8.
К большинству реагентов они инертны,но в стратосфере реагируют с озоном.
Галогеналканы используются в качестве
флегматизаторов – добавление их в
горючую
смесь
обеспечивает
ее
пожаровзрывобезопасность.
Эмульсии
на основе тетрафторэтана,
бромэтана С2Н5Br используются для
тушения
органических
жидкостей,
древесины, хлопка:
тетрафторэтан
Озоновая дыра над
Антарктидой 2006
в очаг пожара попадают капли
бромэтана в водяной оболочке, они
мгновенно
превращаются
в
пар,
распыляя
мелкодисперсную
воду.
Одновременно паром разбавляются
горючие газы и тормозится реакция
окисления.
8
9.
C2Br2F4 (хладон или фреон 114В2) вместе суглекислотой представляет огнетушащий
состав, в 10 раз более эффективный чем
инертные газы и почти в 20 раз – чем вода.
хладон
Novec 1230,
используемый в
системах
автоматического
газового пожаротушения
Тетрафторид углерода
CHCl3
- еще более эффективный
ингибитор горения, но при высоких
температурах окисляется до COCl2
(СДЯВ). В пожарной практике вместо
него применяется CFClBr2.
Огнеингибирующее
действие
галогеналканов увеличивается в ряду:
I < Br < Cl < F
Все галогеналканы очень токсичны!
Являются
кровяными
ядами,
растворяют жиры в тканях печени и
почек.
9
10.
Реакция Коновалова (нитрование)Концентрированная азотная кислота при нагревании
окисляет насыщенные углеводороды, а на холоду - не
действует на них. В 1889 г. М.И. Коновалов открыл, что
при
действии
на
насыщенные
углеводороды
разбавленной азотной кислоты, но при нагревании и под
давлением,
возможно
замещение
водорода
в
углеводородах на остаток азотной кислоты – NO2
(нитрогруппу):
P, to
R—H + HO—NO2 R—NO2 + H2O
углеводород
азотная к-та
нитросоединение
Образующиеся
вещества
называют
нитросоединениями. В их молекулах азот нитрогрупы
непосредственно связан с углеродом.
10
11.
Реакциянитрования
протекает
по
радикальному механизму. Ее инициатором
является двуокись азота с неспаренным
электроном, образующаяся при распаде
азотистой кислоты, всегда присутствующей
в разбавленной азотной:
- H2O
O2N • • OH + H • • ONO O2N • • ONO 2O2N
Промышленное нитрование осуществляется
по непрерывному газофазному методу.
Нитросоединения являются основой синтеза
аминов, взрывчатых веществ и твердых
ракетных топлив.
11
12.
При нитровании по Коновалову наиболее легко на нитрогруппузамещается водород у третичного атома углерода, медленнее – у
вторичного и труднее всего – у первичного.
СН3—СН2—СН2—СН3 + НО—NO2
бутан
CH3—CH2—CH—CH3 + H2O
2-нитробутан
CH3
NO2 СН3
СH3—CH—CH2—CH3 + HO—NO2
CH3—C—CH2—CH3
2-метилбутан
2-нитро-2-метилбутан
NO2 + H2O
Название нитросоединений образуется добавлением к
названию углеводорода (по международной номенклатуре)
приставки нитро-; перед этой приставкой ставят цифру –
номер углеродного атома главной цепи, при котором
находится нитрогруппа.
12
13.
Нитроалканы – высококипящие, плохо растворимыев воде, легко воспламеняемые и взрывоопасные
жидкости. Способны к взрывному горению и
детонации без участия кислорода:
CH3NO2 0,2 CO2 + 0,8 CO + 0,8 H2O + 0,7 H2 + 0,5 N2
Нитрометан и нитроэтан – добавки к
горючему при автогонках. Высшие
нитроалканы
со
многими
нитрогруппами – твердые ракетные
топлива.
нитроэтан
Нитроалканы очень токсичны!
CCl3-NO2 трихлорнитрометан (хлорпикрин) – боевое
ОВ
слезоточивого
действия.
Эффективный
инсектицид.
13
14.
Реакция с серной кислотой (сульфирование)На холоду даже дымящаяся серная кислота (олеум)
почти не действует на предельные углеводороды, но при
высокой температуре она может их окислять. При
умеренном нагревании углеводороды, преимущественно
изостроения, с третичным углеродом в молекуле,
вступают во взаимодействие с дымящейся серной
кислотой. В результате выделяется вода и образуется
продукт замещения водород при третичном углероде на
остаток серной кислоты – SO2OH (сульфогруппу):
R
R—C—H +
R
углеводород
HO—SO2OH
R
R—C—SO2OH + H2O
R
сульфокислота
14
15.
Как и при нитровании, в случаесульфирования водородные
атомы
у
вторичных
и
третичных атомов углерода
замещаются легче, чем у
первичных.
Образующиеся
вещества
называют
сульфокислотами.
Реакция
сульфирования
имеет
особенно
большое
практическое
значение
для
ряда
ароматических
углеводородов.
Сульфокислоты
предельных
углеводородов (алкансульфокислоты) с цепью
из
8-20
атомов
углерода
нашли
ценное
применение для получения
детергентов –
синтетических моющих средств.
15
16.
Отношение к действию окислителей и высоких температурПри низких температурах предельные углеводороды
устойчивы даже к действию сильных окислителей.
Раствор KMnO4 или хромовая смесь (K2Cr2O7+H2SO4) при
комнатной температуре не окисляют предельные
углеводороды и при действии на них не изменяют своей
окраски.
Действие кислорода воздуха. При высоких температурах на
воздухе алканы воспламеняются и сгорают с образованием
СО2 и Н2О, выделяя большое количество тепла; на этом
основано применение их в качестве топлива.
16
17.
В настоящее время разработаны способыокисления углеводородов кислородом воздуха при
низких температурах при помощи катализаторов - из
смеси высших углеводородов нефти путем окисления
удается получить смеси высших жирных кислот, а
также спирты, альдегиды и кетоны. Катализаторами
служат соли и оксиды цветных металлов.
О2
СН3—(СН2)m—CH3 СH3—(CH2)n—C
кат-р.
и т.д
О
+ CH3—(CH2)p—C
ОН
n, p < m
О
ОН
Так как окисление сопровождается разрывом
углеродных цепей, образующиеся кислоты содержат
меньшее число углеродных атомов, чем исходные
углеводороды.
17
18.
Крекингуглеводородов.
При
нагревании
углеводородов до высоких температур (450—550оС) без
доступа воздуха они распадаются с разрывом углеродных
цепей и образованием более простых и непредельных
углеводородов. Такой процесс называют крекингом
(расщеплением).
Разложение углеводородов при еще более высоких
температурах (550—650оС и выше) приводит к образованию
простейших (главным образом газообразных) углеводородов;
кроме того, при этом происходит замыкание углеродных
цепей в циклы и получаются значительные количества
ароматических углеводородов. Этот процесс называют
пиролизом. Применением в процессах крекинга и пиролиза
специальных катализаторов и давления удается регулировать
эти процессы и получать необходимые продукты.
18
19.
Реакция дегидрирования. Эта реакция заключается вотщеплении от молекул предельных углеводородов атомов
водорода и приводит к образованию непредельных и
циклических углеводородов. Она имеет большое
промышленное значение.
образование пропилена:
400-600 оС
СН3—СН2—СН3 СН3—СН=СН2 + Н2
кат. (Cr2O3)
19
20.
Детонационные свойства углеводородовУглеводороды входят в состав бензинов, являющихся
горючим двигателей внутреннего сгорания. В последних пары
горючего подвергаются максимальном сжатию; при
воспламенении входящие в его состав углеводороды
мгновенно разлагаются со взрывом, образуя продукты
полного сгорания (СО2, пары Н2О). Этот процесс может
сопровождаться
так
называемой
детонацией,
т.е
преждевременным взрывом горючего до достижения
максимального сжатия. При этом происходит неполное
сгорание с образованием СО, Н2 и "остатков" (осколков)
углеводородов.
Детонационные свойства углеводородов зависят от их
строения: чем больше разветвлена цепь углеводорода (т.е.
чем больше в его молекуле третичных и четвертичных
углеродных атомов), тем меньше он склонен к детонации и
тем выше его качество как горючего; чем меньше
разветвлена цепь, тем склонность к детонации больше.
20
21.
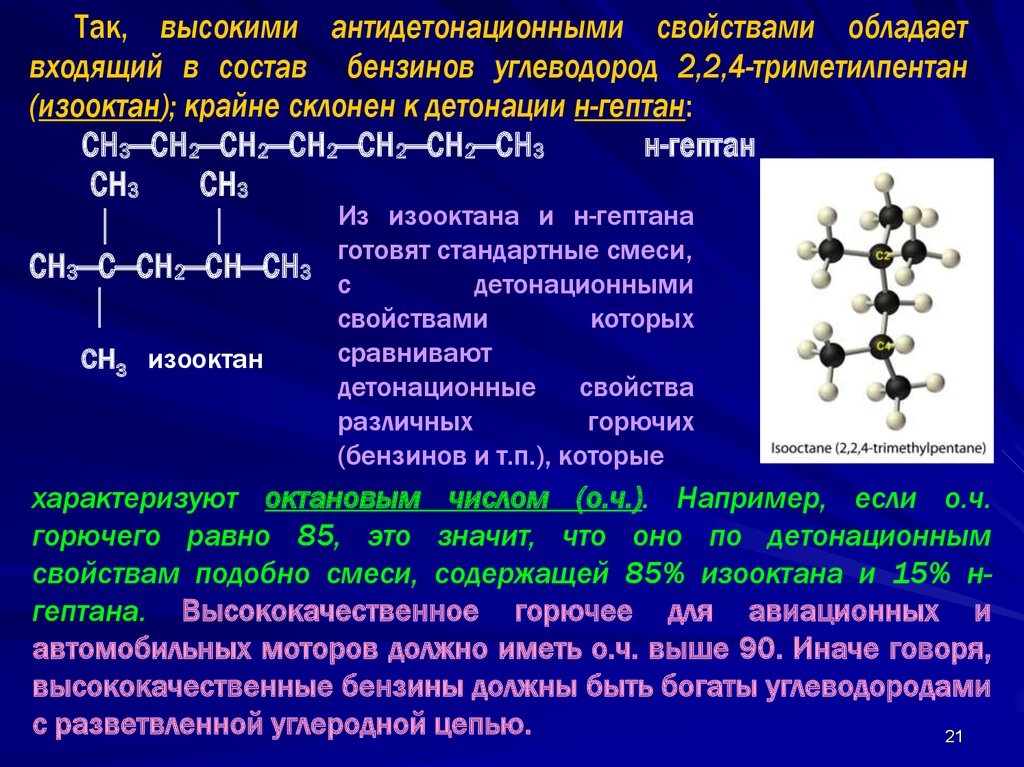
Так, высокими антидетонационными свойствами обладаетвходящий в состав бензинов углеводород 2,2,4-триметилпентан
(изооктан); крайне склонен к детонации н-гептан:
СН3—СН2—СН2—СН2—СН2—СН2—СН3
н-гептан
СН3
СН3
Из изооктана и н-гептана
готовят стандартные смеси,
СН3—С—СН2—СН—СН3 с
детонационными
свойствами
которых
СН3 изооктан
сравнивают
детонационные
свойства
различных
горючих
(бензинов и т.п.), которые
характеризуют октановым числом (о.ч.). Например, если о.ч.
горючего равно 85, это значит, что оно по детонационным
свойствам подобно смеси, содержащей 85% изооктана и 15% нгептана. Высококачественное горючее для авиационных и
автомобильных моторов должно иметь о.ч. выше 90. Иначе говоря,
высококачественные бензины должны быть богаты углеводородами
с разветвленной углеродной цепью.
21
22.
Цетановое числоВ случае дизельного топлива горючее впрыскивается в
камеру с нагретым до нескольких сот градусов (за счет
адиабатического сжатия) воздухом и должно сгореть со
взрывом. Идеальным топливом для дизелей является н–цетан
(С16Н34 – н-гексадекан) с цетановым числом 100; эталоном
наиболее
плохого
дизельного
топлива
является
метилнафталин (цетановое число 0). В качестве дизельного
горючего особенно пригодны средние фракции парафиновых
нефтей, кипящие между 230 о и 290 оС.
Фракции с цетановым числом ниже 45 для этих целей
непригодны. Для повышения способности дизельных масел к
воспламенению
к
ним
добавляют
органические
нитросоединения
в
качестве
так
называемых
ускорителей зажигания.
СН3
-метилнафталин (эталон вещества с наиболее плохой
способностью к воспламенению)
22
23.
С п о со б ы п о луч е н и я н а сы щ е н н ы х угле в о до р о до вСинтез из ненасыщенных углеводородов
Состав ненасыщенных углеводородов, содержащих,
например, двойную или тройную связи, выражается общими
эмпирическими формулами: СnH2n или СnH2n-2: т.е. они
отличаются от предельных углеводородов по содержанию
водорода. Для получения предельных углеводородов
непредельные подвергают воздействию водорода (реакция
гидрирования) в присутствии катализаторов (Ni, Pd, Pt):
+H
+ 2H
2
2
CnH2n+2
углеводород с двойной
предельный
CnH2n
связью
кат-р
углеводород
кат-р
CnH2n-2
углеводород с тройной
связью
23
24.
Восстановление галогенпроизводныхПри замещении атомов галогенов в молекулах
насыщенных (предельных) галогенпроизводных на водород
образуются насыщенные углеводороды. Наиболее удобно
действие водорода в момент
выделения или
иодистоводородной кислотой на иодпроизводные:
+2Н
R—I RH + HI
иодпроизводное
углеводород
углеводорода
+HJ
R—I RH + I2
иодпроизводное
углеодород
углеводорода
24
25.
П о л уч е н и е и з о р га н и ч е с к и х к и с л о тО р га н и ч е ск и е
р а зла га ться
с
к и сло ты
в
образованием
различны х
условиях
п р е де льн о го
м о гут
угле в о до р о д а
по
общ ей схем е
O
R—C
к и сло та
RH
+
CO
2
углев одор од
OH
Р е а к ц и ю удо б н о в е сти , е сли б р а ть со ли к и сло т и сп ла в ля ть
и х с тв е р ды м и щ е ло ч а м и . Н а п р и м е р :
О
t
C H 3— C — O N a
+
Na—O—H
CH
4
+
N a 2C O
3
ук сусн о к с лы й н а тр и й
Э то т
м еньш им
м е то д
приводит
числом
к
образованию
угле р о д н ы х
а то м о в ,
угле в о до р о до в
чем
в
с
исходном
соединении.
25
26.
Синтез более сложных углеводородов из галогенпроизводныхс меньшим числом атомов углерода (синтез Вюрца)
Данный метод заключается в получении углеводородов из
галогенпроизводных при действии на них металлического
натрия. Реакция протекает при нагревании:
t
R—I + 2Na + I—R1 R—R1 + 2NaI
иодпроизводное
иодпроизводное
углеводород
В результате получается углеводород, содержащий большее
число углеродных атомов, чем исходное галогенпроизводное.
t
CH3—I + 2Na + I—CH3 CH3—CH3 + 2NaI
иодистый метил
иодистый метил
этан
26
27.
Допустим требуется получить один из изомерных пентанов- 2-метилбутан: CH3—CH—CH2—CH3
CH3
Очевидно, что наиболее простым и удобным для синтеза
этого углеводорода исходными галогенпроизводными будут 2иодпропан (иодистый изопропил) и иодэтан (иодистый этил);
действуя на их смесь металлическим натрием, получают
заданный углеводород:
CH3
CH3
CH3—CH—I + 2Na + I—CH2—CH3 CH3—CH—CH2—CH3
иодистый изопропил
иодистый этил
2-метилбутан
+ 2NaI
27
28.
О днакок о гд а
в
реакцию
вводят
см есь
двух
га ло ге н п р о и зв о дн ы х, э та р е а к ц и я б уде т п р о те к а ть е щ е п о дв ум
н а п р а в л е н и я м , т .к . м о л е к у л ы
к а ж до го и з га ло ге н п р о и з в о дн ы х
м о гут р е а ги р о в а ть п о п а р н о др уг с д р уго м , а и м е н н о :
CH
CH
3
CH
3
— CH — I + 2N a
пропил
+
2N aI
CH
3
— CH
+ I— C H — C H
3
CH
иодисты й пр опи л
2
— I + 2 N a + I— C H
и о д и с ты й э ти л
+
CH
3
2
— CH
3
3
CH
3
— CH — CH — CH
и о д и с ты й
3
2 ,3 -д и м е т и л б у т а н
3
CH
3
— CH
2
— CH
2
иодиты й этил
— CH
3
б ута н
2N aI
Таким
образом ,
из
см еси
дв ух
га ло ге н п р о и зв о дн ы х
по
р е а к ц и и В ю р ц а о б р а з уе тся см е сь тр е х угле в о до р о д о в , к о то р а я
м ож ет разделена
на
со ста в ля ю щ и е
соединения
(о б ы ч н о
при
п о м о щ и д р о б н о й п е р е го н к и ).
28
29.
Синтез углеводородов из окиси углерода и водородаПри пропускании смеси окиси углерода (СО) и водорода (Н2)
над нагретым до 200 0С катализатором, содержащим
восстановленное железо, образуются смеси преимущественно
предельных углеводородов:
2nCO + (n+1)H2 CnH2n+2 + nCO2
Fe
Процесс имеет большое практическое значение, т.к.
полученные смеси углеводородов представляют собой
синтетический бензин. Исходным продуктом для синтеза могут
служить получаемые различными методами смеси СО и Н2.
Смесью этих газов является, например, синтез-газ, получаемый
из природных газов, содержащих метан, или водяной газ,
образующийся при пропускании водяного пара на раскаленным
углем.
29
30.
Получение насыщенных углеводородов (алканов) изприродных продуктов
Природными источниками предельных углеводородов
служат разнообразные продукты, из которых наиболее важны
природные горючие газы, нефть и горный воск.
Природные горючие газы представляют собой смеси
газообразных углеводородов; они часто в больших
количествах выделяются из скважин в процессе нефтедобычи
(попутный нефтяной газ).
Главная составная часть природных газов – метан.
Нефтяной газ наряду с метаном содержит этан, пропан, бутан
и изобутан. Иногда
в нефтяном газе содержится и
значительное количество паров низкокипящих углеводородов,
входящих в состав бензинов; поэтому он может служить
источником легких бензиновых фракций.
30
31.
Нефть представляет собой сложную смесьорганических веществ, главным образом
углеводородов, с водой может образовывать
стойкие эмульсии.
В качестве примесей нефть содержит
нафтеновые кислоты, сернистые и азотистые
соединения, воду, минеральные соли.
Нефть – эффективное и дешевое топливо.
Кроме того, она является наиболее ценным
химическим сырьем, на основе которого
получают синтетический каучук, пластмассы,
растворители,
лекарственные
препараты,
ядохимикаты, взрывчатые вещества и т.д.
31
32.
Было выдвинуто много теорий, объясняющихпроисхождение нефти. Из них основными являются:
неорганическая, космическая и органическая.
Согласно
неорганической
теории,
автором
которой был Д.И.Менделеев, нефть образовалась в
результате взаимодействия карбидов металлов,
находящихся в ядре Земли, с водой, проникшей по
трещинам к раскаленным карбидам.
По космической теории нефть образовалась из
углерода и водорода при формировании Земли. Эта
теория находит подтверждение в наличии метана в
атмосфере некоторых планет.
Согласно
органической
теории,
получившей
наибольшее распространение, нефть образовалась
из остатков морских животных, низших организмов
или растительных остатков, которые скапливались
в течение миллионов лет и под давлением
находившихся над ними пород и под действием
тепла ядра Земли превращались в углеводороды.
32
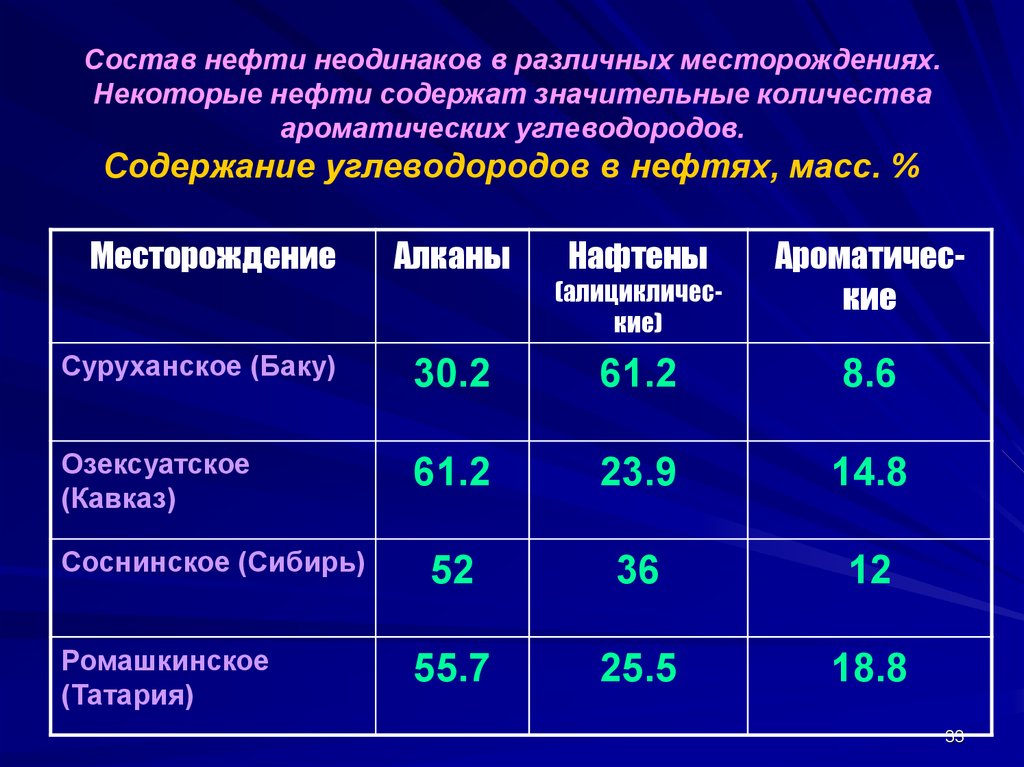
33. Состав нефти неодинаков в различных месторождениях. Некоторые нефти содержат значительные количества ароматических углеводородов. Содер
Состав нефти неодинаков в различных месторождениях.Некоторые нефти содержат значительные количества
ароматических углеводородов.
Содержание углеводородов в нефтях, масс. %
Месторождение
Алканы
Нафтены
(алициклические)
Ароматические
Суруханское (Баку)
30.2
61.2
8.6
Озексуатское
(Кавказ)
61.2
23.9
14.8
52
36
12
55.7
25.5
18.8
Соснинское (Сибирь)
Ромашкинское
(Татария)
33
34.
Путем перегонки из нефти получают продуктыразличного назначения. Главный способ переработки
нефти – фракционирование (перегонка), при котором
(после предварительного удаления газов) выделяют
следующие основные нефтепродукты:
Бензин
При вторичной перегонке выделяют
несколько фракций авиационный и автомобильный:
Легкий с плотностью 0.64-0.66
Средний
0.66-0.7
Тяжелый
0.7-0.77
Керосин делится на осветительный, тракторный
легкий и тракторный тяжелый (дизельное топливо).
После каталитического гидрирования служит топливом
для реактивных двигателей.
Парафины и церезины применяются для изготовления
свечей, для
пропитки
соломки
спичек,
в
производстве
восковой
бумаги, в качестве
диэлектрика в электротехнической и радиотехнической
34
промышленности.
35.
При окислении хорошо очищенного парафинавоздухом в присутствии катализаторов образуются
карбоновые кислоты, применяемые в мыловарении
как
заменители
жиров.
Крекингом парафина
получают -олефины — сырье для
производства
моющих веществ и др.
Из мазута при температуре выше 300 оС отгоняется
некоторое количество соляровых масел, применяемых
в качестве различных смазочных средств. Кроме того,
из мазута путем очистки, перегонки под уменьшенным
давлением или с водяным паром получают вазелин и
парафин (смесь твердых углеводородов, которыми
особенно богаты некоторые сорта нефти).
Остаток после переработки мазута – так
называемый гудрон – применяют для покрытия
дорог. Мазут используют и непосредственно как
топливо.
35
36.
Отдельные представители насыщенныхуглеводородов
Метан – бесцветный газ, не имеющий запаха. В
природе образуется
в результате различных
процессов брожения или при гниении клетчатки
растений без доступа кислорода под влиянием особых
микроорганизмов:
(С6Н10О5)х + Н2О 3хСН4 + 3хСО2
клетчатка
метан
Метан является главной составной частью
выделяющегося со дна болот болотного газа. Газ,
образующийся в каменноугольных пластах, также
содержит до 90% метана; поэтому метан еще
называют рудничным газом.
36
37.
На воздухе метан горит бесцветнымпламенем. Смесь одного объема метана с
двумя объемами кислорода сгорает с сильным
взрывом (гремучая смесь):
СН4 + 2О2 СО2 + 2Н2О
Образование такого рода смеси является
причиной взрывов рудничного газа, крайне
опасных при разработке углей.
37
38.
Метан – ценное химическое сырье; большиеколичества метана подвергают конверсии в синтез-газ
(смесь СО и Н2). Для этого метан с парами воды
пропускают над никелевым катализатором при 700-800
оС или же подвергают неполному окислению кислородом
в печах при 1400-1500 оС (кислородная конверсия):
700-800 оС
1400-1500 оС
СН4 + Н2О СО + 3Н2; 2СН4 + О2 2СО +
4Н2.
кат-р
кат-р
Синтез-газ используют для получения углеводородов,
метанола, аммиака и др. Из метана при высокой
температуре может быть получен ацетилен:
1500 оС
2СН4 СН СН + 3Н2.
38




































 chemistry
chemistry








