Similar presentations:
Молекулярно-кинетическая теория вещества. (Лекция 1)
1.
ЛЕКЦИЯ 1. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ВЕЩЕСТВА2.
Молекулярнаяфизика – раздел физики,
изучающий физические свойства вещества
на основе рассмотрения его молекулярного
строения
3.
1.Все тела – твердые, жидкие, газообразные –
состоят из атомов и молекул.
2.
Молекулы всех тел находятся в беспорядочном
хаотическом движении, не имеющем какого-либо
выбранного направления; такое движение
называется тепловым, т.к. его скорость зависит
от температуры вещества.
4.
Молекула– наименьшая частица вещества,
определяющая все его химические свойства;
молекула состоит из атомов.
Атом
– наименьшая частица химического
элемента, способная к самостоятельному
существованию и являющаяся носителем его
индивидуальных свойств.
5.
Молекулярнаяфизика пользуется
вероятностными (статистическими)
методами и объясняет наблюдаемые на
опыте свойства тел суммарным результатом
действия отдельных молекул; поэтому
молекулярная физика часто называется
статистической физикой
6.
ЛЕКЦИЯ 1. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ВЕЩЕСТВА7.
Атомнаяединица массы (а.е.м) – единица
измерения массы атомов и молекул.
1 а.е.м. называется масса, равная 1/12
массы атома 12С (изотопа углерода с
массовым числом 12):
1 а.е.м. = 1,66 10-27 кг
8.
Относительнойатомной массой Ar
химического элемента называется
отношение массы атома этого элемента к 1
а.е.м.
9.
Относительноймолекулярной массой
Mr вещества называется отношение
массы молекулы этого вещества к 1
а.е.м.
mат Ar 1,66 10
27
кг
mмол M r 1,66 10 27 кг
10.
Моль(единица измерения количества
вещества в МКТ) – количество вещества,
в котором содержится столько
структурных единиц (атомов, молекул,
ионов, кластеров, электронов и т.д.),
сколько атомов содержится в 12 г
изотопа углерода 12С.
11.
ЧислоАвогадро NA – число частиц а одном
моле вещества:
N A 6,02213 10 23 моль -1
12.
Молярноймассой M называется масса
одного моля вещества:
M N A M r 1 а.е.м.
M N A mмол N A M r 1 а.е.м.
Молярная
масса, выраженная в граммах
на моль, численно равна относительной
молекулярной массе: M = Mr (г/моль)
13.
ЛЕКЦИЯ 1. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ВЕЩЕСТВА14.
Идеальнымкоторого:
газом называется газ, молекулы
▪ не взаимодействуют друг с другом на расстоянии (при
столкновении друг с другом и со стенками сосуда молекул
ведут себя как абсолютно упругие шары).
▪ Собственный объем молекул газа ничтожно мал по
сравнению с объемом сосуда, в котором находится газ.
15.
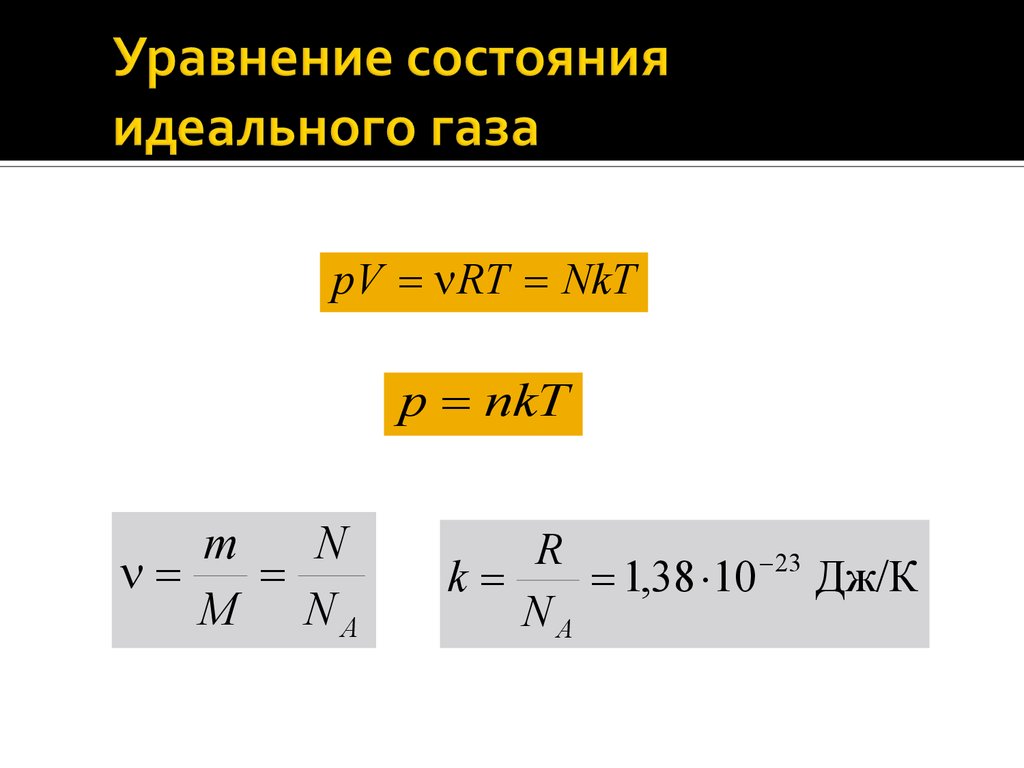
Уравнениесостояния идеального газа
(уравнение Менделеева – Клапейрона):
m
pV
RT
M
R 8,31 Дж/(моль К)
16.
pV RT NkTp nkT
m
N
M NA
R
k
1,38 10 23 Дж/К
NA
17.
Водинаковых объемах идеальных газов при
одинаковых температурах и давлении
содержится одно и то же число молекул (верно
и обратное утверждение: различные газы,
содержащие одинаковое число молекул, при
одинаковых температуре и давлении занимают
одинаковые объемы).
В
частности, при нормальных условиях
(T0 = 273,15 K, p0 = 1,0132 105 Па) 1 моль
любого газа занимает объем Vm = 22,415 10-3 м3
18.
m pMV
RT
19.
Давлениесмеси идеальных газов равно сумме
парциальных давлений этих газов:
r
p pi
i 1
Парциальным давлением компоненты газовой смеси
называется давление, которые производила бы она, если бы
занимала весь объем смеси в отсутствии других компонент
При этом каждая и газовая компонента смеси подчиняется
уравнению Менделеева – Клапейрона.
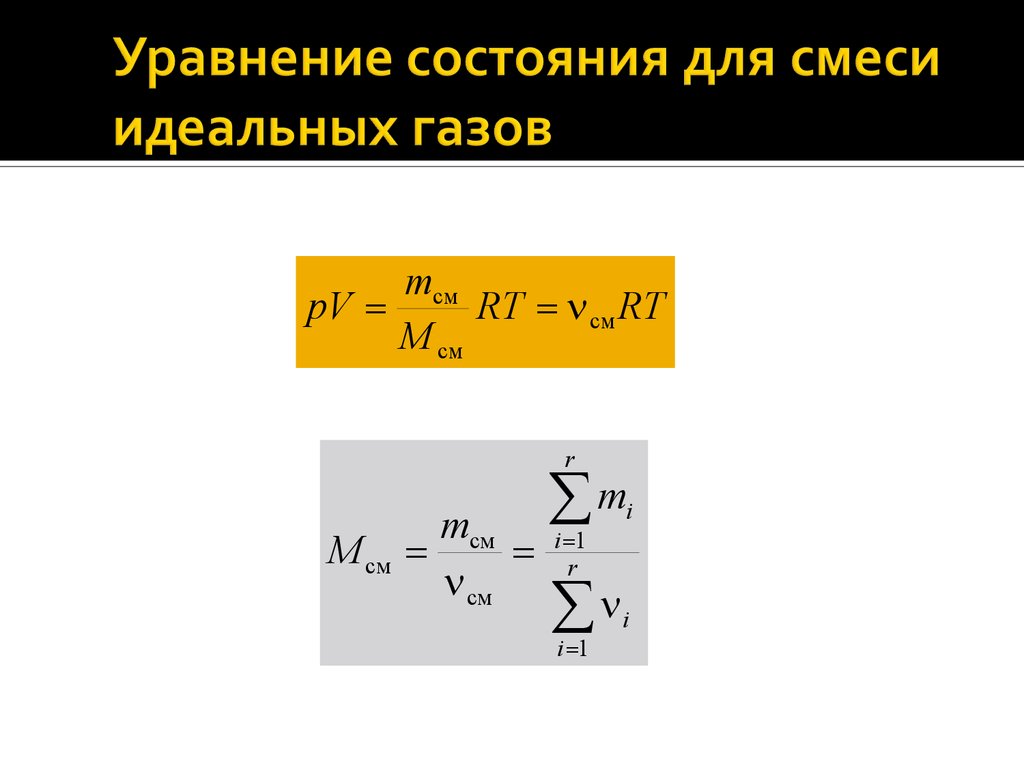
20.
mсмpV
RT см RT
M см
r
M см
mсм
см
m
i 1
r
i 1
i
i
21.
ЛЕКЦИЯ 1. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ВЕЩЕСТВА22.
Основноеуравнение молекулярнокинетической теории газов связывает
давление p, оказываемое газом на стенки
сосуда, со средней кинетической энергией
поступательного движения молекулы
< пост>:
2
p n пост
3
23.
Газнаходится в состоянии термодинамического
равновесия со стенками сосуда; давление газа не
зависит от формы и размеров сосуда.
Взаимодействие
молекул со стенками сосуда
описывается моделью упругих соударений с
зеркальным отражением.
Все
направления движения молекул
равновероятны.
24.
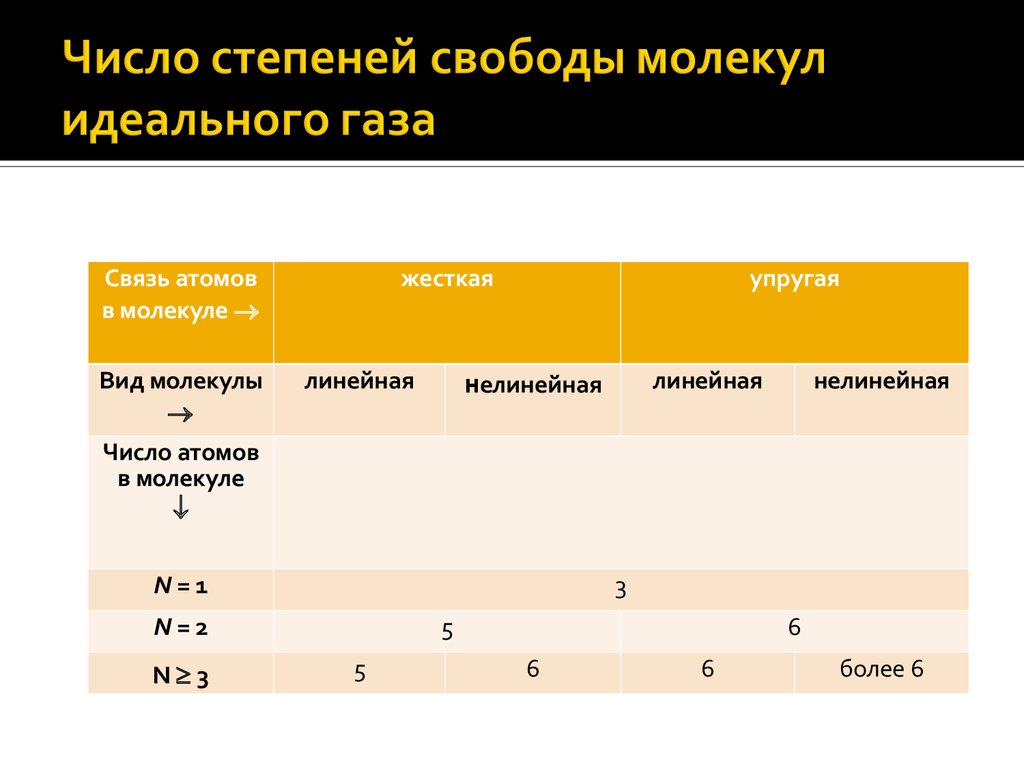
ЛЕКЦИЯ 1. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ВЕЩЕСТВА25.
Числомстепеней свободы механической
системы называется число независимых
величин, полностью определяющих
положение системы в пространстве.
Степени
свободы молекул идеального газа
могут быть поступательными (т. е.
соответствовать поступательному
движению), вращательными и
колебательными
26.
Связь атомовв молекуле
Вид молекулы
жесткая
линейная
упругая
линейная
нелинейная
нелинейная
Число атомов
в молекуле
N=1
3
N=2
N 3
5
5
6
6
6
более 6
27.
ЗаконБольцмана (закон
равнораспределения энергии по
степеням свободы): в состоянии теплового
равновесия на каждую степень свободы в
среднем приходится одинаковая энергия,
равная (½)kT
28.
Упругаямолекула (молекула, атомы которой
совершают колебания), обладает как
кинетической, так и потенциальной энергией,
связанной с колебаниями, поэтому
колебательная степень свободы
характеризуется удвоенной энергетической
емкостью: средняя энергия, приходящаяся на
колебательную степень свободы, равна kT (по
(1/2)kT на кинетическую и на потенциальную
энергии колебаний)
29.
i iпост iвращ 2iкол30.
ikT
2
N
i
NkT
2



























 physics
physics








