Similar presentations:
6-я группа элементов. 9 класс
1.
ХИМИЯ9 класс
6я группа элементов
Мария Дмитриевна Смирнова
Smirnova@sch2101.ru
Vk.com/masha2101
1
2.
Проверка ДЗНаписать 5 примеров солей кислот имеющих в своим составе серу и назвать их.
3.
СераГлавные кислоты
серы
-2
Сероводородная
H2S
+4
Сернистая
H2SО3
+6
Серная
H2SО4
4.
Сероводород-2
Сероводородная
H2S
Сероводород – бесцветный и очень токсичный газ с запахом тухлых яиц.
Получение в лаборатории:
FeS + 2HCl -> FeCl2 + H2S
Al2S3 + 6H2O -> 2Al(OH)3 + 3H2S
H2S – типичный восстановитель:
H2S + Br2 -> S + 2HBr
А так же, слабая кислота
Pb(OH)2 + H2S -> PbS + 2H2O
5.
Сернистая кислота+4
Сернистая
H2SО3
SO2 + H2O <-> H2SO3
Сернистый газ можно получить при взаимодействии:
Me + 2H2SO4 (конц) -> CuSO4 + SO2 + 2H2O
H2S + O2 -> SO2 + H2O
Характерные реакции:
Реакции, протекающие без изменения степени окисления:
Ca(OH)2 + SO2 -> CaSO3 + H2O
Реакции с повышением степени окисления до +6
Na2SO3 + Cl2 + H2O -> Na2SO4 + 2HCl
Реакции протекающие с понижением степени окисления
2H2S + H2SO3 -> 3S + 3H2O
Реакции самооксиления-самовосстановления
• NaSO3 + S -> Na2S2O3
6.
Серная кислотаПолучение ангидрида серной кислоты (SO3) при катализаторе Pt или V2O5
+6
2SO2 + O2 -> 2SO3 + Q
Серная
SO3 + H2O = H2SO4
H2SО4
Олеум – раствор SO3 в 100%-ной серной кислоте.
Разбавленная серная кислота окисляет только металлы, стоящие в ряду напряжений до
водорода:
Zn + H2SO4 (разб) = ZnSO4 + H2
При прокаливании:
ZnSO4 = ZnO + SO3
4FeSO4 = 2Fe2O3 + 4SO2 + O2
Ag2SO4 = 2Ag + SО2 + O2
Концентрированная кислота реагирует:
Zn + 2H2SO4 (конц) = ZnSO4 + SO2 + 2H2O
Пассируются: алюминий, хром и железо.
7.
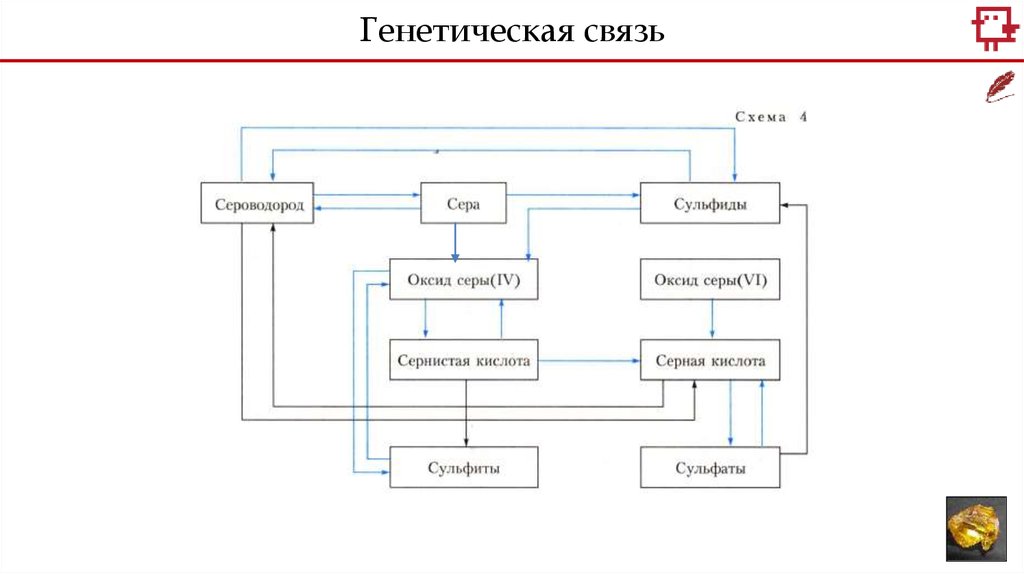
Генетическая связь8.
ПрименениеСера применяется в :
• Получении SO2, H2SO4, H2S, CS2
• Вулканизация резины
• Производство пороха
• Производство инсектицидов (химические препараты для уничтожения вредных
насекомых) и фунгицидов (химические вещества для борьбы с грибковыми
болезнями растений ).
Серная кислота, на производстве получается в три этапа: получение SO2;
каталитическое окисление SO2 до SO3; поглощение SO3 96%-ной серной кислотой –
получается 100% кислота.
Серная кислота нужна для химической, аграрной и лекарственной промышленности.
9.
Задачки1. Напишите уравнения реакций, характеризующих следующие превращения:
SO2 -> Na2SO3 -> NaHSO3 -> Na2SO3 -> Na2SO4
2. Какую массу оксида серы (VI) надо растворить в 100г 91%-ного раствора серной
кислоты для того, что бы получить 30%-ный олеум?
10.
Селен и ТеллурХимия селена и теллура схожа с химией серы.
Селеноводород, H2Se
Оксид селена(IV) SeO2
Селенистая кислота, H2SeO3
Оксид селена(VI) SeO3
Селеновая кислота, H2SeO4
Теллуроводород TeH2
Оксид теллура (IV) TeO2
Теллуристая кислота H2TeO3
Оксид теллура (VI) TeO3
Ортотеллуровая кислота H6TeO6









 chemistry
chemistry








