Similar presentations:
6-я группа элементов. 9 класс
1.
Урок 9 класса6я группа элементов
28.11.2016
5е занятие 2го триместра
2.
Ангидрид серной кислоты. Серная кислота.Получение ангидрида серной кислоты (SO3) при катализаторе Pt
или V2O5
2SO2 + O2 -> 2SO3 + Q
SO3 + H2O = H2SO4
Олеум – раствор SO3 в 100%-ной серной кислоте.
Разбавленная серная кислота окисляет только металлы, стоящие в
ряду напряжений до водорода:
Zn + H2SO4 (разб) = ZnSO4 + H2
При прокаливании:
ZnSO4 = ZnO + SO3
4FeSO4 = 2Fe2O3 + 4SO2 + O2
Ag2SO4 = 2Ag + SО2 + O2
Концентрированная кислота реагирует:
Zn + 2H2SO4 (конц) = ZnSO4 + SO2 + 2H2O
Пассируются: алюминий, хром и железо.
3.
АллотропияЯвление когда один и тот же химический элемент образует
несколько простых веществ, называют аллотропией. Простые
вещества, образованные одним и тем же химическим элементом,
называют аллотропными модификациями этого элемента.
Аллотропные модификации фосфора (белый, красный, жёлтый, чёрный фосфор)
4.
ФлотацияСера на втором месте, после углерода, по количеству аллотропных
модификаций.
Плотность серы в двое больше воды, но порошок её будет
всплывать, т.к. не смачивается (гидрофобный) водой.
5.
Аллотропия серыЕсли кристаллическую серу расплавить, а потом резко закалить –
она образует серу. Такая сера легко тянется.
6.
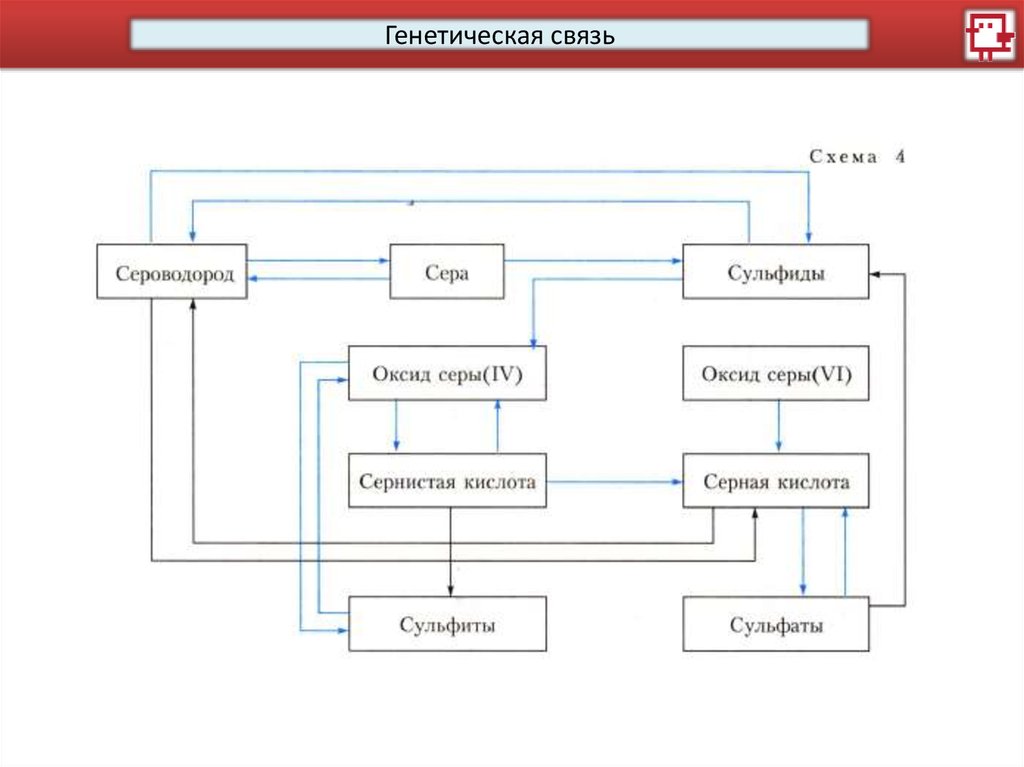
Генетическая связь7.
ПрименениеСера применяется в :
• Получении SO2, H2SO4, H2S, CS2
• Вулканизация резины
• Производство пороха
• Производство инсектицидов (химические препараты для
уничтожения вредных насекомых) и фунгицидов (химические
вещества для борьбы с грибковыми болезнями растений ).
Серная кислота, на производстве получается в три этапа: получение
SO2; каталитическое окисление SO2 до SO3; поглощение SO3 96%ной серной кислотой – получается 100% кислота.
Серная кислота нужна для химической, аграрной
И лекарственной производства.
8.
ДЗ1. Напишите уравнения реакций, характеризующих следующие
превращения:
SO2 -> Na2SO3 -> NaHSO3 -> Na2SO3 -> Na2SO4
2. Какую массу оксида серы (VI) надо растворить в 100г 91%-ного
раствора серной кислоты для того, что бы получить 30%-ный олеум?
9.
Скорость химической реакцииСкорость химической реакции определяется изменением
концентрации одного из реагирующих веществ в единицу времени.
2H2 + O2 -> 2H2O
Fe + 3O2 -> 2Fe2O3 (ржавление)
10.
Скорость химической реакцииНекоторые процессы нужно ускорять (например, в производстве), а
некоторые замедлять.
Как рассчитать скорость?
S + O2 -> SO2
Если в начальный момент времени t1, была концентрация - c1, а в
t2 – с2, то скорость химической реакции будет выражается:
v=(c1-c2)/(t2-t1) или v = dc/dt.
11.
Скорость химической реакцииОт чего зависит скорость химической реакции?
1. От природы реагирующих веществ
2. Для растворов и газов, скорость зависит от концентрации
3. Для твёрдых веществ, есть прямая пропорциональная
зависимость от поверхности реагирующих веществ
4. При повышении температуры на каждый 10 С, скорость
большинства реакций увеличивается в 2-4 раза. [Правило ВантГоффа]
5. От наличия катализаторов и ингибиторов.
12.
Химическое равновесиеХимическое равновесие характерно для реакций, способных
протекать в прямом и обратном направлениях, т.е. из исходников
образуются продукты, но и реакция продуктов с образованием
исходников протекает.
SO2 + O2 <-> 2SO3
H2O + SO2 <-> H2SO3
N2 + 3H2 <-> 2NH3
Такие химические системы находятся в равновесии, когда скорость
прямой и обратной реакции равны.
Равновесное состояние системы сохранится, пока не поменяются
условия.
13.
Химическое равновесиеВ случае изменения условий протекания реакции, в силу вступает
принцип Ле Шателье:
«При изменении внешних условий химическое равновесие
смещается в сторону той реакции (прямой или обратно), которая
ослабляет это внешние воздействие.
CH4 + 2O2 = CO2 + 2H2O + 891кДж
Т











 chemistry
chemistry








