Similar presentations:
Р-элементы VI A группы
1.
р-ЭЛЕМЕНТЫ VI A ГРУППЫПолные электронные формулы атомов халькогенов:
22s22р4;
O:
1s
8
22s22р63s23р4;
S:
1s
16
22s22р63s23р63d104s24р4;
Se:
1s
34
22s22р63s23р63d104s24р64d105s25р4
Te:
1s
52
Сокращенная электронная конфигурация …ns2np4
2s
O
2p
3s
S
3p
3d
2.
До завершения внешнего р-подуровня атомамне хватает по два электрона
O: степени окисления: -2,-1, +1,+2
S: степени окисления: -2,+2, +4, +6
3d
3p
3d
3s
3p
*
S
3s
S**
3.
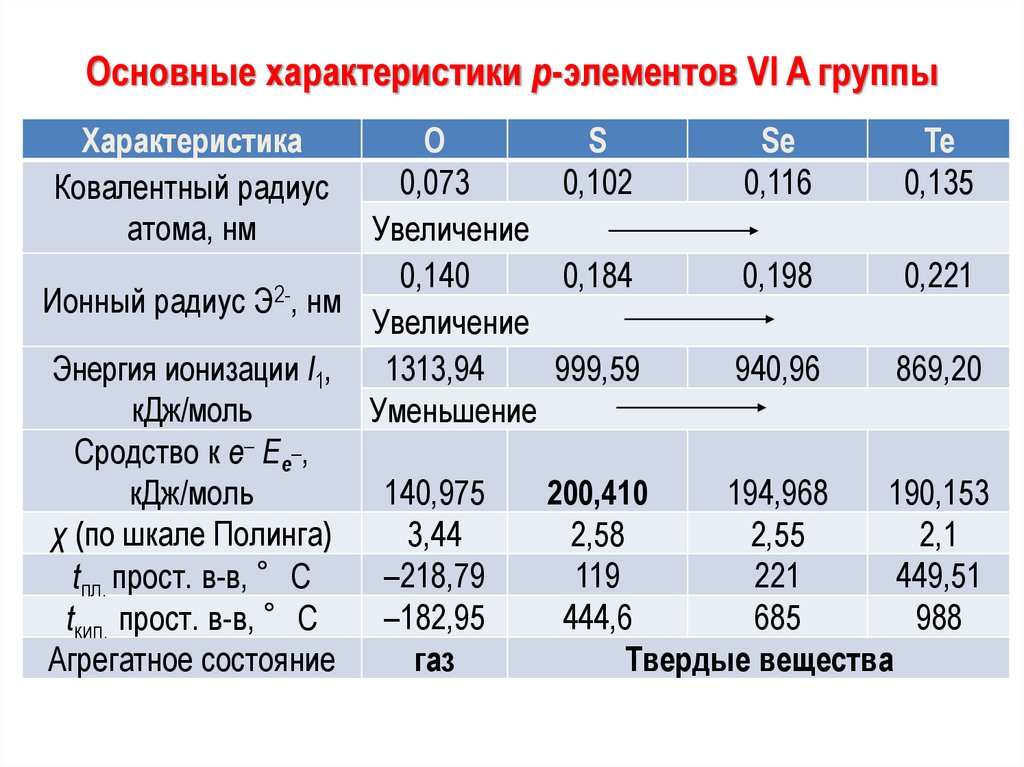
Основные характеристики р-элементов VI A группыХарактеристика
Ковалентный радиус
атома, нм
O
S
Se
Te
0,073
0,102
0,116
0,135
Увеличение
0,140
0,184
0,198
0,221
2Ионный радиус Э , нм
Увеличение
Энергия ионизации I1,
1313,94
999,59
940,96
869,20
кДж/моль
Уменьшение
Сродство к е– Ее_,
кДж/моль
140,975
194,968
190,153
200,410
χ (по шкале Полинга)
3,44
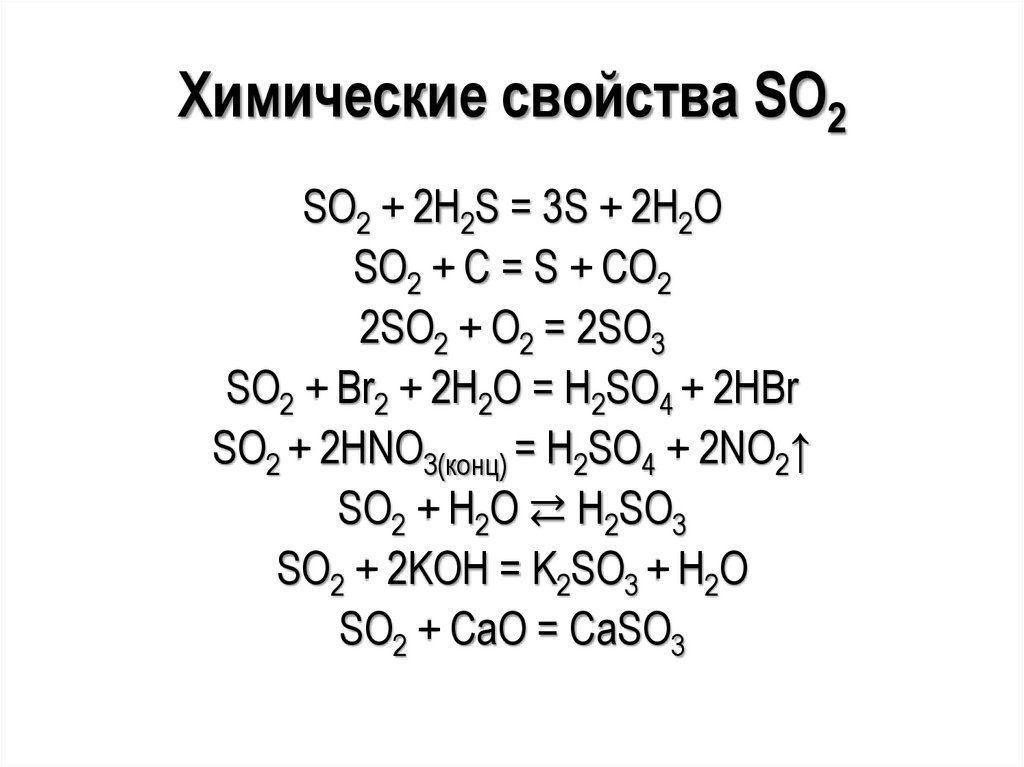
2,58
2,55
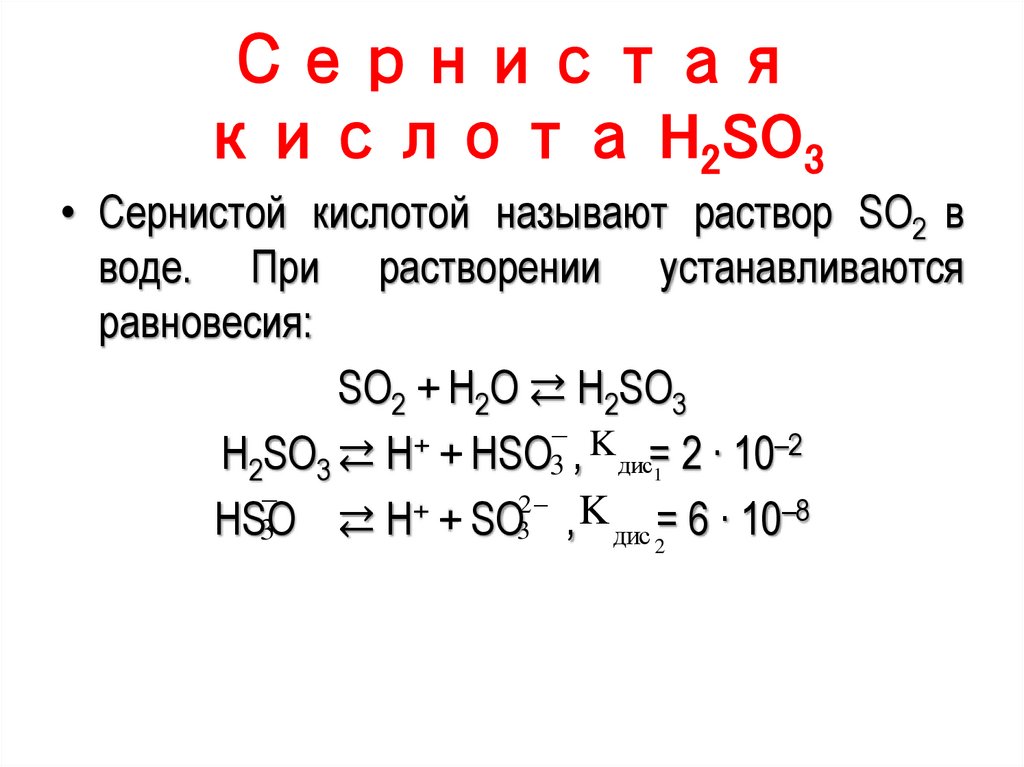
2,1
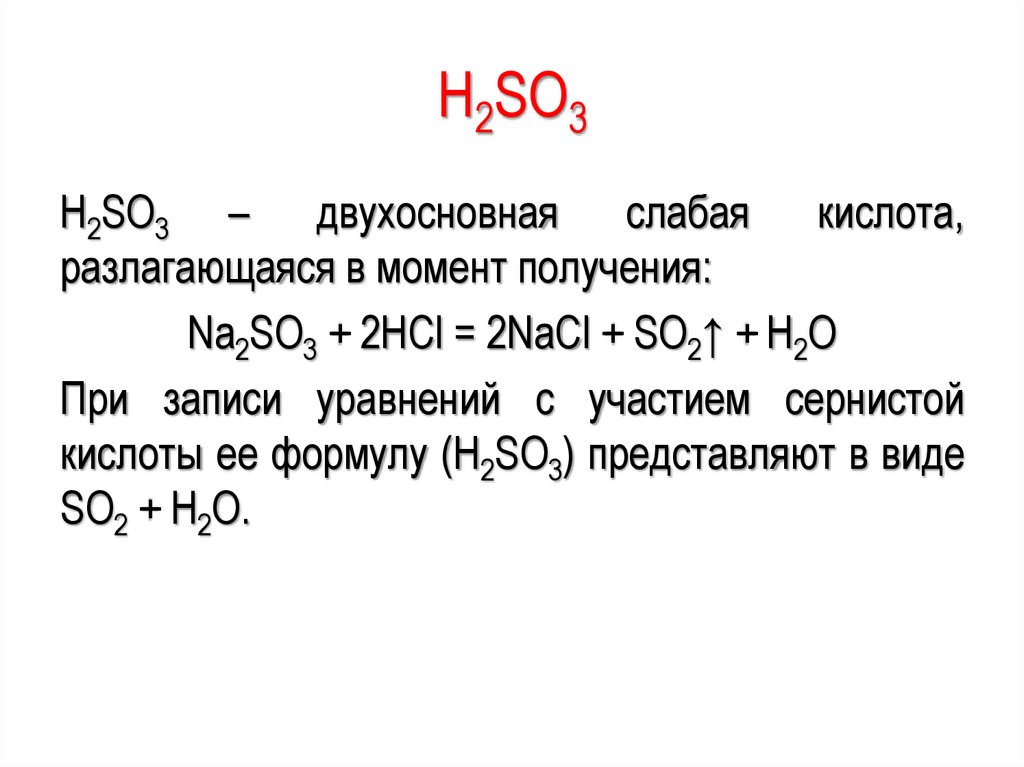
–218,79
119
221
449,51
tпл. прост. в-в, °С
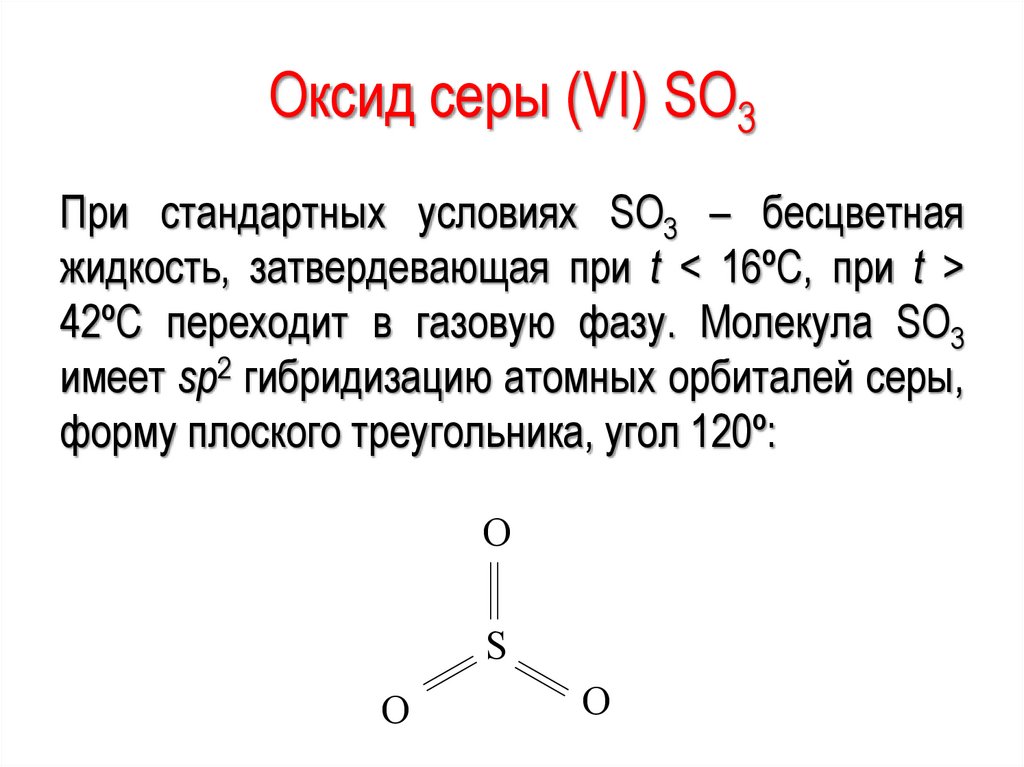
–182,95
444,6
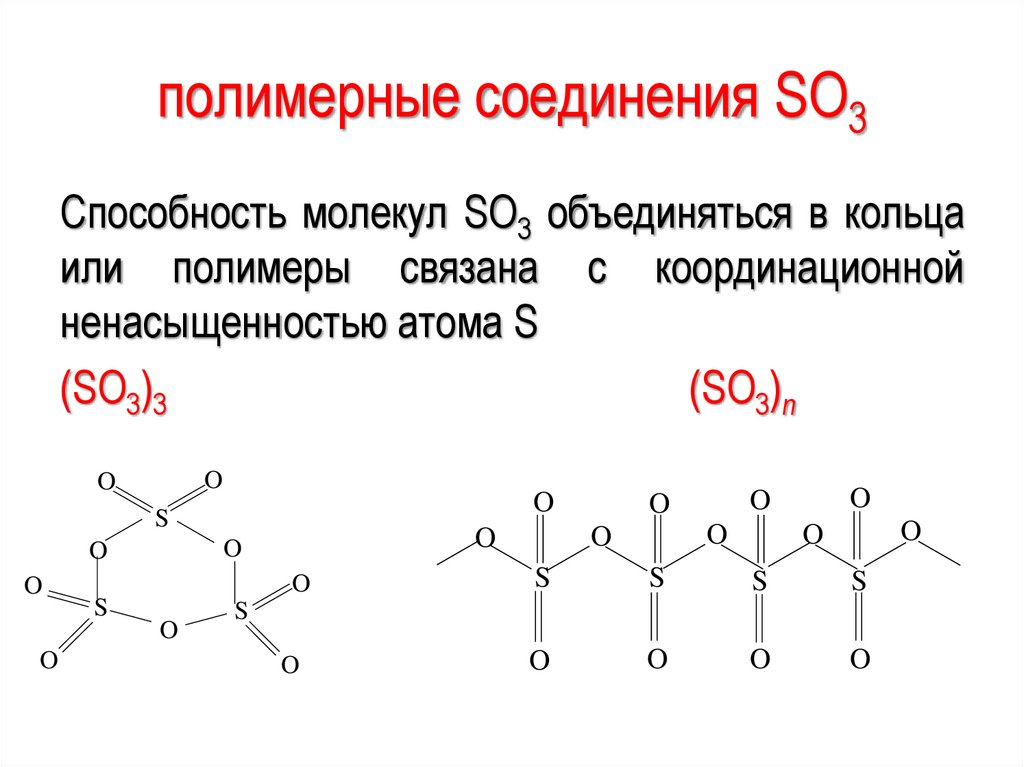
685
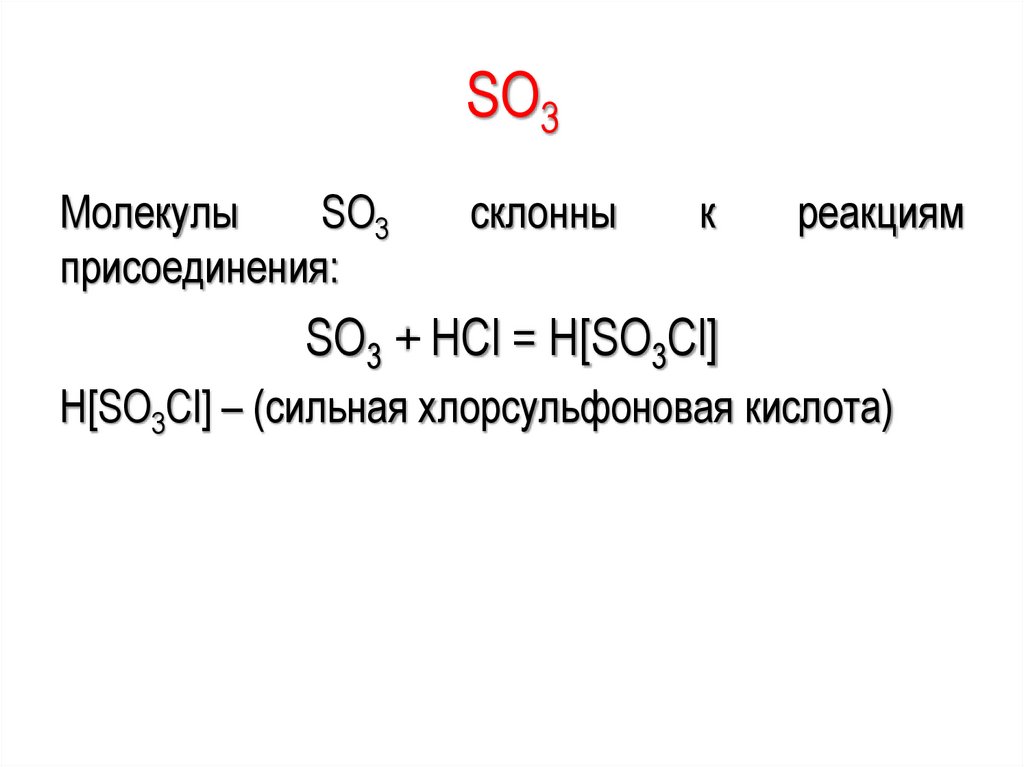
988
tкип. прост. в-в, °С
Агрегатное состояние
газ
Твердые вещества
4.
Аллотропия кислородаВ-во
Кислород О2
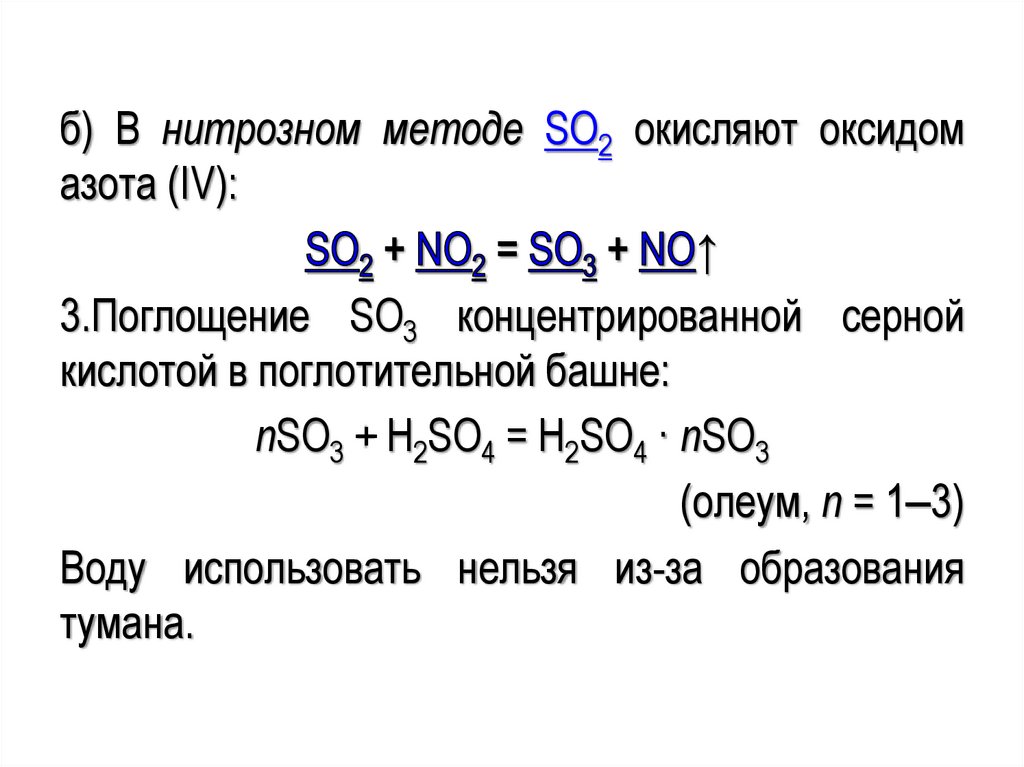
Озон О3
Цвет
Бесцветный,
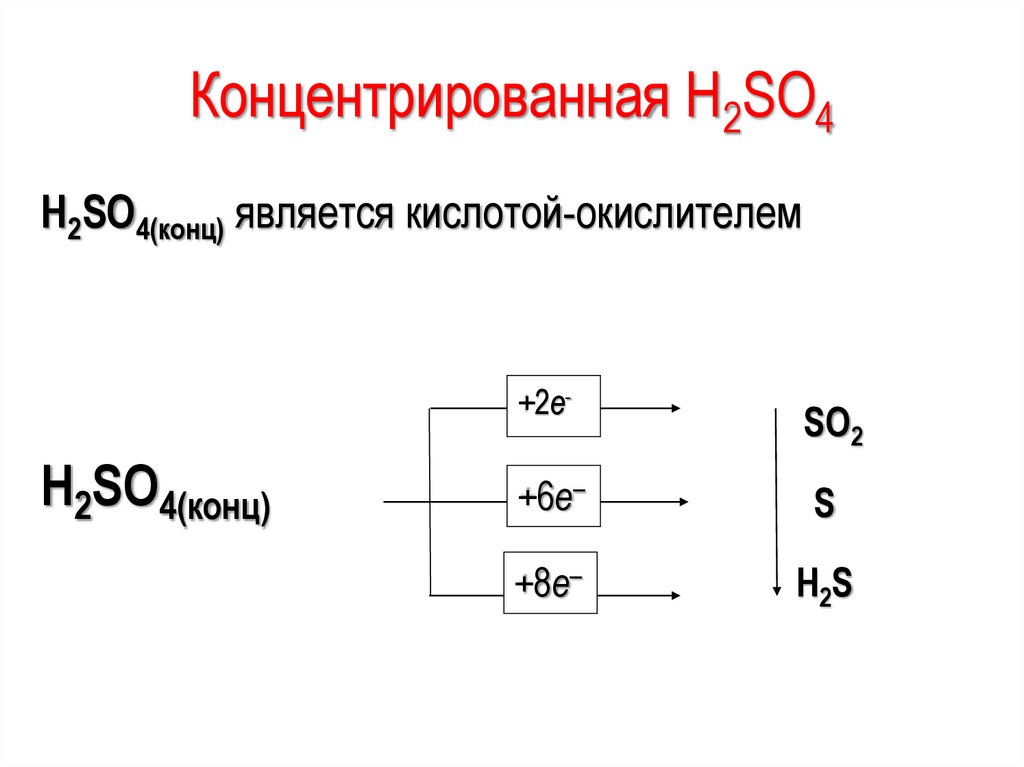
в жидком состоянии
голубой
Бесцветный,
в жидком состоянии
синий
Запах
Без запаха
Характерный резкий
запах
tпл, °С
–218,79
–251
tкип, °С
–182,95
–112
5.
Получение кислорода впромышленности
• 1) фракционная перегонка
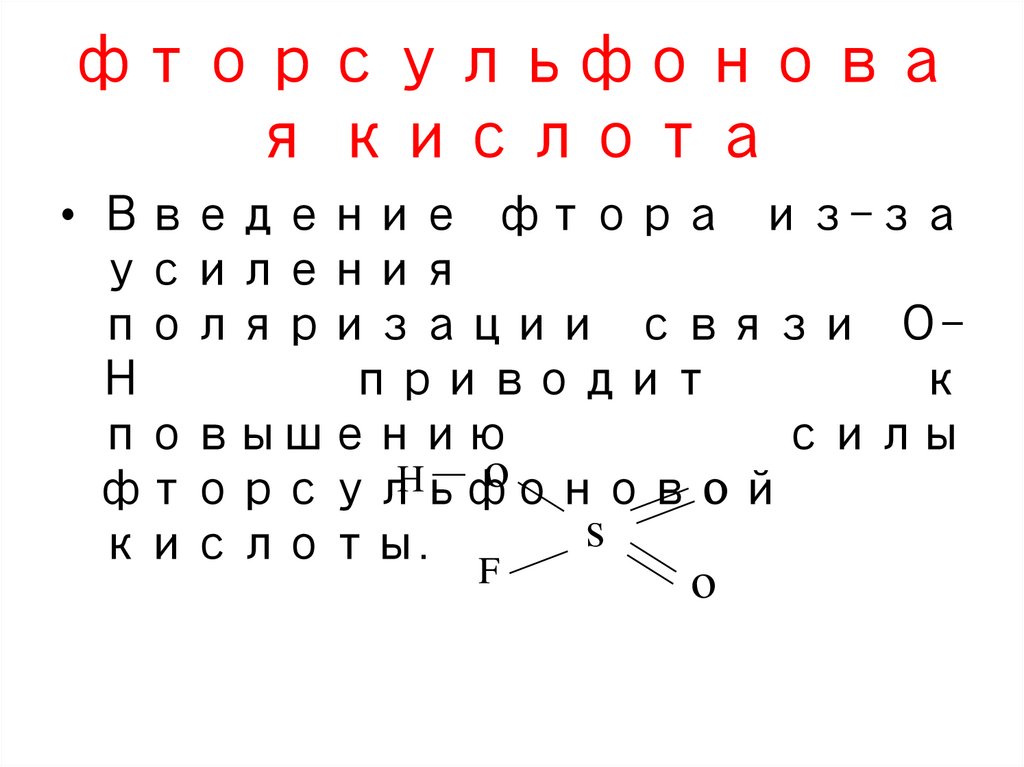
жидкого воздуха (tкип(O2) =
‒182,95oC), tкип(N2) = ‒195,79oC);
• 2) электролизом водных
растворов
щелочей,
который
сводится
к
электролизу H2O. Щелочь
необходима
для
электропроводности
Электролиз
раствора
:
катод ⊝: 2H2O + 2e– = H2 + 2OH–
анод ⊕: 4OН– – 4e– = O2 + 2H2O
6.
Получение кислорода в лабораториипрокаливание легко разлагающихся
кислородсодержащих веществ
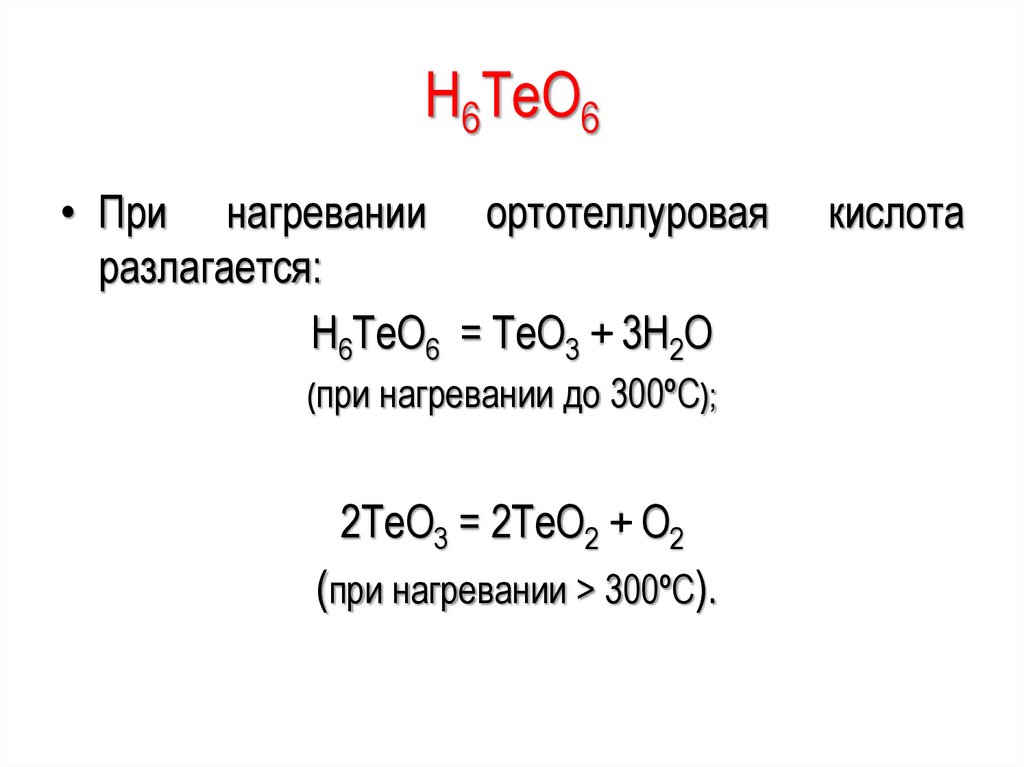
(H2O2, KClO3, HgO, KNO3, KMnO4):
2HgO = 2Hg + O2
2KMnO4 = K2MnO4 + MnO2 + O2
2KСlО3 = 2KСl + 3О2
2KNО3 = 2KNО2 + О2
7.
2BaO2 = 2BaO + О22H2O2 = 2H2O + O2
2Na2O2 + 2CО2 = 2Na2CO3 + O2
4KO2 + 2CО2 = 2K2CO3 + 3O2
8.
Получение озонаОзон получают из кислорода под
действием электрического разряда:
3O2 Электрический разряд 2O3
9.
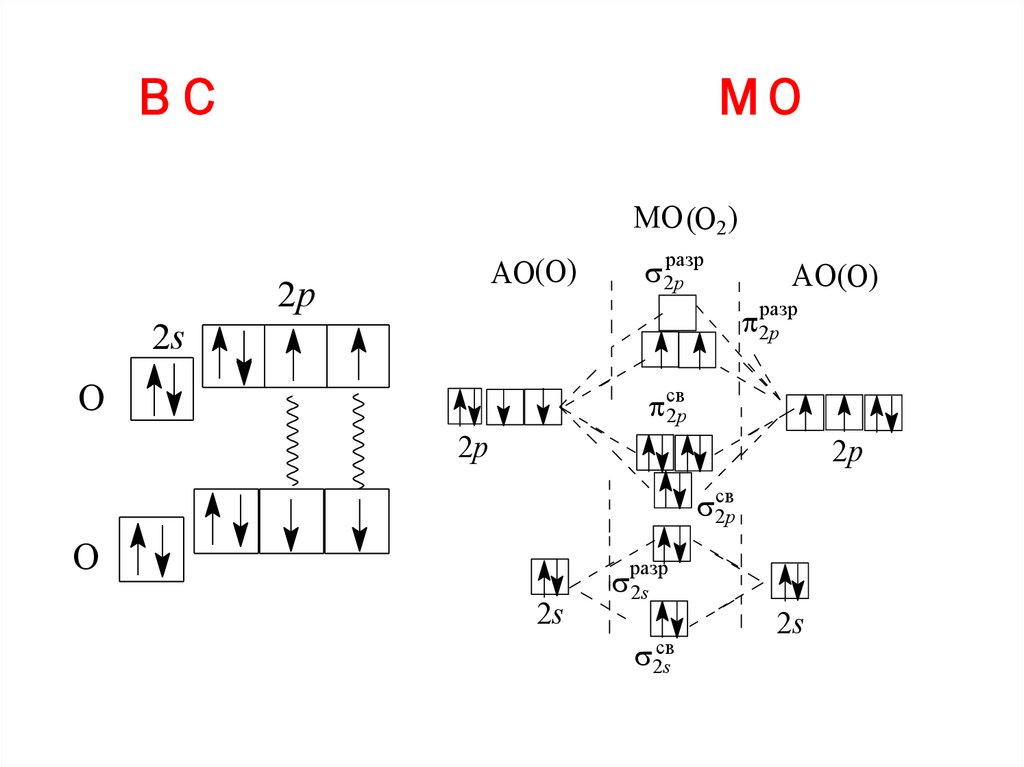
O2 в соответствии с методами ВС и МОВ соответствии с методом ВС порядок
связи в молекуле O2 равен 2,
неспаренные электроны отсутствуют.
Однако жидкий кислород обладает
парамагнитными свойствами, втягивается
в магнитное поле, следовательно, у него
есть неспаренные электроны.
Более правильно объясняет строение
молекулы О2 метод молекулярных
орбиталей.
10.
ВСМО
МО (O2 )
АО(O)
2p
разр
2p
АО(O)
разр
2p
2s
O
св
2p
2p
2p
св
2p
O
2s
разр
2s
2sсв
2s
11.
Порядок (кратность) связи в молекуле кислорода исоответствующих молекулярных ионах кислорода
2
О ,
2,5
Порядок связи
2
О2 ,
2
О 2 ,
1,5
О 22
1
диоксигенил-катион О ‒ самая прочная из всех частиц.
О2
в соединении O2[PtF6] – гексафтороплатинат (V)
диоксигенила.
О2 (существует в надпероксидах)
K + O2 = K+O2 (надпероксид калия)
2
О 2 с одинарной слабой связью содержится в пероксидах:
2Na + O2 = Na2O2 (пероксид натрия)
12.
Химические свойства кислородаПри обычных условиях кислород относительно неактивен
(двойная связь О=О).
При нагревании кислород реагирует с большинством
простых веществ. Исключение – благородные газы,
галогены, благородные металлы (Ag, Au, Pt).
13.
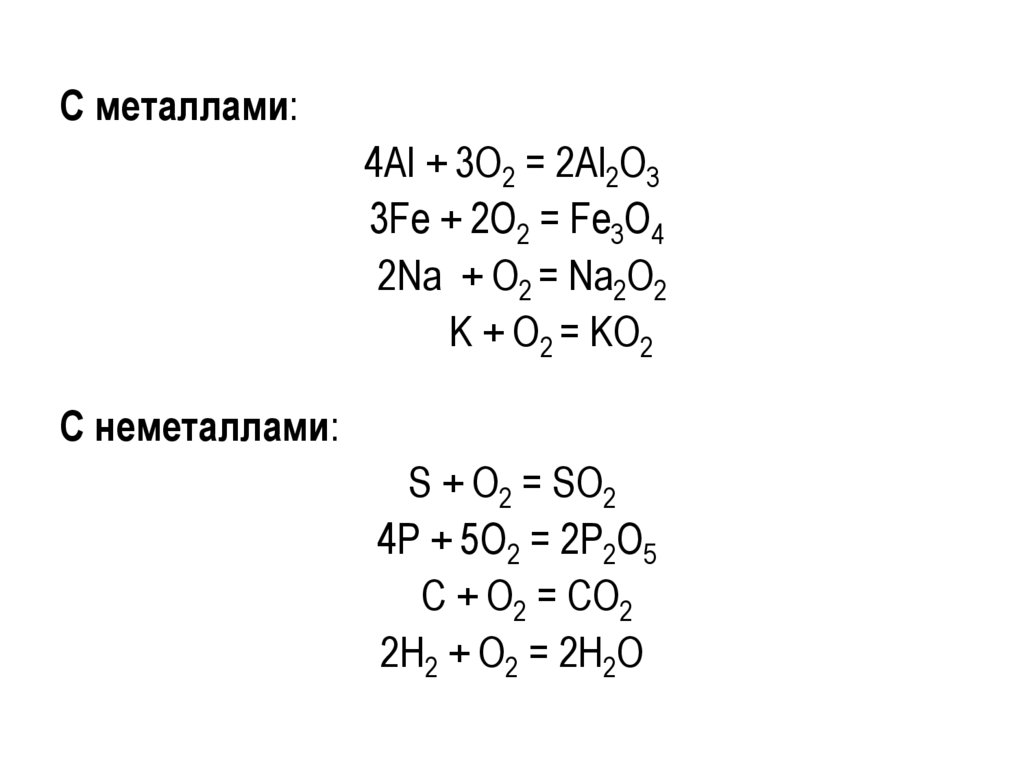
С металлами:4Al + 3O2 = 2Al2O3
3Fe + 2O2 = Fe3O4
2Na + O2 = Na2O2
K + O2 = KO2
С неметаллами:
S + O2 = SO2
4Р + 5О2 = 2Р2О5
С + О2 = СО2
2Н2 + О2 = 2Н2О
14.
Окисление водородных соединений металлов инеметаллов
2LiН + О2 = 2LiOН
4NН3 + 3О2 = 2N2 + Н2О
2Н2S + 3О2 = 2SО2 + 2Н2О
СН4 + 2О2 = СО2 + 2Н2О
Окисление сульфидов
2CuS + 3O2 = 2CuO + 2SO2
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
15.
Озон – сильнейший окислительОкислительная способность O3 обусловлена
нестойкостью
его
молекул,
образованием
атомарного кислорода, который активнее молекулы
кислорода О2:
O3 ⇄ O2 + O, Н0 = –142 кДж.
Озон окисляет почти все металлы, неметаллы,
обесцвечивает красители, убивает микробы. При
высоких концентрациях – яд.
16.
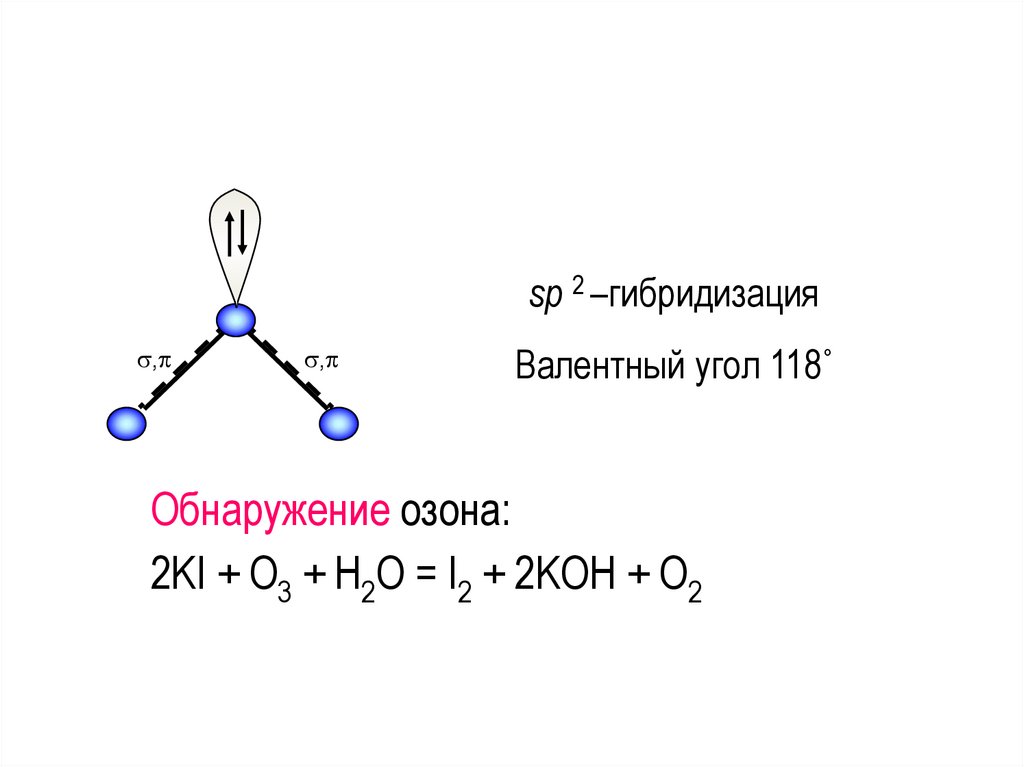
Строение озонаУгловое строение (sp2-гибридизация).
В результате делокализации π-связи образуется трехцентровая
двухэлектронная связь с концевыми атомами кислорода.
Озон существует в нескольких таутомерных формах. Срединному
атому кислорода приписывается степень окисления, равная +4,
концевым атомам –2.
2s
O
O
O*
2p
_
..
O
..
+
..
O
..
O
..
O
+
..
O
+4
_
..
O
..
-2
O
O
-2
O
17.
sp 2 –гибридизация,
,
Валентный угол 118˚
Обнаружение озона:
2KI + O3 + H2O = I2 + 2KOH + O2
18.
Химичесие свойства О3Озон – сильнейший окислитель
2Ag + O3 = Ag2O + O2
PbS + 2O3 = PbSO4 + O2
2KOH + 7/3O3 = O2 + 2KO3 + H2O
19.
Применение озона• При обработке питьевой воды. Уничтожает
микроорганизмы, устраняет неприятный вкус и
запах у воды, содержащей пахучие вещества
(сероводород, сернистые соединения и т. д.).
• Для
обеззараживания
сточных
вод,
содержащих цианиды и фенолы.
• Для уничтожения запаха у жиров и масел.
• Как
дезодоратор
в
системах
кондиционирования воздуха.
20.
• Малое содержание озона придает воздухуприятный освежающий запах, повышение
содержания озона в воздухе вызывает
раздражение дыхательных путей и становится
опасным для жизни.
• Озон ослабляет работу легких.
21.
Озоновый слой• Располагается на высоте около 25 км от земной
поверхности.
• Образуется за счет поглощения кислородом
ультрафиолетового излучения Солнца.
• ограничивает поток ультрафиолетового излучения,
падающего на Землю. Увеличение интенсивности
ультрафиолетового излучения, достигающего Землю,
могло бы привести к возрастанию заболеваний раком
кожи
22.
23.
озоновый слой разрушается• под
воздействием
хлорфторуглеводородов
(охлаждающие
жидкости
холодильников
и
кондиционеров, растворители, аэрозоли, спреи и
огнетушители).
• В меньшей степени запуск космических ракет,
полёты реактивных самолётов в высоких слоях
атмосферы,
испытания
ядерного
оружия,
сокращение лесных угодий планеты.
• Утончению
озонового
слоя
способствует
глобальное потепление.
24.
Вода• Молекула воды имеет угловое строение в
виде равнобедренного треугольника с
атомом кислорода в вершине. Угол НОН =
104,5°.
• В соответсвии с методом ВС орбитали
атома кислорода находятся в sp3гибридном состоянии:
25.
2p2s
O
H1s H1s
26.
Физические свойства воды• жидкость без вкуса и запаха. В тонком слое она
бесцветна. При толщине более 2 м вода
приобретает голубоватый оттенок. Температура
плавления ‒ 0°С, температура кипения ‒
+100°С, что значительно выше, чем у H2S,
H2Se, H2Te. Аномально высокие температуры
плавления и кипения воды объясняются
существованием водородных связей между
молекулами.
27.
...
..
.
О
..
.
.
О
..
Н.
.
Н
.
.
.
О
.
.
О
.
.
.
Н
.
.
Н.
.
.
О
.
.
.
28.
Аномалия плотности воды• При образовании водородных связей в
алмазоподобной структуре льда образуются
пустоты. Поэтому лед имеет меньшую
плотность, чем жидкая вода.
• Плавление льда сопровождается частичным
разрушением водородных связей и заполнением
пустот молекулами воды. Плотность жидкой
воды
при
Р = 1,013 · 105 Па имеет максимальное значение
1 г/см3 при +4°С.
29.
Самоионизация воды+
–
Н2О ⇄ Н + ОН
или 2Н2О ⇄ Н3О+ + ОН–
• В чистой воде при стандартной температуре
концентрации ионов водорода (гидроксония) и
гидроксид-ионов равны:
С(Н+) = С(ОН–) = 10–7моль/л;
рН чистой воды при 25°С = 7.
30.
Химическиесвойства воды
Взаимодействие
cо
щелочными
и
щелочноземельными металлами:
Ca + 2H2O = Ca(OH)2 + H2
Mg + 2H2O (t) = Mg(OH)2 + H2
3Fe + 4H2O (t) = Fe3O4 + 4H2
С амфотерными элементами в
присутствии
щелочей:
2Al + 6H2O + 6NaOH = 2Na3[Al(OH)6] + 3H2
31.
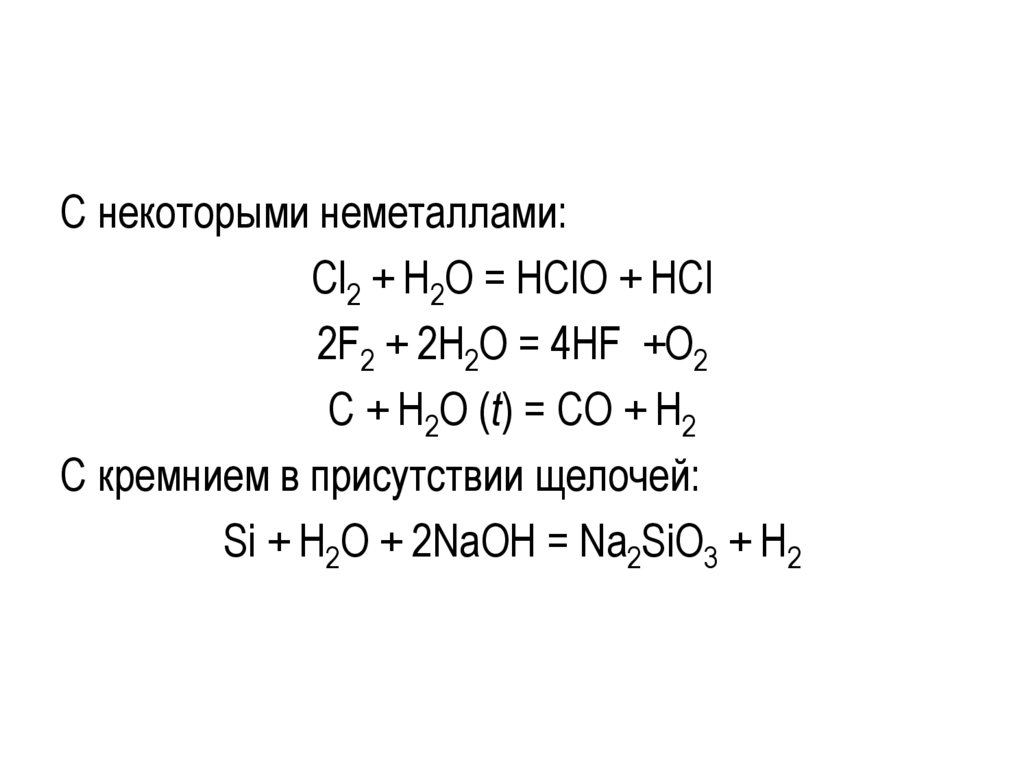
С некоторыми неметаллами:Cl2 + H2O = HClO + HCl
2F2 + 2H2O = 4HF +O2
C + H2O (t) = CO + H2
С кремнием в присутствии щелочей:
Si + H2O + 2NaOH = Na2SiO3 + H2
32.
Со сложными веществами:CaO + H2O = Ca(OH)2
P2O5 + 3H2O = 2H3PO4
KH + H2O = KOH + H2
Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3
Ca2Si + 4H2O = 2Ca(OH)2 + SiH4
Na2CO3 + H2O ⇄ NaHCO3 + NaOH
33.
Пероксид водорода Н2О2Строение
H2O2
Молекула H2O2 неплоская, имеет
строение H−O−O−H с σ-связью
O−O на ребре и σ-связями H–O на
плоскостях двугранного угла.
Степень окисления кислорода
равна −I, валентность атома O
равна 2. Группу –O–O– называют
пероксогруппой.
34.
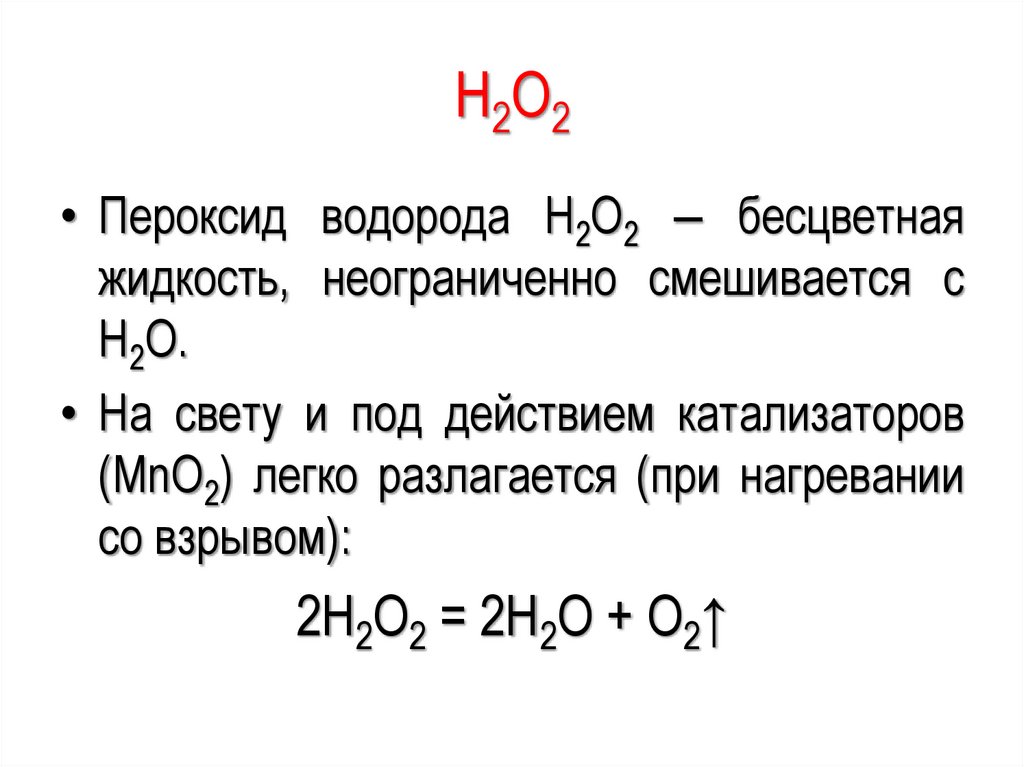
H2O2• Пероксид водорода H2O2 ‒ бесцветная
жидкость, неограниченно смешивается с
H2O.
• На свету и под действием катализаторов
(MnO2) легко разлагается (при нагревании
со взрывом):
2H2O2 = 2H2O + O2↑
35.
Пероксид водорода в водных растворахВ водных растворах пероксид водорода
значительно устойчивее и является слабой
кислотой:
H2O2 ⇄ Н+ + НО2– (Kдис= 1,4·10–12)
H2O ⇄ Н+ + ОН– (Kдис = 1,8 · 10–16)
36.
Ионизация по второй ступени в воднойсреде практически не протекает. Как
кислота H2O2 реагирует со щелочами:
2NaOH + Н2О2 = Na2О2 + 2Н2О
37.
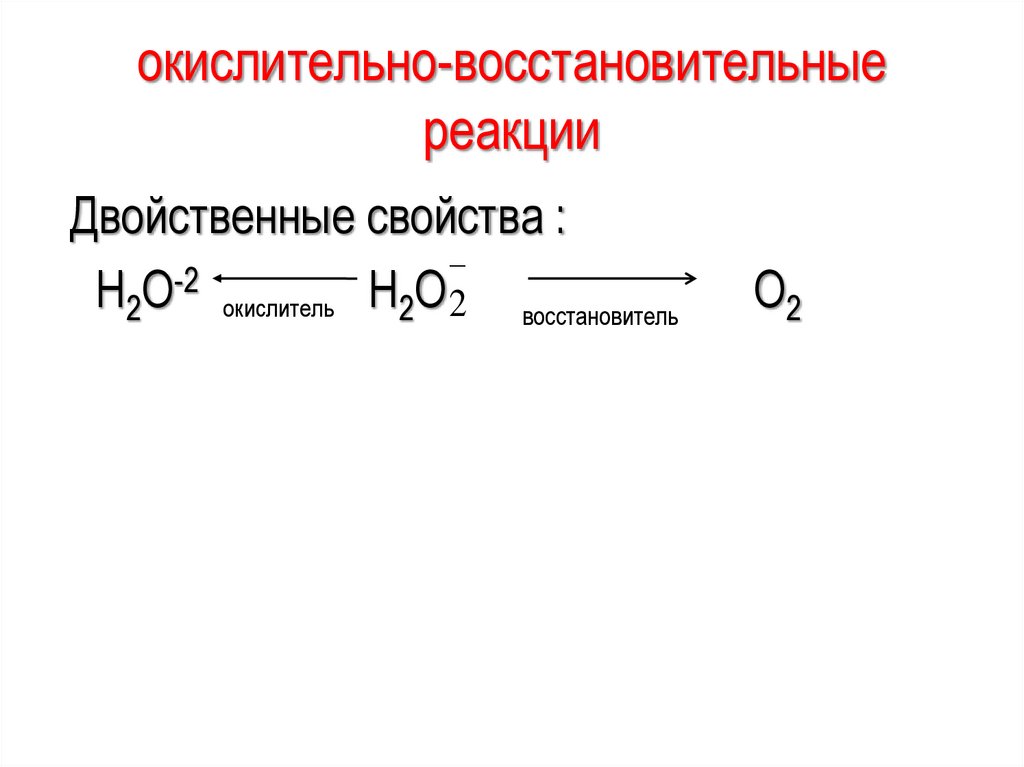
окислительно-восстановительныереакции
Двойственные свойства :
-2
Н2О окислитель Н2О 2 восстановитель
О2
38.
Примеры ОВР с Н2О2 какокислителя:
Н2О2 + 2KI + H2SO4 = I2+ K2SO4+2Н2О
Н2О2 + 2KI = 2KOH + I2
Н2О2 + 2Н+ + 2ē = 2Н2О; Е˚ = 1,776 В
(в кислой среде);
Н2О2 + 2ē = 2ОН–; Е˚ = 0,88 В
(в щелочной среде)
39.
Пример ОВР с Н2О2 каквосстановителя
2KMnO4 + 5Н2О2 + 3H2SO4 = 2MnSO4 +
+ K2SO4 + 5O2 + 8Н2О
Н2О2 – 2ē = О2 + 2Н+; Ео = 0,695 В
(в кислой среде);
40.
Получение Н2О2В
промышленности.
Электролиз
50%-ного
раствора
H2SO4
с
последующим
2
2
гидролизом
4
8
пероксодисерной
кислоты:
A ⊕: 2SО – 2ē = S2О , Е0 =2,01 В;
Н2S2O8 + 2Н2О = 2H2SO4 + Н2О2↑
41.
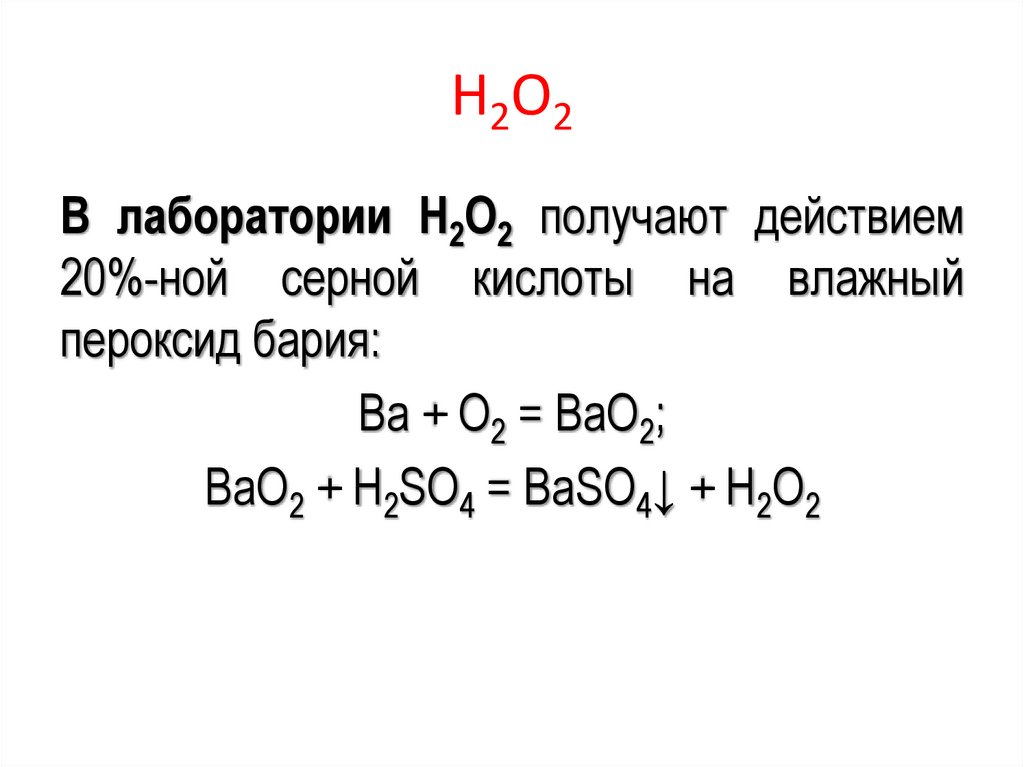
Н 2 О2В лаборатории Н2О2 получают действием
20%-ной серной кислоты на влажный
пероксид бария:
Ва + О2 = ВаО2;
ВаО2 + H2SO4 = ВаSO4↓ + Н2О2
42.
Применениепероксида водорода
• В
качестве
обесцвечивающего
и
отбеливающего
средства.
• В
медицине
как
дезинфицирующего
средства.
• Пероксид
водорода
применяется
как
кровоостанавливающ
43.
• В медицинской практике пероксид водородаприменяется как наружное средство в качестве
антисептика.
Антисептическое
действие
обусловливается окислительными свойствами
пероксида водорода, который выделяет
кислород в присутствии ферментов – каталазы
крови. Каталаза быстро разлагает пероксид
водорода, при этом бурно выделяется кислород,
что создает видимость пены.
44.
Производные Н2О2 – пероксосоединенияВ их структуре существует пероксидная цепочка
(−О–О−). Пероксокислоты образуются при
замещении атома водорода в молекуле Н2О2 на
кислотные радикалы, например:
H
O
H
O
O
O
O
S
O
O
H
O
S
O
O
O
S
O
O
H
45.
Пирит FeS2Халькопирит CuFeS2
Сфалерит (цинковая обманка) ZnS
Галенит (свинцовый блеск) PbS …
Гипс CaSO4 · 2H2O
Мирабилит Na2SO4 · 10H2O …
Пирит
Галенит
Халькопирит
46.
Сера• При
стандартных
условиях
простое
вещество
сера
представляет
собой
порошок
или
кристаллы
желтого
цвета
47.
Катенация• Способность связываться друг с другом в кольца
или цепи объясняется энергиями связей.
Свя
зь
Э=Э
Кис О=О
лор
од
Сер S=S
Энерг Связ
ия E,
ь
кДж/мо Э–Э–Э
ль
Энергия E,
кДж/моль
493,6
О–О–
О
146 · 2 = 292
421,3
S–S–S
265 · 2 = 530
48.
образование двух одинарных σ-связей для серывместо одной двойной связано с выигрышем в
энергии
(530 – 421 = 108,7 кДж).
• Для кислорода, напротив, одна двойная связь
энергетически предпочтительнее
(494 – 292 = 201,6 кДж), чем две одинарные.
для кислорода катенация ограничивается
небольшим числом нестойких соединений
(например, озон O3)
49.
Аллотропные модификации серы• ромбическая, моноклинная и пластическая.
Гомоцепи серы имеют зигзагообразную форму,
поскольку в их образовании принимают участие
электроны взаимно перпендикулярных рорбиталей. При комнатной температуре
устойчива ромбическая сера. Молекула S8 имеет
форму короны
S
S
S
S
S
S
S
S
50.
Поведение при нагревании• При плавлении кристаллов серы (tпл = 119ºС)
разрываются слабые межмолекулярные связи и
освобождаются
циклические
молекулы
S 8,
приобретающие при этом легкую подвижность.
Вязкость расплава в этих условиях меньше
вязкости воды. При 159,4ºС все свойства жидкой
серы изменяются скачкообразно (теплоемкость,
плотность,
цвет,
электропроводность,
поверхностное натяжение и др.). Особенно резко
меняется вязкость расплава, которая при
нагревании до 195ºС возрастает в 10 тысяч раз
(расплав перестает выливаться из пробирки).
51.
Это связано с процессом полимеризации,результате которой образуются гомоцепи:
цикл S8 → цепь S8;
цепь S8 + цикл S8 → цепь S16 и т. д.
в
В результате полимеризации образуются цепи длиной
более 200 тысяч атомов серы. При дальнейшем
нагревании вязкость расплава понижается из-за
начинающейся деполимеризации. Цепи постепенно
укорачиваются до ~1000 атомов при 400ºС и до ~100
атомов при 600ºС.
52.
Выше 445ºС давление насыщенного паранад жидкой серой превышает 105 Па (1атм).
В газообразном состоянии присутствуют все
молекулы Sn (2 ≤ n ≥ 10), включая молекулы
с нечетным числом атомов.
53.
Получение серы в промышленности• из самородной серы путем отделения ее от
пустой породы. Это достигается выплавлением
серы с помощью горячей воды (при повышенном
давлении, так как сера плавится при 119° С)
• из газов, содержащих Н2S и SO2:
2H2S + O2 = 2S + 2H2O
2H2S + SO2 = 2H2O + 3S
54.
Химические свойства серыВзаимодействие c металлами:
2K + S = K2S
Cu + S = CuS
Hg + S = HgS (комнатная температура
С неметаллами:
C + 2S = CS2
2P + 5S = P2S5
S + 3F2 = SF6
55.
Химические свойства серыС водородом
С кислородом
H2 + S = H2S
S + O2 = SO2
Со сложными веществами
S + 2HNO3 = 2NO + H2SO4
S + 2H2SO4(конц) = 3SO2 + 2H2O
S + K2Сr2O7 = K2SO4 + Cr2O3
3S + 6KOH = K2SO3 + 2K2S + 3H2O
56.
Сероводород H2SБесцветный газ, с сильным характерным запахом
тухлых
яиц.
tпл = ‒86°С, tкип = ‒60°С, плохо растворим в
воде, хорошо растворим в спирте. Очень ядовит.
При растворении в воде образует слабую
двухосновную
сероводородную
кислоту.
Диссоциация сероводородной кислоты протекает
обратимо и ступенчато:
57.
I ступеньH2S ⇄ H+ + HS‒; KI = 6 ∙ 10‒8;
II ступень
HS‒ ⇄ H+ + S2‒; KII = 1 ∙ 10‒14
H2S + 2KOH = K2S + 2H2O
H2S + KOH = KHS + H2O
H2S + CuSO4 = CuS↓ + H2SO4
58.
Получение H2SВ промышленности прямым синтезом:
H2 + S = H2S
H2S в лаборатории:
FeS + 2HCl(конц) = FeCl2 + H2S;
4Ca + 5H2SO4(конц) = 4CaSO4 + 4H2O + H2S
59.
Получение сульфидовИз растворов солей по реакции ионного обмена:
Pb(NO3)2 + (NH4)2S = PbS↓ + 2NH4NO3
60.
классификация сульфидовNa2S MgS
Основные
Al2S3
SiS2 P2S5
aмфотерный
Кислотные
Na2S + H2O = NaHS + NaOH (рН > 7)
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
SiS2 + 3H2O = H2SiO3 +2H2S (рН < 7)
61.
Cульфиды• Различные
по
характеру
сульфиды
взаимодействуют между собой:
Na2S + CS2 = Na2CS3
тиокарбонат натрия;
As2S3 + 3Na2S = 2Na3AsS3
62.
сульфиды меди (II), серебра и свинца (II)– черные
• PbS
Свинцовый блеск
Ag2S
63.
FeS2 (пирит)64.
Сфалерит (цинковая обманка) – ZnSЦвет и внешний вид минерала могут
значительно отличаться
65.
HgS киноварь66.
67.
Качественные реакции• Осаждение из растворов характерно окрашенных
сульфидов металлов с очень малой растворимостью
используют как качественные реакции.
• Для
доказательства
присутствия
следов
сероводорода в воздухе (или растворе) применяют
пропитанную раствором ацетата свинца бумагу,
которая при наличии H2S чернеет из-за образования
сульфида свинца:
Н2S + Рb(СН3СОО)2 = РbS↓ + 2СН3СООН
68.
Классификация сульфидовпо растворимости
1. Растворимые в воде – сульфиды щелочных
металлов (Na2S, K2S).
2. Нерастворимые в воде, но растворимые в
соляной и разбавленной серной кислоте (ZnS,
MnS, FeS):
FeS + 2HCl FeCl2 + H2S
3. Нерастворимые в воде и кислотах (PbS, CuS,
HgS и др.), реагируют с кислотами-окислителями:
CuS + 8HNO3 = CuSO4 + 8NO2 + 4H2O
69.
Окисление H2S и сульфидовH2S + 4Br2 + 4H2O = H2SO4 + 8HBr
3H2S + H2SO4 = 4S + 4H2O
2H2S + O2 = 2S + 2H2O
2H2S + 3O2(изб) = 2SO2 + 2H2O
H2S + I2 = 2HI + S
H2S + 2HNO3(конц) = S↓ + 2NO2↑ + 2H2O
2ZnS + O2(нед) = 2ZnO + 2S
MnS(т)+ 8HNO3(конц)=MnSO4+ 8NO2↑+ 4H2O
70.
Сульфаны (полисульфидыводорода)
Общая
формула
сульфанов
(n = 1‒8): H2S2, H2S3, H2S4 и т. д.
S
H
S
S
H2Sn
S
S
Получение сульфанов:
Na2S + S = Na2S2
Na2S + 2S = Na2S3
Na2S3 + 2HCl = H2S3 + 2NaCl
H
71.
Сульфаны• Сульфаны – это желтые, вязкие жидкости с
резким запахом, растворимые в растворах
щелочей с образованием полисульфидов
щелочных металлов. В воде сульфаны
проявляют свойства более сильных кислот, чем
H2S.
• Соответствующие соли – полисульфиды –
используются, как пестициды.
72.
Кислородсодержащие соединениясеры.
Оксид серы (IV) SO2. Центральный атом серы в
состоянии sp2-гибридизации
2s
O
S
O*
2p
S
o
O 119,5 O
73.
Физические свойства• При обычных условиях оксид серы (IV) или
сернистый газ – бесцветный газ с резким
удушливым запахом, температура плавления
равна ‒75°С, температура кипения равна
‒10°С.
• SO2 хорошо растворим в воде: при 20°С в 1
объеме воды растворяется 40 объемов
сернистого газа.
74.
Получение SO2• В промышленности:
S + O2 = SO2
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
• В лаборатории:
BaSO3+ H2SO4(конц)= BaSO4↓ + SO2↑+H2O
2H2SO4(конц) + Cu = SO2↑ + CuSO4 + 2H2O
75.
Химические свойства SO2SO2 + 2H2S = 3S + 2H2O
SO2 + C = S + CO2
2SO2 + O2 = 2SO3
SO2 + Br2 + 2H2O = H2SO4 + 2HBr
SO2 + 2HNO3(конц) = H2SO4 + 2NO2↑
SO2 + H2O ⇄ H2SO3
SO2 + 2KOH = K2SO3 + H2O
SO2 + CaO = CaSO3
76.
На прямом солнечном свету SO2 соединяется схлором, образуя S(Cl2)O2 – диоксид-дихлорид серы
сульфурилхлорид:
SO2 + Сl2 = SO2Cl2
SO2Cl2 – бесцветная жидкость с резким запахом,
является хлорангидридом серной кислоты, легко
гидролизуется:
SO2Cl2 + 2H2O = H2SO4 + 2НСl
77.
Сернистаякислота H2SO3
• Сернистой кислотой называют раствор SO2 в
воде. При растворении устанавливаются
равновесия:
SO2 + H2O ⇄ H2SO3
K
+
H2SO3 ⇄ H + HSO3 , дис=1 2 ∙ 10–2
+ + SO2 , K
–8
HSO
⇄
H
=
6
∙
10
3
3
дис 2
78.
H2SO3H2SO3 – двухосновная слабая кислота,
разлагающаяся в момент получения:
Na2SO3 + 2HCl = 2NaCl + SO2↑ + H2O
При записи уравнений с участием сернистой
кислоты ее формулу (H2SO3) представляют в виде
SO2 + H2O.
79.
H2SO3Образует средние соли (сульфиты) и кислые соли
(гидросульфиты):
SO2 + 2KOH = K2SO3 + H2O
SO2 + KOH(нед) = KНSO3
При нагревании сульфиты диспропорционируют:
4Na2SO3 (t)= 3Na2SO4 + Na2S
80.
Окислительно-восстановительнаядвойственность сульфитов
5Na2SО3 + 2KМnО4 + 3Н2SО4 = 5Na2SО4 +
+2МnSО4 + K2SО4 + 3H2O
Na2SО3 + Сl2 + H2O = Na2SО4 + 2НСl
H2SO3 + 4Н+ + 4e– = S + 2H2O, Ео = 0,45 В
– – 2e– = SО 2- + H O,Ео = –0,93 В
2
SO
+
2ОН
4
2
3
2Na2SО3 + О2 = 2Na2SО4
81.
Сульфиты легко присоединяют серуK2SO3 + S = K2S2O3 (тиосульфат калия)
K
O
O
S
K
O
K
+
S
=
K
O +6
S
O
O
S
2
82.
ГидролизРастворимые сульфиты подвергаются гидролизу:
SO32– + HOH ⇄ HSO3– + OH–
K2SO3 + HOH ⇄ KHSO3 + KOH
83.
Оксид серы (VI) SO3При стандартных условиях SO3 – бесцветная
жидкость, затвердевающая при t < 16ºС, при t >
42ºС переходит в газовую фазу. Молекула SO3
имеет sp2 гибридизацию атомных орбиталей серы,
форму плоского треугольника, угол 120º:
O
S
O
O
84.
SO3• В виде молекул SO3 существует только в газовой
фазе, в жидком состоянии полимеризуется в
циклический тример (SO3)3. В кристаллическом
состоянии
образуются
зигзагообразные
полимерные цепи (SO3)n. Атомные орбитали
серы в полимерных соединениях находятся в
состоянии sp3 – гибридизации, связи
направлены к вершинам тетраэдра:
85.
полимерные соединения SO3Способность молекул SО3 объединяться в кольца
или полимеры связана с координационной
ненасыщенностью атома S
(SO3)3
(SO3)n
O
O
O
S
O
O
O
S
O
O
O
O
O
O
O
O
O
O
O
S
S
S
S
O
O
O
O
O
S
86.
SО3Молекулы
SО3
присоединения:
склонны
к
реакциям
SО3 + НСl = Н[SО3Сl]
Н[SО3Сl] – (сильная хлорсульфоновая кислота)
87.
SO3• SO3 – типичный кислотный оксид, бурно
реагирует с водой. На воздухе SО3 дымит,
взаимодействуя с парами воды с образованием
мельчайших капелек серной кислоты:
SO3 + H2O → H2SO4
88.
SО3Проявляя кислотные свойства, SО3 реагирует с
основными оксидами, со щелочами:
SO3 + CaO = CaSO4
SO3 + Ba(OH)2 = BaSO4↓ + H2O
SO3 + NaOH(разб) = NaHSO4
SO3 + 2NaOH(конц) = Na2SO4 + H2O
89.
SO3SO3 термически нестоек, при t > 700ºС
разлагается:
t
2SO3
2SO2 + O2
Степень окисления серы S+6 – наивысшая,
поэтому SO3 является сильнейшим окислителем:
5SO3 + 2P = P2O5 + 5SO2↑
3SO3 + H2S = 4SO2↑ + H2O
90.
SO3В промышленности SO3 получают окислением
SO2 в присутствии катализатора (Pt или V2O5):
2SO2 + O2
V2 O5
2SO3
91.
H2SO4 Физические свойства• Бесцветная маслообразная жидкость, очень
гигроскопичная, неограниченно смешивается c
водой.
• Процесс растворения сильно экзотермичен, при
нагревании выше 296ºС начинает разлагаться
на SO3 и Н2О
92.
Синтез в промышленности1. Получение SO2:
S + O2 = SO2
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Процесс гетерогенный:
- измельчение железного колчедана (пирита)
метод "кипящего слоя"
- 800°С; отвод лишнего тепла
- увеличение концентрации кислорода в воздухе
93.
2. Окисление SO2.а) После очистки, осушки и теплообмена
сернистый газ поступает в контактный
аппарат, где окисляется в серный ангидрид
(450°С – 500°С; в контактном методе
катализатор V2O5):
2SO2 + O2
V2 O5
2SO3
94.
б) В нитрозном методе SO2 окисляют оксидомазота (IV):
↑
3.Поглощение SO3 концентрированной серной
кислотой в поглотительной башне:
nSO3 + H2SO4 = H2SO4 · nSO3
(олеум, n = 1‒3)
Воду использовать нельзя из-за образования
тумана.
95.
4. H2SO4 · nSO3 + nH2O = (n + 1)H2SO4.Правило разбавления концентрированной серной
кислоты
(олеума):
при
непрерывном
перемешивании раствора кислоту вливают в
воду.
96.
Разбавленная H2SO4Fe + H2SO4 = FeSO4 + Н2
CuO + H2SO4 = CuSO4 + Н2O
Ca(OH)2 + H2SO4 = CaSO4 + 2Н2O
CaCO3 + H2SO4 = CaSO4 + Н2O + CO2
NH3 + H2SO4 = NH4HSO4
97.
Концентрированная H2SO4H2SO4(конц) является кислотой-окислителем
H2SO4(конц)
+2e-
SO2
+6e–
S
+8e–
H 2S
98.
H2SO4(конц)2H2SO4(конц) + 2Ag = SO2↑+Ag2SO4↓+2H2O
5H2SO4(конц) +4Mg=H2S↑+4MgSO4↓+ 4H2O
2H2SO4(конц) +C(графит)= 2SO2↑+СO2↑+2H2O
H2SO4(конц) + H2S = SO2↑ + S↓ +2H2O
H2SO4(конц) + KCl = KHSO4 + HCl
99.
Соли сернойкислоты
Большинство солей хорошо растворимы в воде.
Малоратворимыми
являются
сульфаты
щелочноземельных металлов, серебра, свинца,
многие сульфаты кристаллизуются из растворов в
виде кристаллогидратов:
CuSО4 · 5H2O – медный купорос
FeSО4 · 7H2O – железный купорос
Na2SО4 · 10H2O – глауберова соль
MgSО4 · 7H2O – горькая (английская) соль
CaSО4 · 2H2O – гипс
100.
Двойныесоли
квасцы,
например:
хромовокалиевые квасцы KСr(SО4)2 · 12Н2О;
алюмокалиевые квасцы KАl(SО4)2 · 12Н2О.
Наименьшей растворимостью обладает сульфат
бария. Образование ВаSО4 в виде белого осадка
используют как качественную реакцию на
сульфат-ион:
Ва2+ + SO24 = ВаSО4↓
H2SO4 + BaCl2 = BaSO4↓ + 2HCl
101.
Разложение сульфатовСульфаты щелочных металлов плавятся без
разложения. Сульфаты металлов средней
активности образуют соответствующие оксиды:
t
ZnSО4
ZnО + SО3↑
Сульфат железа (II) разлагается по механизму
внутримолекулярного окисления-восстановления:
t
4FeSО4
2Fе2О3 + 4SО2↑ + О2↑
Сульфаты наиболее тяжелых металлов
разлагаются до металла:
t
Ag2SО4
2Ag + SО2↑ + О2↑
102.
Оксокислоты серы(VI)Можно рассматривать как результат замещения
кислорода или гидроксидной группы в молекуле
серной кислоты на изоэлектронные частицы.
•При замещении в H2SO4 концевого атома
кислорода на атом серы образуется тиосерная
кислота H2S2O3
H
H
O
O
H
O
H
S
O
O +6
S
O
O
S
2
103.
В лаборатории тиосульфаты получают прикипячении раствора сульфита с порошком серы:
t
+4
0
Na2S O3 + S
Na2S2O3
Тиосерная кислота неустойчива:
Na2S2O3 + 2HCl = 2NaCl + SO2↑ + S↓+H2O
104.
ТиосульфатыНаличие в тиосульфатах S-2 придаёт им
восстановительные свойства. Тиосульфат натрия
используется для связывания хлора:
Na2S2O3+ Сl2(нед) + Н2О = Na2SО4 + S + 2НСl
Na2S2O3 + 4Сl2(изб) + 5Н2О = Na2SО4 + Н2SО4 +
8НСl
105.
Na2S2O3∙5H2O (тривиальное название – гипосульфит)используют для растворения малорастворимых
солей, например бромида серебра:
2Na2S2O3+ AgBr=NaBr+Na3[Ag(S2O3)2]
Na2S2O3 используется в медицине как
противотоксическое средство при отравлениях
соединениями ртути, свинца, синильной кислотой
и ее солями, при этом образуются плохо
растворимые нетоксичные сульфиты или менее
ядовитые тиоцианаты
106.
Na2S2O3 образует с иодом бесцветныйтетратионат нария:
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
(тетратионат натрия)
Na
O
O
Na
S
Na
Na
S
S
O
S
O
S
+ I2 =
O
O
S
S
Na
O
O
O
S
O
Na
O
O
+ 2NaI
107.
Политионовые кислотыСостав Н2SnО6 или Н2(О3S–Sn ‒ 2–SО3), где
n = 2 – 22. В состав политионовых кислот входят
зигзагообразные цепи атомов серы. Название
кислоты и ее солей определяется числом атомов
серы:
Na2S6O6 – гексатионат
Na2S5O6 – пентатионат
Na2S4O6 – тетратионат
Na2S2O6 – дитионат
108.
Политионовые кислоты существуют только вводных растворах и медленно разлагаются при
хранении:
Н2SnО6 = Н2SО4 + SО2 + (n ‒ 2)S
Соли политионовых кислот щелочных металлов
хорошо растворимы в воде. В сухом состоянии
довольно устойчивы, при нагревании они
разлагаются:
t Na SО + SО + 4S↓
Na2S6O6
2
4
2
109.
Полисерные кислотыН2SО4 · nSО3 (n = 1 ÷ 3) существуют в свободном
виде. Тяжелые маслянистые жидкости, носят
название «олеум»
H2S2O7 – дисерная (Н2SО4 · SО3)
H2S3O10 – трисерная (Н2SО4 · 2SО3)
O
H
O
S
O
O
(O
S
O
)n
O H
110.
Пероксосерные кислотыхарактеризуются
наличием
в
структуре
пероксидной группы (–О–О–)
H2SO5 – пероксомоносерная (мононадсерная
кислота, кислота Каро), H2S2O8 – пероксодисерная
кислота (двунадсерная)
H
H
O
O
O
S
O
H
O
O
O
S
O
O
O
S
O
O
O
H
111.
• Кислотыплавятся
при
нагревании
с
разложением при температуре 47°С (H2SO5) и
65°С (H2S2O8):
2H2SO5 = 2H2SO4 + О2
• Водород, связанный с пероксогруппой в H2SO5,
на металл не замещается, кислота является
одноосновной. Для H2SO5 известны соли,
например КНSО5 (пероксомоносульфат или
кароат калия).
112.
Гидролиз пероксодисерной кислоты• Протекает в две стадии:
H2S2O8 + H2O = H2SO5 + Н2SО4
H2SO5 + Н2О ⇄ Н2SО4 + Н2О2
113.
Окислительные свойства5(NH4)2S2O8 + 2MnSO4 + 8Н2О = =5(NH4)2SO4 +
2HMnO4 + 7H2SO4
3(NH4)2S2O8 + Сr2(SO4)3 + 7Н2О =
= 3(NH4)2SO4 + H2Сr2О7 + 6H2SO4.
• Стандартный электродный потенциал системы:
S2O82- + 2e– = 2SO42- , Ео = 2,01 В
114.
ПолучениеH2S2O8 получают электролизом
концентрированной серной кислоты:
холодной
2Н2SО4(конц) Электролиз
H2S2O8 + H2
H2S2O8 можно получить действием H2SO4(конц) на
пероксодисульфаты:
K2S2O8 + H2SO4(конц) = H2S2O8 + K2SO4
H2SO5 получают действием 100-го H2O2 на H2S2O8
или H2SO4:
H2SO4 + H2O2 = H2SO5 + H2O
H2S2O8 + H2O2 = 2H2SO5
115.
фтор- (F(OH)SO2) и хлорсульфоновая(Cl(OH)SO2) кислоты
•При замещении гидроксидной группы серной
кислоты на изоэлектронные группы (F–, Cl–)
образуются соответственно.
•Практически их синтезируют взаимодействием
галогеноводородных кислот HF (HCl) с жидким
SO3:
HF + SO3 = HSO3F
116.
фторсульфоновая кислота
• Введение фтора из-за
усиления
поляризации связи О–
Н
приводит
к
повышению
силы
o
H
o
фторсульфоновой
s
кислоты.
F
o
117.
Элементы подгруппы селенаВ ряду O – S – Se – Te – Po радиус атомов
увеличивается, энергия ионизации уменьшается,
неметаллические свойства элементов убывают, а их
металлические свойства растут.
Se
Te
118.
• В реакциях с азотной кислотой сера и селенведут себя как неметаллы, а полоний – как
металл:
S + 2HNO3 = H2SO4 + 2NO
Se + 2HNO3 = H2SeO4 + 2NO
Po + 8HNO3 = Po(NO3)4 + 4NO2 + 4Н2О
119.
С кислородом• Se и Te очень сходны с серой. Горят на воздухе
с образованием диоксидов:
Se + О2 = SeО2
Тe + О2 = ТeО2
• SeО2 и ТeО2 – твердые вещества в отличие от
SО2
120.
С водородом• Частично взаимодействует лишь селен, теллур
непосредственно с водородом не соединяется:
Н2 + Se = Н2Se
• Н2Se и Н2Тe прямым взаимодействием не
получают. Они могут быть получены действием
разбавленных кислот на селениды и теллуриды
металлов:
2Na + Se = Na2Se (селенид натрия)
Na2Se + 2HCl = H2Se + 2NaCl
121.
Н2Se и Н2Тe• Н2Se и Н2Тe менее устойчивы, чем Н2S, и
проявляют более сильные восстановительные
свойства.
• H2Se и H2Тe при нормальных условиях –
бесцветные газы с неприятным запахом.
• Селеноводород
более
ядовит,
а
теллуроводород
менее
ядовит,
чем
сероводород.
• Растворимость в воде H2Se и H2Тe примерно
такая же, как и H2S. Водные растворы этих
соединений проявляют кислотные свойства.
122.
123.
Водородные соединения халькогенов• В ряду H2O – H2S – H2Se – H2Te
восстановительные свойства соединений и
кислотные
свойства
водных
растворов
увеличиваются, а термическая устойчивость
падает.
• Соли селеноводородной кислоты (селениды) и
теллуроводородной кислоты (теллуриды) по
свойствам близки к сульфидам
124.
C водой и разбавленными кислотами• Сера и селен не взаимодействуют.
• Теллур взаимодействует с водой даже при
обычных условиях, а полоний взаимодействует
с соляной кислотой:
Те + 2Н2О = ТеО2 + 2Н2↑
Ро + 2НСl = РоСl2 + Н2↑
125.
Со щелочами• В кипящих водных растворах щелочей селен и
теллур, подобно сере, медленно растворяются
(диспропорционируют):
3Se + 6KОН = 2K2Se + K2SeО3 + 3Н2О
126.
Кислородные соединения• SeО2 и ТeО2 образуются при сгорании селена и
теллура на воздухе, при обжиге селенидов и
теллуридов, при сжигании водородных соединений
этих элементов:
2СdSe + 3О2 = 2СdО + 2SeО2
2Н2Те + 3О2 = 2Н2О + 2ТeО2
• SeО2 и ТeО2 – бесцветные кристаллические
вещества, проявляющие свойства кислотных
оксидов. Им соответствуют селенистая (H2SeО3) и
теллуристая (H2ТeО3) кислоты.
127.
• SeО2 растворяется в воде, ТeО2 с водой невзаимодействует:
SeО2 + Н2О = H2SeО3
• H2SeО3 выделена в свободном состоянии,
H2TeО3 получают косвенным путем, в свободном
виде не получена, существует только в водных
растворах в виде полимера ТeО2 · nН2О.
128.
SО2 – SeО2 – ТeО2 – РоО2• В ряду происходит ослабление кислотных свойств и
усиление основных свойств.
• ТeО2 можно растворить в растворе щелочи, как и
SО2, SeО2:
ТeО2 + 2KОН =K2ТеО3 + Н2О
• РоО2 со щелочами взаимодействует только при
сплавлении, но взаимодействует с кислотами,
проявляя основные свойства:
РоО2 + 2KОН = K2РоО3 + Н2О
РоО2 + 2H2SО4 = Ро(SО4) 2 + 2Н2О
129.
H2SО3– H2SeО3 – H2ТeО3• В ряду кислотные свойства ослабевают.
• Соединения S+4 преимущественно проявляют
восстановительные свойства, Sе+4 и Те+4
проявляют главным образом окислительные
свойства:
2SО2 + SeО2 + 2H 2О = 2H2SО4 + Se;
К2ТеО3 + 2SО2 + Н2О = H2SО4 + К2SО4 + Тe
130.
SeО3• SeО3 получают при взаимодействии селената
натрия с избытком SО3:
Nа2SeО4 + SО3 = Nа2SО4 + SeО3
• SeО3 – бесцветное кристаллическое вещество,
хорошо растворяется в воде с образованием
селеновой кислоты:
SeО3 + Н2О = H2SeО4
131.
Селеновая и теллуровая кислоты• Бесцветные кристаллические вещества, хорошо
растворимые в воде. Свободная теллуровая
кислота
обычно
выделяется
в
виде
кристаллогидрата H2ТeО4 · 2Н2О или H6ТeО6.
• В ортотеллуровой кислоте атомы водорода могут
частично или полностью замещаться атомами
металлов (K6ТeО6). Селеновая кислота по силе
близка к серной кислоте, водный раствор
теллуровой кислоты проявляет свойства слабой
кислоты.
132.
H2SО4 – H2SeО4 – H2ТeО4 (H6ТeО6)• В ряду кислотные свойства ослабевают
• Селеновая кислота менее устойчива, чем серная
кислота, поэтому H2SeО4 конц более сильный
окислитель, чем H2SО4конц.
• Окислительные свойства теллуровой кислоты
слабее, чем у серной кислоты.
• Селеновая кислота обугливает органические
вещества.
H2SО4конц
не
окисляет
концентрированную соляную кислоту.
133.
H2SeО4• Селеновая кислота окисляют НСl с выделением
свободного хлора:
H2SeО4 + 2НСl = H2SeО3 + Сl2 + Н2О
• За счет выделения атомарного хлора смесь
селеновой и соляной кислот растворяет золото и
платину.
• Золото не растворяется в горячей серной кислоте,
горячая безводная селеновая кислота растворяет
его:
2Au + 6H2SeО4 = Au2(SeO4)3 + 3H2SeО3 + +3Н2О
134.
Te (VI)• Атом теллура по сравнению в атомом селена
имеет больший радиус, для него характерно
координационное число 6.
• Повышение стабильности и уменьшение
окислительной способности оксосоединений при
переходе от Se (VI) к Te (VI) обусловлено
особенностями строения и увеличением
прочности связи Te–O в октаэдрических ионах
TeO66по сравнению со связью Se–O в
тетраэдрах SeО42-
135.
H6ТeО6• При нагревании ортотеллуровая
разлагается:
H6ТeО6 = ТeО3 + 3Н2О
(при нагревании до 300ºС);
2ТeО3 = 2ТeО2 + О2
(при нагревании > 300ºС).
кислота
136.
ТeО3• ТeО3 – порошок желтого цвета, не растворяется
в воде, в разбавленных растворах кислот и
щелочей
• растворяется только в концентрированных
водных растворах щелочей:
ТeО3 + 2NаОНконц = Nа2ТeО4 + Н2О
137.
Применение р-элементов VI А группыи их соединений
• Кислород в металлургии при производстве чугуна и стали, в
смеси с ацетиленом для сварки и резки металлов.
• Озон как сильный окислитель используют для дезинфекции
помещений, обеззараживания воздуха и очистки питьевой
воды.
• Пероксид водорода применяют в ракетной технике, для
обработки и травления поверхности металлов, для
производства неорганических и органических пероксидов,
для обеззараживания сточных вод, в медицине и косметике.
Отбеливание естественных и искусственных волокон,
бумажной массы, для осветления мыл и синтеза
синтетических моющих средств. В пищевой промышленности
Н2О2 используют для удаления из некоторых продуктов
солей сернистой кислоты.
138.
• Сера производство серной кислоты, взрывчатых веществ,вулканизация каучука.
• Нерастворимые сульфиды - пигменты при производстве красок.
Сплавы, полученные в результате прокаливания сульфидов
щелочноземельных металлов с добавками флюса (плавиковый
шпат, бура) и следами тяжелых металлов, применяют для
изготовления
светящихся
красок.
В
кожевенной
промышленности применяют полисульфиды натрия.
• В медицине сульфид калия, сера
• SO2 - для уничтожения плесневых грибков, окуривают сырые
подвалы, погреба, винные бочки и др. Используют при перевозке
и хранении фруктов и ягод.
139.
• Na2SO4 ∙ 10H2O – глауберова соль (в производствесоды, стекла).
• 2CaSO4 ∙ H2O – алебастр (лепка, шины при
переломах).
• MgSO4 ∙ 7H2O – (горькая соль) в медицине
слабительное.
• CuSO4 ∙ 5H2O – для борьбы с вредителями
сельского хозяйства.
• FeSO4 ∙ 7H2O – для очистки воды, консервирования
(предохранение древесины от гниения).
140.
• BaSO4 –рентгеноконтрастное вещество вмедицине.
• ZnSO4 ∙ 7H2O – цинковый купорос – протрава при
крашении тканей.
• KCr(SO4)2 ∙ 12H2O; KAl(SO4)2 ∙ 12H2O квасцы, при
дублении кожи, изготовлении красок.
141.
• Основная масса производимого теллура потребляетсяметаллургией. Добавки теллура к свинцу повышают
прочность и коррозионную устойчивость изделий из
свинца. Медь и сталь, содержащие теллур, легко
обрабатываются резкой. В производстве стекла добавки
теллура придают ему коричневый оттенок и увеличивают
коэффициент лучепреломления.
• Селен применяют для изготовления выпрямителей и
фотоэлементов.
• Селен и теллур применяют в полупроводниковой технике.



























































































































 chemistry
chemistry








