Similar presentations:
Типичные окислители
1.
ХИМИЯ9 класс
Типичные окислители
Мария Дмитриевна Смирнова
Smirnova@sch2101.ru
Vk.com/masha2101
1
2.
Метод электронно-ионного балансаОкислительно-восстановительные реакции бывает сложно уровнять.
K2Cr2O7 + 4H2SO4 + 3H2S = Cr2(SO4)3 + 7H2O + 3S(т) + K2SO4
Метод электронно-ионного баланса
а) записывают формулы реагентов данной реакции и устанавливают химическую
функцию каждого из них (окислитель, кислотная среда реакции, восстановитель);
б) записывают формулы реагентов в ионном виде, указывая только те ионы, молекулы и
формульные единицы, которые примут участие в реакции в качестве окислителя, среды и
восстановителя
в)
определяют
восстановленную
форму
окислителя
и
окисленную
форму восстановителя, составляют электронно-ионные уравнения полуреакций
восстановления и окисления
г) суммируя уравнения полуреакций, составляют ионное уравнение данной реакции,
д) на основе ионного уравнения составляют молекулярное уравнение данной реакции
е) проводят проверку подобранных коэффициентов
3.
Один пример1. Сначала записываем схему реакции:
S + HNO3 = H2SO4 + NO
4.
Метод электронно-ионного баланса1. Сначала записываем схему реакции.
2. Определяем окислитель и восстановитель.
S + HNO3 = H2SO4 + NO
5.
Метод электронно-ионного баланса1.
2.
3.
Сначала записываем схему реакции.
Определяем окислитель и восстановитель.
Под схемой реакции записываем в ионном виде полуреакции окисления и
восстановления. Слабые электролиты, твёрдые и газообразные вещества
записываются в молекулярном виде.
6.
Метод электронно-ионного баланса1.
2.
3.
Сначала записываем схему реакции.
Определяем окислитель и восстановитель.
Под схемой реакции записываем в ионном виде полуреакции окисления и
восстановления. Слабые электролиты, твёрдые и газообразные вещества
записываются в молекулярном виде.
S + HNO3 = H2SO4 + NO
1-я полуреакция: S0
2-я полуреакция:
SO42-
NO3- NO
7.
Метод электронно-ионного баланса1.
2.
3.
Сначала записываем схему реакции.
Определяем окислитель и восстановитель.
Под схемой реакции записываем в ионном виде полуреакции окисления и
восстановления. Слабые электролиты, твёрдые и газообразные вещества
записываются в молекулярном виде.
S + HNO3 = H2SO4 + NO
1-я полуреакция: S0 SO422-я полуреакция: NO3- NO, дополняем их
1-я полуреакция: S0 + 4H2O - 6e- SO42- + 8H+
2-я полуреакция: NO3- + 4H+ + 3e- NO + 2H2O
8.
Метод электронно-ионного баланса1.
2.
3.
4.
Сначала записываем схему реакции.
Определяем окислитель и восстановитель.
Под схемой реакции записываем в ионном виде полуреакции окисления и
восстановления. Слабые электролиты, твёрдые и газообразные вещества
записываются в молекулярном виде.
Балансируем заряд
S + HNO3 = H2SO4 + NO
S0 + 4H2O - 6e- SO42- + 8H+
NO3- + 4H+ + 3e- NO + 2H2O
9.
Метод электронно-ионного баланса1.
2.
3.
4.
5.
Сначала записываем схему реакции.
Определяем окислитель и восстановитель.
Под схемой реакции записываем в ионном виде полуреакции окисления и
восстановления. Слабые электролиты, твёрдые и газообразные вещества
записываются в молекулярном виде.
Балансируем заряд.
Суммируют обе полуреакции:
S0 + 4H2O + NO3- + 4H+ = SO42- + 8H+ + NO + 2H2O
S + 2HNO3 = H2SO4 + 2NO
10.
Метод электронно-ионного балансаПопробуем:
HCl + Cu + O2 CuCl2 + H2O
11.
Окислители – акцепторы электроновОкислители можно разделить на группы
По проявлению окислительных свойств
Группа 1
Температура
2Na2O2 2Na2O + O2
Группа 2
Кислотная
среда
Группа 3
Щелочная
среда
Me + H2SO4конц =
Me2(SO4)n+H2O+( H2S,
S, SO2 ).
NaCrO2+Br2+NaOH
Na2CrO4+NaBr+H2O
2 Н+ + [О-2] = Н2О
2 ОН¯ - [О-2] = Н2О
12.
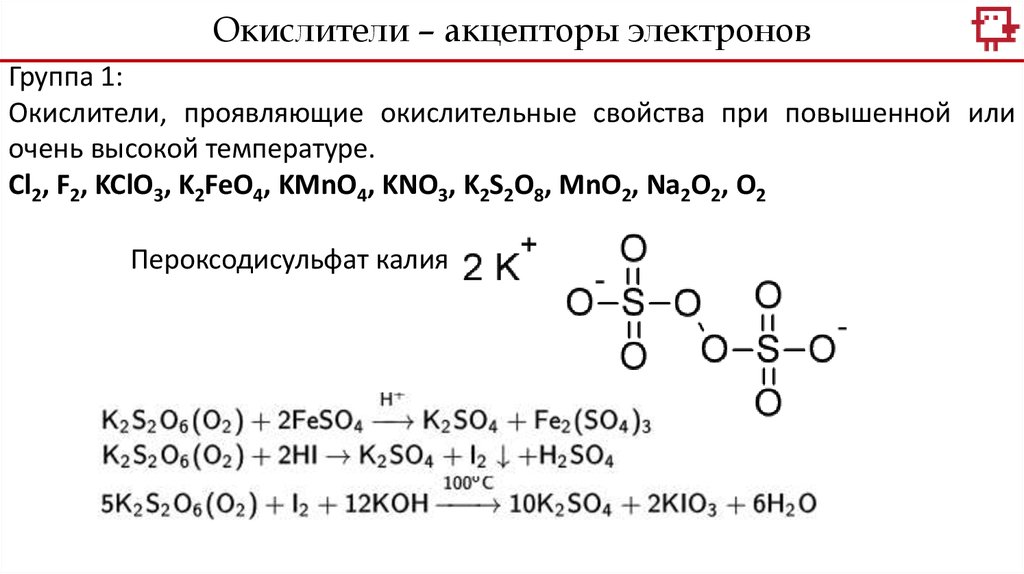
Окислители – акцепторы электроновГруппа 1:
Окислители, проявляющие окислительные свойства при повышенной или
очень высокой температуре.
Cl2, F2, KClO3, K2FeO4, KMnO4, KNO3, K2S2O8, MnO2, Na2O2, O2
Пероксодисульфат калия
13.
Окислители – акцепторы электроновГруппа 2:
Окислители, проявляющие окислительные свойства в кислотной среде:
F2, Na2O2, O3, K2S2O8, H2O2, KMnO4, KBrO3, Cl2, K2Cr2O7, MnO2, O2, KIO3,
HNO3(конц), H2SO4.
Пероксид
Натрия.
14.
Окислители – акцепторы электроновГруппа 3:
Окислители, проявляющие окислительные свойства в щелочной среде:
F2, K2S2O8, Сl2O4, Na2O2, Br2, H2O2, KMnO4, I2, O2, K2Cr2O4
+1
+7
Cl2O4 - ClOClO3, смесь двух оксидов.
2 ClOClO3 → O2 + Cl2 + Cl2O6
15.
Ещё раз про уравненияПоследовательность действий:
1) Проверяем является ли реакция окислительно-восстановительной
(ОВР).
Чем ОВР отличается от других реакций?
Cl2 + O3 ClO3
NaBr + AgNO3 AgBr + NaNO3
16.
Ещё раз про уравненияПоследовательность действий:
1) Проверяем является ли реакция окислительно-восстановительной
(ОВР).
2) Расставляем степени окисления над элементом-окислителем и
элементом-восстановителем.
Cl2 + H2O(пар) + С(кокс) CO2 + HCl
17.
Почему кокс?Кокс каменноугольный — твёрдый пористый продукт
серого цвета, получаемый путём коксования каменного угля
при температурах 950—1100°С без доступа кислорода.
18.
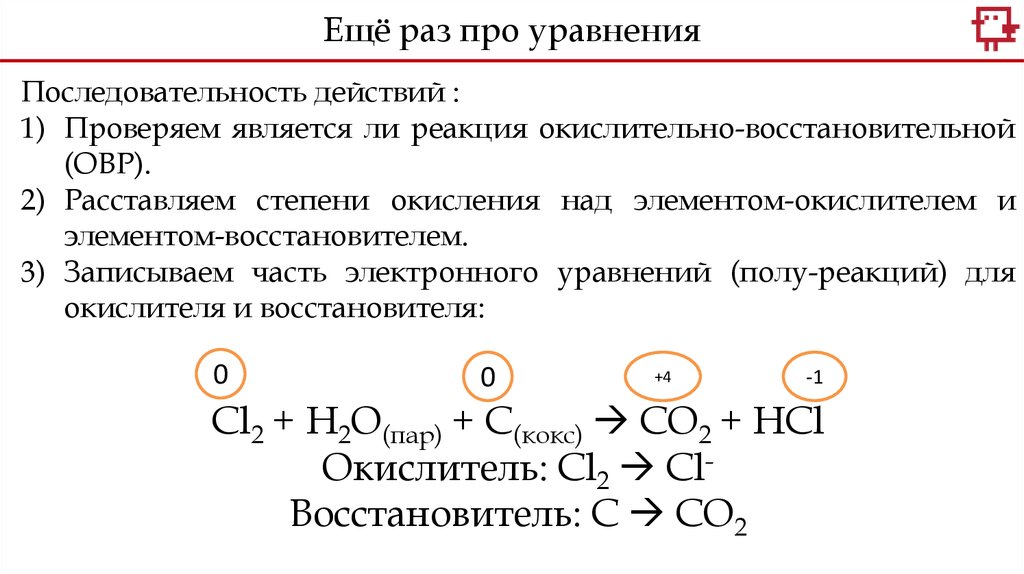
Ещё раз про уравненияПоследовательность действий:
1) Проверяем является ли реакция окислительно-восстановительной
(ОВР).
2) Расставляем степени окисления над элементом-окислителем и
элементом-восстановителем.
+4
-1
0
0
Cl2 + H2O(пар) + С(кокс) CO2 + HCl
19.
Ещё раз про уравненияПоследовательность действий :
1) Проверяем является ли реакция окислительно-восстановительной
(ОВР).
2) Расставляем степени окисления над элементом-окислителем и
элементом-восстановителем.
3) Записываем часть электронного уравнений (полу-реакций) для
окислителя и восстановителя:
0
0
+4
-1
Cl2 + H2O(пар) + С(кокс) CO2 + HCl
Окислитель: Сl2 ClВосстановитель: С CO2
20.
Ещё раз про уравненияПоследовательность действий:
4) Качественно уравниваем полу-реакции:
Cl2 + H2O(пар) + С(кокс) CO2 + HCl
Окислитель: Сl2 + A Cl- + B
Восстановитель: С + X CO2 + D
21.
Ещё раз про уравненияПоследовательность действий:
4) Качественно уравниваем полу-реакции:
Cl2 + H2O(пар) + С(кокс) CO2 + HCl
Окислитель: Сl2 ClВосстановитель: С + H2O CO2 + Н+
22.
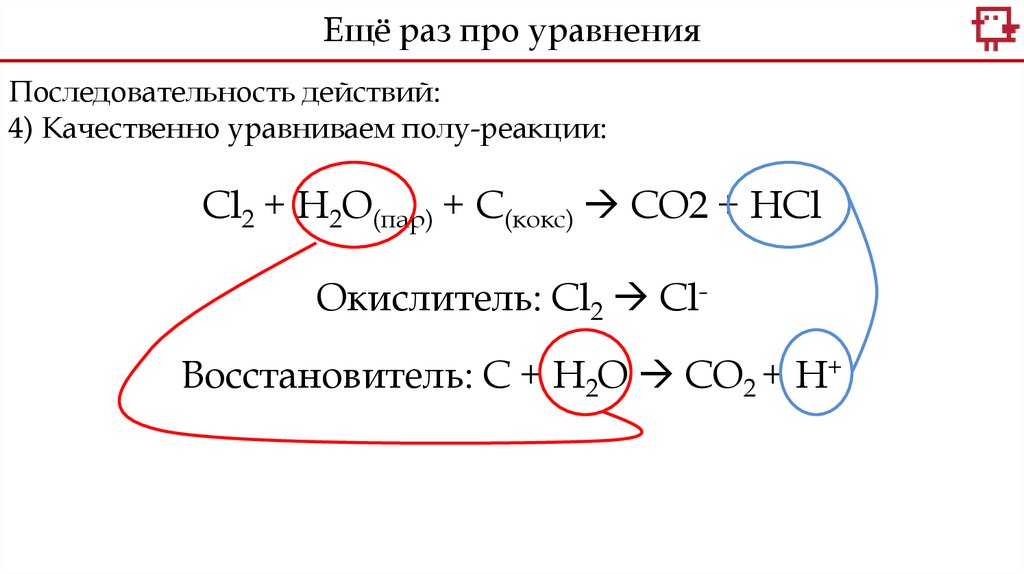
Ещё раз про уравненияПоследовательность действий:
4) Качественно уравниваем полу-реакции.
5) Количественно уравниваем полу-реакции:
Cl2 + H2O(пар) + С(кокс) CO2 + HCl
Окислитель: Сl2 Cl-
Восстановитель: С + H2O CO2 + Н+
23.
Ещё раз про уравненияПоследовательность действий:
4) Качественно уравниваем полу-реакции.
5) Количественно уравниваем полу-реакции:
Cl2 + H2O(пар) + С(кокс) CO2 + HCl
Окислитель: Сl2 2Cl-
Восстановитель: С + 2H2O CO2 + 4Н+
24.
Ещё раз про уравненияПоследовательность действий:
4) Качественно уравниваем полу-реакции.
5) Количественно уравниваем полу-реакции.
6) Считаем заряды и уравниваем их электронами:
Cl2 + H2O(пар) + С(кокс) CO2 + HCl
Окислитель: Сl2 2ClВосстановитель: С + 2H2O CO2 + 4Н+
25.
Ещё раз про уравненияПоследовательность действий:
4) Качественно уравниваем полу-реакции.
5) Количественно уравниваем полу-реакции.
6) Считаем заряды и уравниваем их электронами:
Cl2 + H2O(пар) + С(кокс) CO2 + HCl
+2е-
Окислитель: Сl2 2Cl-4е-
Восстановитель: С + 2H2O CO2 + 4Н+
26.
Ещё раз про уравненияПоследовательность действий:
4) Качественно уравниваем полу-реакции.
5) Количественно уравниваем полу-реакции.
6) Считаем заряды и уравниваем их электронами.
7) Вычисляем коэффициенты пропорциональности по электронном
для каждой полу-реакции:
+2е-
Сl2 2Cl-4еС + 2H2O CO2 + 4Н+
2
1
27.
Ещё раз про уравненияПоследовательность действий:
8) Складываем полу-реакции с учётом коэффициентов:
Сl2 2ClС + 2H2O CO2 + 4Н+
2
1
28.
Ещё раз про уравненияПоследовательность действий:
8) Складываем полу-реакции с учётом коэффициентов:
2Cl-
Сl2
С + 2H2O CO2 + 4Н+
2
1
2Сl2 + C + 2H2O = CO2 + 4Cl- + 4H+
4HCl
Ура!
29.
УРАВНЯТЬ!!!SO2 + SeO2 + H2O Se + H2SO4
30.
УРАВНЯТЬ!!!H2SO4(конц) + Zn H2S + H2O + ZnSO4



























 chemistry
chemistry








