Similar presentations:
Кислоты. Типичные реакции кислот
1.
Кислоты — это сложные вещества,молекулы которых состоят из ионов
водорода и кислотного остатка.
2.
Основные типы химических реакций3.
Основные типы химических реакций1. Взаимодействие кислот с основаниями.
4.
Основные типы химических реакций1. Взаимодействие кислот с основаниями.
2. Взаимодействие кислот с оксидами металлов.
5.
Основные типы химических реакций1. Взаимодействие кислот с основаниями.
2. Взаимодействие кислот с оксидами металлов.
3. Взаимодействие кислот с металлами.
6.
Основные типы химических реакций1. Взаимодействие кислот с основаниями.
2. Взаимодействие кислот с оксидами металлов.
3. Взаимодействие кислот с металлами.
4. Взаимодействие кислот с солями.
7.
Взаимодействие кислот с основаниямиKOH
8.
Взаимодействие кислот с основаниямифенолфталеин
KOH
9.
Взаимодействие кислот с основаниямифенолфталеин
KOH
KOH
+
фенолфталеин
10.
Взаимодействие кислот с основаниямиH2SO4
KOH
+
фенолфталеин
11.
Взаимодействие кислот с основаниямиH2SO4
KOH
+
фенолфталеин
KOH
+
H2SO4
12.
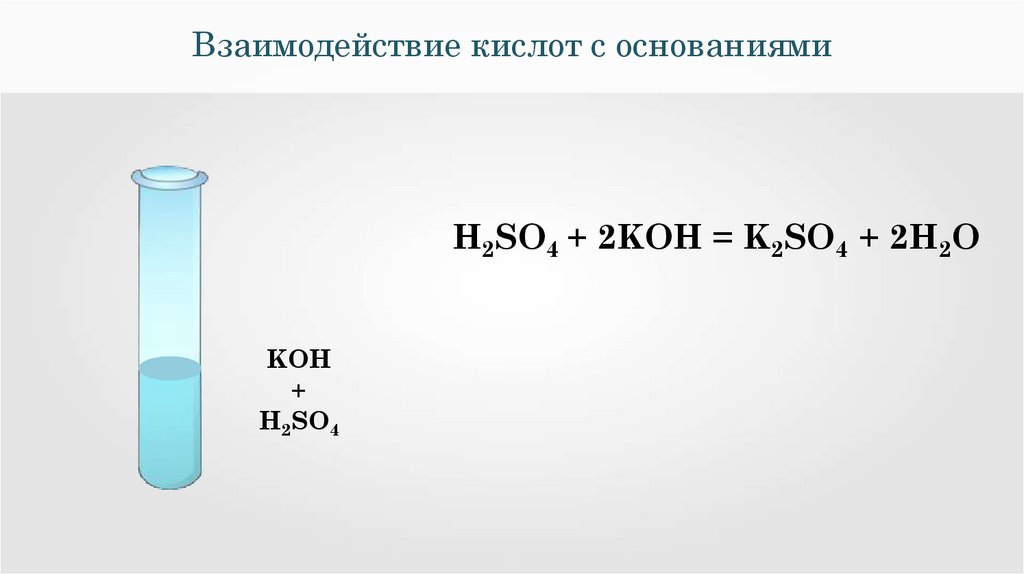
Взаимодействие кислот с основаниямиН2SO4 + 2KOH = K2SO4 + 2H2O
KOH
+
H2SO4
13.
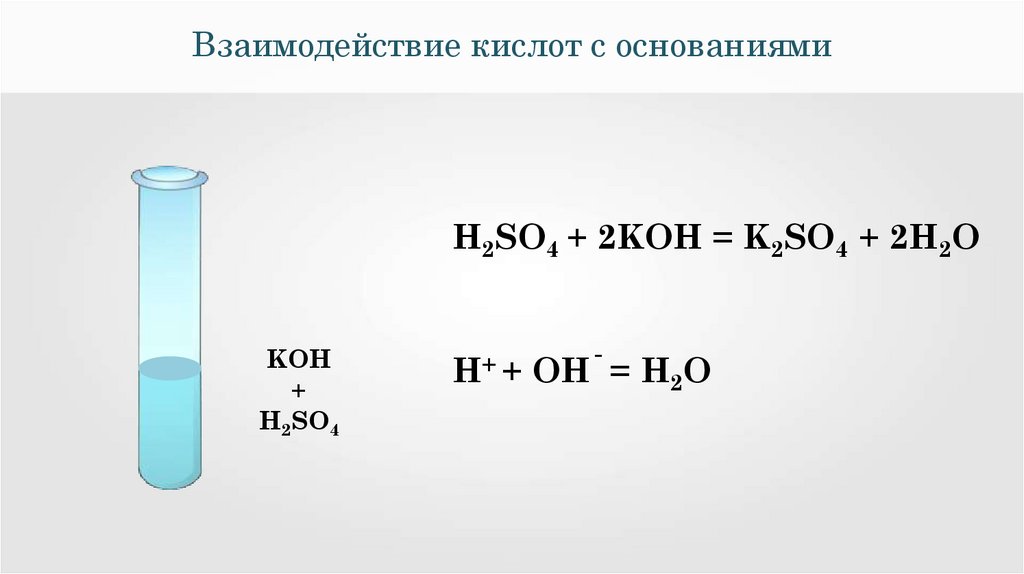
Взаимодействие кислот с основаниямиН2SO4 + 2KOH = K2SO4 + 2H2O
KOH
+
H2SO4
Н+ + ОН
-
= H2O
14.
Взаимодействия серной кислоты сгидроксидом калия
Н2SO4 + 2KOH = K2SO4 + 2H2O
Реакции нейтрализации — это реакции
взаимодействия сильной кислоты со
щелочью, в результате которых образуется
малодиссоциирующее вещество вода.
15.
Взаимодействие кислот с нерастворимымиоснованиями
16.
Взаимодействие кислот с нерастворимымиоснованиями
NaOH
17.
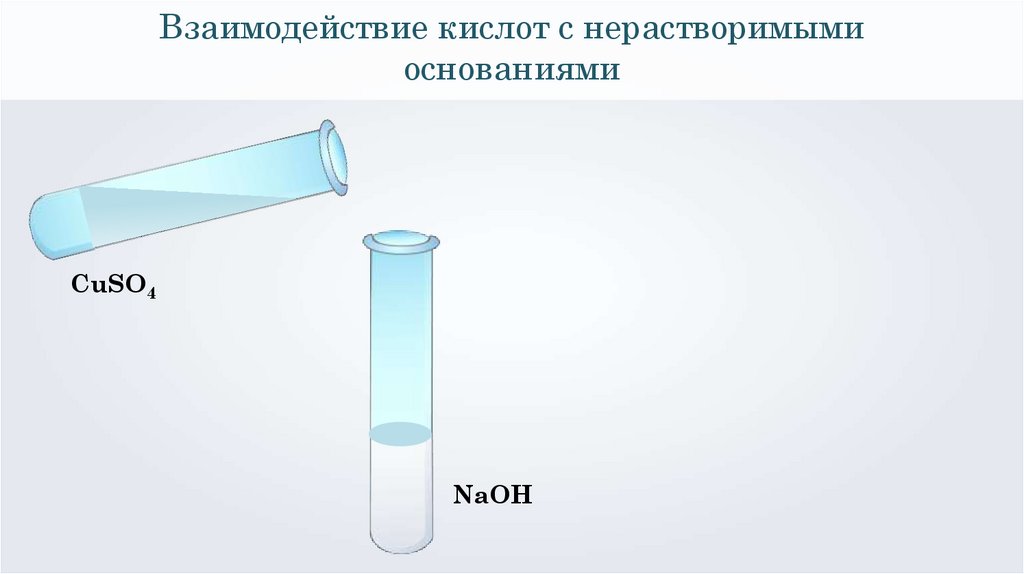
Взаимодействие кислот с нерастворимымиоснованиями
CuSO4
NaOH
18.
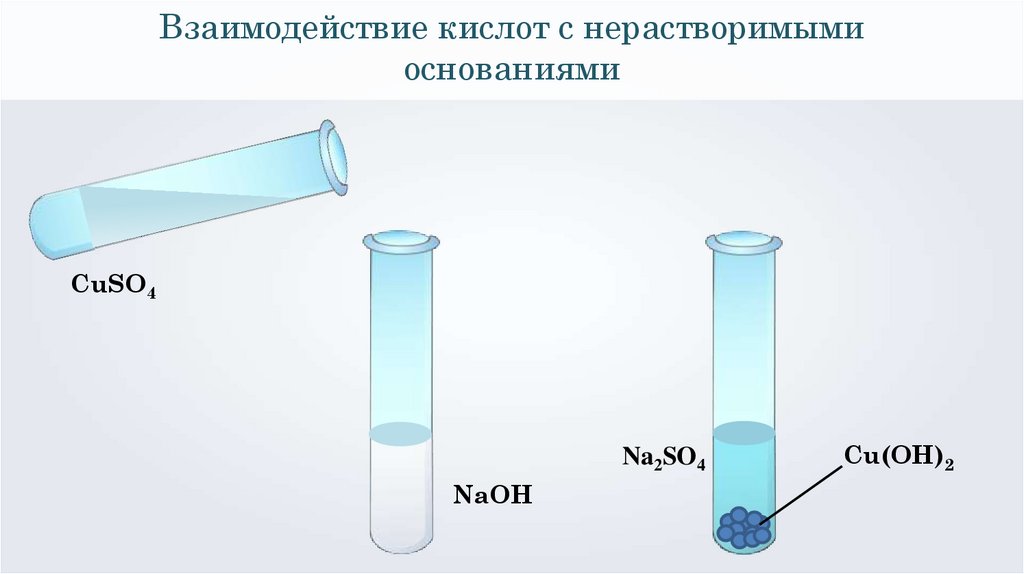
Взаимодействие кислот с нерастворимымиоснованиями
CuSO4
Na2SO4
NaOH
Cu(OH)2
19.
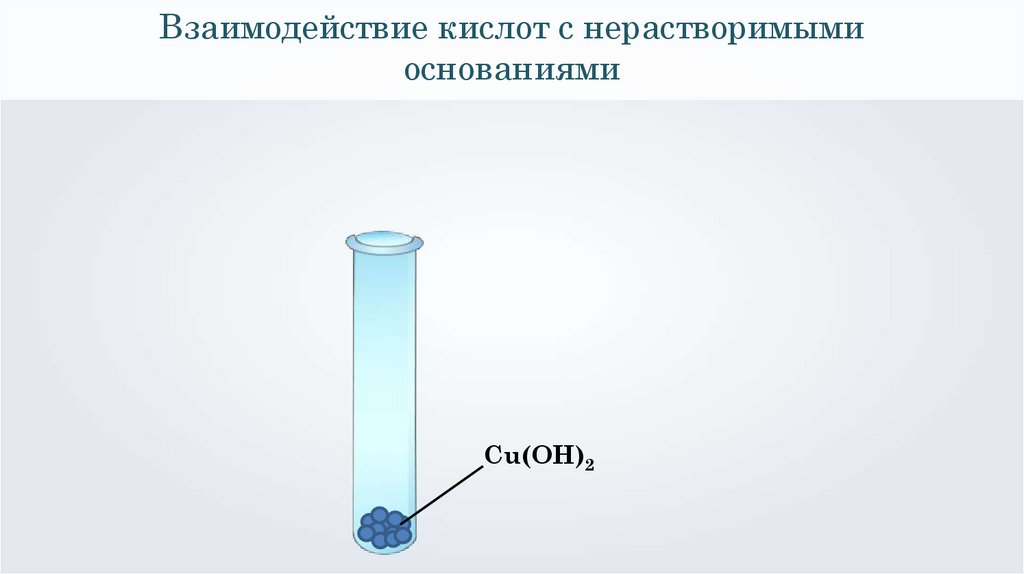
Взаимодействие кислот с нерастворимымиоснованиями
Cu(OH)2
20.
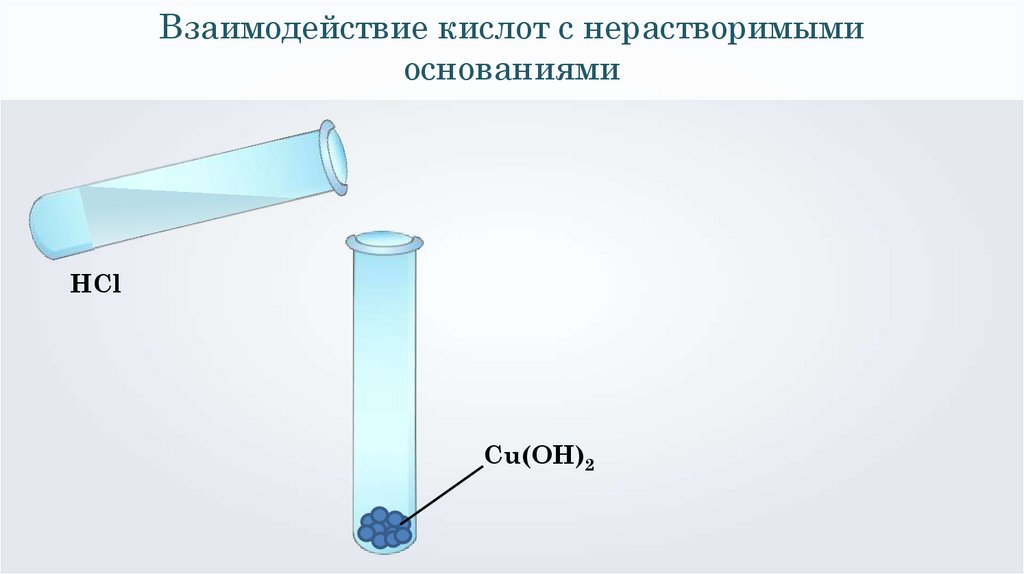
Взаимодействие кислот с нерастворимымиоснованиями
HCl
Cu(OH)2
21.
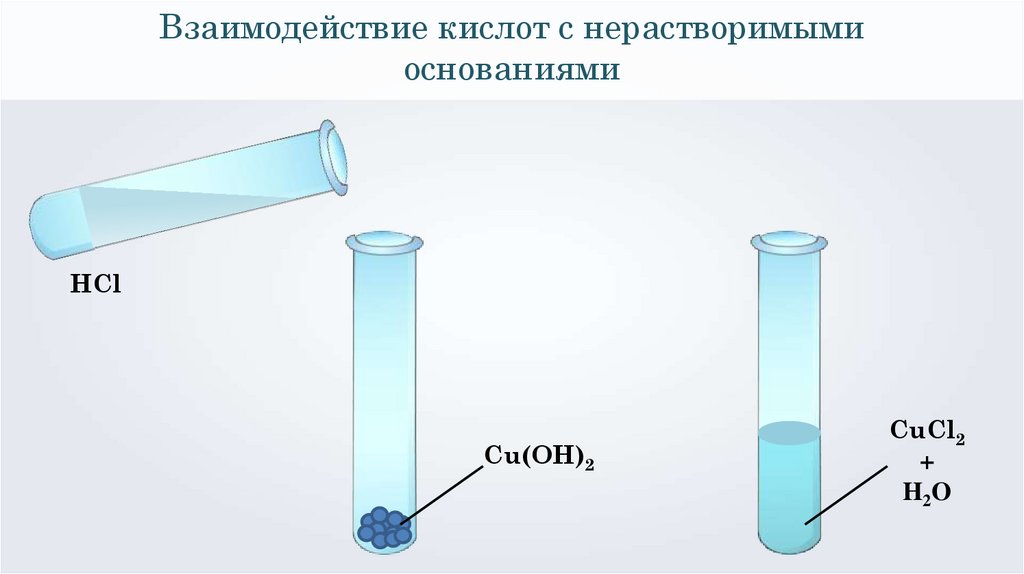
Взаимодействие кислот с нерастворимымиоснованиями
HCl
Cu(OH)2
CuCl2
+
H2O
22.
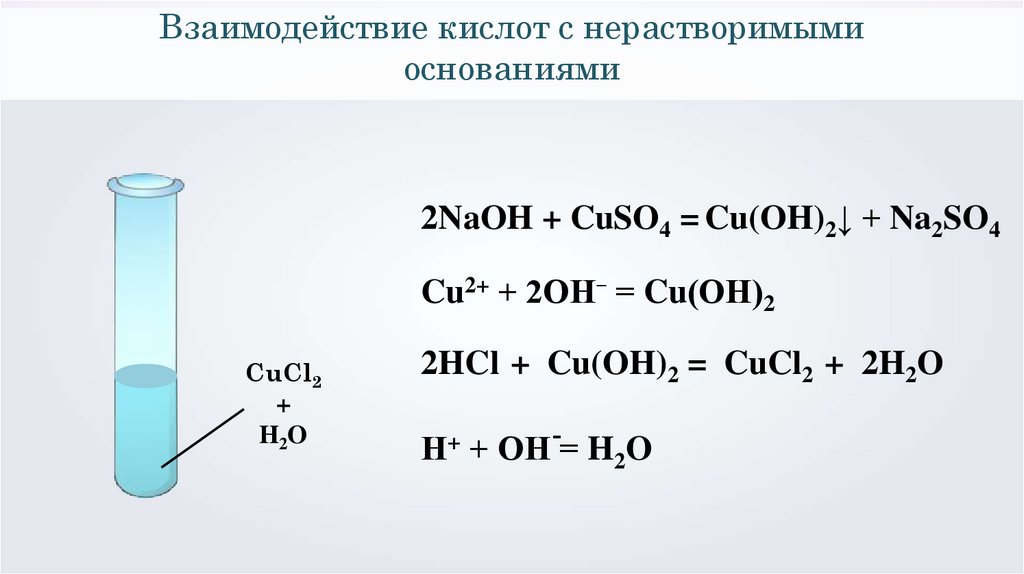
Взаимодействие кислот с нерастворимымиоснованиями
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4
Cu2+ + 2ОН⁻ = Cu(ОН)2
CuCl2
+
H2O
2HCl + Cu(OH)2 = CuCl2 + 2H2O
Н+ + ОН-= H2O
23.
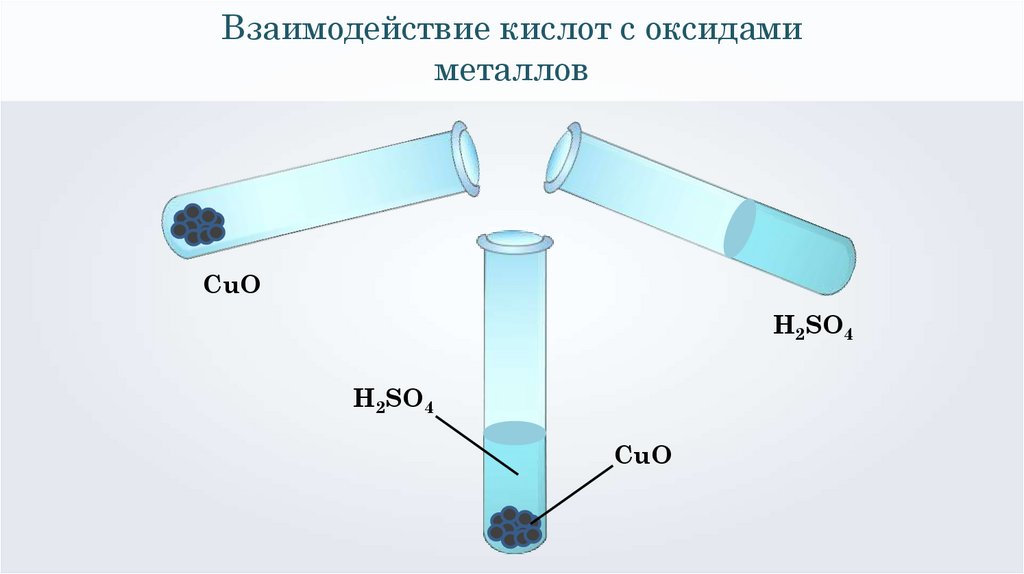
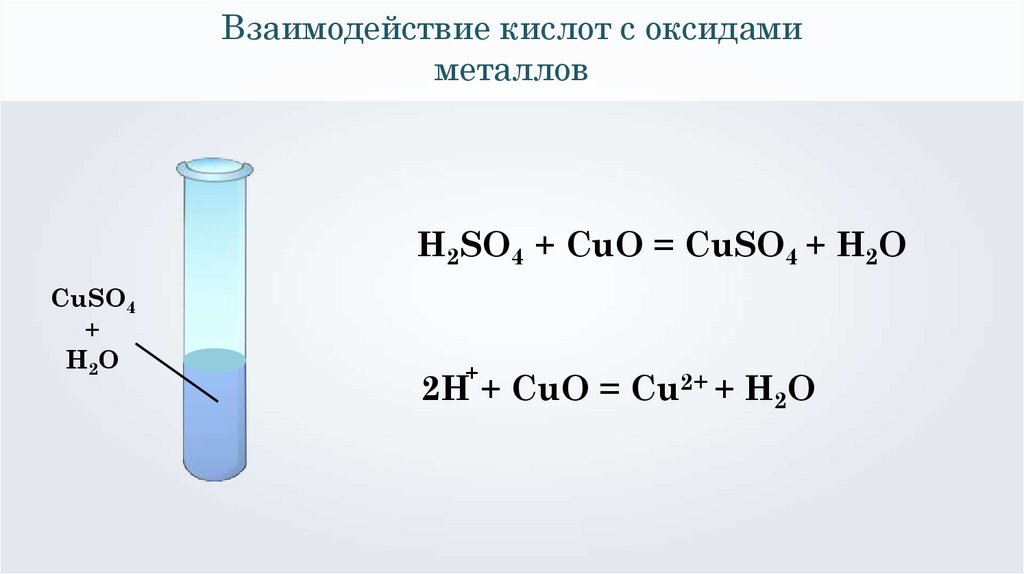
Взаимодействие кислот с оксидамиметаллов
CuO
H2SO4
H2SO4
CuO
24.
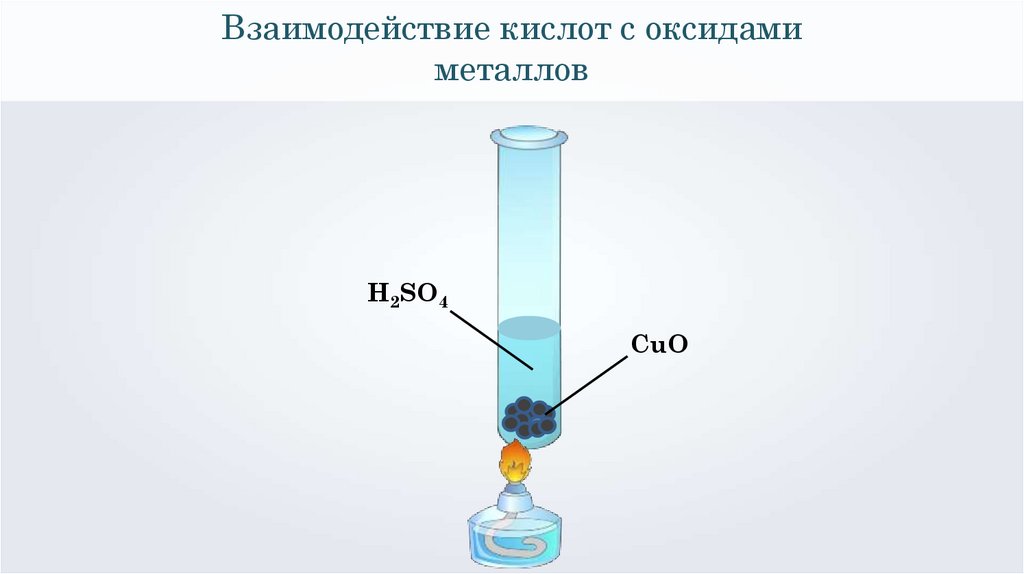
Взаимодействие кислот с оксидамиметаллов
H2SO4
CuO
25.
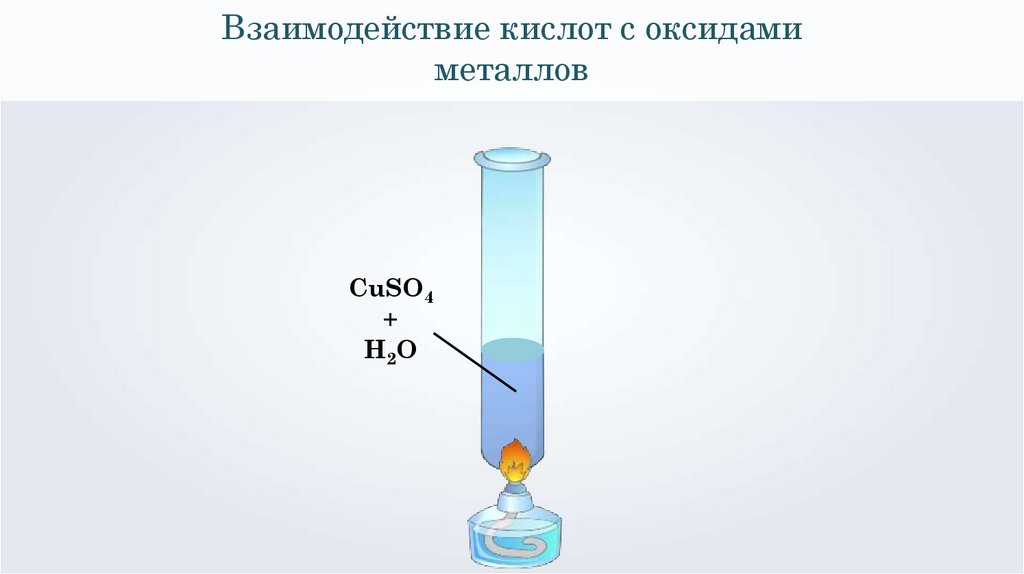
Взаимодействие кислот с оксидамиметаллов
CuSO4
+
H2O
26.
Взаимодействие кислот с оксидамиметаллов
H2SO4 + CuO = CuSO4 + H2O
CuSO4
+
H2O
+
2H + CuO = Cu2+ + H2O
27.
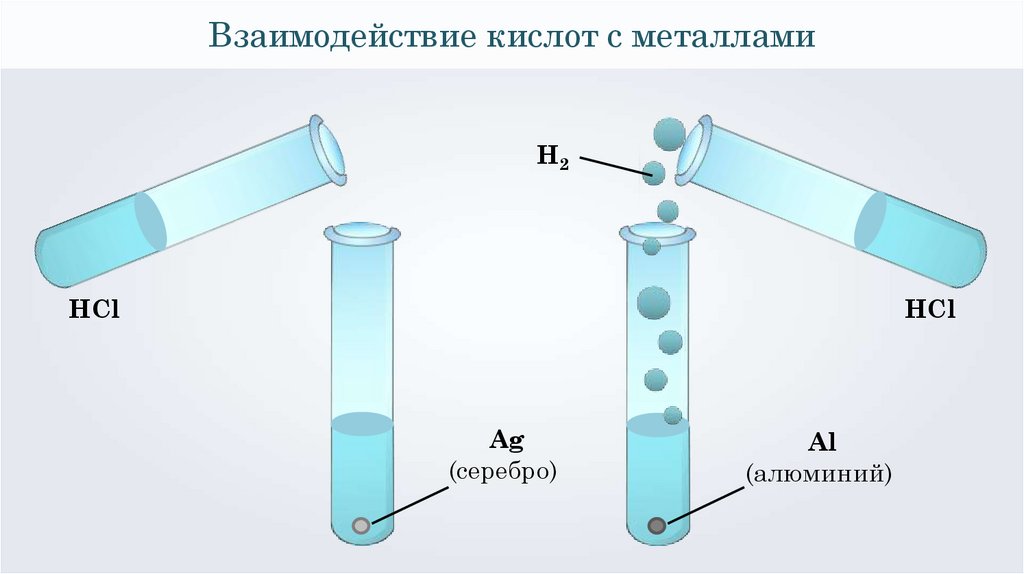
Взаимодействие кислот с металламиУсловия протекания этого типа реакций.
1. Металл, взаимодействующий с кислотой, должен находиться в
ряду напряжений металлов левее водорода.
Ряд напряжений металлов:
K, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au
28.
Взаимодействие кислот с металламиH2
HCl
HCl
Ag
(серебро)
Al
(алюминий)
29.
Взаимодействие кислот с металламиH2
0
+
3+
0
2Al + 6H = 2Al + 3H2 ↑
HCl
Ag
2Al + 6HCl = 2AlCl3 + 3H2↑
AlCl3
Ag + HCl ≠
30.
Взаимодействие кислот с металламиРяд напряжений металлов:
K, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au
31.
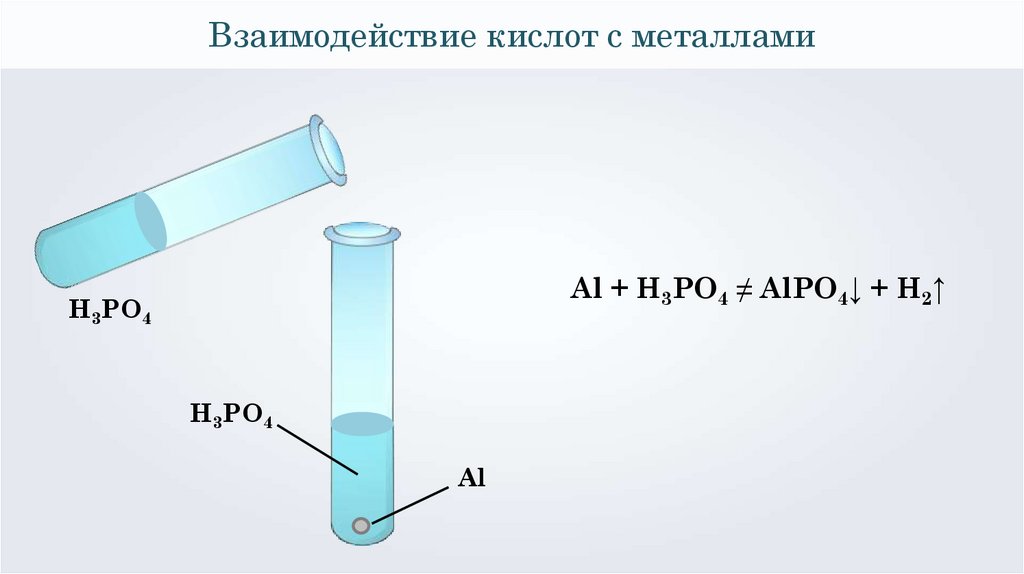
Взаимодействие кислот с металламиУсловия протекания этого типа реакций.
2. В результате реакции должна получиться растворимая соль, т.к.
в случае образования нерастворимой соли сразу образуется
нерастворимая пленка, и реакция полностью не идёт.
32.
Взаимодействие кислот с металламиAl + H3PO4 ≠ AlPO4↓ + H2↑
H3PO4
H3PO4
Al
33.
Взаимодействие кислот с металламиУсловия протекания этого типа реакций.
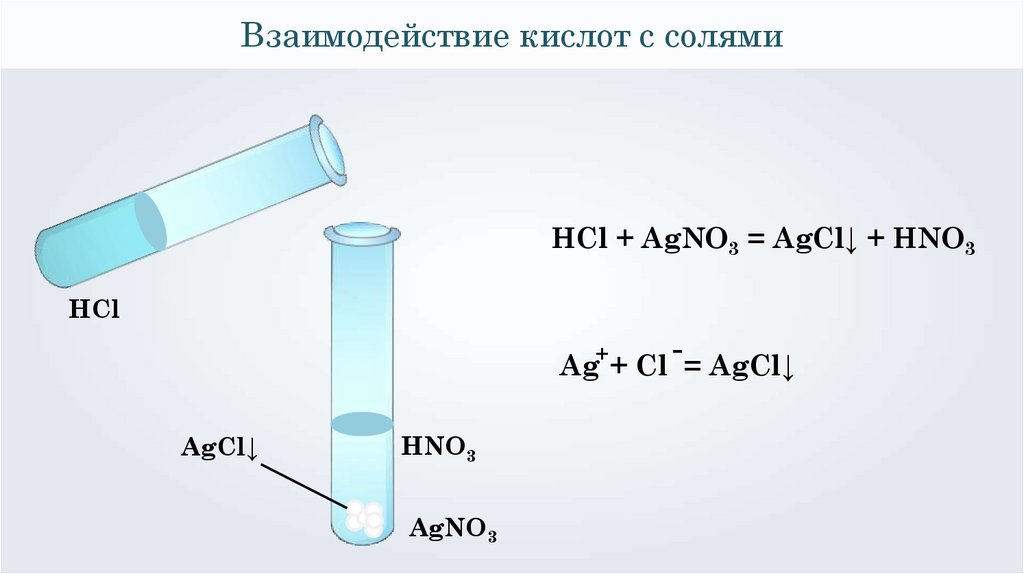
34.
Взаимодействие кислот с солямиHCl + AgNO3 = AgCl↓ + HNO3
HCl
+
Ag + Cl = AgCl↓
AgCl↓
HNO3
AgNO3
35.
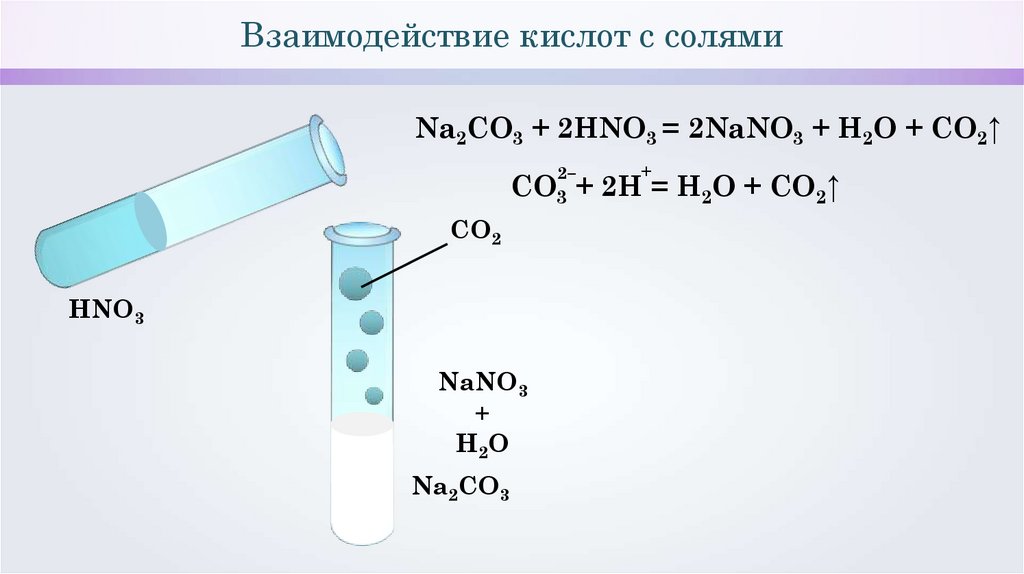
Взаимодействие кислот с солямиNa2CO3 + 2HNO3 = 2NaNO3 + H2O + CO2↑
2–
+
CO3 + 2H = H2O + CO2↑
CO2
HNO3
NaNO3
+
H2O
Na2CO3
36.
Кислоты взаимодействуют с основаниями,металлами, оксидами металлов и солями.




















 chemistry
chemistry