Similar presentations:
Степень окисления ОВР
1.
ХИМИЯ9 класс
Степень окисления
ОВР
Мария Дмитриевна Смирнова
Smirnova@sch2101.ru
Vk.com/masha2101
1
2.
Проверка ДЗ9м: H2SO4, SO2, NO2, HNO3, KMnO4
9ч:H2SO4 SO2 H2S
3.
ОВРРеакции протекающие с изменением степеней окисления – называются окислительновосстановительными реакциями (ОВР).
Окислитель – химический элемент, принимающие электроны в окислительновосстановительной реакции.
Восстановитель – химический элемент, отдающий электроны в ОВР.
S + O2 = SO2
S + H2 = H2S
S + K2Cr2O7 = Cr2O3 + K2SO4
4.
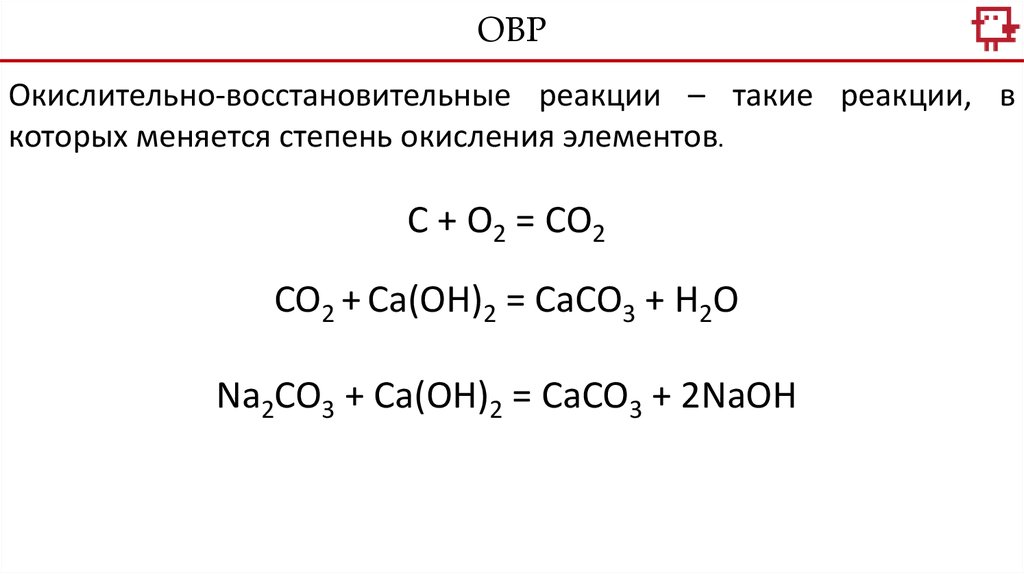
ОВРОкислительно-восстановительные реакции – такие реакции, в
которых меняется степень окисления элементов.
С + О2 = СО2
CO2 + Ca(OH)2 = CaCO3 + H2O
Na2CO3 + Ca(OH)2 = CaCO3 + 2NaOH
5.
ОВРОкислительно-восстановительные реакции – такие реакции, в
которых меняется степень окисления элементов.
e-
С + О2 = СО2
Процесс отдачи электронов называют окислением, а процесс
присоединения – восстановлением.
С – окисляется, но является восстановителем.
О – восстанавливается, но является окислителем.
6.
Метод электронно-ионного балансаОкислительно-восстановительные реакции бывает сложно уровнять.
K2Cr2O7 + H2SO4 + H2S = Cr2(SO4)3 + H2O + S + K2SO4
Метод электронно-ионного баланса
а) записывают формулы реагентов данной реакции и устанавливают химическую
функцию каждого из них (окислитель, кислотная среда реакции, восстановитель);
б) записывают формулы реагентов в ионном виде, указывая только те ионы, молекулы и
формульные единицы, которые примут участие в реакции в качестве окислителя, среды и
восстановителя
в)
определяют
восстановленную
форму
окислителя
и
окисленную
форму восстановителя, составляют электронно-ионные уравнения полуреакций
восстановления и окисления
г) суммируя уравнения полуреакций, составляют ионное уравнение данной реакции,
д) на основе ионного уравнения составляют молекулярное уравнение данной реакции
е) проводят проверку подобранных коэффициентов
7.
Метод электронно-ионного балансаK2Cr2O7 + 4H2SO4 + 3H2S = Cr2(SO4)3 + 7H2O + 3S(т) + K2SO4
Метод электронно-ионного баланса
а) записывают формулы реагентов данной реакции и устанавливают
химическую функцию каждого из них (окислитель, кислотная среда реакции,
восстановитель)
б) записывают формулы реагентов в ионном виде, указывая только те ионы, молекулы и формульные единицы,
которые примут участие в реакции в качестве окислителя, среды и восстановителя
в) определяют восстановленную форму окислителя и окисленную форму восстановителя, составляют электронноионные уравнения полуреакций восстановления и окисления
г) суммируя уравнения полуреакций, составляют ионное уравнение данной реакции,
д) на основе ионного уравнения составляют молекулярное уравнение данной реакции
е) проводят проверку подобранных коэффициентов
8.
Метод электронно-ионного балансаK2Cr2O7 + 4H2SO4 + 3H2S = Cr2(SO4)3 + 7H2O + 3S(т) + K2SO4
Cr2O72− + H+ + H2S
б) записывают формулы реагентов в ионном виде, указывая только те ионы,
молекулы и формульные единицы, которые примут участие в реакции в качестве
окислителя, среды и восстановителя
в) определяют восстановленную форму окислителя и окисленную форму восстановителя,
составляют электронно-ионные уравнения полуреакций восстановления и окисления
г) суммируя уравнения полуреакций, составляют ионное уравнение данной реакции,
д) на основе ионного уравнения составляют молекулярное уравнение данной реакции
е) проводят проверку подобранных коэффициентов
9.
Метод электронно-ионного балансаK2Cr2O7 + 4H2SO4 + 3H2S = Cr2(SO4)3 + 7H2O + 3S(т) + K2SO4
Cr2O72− + 14H+ + 6e− = 2Cr3+ + 7H2O
H2S − 2e− = S(т) + 2H+
в) определяют восстановленную форму окислителя и окисленную
форму восстановителя, составляют электронно-ионные уравнения полуреакций
восстановления и окисления
г) суммируя уравнения полуреакций, составляют ионное уравнение данной реакции,
д) на основе ионного уравнения составляют молекулярное уравнение данной реакции
е) проводят проверку подобранных коэффициентов
10.
Метод электронно-ионного балансаK2Cr2O7 + 4H2SO4 + 3H2S = Cr2(SO4)3 + 7H2O + 3S(т) + K2SO4
Cr2O72− + 8H+ + 3H2S = 2Cr3+ + 7H2O + 3S(т)
K2Cr2O7 + 4H2SO4 + 3H2S = Cr2(SO4)3 + 7H2O + 3S(т) + K2SO4
г) суммируя уравнения полуреакций, составляют ионное уравнение данной
реакции,
д) на основе ионного уравнения составляют молекулярное уравнение данной
реакции
е) проводят проверку подобранных коэффициентов
11.
Ещё один пример1. Сначала записываем схему реакции:
S + HNO3 = H2SO4 + NO
12.
Метод электронно-ионного баланса1. Сначала записываем схему реакции.
2. Определяем окислитель и восстановитель.
S + HNO3 = H2SO4 + NO
13.
Метод электронно-ионного баланса1.
2.
3.
Сначала записываем схему реакции.
Определяем окислитель и восстановитель.
Под схемой реакции записываем в ионном виде полуреакции окисления и
восстановления. Слабые электролиты, твёрдые и газообразные вещества
записываются в молекулярном виде.
S + HNO3 = H2SO4 + NO
1-я полуреакция: S0
2-я полуреакция:
SO42-
NO3- NO
14.
Метод электронно-ионного баланса1.
2.
3.
Сначала записываем схему реакции.
Определяем окислитель и восстановитель.
Под схемой реакции записываем в ионном виде полуреакции окисления и
восстановления. Слабые электролиты, твёрдые и газообразные вещества
записываются в молекулярном виде.
S + HNO3 = H2SO4 + NO
1-я полуреакция: S0 SO422-я полуреакция: NO3- NO, дополняем их
1-я полуреакция: S0 + 4H2O - 6e- SO42- + 8H+
2-я полуреакция: NO3- + 4H+ + 3e- NO + 2H2O
15.
Метод электронно-ионного баланса1.
2.
3.
4.
Сначала записываем схему реакции.
Определяем окислитель и восстановитель.
Под схемой реакции записываем в ионном виде полуреакции окисления и
восстановления. Слабые электролиты, твёрдые и газообразные вещества
записываются в молекулярном виде.
Балансируем заряд
S + HNO3 = H2SO4 + NO
S0 + 4H2O - 6e- SO42- + 8H+
NO3- + 4H+ + 3e- NO + 2H2O
16.
Метод электронно-ионного баланса1.
2.
3.
4.
5.
Сначала записываем схему реакции.
Определяем окислитель и восстановитель.
Под схемой реакции записываем в ионном виде полуреакции окисления и
восстановления. Слабые электролиты, твёрдые и газообразные вещества
записываются в молекулярном виде.
Балансируем заряд.
Суммируют обе полуреакции:
S0 + 4H2O + NO3- + 4H+ = SO42- + 8H+ + NO + 2H2O
S + 2HNO3 = H2SO4 + 2NO
17.
Метод электронно-ионного балансаПопробуем:
HCl + Cu + O2 CuCl2 + H2O
18.
Что будет на КР1) 10 заданий: меньше 4 – два; 5-6 – три; 7-8 – четыре; 9-10 – пять.
2) Одна задание на знание названия химических элементов и
веществ.
3) 3 задания на моль (примеры могут быть разными)
4) 3 задания на диссоциацию, в том числе степень диссоациации.
5) Одно задание на степень окисления и ОВР
6) Одна жесть-задача.

















 chemistry
chemistry








