Similar presentations:
Электронно-ионный баланс и Закон Авогадро. 8 класс
1.
Урок 8 классаЭлектронно-ионный баланс
И
Закон Авогадро
16.05.2016
1
2.
Метод электронно-ионного балансаОкислительно-восстановительные реакции бывает сложно уровнять.
K2Cr2O7 + H2SO4 + H2S = Cr2(SO4)3 + H2O + S + K2SO4
Метод электронно-ионного баланса
а) записывают формулы реагентов данной реакции и устанавливают химическую
функцию каждого из них (окислитель, кислотная среда реакции, восстановитель);
б) записывают формулы реагентов в ионном виде, указывая только те ионы, молекулы и
формульные единицы, которые примут участие в реакции в качестве окислителя, среды и
восстановителя
в) определяют восстановленную форму окислителя и окисленную
форму восстановителя, составляют электронно-ионные уравнения полуреакций
восстановления и окисления
г) суммируя уравнения полуреакций, составляют ионное уравнение данной реакции,
д) на основе ионного уравнения составляют молекулярное уравнение данной реакции
е) проводят проверку подобранных коэффициентов
16.05.2016
2
3.
Метод электронно-ионного баланса2e-
K2Cr2O7 + 4H2SO4 + 3H2S = Cr2(SO4)3 + 7H2O + 3S(т) + K2SO4
Метод электронно-ионного баланса
а) записывают формулы реагентов данной реакции и устанавливают
химическую функцию каждого из них (окислитель, кислотная среда реакции,
восстановитель)
б) записывают формулы реагентов в ионном виде, указывая только те ионы, молекулы и формульные единицы,
которые примут участие в реакции в качестве окислителя, среды и восстановителя
в) определяют восстановленную форму окислителя и окисленную форму восстановителя, составляют электронноионные уравнения полуреакций восстановления и окисления
г) суммируя уравнения полуреакций, составляют ионное уравнение данной реакции,
д) на основе ионного уравнения составляют молекулярное уравнение данной реакции
е) проводят проверку подобранных коэффициентов
16.05.2016
3
4.
Метод электронно-ионного балансаK2Cr2O7 + 4H2SO4 + 3H2S = Cr2(SO4)3 + 7H2O + 3S(т) + K2SO4
Cr2O72− + H+ + H2S
б) записывают формулы реагентов в ионном виде, указывая только те ионы,
молекулы и формульные единицы, которые примут участие в реакции в качестве
окислителя, среды и восстановителя
в) определяют восстановленную форму окислителя и окисленную форму восстановителя,
составляют электронно-ионные уравнения полуреакций восстановления и окисления
г) суммируя уравнения полуреакций, составляют ионное уравнение данной реакции,
д) на основе ионного уравнения составляют молекулярное уравнение данной реакции
е) проводят проверку подобранных коэффициентов
16.05.2016
4
5.
Метод электронно-ионного балансаK2Cr2O7 + 4H2SO4 + 3H2S = Cr2(SO4)3 + 7H2O + 3S(т) + K2SO4
Cr2O72− + 14H+ + 6e− = 2Cr3+ + 7H2O
H2S − 2e− = S(т) + 2H+
в) определяют восстановленную форму окислителя и окисленную
форму восстановителя, составляют электронно-ионные уравнения полуреакций
восстановления и окисления
г) суммируя уравнения полуреакций, составляют ионное уравнение данной реакции,
д) на основе ионного уравнения составляют молекулярное уравнение данной реакции
е) проводят проверку подобранных коэффициентов
16.05.2016
5
6.
Метод электронно-ионного балансаK2Cr2O7 + 4H2SO4 + 3H2S = Cr2(SO4)3 + 7H2O + 3S(т) + K2SO4
Cr2O72− + 8H+ + 3H2S = 2Cr3+ + 7H2O + 3S(т)
K2Cr2O7 + 4H2SO4 + 3H2S = Cr2(SO4)3 + 7H2O + 3S(т) + K2SO4
г) суммируя уравнения полуреакций, составляют ионное уравнение данной
реакции,
д) на основе ионного уравнения составляют молекулярное уравнение данной
реакции
е) проводят проверку подобранных коэффициентов
16.05.2016
6
7.
Основные ОВР2K + 2H2O = 2KOH + H2
HCl + Zn = ZnCl + 1/2H2
HNO3 + Cu = Cu(NO3)2 + NO + H2O
KNO3 = KNO2 + O2
Mg(NO3)2 = MgO + NO3 + O2
AgNO3 = Ag + NO2 + O2
16.05.2016
7
8.
Агрегатные состояния веществаТвёрдое
Жидкое
FeS2
Hg
16.05.2016
Газообразное
8
9.
Амедео АвогадроЗакон Авогадро:
В равных объёмах различных газов при одинаковых условиях
содержится одинаковое число молекул.
Закон Бойля – Мариотта
При постоянных температуре и массе газа произведение
давления газа на его объём постоянно.
p1V1=p2V2
Закон Гей-Люссака
Относительное изменение объёма данной массы газа при
неизменном давлении P пропорционально изменению
температуры.
V/T = const
Закон Шарля
P/T = const
16.05.2016
9
10.
Закон состояния идеального газаPV = νRT
ν – количество вещества, [моль]
P – давление, [Па]
V – объём, [м3]
R – универсальная газовая постоянная, [8. 31, Дж/(моль*К)]
T – температура, [К]
*0,0821 л·атм/моль·K
16.05.2016
10
11.
Закон АвогадроЗакон Авогадро:
В равных объёмах различных газов при одинаковых условиях содержится
одинаковое число молекул.
Следствие из закона Авогадро:
В равных объёмах газов при одинаковых условиях содержится
одинаковое число молекул, значит массы различных газов, в
которых содержится одинаковое число молекул, тоже должны
занимать одинаковые объёмы.
16.05.2016
11
12.
Эксперименты Ж.Л. Гей-ЛюссакаВ этом и других экспериментах неизменно обнаруживалось, что
газы реагируют между собой в простых целочисленных объемных
отношениях.
Гей-Люссак опубликовал свои наблюдения, не делая из них
никаких выводов. Важные выводы спустя три года сделал
итальянский химик Амедео Авогадро. Он предположил,
что РАВНЫЕ ОБЪЕМЫ любых газов содержат РАВНОЕ ЧИСЛО
МОЛЕКУЛ.
2 H2 + O2 = 2 H2O
Жозеф Луи Гей-Люссак
H2
2 моль
16.05.2016
О2
1
моль
12
13.
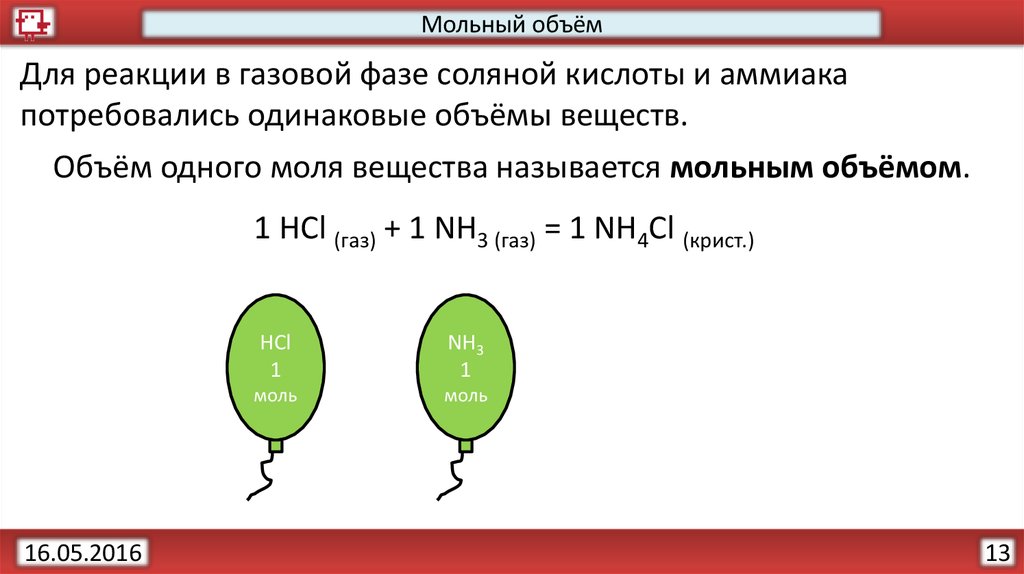
Мольный объёмДля реакции в газовой фазе соляной кислоты и аммиака
потребовались одинаковые объёмы веществ.
Объём одного моля вещества называется мольным объёмом.
1 HCl (газ) + 1 NH3 (газ) = 1 NH4Cl (крист.)
16.05.2016
HCl
1
NH3
1
моль
моль
13
14.
Мольный объёмМоль — единица измерения количества вещества в
Международной системе единиц (СИ), одна из семи основных
единиц СИ.
Ne
1
моль
16.05.2016
14
15.
Мольный объёмМоль любого вещества содержит равное число частиц
(атомов, молекул, электронов).
Моль есть количество вещества системы, содержащей столько же
структурных элементов, сколько содержится атомов в углероде-12
(С12) массой 0,012 кг.
Ne
1
моль
16.05.2016
=
1г
=
5 карат
15
16.
Постоянная АвогадроКоличество частиц в одном моле вещества называется числом
Авогадро. Но определено оно было только в конце XIX.
Был такой эксперимент:
Взяли 0,5 г радия и выдержали год в сосуде, который сначала
сделали «пустым», объёмом 30 мл. Известно, что за секунду 1г
радия испускает 3,7·1010 альфа-частиц (ядра гелия), которые
реагируют со стенками сосуда и превращаются в атомы гелия.
За год давление в сосуде выросло до 7,95·10-4 атм (при температуре
27 оС). Изменением массы радия за год можно пренебречь. Итак,
чему равна NA?
16.05.2016
16
17.
Постоянная АвогадроНайдем, сколько альфа-частиц (то есть атомов гелия) образовалось за один год.
Обозначим это число как N атомов:
N = 3,7·1010 · 0,5 г · 60 сек · 60 мин · 24 час · 365 дней = 5,83·1017 атомов.
Запишем уравнение Клапейрона-Менделеева PV = nRT и заметим, что число молей
гелия n = N/NA. Отсюда:
Таким образом, в каждом моле
любого вещества содержится
6.02*1023
16.05.2016
Ne
1
моль
Ne
6.02*
1023
17
















 chemistry
chemistry








