Similar presentations:
Оксид кремния
1.
Оксид кремнияSiO2
SiO
2.
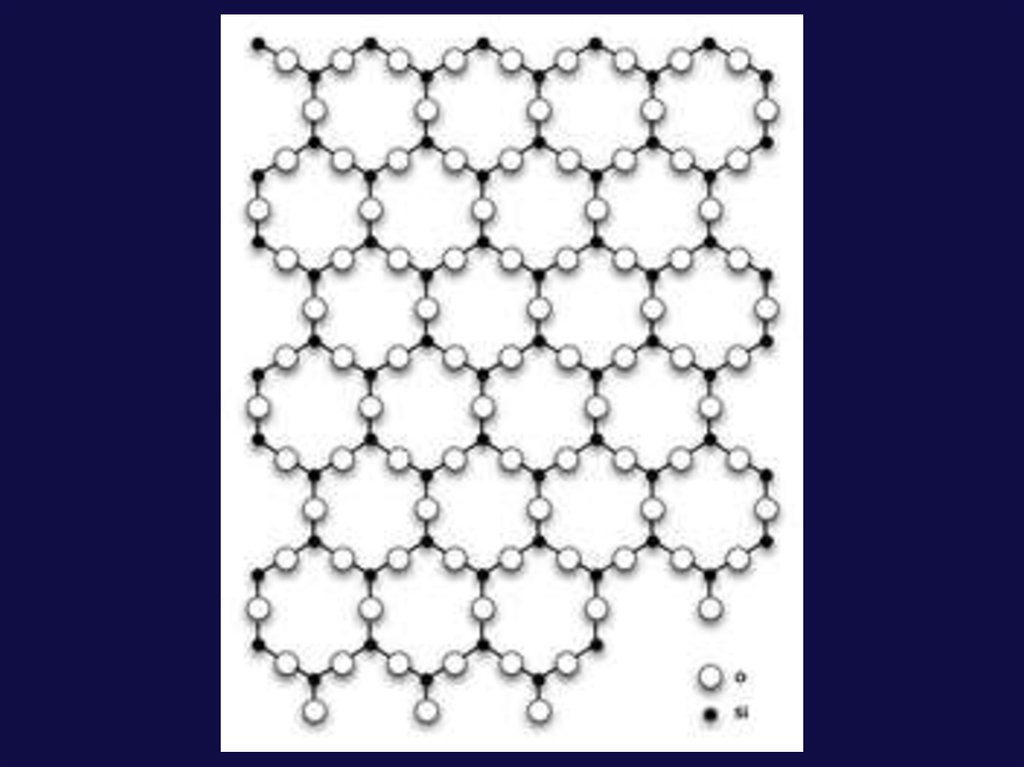
Оксид кремния— смолоподобноеаморфное или кристаллическое
вещество, при обычных условиях
устойчиво к действию кислорода.
Относится к несолеобразующим
оксидам.
3.
Вещество имеет много полиморфныхмодификаций, наиболее часто
встречается в двух видах:
•кристаллический - в виде
природного минерала кварца, а
также его разновидностей
(халцедон, горный хрусталь,
яшма, агат, кремень);
•аморфный встречается в виде
природного минерала опала,
состав которого можно описать
формулой SiO2, его формами
являются трепел (горная мука)
или диатомит, силикагель.
яшма
агат
опал
силикагель
4. Физические свойства кремния
1) Кристаллический кремний – веществосеребристо-серого цвета с металлическим
блеском, кристаллическая решетка типа алмаза;
является полупроводником. Кристаллический
кремний обладает стальным блеском.
2) Аморфный кремний – порошок бурого
цвета.
Кремний растворим в расплавленных
металлах. При медленном охлаждении
раствора кремния в цинке или в
алюминии кремний выделяется в виде
хорошо образованных кристаллов
октаэдрической формы.
5. Получение
Свободный кремний можно получитьпрокаливанием с магнием мелкого белого
песка, который представляет собой
диоксид кремния:
SiO2 + 2 Mg -> 2 MgO + Si
При этом образуется бурый порошок
аморфного кремния.
6. Химические свойства
1. При нагревании аморфныйкремний легко соединяется с
кислородом, галогенами и
серой.
Si + O2 =SiO2
Si + 2F2 = SiF4
Si + 2HaI2 =SiHaI4
Si + 2S =SiS2
3Si + 2N2 =Si3N4
Si + C =SiC
7.
2. С водородом кремнийнепосредственно не реагирует.
3. Кислоты, кроме, смеси
фтористоводородной и азотной
(плавиковой), не действуют на кремний:
3 Si + 4 HNO3 + 18 HF ═ 3 H2SiF6 + 4 NO + 8 H2O
4. Реагирует с растворами щелочей с
образованием силикатов и выделением
водорода:
Si + 2 КОН + Н2O = К2SiO3 + 2 H2 ↑
8.
5. При высокой температуре кремнийвступает в соединение со многими
металлами, образуя силициды.
Например, при нагревании диоксида
кремния с избытком металлического
магния восстанавливающийся кремний
соединяется с магнием, образуя силицид
магния Mg2Si:
4 Mg + SiO2 = Mg2Si + 2 MgO
9.
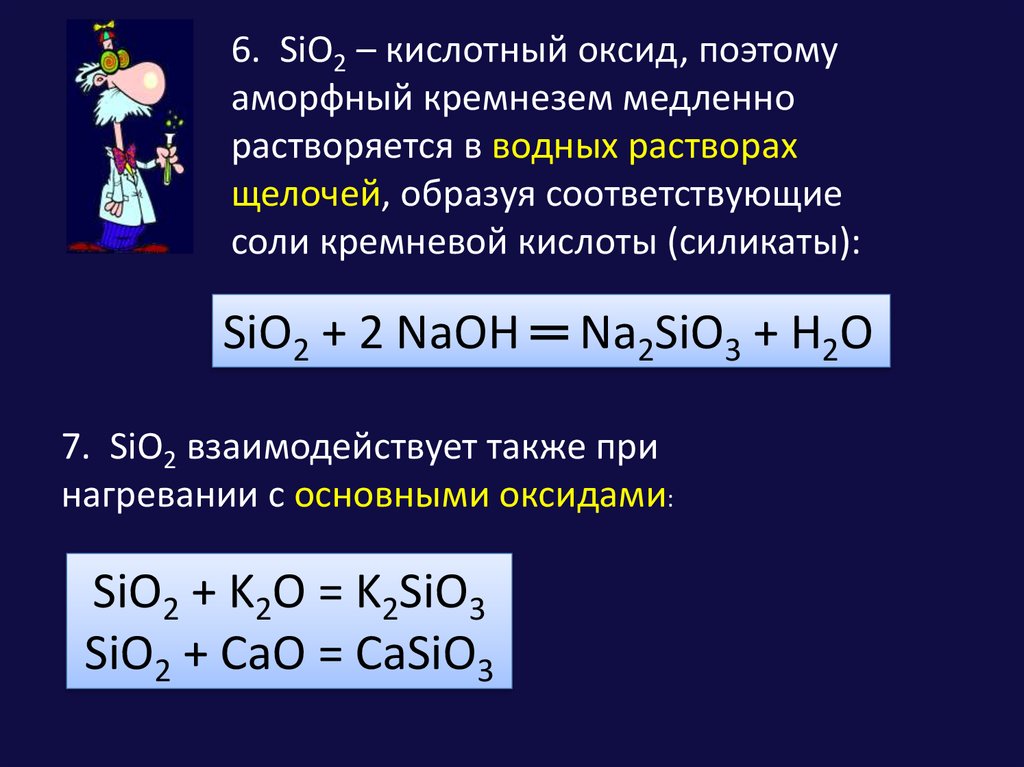
6. SiO2 – кислотный оксид, поэтомуаморфный кремнезем медленно
растворяется в водных растворах
щелочей, образуя соответствующие
соли кремневой кислоты (силикаты):
SiO2 + 2 NaOH ═ Na2SiO3 + H2O
7. SiO2 взаимодействует также при
нагревании с основными оксидами:
SiO2 + K2O = K2SiO3
SiO2 + CaO = CaSiO3
10.
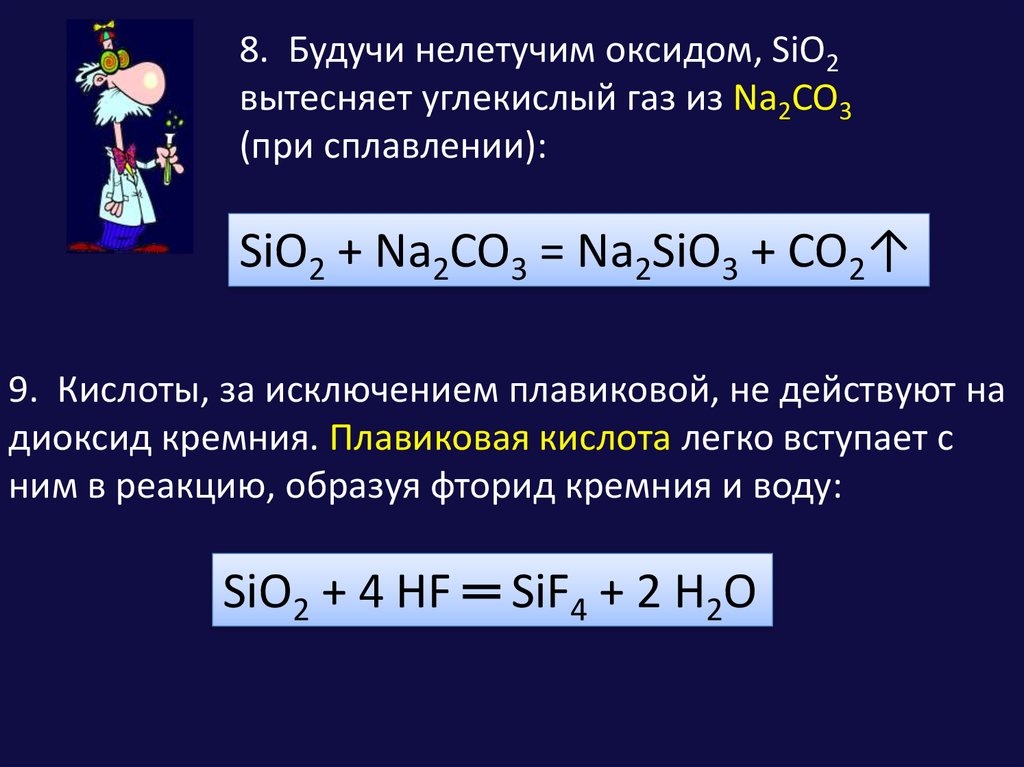
8. Будучи нелетучим оксидом, SiO2вытесняет углекислый газ из Na2CO3
(при сплавлении):
SiO2 + Na2CO3 = Na2SiO3 + CO2↑
9. Кислоты, за исключением плавиковой, не действуют на
диоксид кремния. Плавиковая кислота легко вступает с
ним в реакцию, образуя фторид кремния и воду:
SiO2 + 4 HF ═ SiF4 + 2 H2O
11. Применение
Диоксид кремния применяют в производствестекла, керамики, абразивов, бетонных изделий.
Кристаллы кварца обладают пьезоэлектрическими
свойствами и поэтому используются в
радиотехнике, ультразвуковых установках, в
зажигалках.
12.
Аморфный непористый диоксид кремнияприменяется в пищевой промышленности в качестве
E551, в фармацевтической промышленности в
качестве энтеросорбента (это вещества, которые
связывают и удерживают в себе все токсичные и
ядовитые элементы).
Искусственно полученные плёнки диоксида кремния
используются в качестве изолятора при производстве
микросхем.
Также используется для производства волоконнооптических кабелей.










 chemistry
chemistry








