Similar presentations:
Кремний. Оксид кремния (IV)
1.
Кремний.Оксид кремния (IV)
Презентация по химии 9 класс
Учитель химии Тарасенко Т.В.
2.
Открытие кремнияКремний открыл и получил в 1823 году
шведский химик Йенс Якоб Берцелиус.
Второй по распространённости элемент
в земной коре после кислорода (27,6%
по массе). Встречается в соединениях.
3.
Расположение кремния вПСХЭ
O Период, группа, порядковый
O
O
O
O
O
номер,заряд ядра?
Электронная формула
Количество электронов на внешнем
уровне
Валентность, степень окисления
Высший оксид
Летучее водородное соединение
4.
Расположение кремния вПСХЭ
O Период 3 малый, группа-IVA,
O
O
O
O
O
порядковый номер-14, заряд ядра +14
Электронная формула 1s22s2p63s23p4
Количество электронов на внешнем
уровне- 4
Валентность IV, степень окисления0,+4,-4.
Высший оксид-SiO2
Летучее водородное соединение-SiH4
5.
Аллотропия кремнияКристаллический – тёмно-серое
вещество с металлическим блеском,
большая твёрдость, хрупок,
полупроводник; ρ = 2,33 г/см3, t°пл.
=1415°C; t°кип. = 2680°C.
Имеет алмазоподобную структуру и
образует прочные ковалентные
связи. Инертен.
Аморфный - бурый порошок,
гигроскопичен, алмазоподобная
структура, ρ = 2 г/см3, более
реакционноспособен.
6.
Получение кремнияO Запишите уравнение реакции
получения кремния в лаборатории.
O Запишите уравнение реакции
получения кремния в промышленности.
7.
Получение кремния1) Промышленность – нагревание угля
с песком:
t˚
2C + SiO2 → Si + 2CO
2) Лаборатория – нагревание песка с
магнием:
t˚
2Mg + SiO2 → Si + 2MgO
8.
Химические свойстваВещества, реагирующие с
кремнием
Уравнения реакция
С кислородом
Si0 + O2 → Si+4O2
С фтором
Si0 + 2F2 → t˚SiF4
С углеродом
Si0 + C → Si+4C
t˚
SiC - карборунд - твёрдый; используется
для точки и шлифовки
Со щелочами
Si0 + 2NaOH + H2O t˚→ Na2Si+4O3+ 2H2
С кислотами не
реагирует (только с
плавиковой кислотой)
Si+4HF=SiF4+2H2
С водородом не
взаимодействует.
Силан (SiH4) получают разложением силицидов металлов
кислотой:
Mg2Si + 2H2SO4 → SiH4 + 2MgSO4
Кремний- восстановитель
9.
Химические свойстваВещества, реагирующие с
кремнием
Уравнения реакция
С металлами (образуются
силициды)
Si0 + 2Mg → Mg2Si-4
Кремний-окислитель
t˚
10.
ПрименениеКремний широко используется в
электронике как полупроводник. Добавки
кремния к сплавам повышают их
коррозионную стойкость. Силикаты,
алюмосиликаты и кремнезем – основное
сырье для производства стекла и
керамики, а также для строительной
промышленности.
11.
12.
Силан - SiH4Физические свойства:
Бесцветный газ, ядовит, t°пл. = -185°C,
t°кип. = -112°C.
O Получение: Mg2Si + 4HCl → 2MgCl2 +
SiH4↑
O Химические свойства:
1)
Окисление: SiH4 + 2O2 t˚→ SiO2 +
2H2O
2)
Разложение: SiH4 → Si + 2H2
13.
Оксид кремния (IV) - (SiO2)n14.
Оксид кремния (IV) - (SiO2)n15.
Al2O3 • 2SiO2 • 2H2O –каолинит (основная часть глины)
16.
K2O • Al2O3 • 6SiO2 - ортоклаз(полевой шпат)
17.
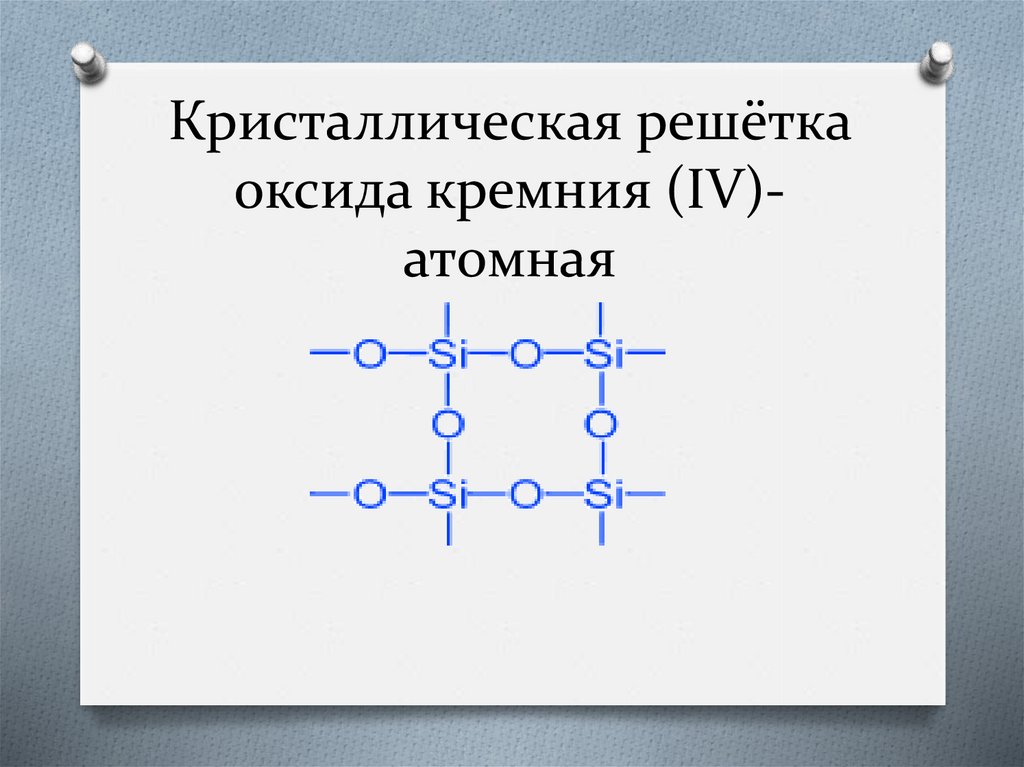
Кристаллическая решёткаоксида кремния (IV)атомная
18.
Физические свойства:Твёрдое, кристаллическое, тугоплавкое
вещество, t°пл.= 1728°C, t°кип.= 2590°C
19.
Химические свойства:Кислотный оксид. При сплавлении
взаимодействует с основными оксидами,
щелочами, а также с карбонатами
щелочных и щелочноземельных
металлов
20.
Веществареагирующие с
оксидом кремния
(IV)
Уравнения реакций
С основными
оксидами
SiO2 + CaO →
Со щелочами
SiO2 + 2NaOH →
С солями
SiO2 + CaCO3 →
С плавиковой
кислотой
SiO2 + 4HF →
С водой не
реагирует
t˚
CaSiO3
t˚
t˚
t˚
Na2SiO3 + H2O
CaSiO3 + CO2
SiF4 + 2H2O
21.
ПрименениеO 1. Изготовление силикатного кирпича
O 2. Изготовление керамических изделий
O 3. Получение стекла
22.
Домашнее заданиеO §30,31
O Задача 1 стр.101
23.
Источник информацииhttps://sites.google.com/site/himulacom/zvo
nok-na-urok/9-klass---vtoroj-godobucenia/urok-no42-kremnij-i-ego-soedineniasteklo-cement






















 chemistry
chemistry








