Similar presentations:
Кремний. Строение атома кремния
1.
2.
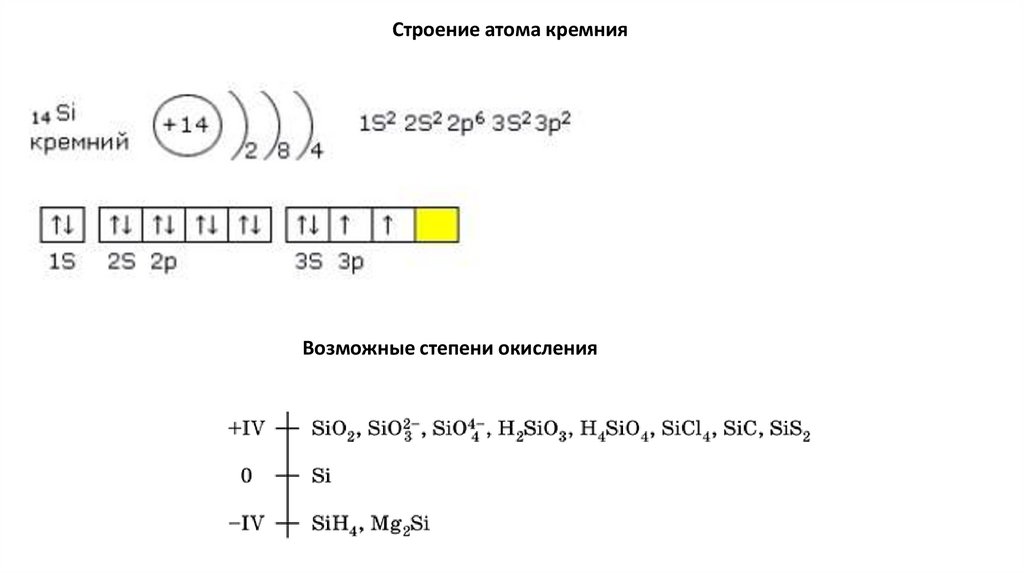
Строение атома кремнияВозможные степени окисления
3.
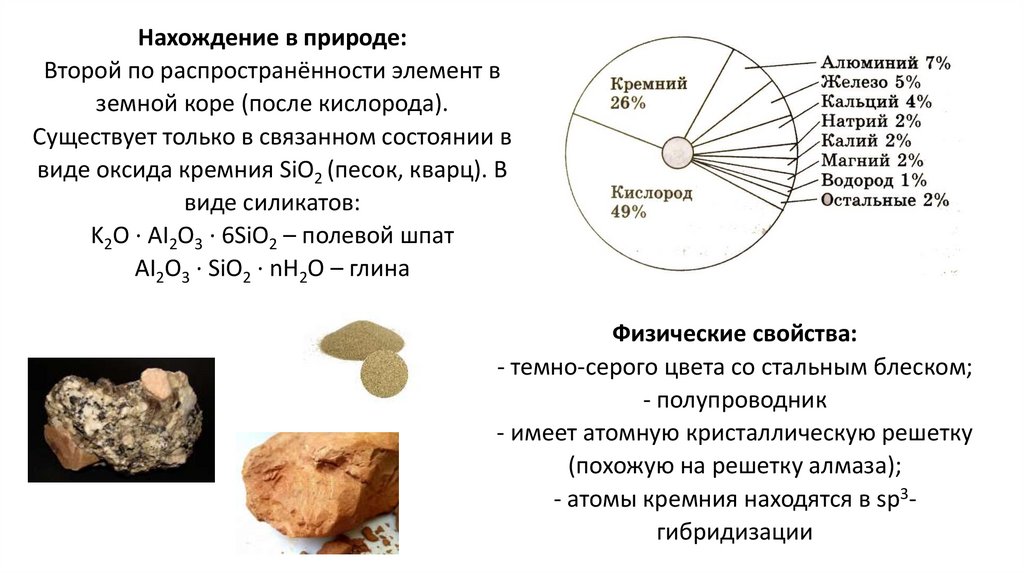
Нахождение в природе:Второй по распространённости элемент в
земной коре (после кислорода).
Существует только в связанном состоянии в
виде оксида кремния SiO2 (песок, кварц). В
виде силикатов:
K2O ∙ AI2O3 ∙ 6SiO2 – полевой шпат
АI2O3 ∙ SiO2 ∙ nH2O – глина
Физические свойства:
- темно-серого цвета со стальным блеском;
- полупроводник
- имеет атомную кристаллическую решетку
(похожую на решетку алмаза);
- атомы кремния находятся в sp3гибридизации
4. Химические свойства: При обычных условиях весьма инертен, но при нагревании, особенно в аморфном состоянии, реагирует со
многими веществами, проявляя свойства как окислителя, так и восстановителя.Кремний – восстановитель
С неметаллами
При комнатной температуре непосредственно взаимодействует только со фтором:
Si + 2F = SiF4
С хлором реагирует только при нагревании до 400-600оС:
Si + 2CI2 = SiCI4
Галогениды кремния в водных растворах гидролизуются:
SiF4 + 3H2O = H2SiO3 + 4HF
SiCI4 + 3H2O = H2SiO3 + 4HCI
Измельченный кремний при нагревании до 400-600оС реагирует с кислородом:
Si + O2 = SiO2
При очень высокой температуре реагирует с углеродом с образованием карбида
кремния (карборунда):
Si + C = SIC
При температуре около 1000оС кремний реагирует с азотом с образованием
нитрида кремния (IV):
2+ 2N2 = Si3N2
С водородом кремний непосредственно не взаимодействует.
5.
С водойКремний вытесняет водород из перегретого пара,
окисляясь до оксида:
Si + 2H2O = SiO2 + 2H2
С кислотами Кремний устойчив к действию кислот, он взаимодействует
только с фтороводородной, а также со смесью плавиковой и
азотной кислот:
Si + 4HF = SiF4 + 2H2
3Si + 18HF + 4HNO3 = 3H2[SiF6] + 4NO + 8H2O
Со щелочами
Кремний взаимодействует со щелочами с выделением
водорода и образованием силиката:
Si + 2NaOH + H2O = Na2SiO3 + H2
6.
Кремний - окислительС металлами
Окислительные свойства для кремния менее характерны, но они
проявляются в реакциях с металлами, при этом образует силициды:
2Ca + Si = Ca2Si
2Mg + Si = Mg2Si
Силициды легко гидролизуются с образованием силана SiH4 –
соединения, подобного метану:
Ca2Si + 4HCI = 2CaCI2 + SIH4
Mg2Si + 4HCI = 2MgCI2 + SiH4
Силан представляет собой бесцветный газ, самовоспламеняющийся на
воздухе, сгорающий при этом с образованием оксида кремния (IV) и
воды:
SiH4 + 2O2 = SiO2 + 2H2O








 chemistry
chemistry








