Similar presentations:
Галогенпроизводные алифатических углеводородов
1. Галогенпроизводные алифатических углеводородов
2. Галогенпроизводные
Это производные, которые можно получить путёмзамещения в молекулах углеводородов одного или
нескольких атомов водорода атомами галогенов.
Насыщенные и ненасыщенные
Моногалогенпроизводные
полигалогенпроизводные
3. Галогенпроизводные Номенклатура и изомерия
12
3
H3C CH2
2
1
CH2
Br
3
4
H3C CH CH2
Br
3
4
1-бромпропан
бромистый изопропил
CH3
2
H3C CH CH
Br
4
3
2
H3C CH CH
Br
1
CH3
Br
2,3-дибромбутан
CH3
2-бромбутан
бромистый втор-бутил
1
CH3
2-метил-3-бромбутан
бромистый втор-изоамил
Br
1 2
H3C C
3
CH2
Br
2,2-дибромбутан
4
CH3
4. Галогенпроизводные Способы получения
1. Непосредственное действие галогенаCH4
+ Cl2
- HCl
CH3Cl
+ Cl2
+ Cl2
+ Cl2
CH2Cl2
CHCl3
CCl4
- HCl
- HCl
- HCl
Cl > Br >> J
Недостаток – всегда получается смесь моно- и
полигалогенпроизводных.
5. Галогенпроизводные Способы получения
2. Действие галогенводорода на спиртыC2H5OH + HBr
C2H5Br + H2O
H2SO4
3. Действие на спирты галогенида фосфора
3 C2H5OH + PJ3
3 J2 + 2 P
3 C2H5J + H3PO3
6. Галогенпроизводные Способы получения
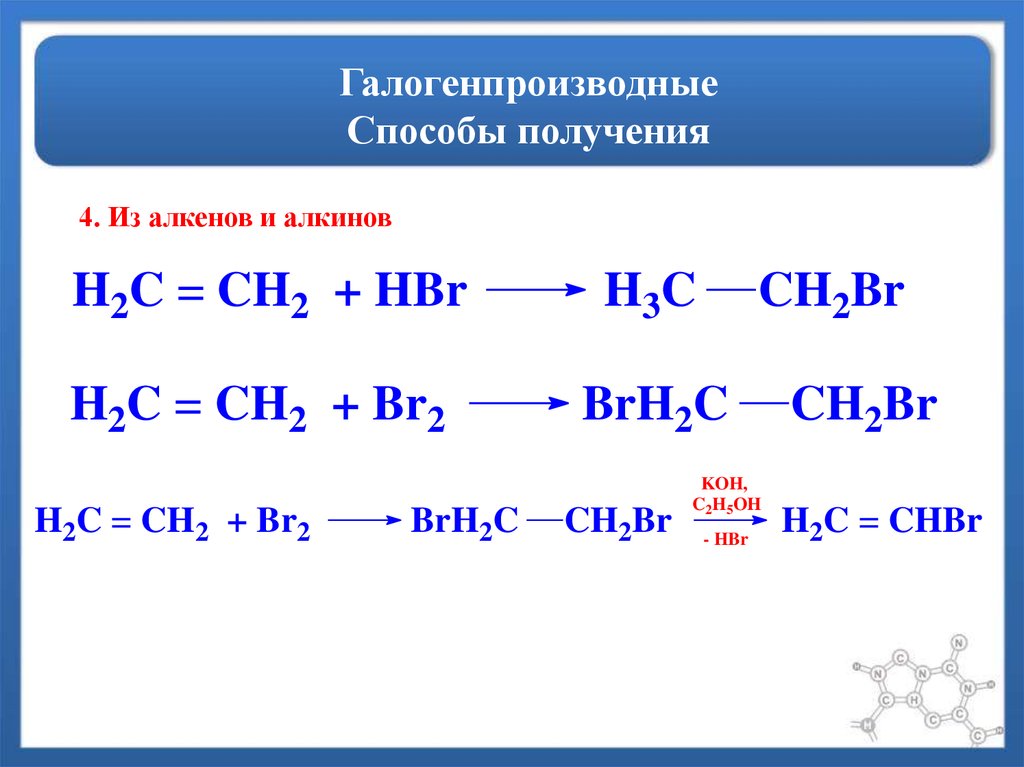
4. Из алкенов и алкиновH2C = CH2 + HBr
H3C
H2C = CH2 + Br2
BrH2C
H2C = CH2 + Br2
BrH2C
CH2Br
CH2Br
KOH,
C2H5OH
- HBr
CH2Br
H2C = CHBr
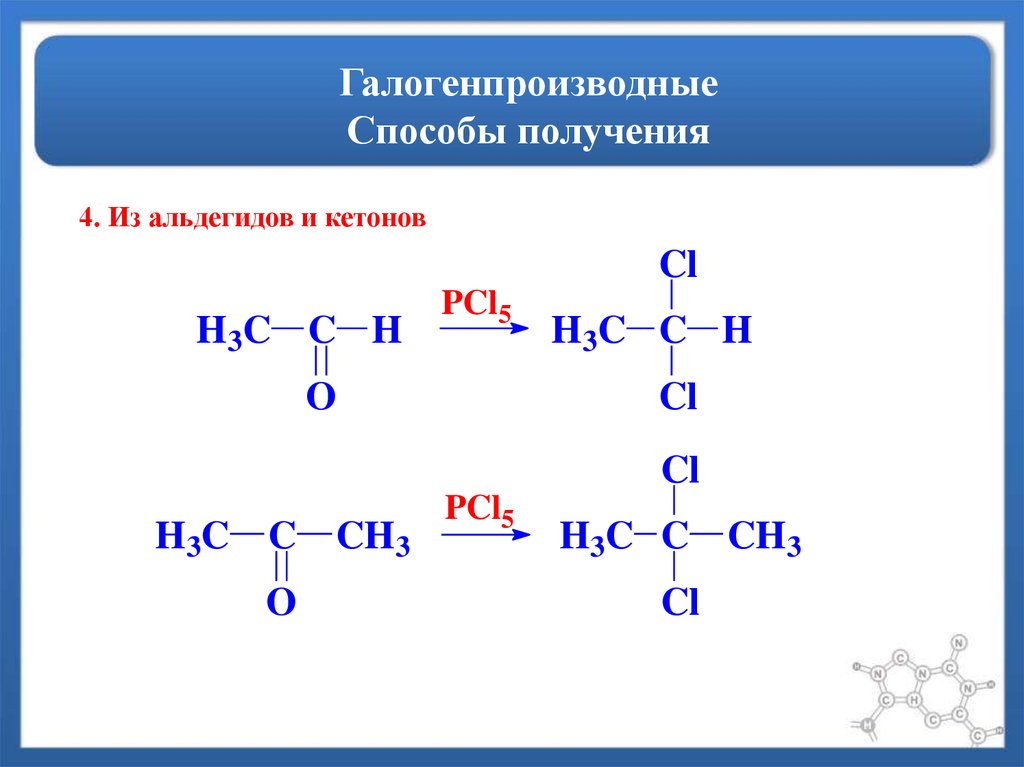
7. Галогенпроизводные Способы получения
4. Из альдегидов и кетоновCl
H 3C C H
PCl5
O
H 3C C H
Cl
Cl
H3C C CH3
O
PCl5
H3C C CH3
Cl
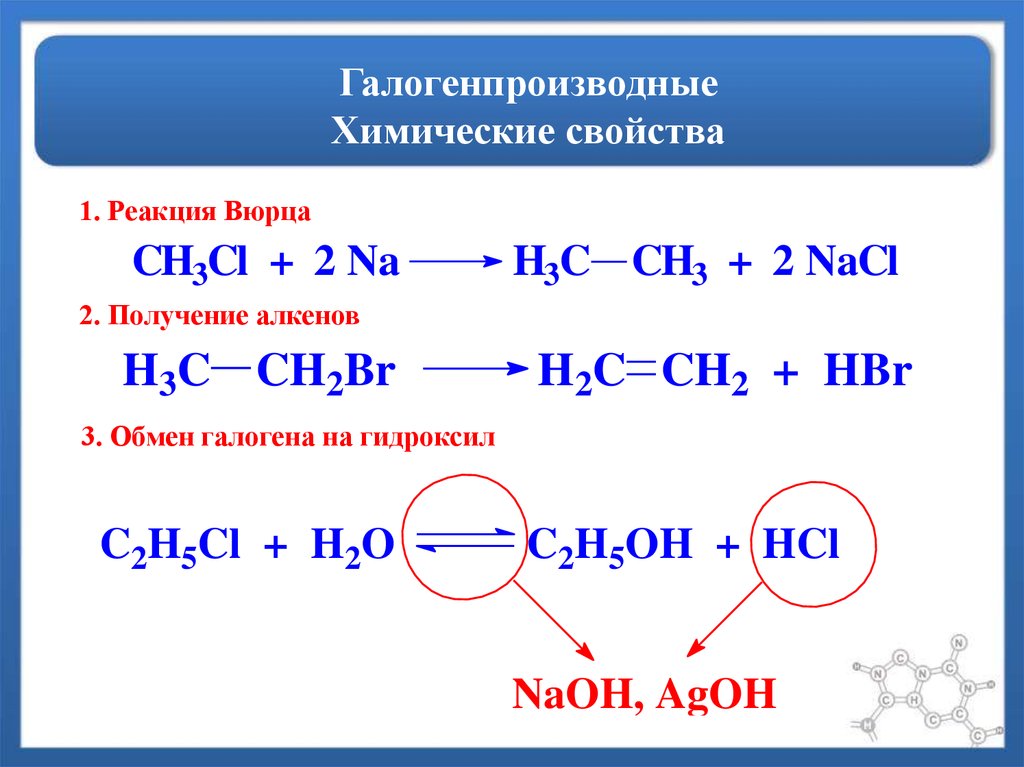
8. Галогенпроизводные Химические свойства
1. Реакция ВюрцаCH3Cl + 2 Na
H3C CH3 + 2 NaCl
2. Получение алкенов
H3C CH2Br
H2C CH2 + HBr
3. Обмен галогена на гидроксил
C2H5Cl + H2O
C2H5OH + HCl
NaOH, AgOH
9. Спирты
10. Спирты
Это соединения, которые можно получить в результатезамещения в углеводородах одного или нескольких атомов
водорода одной или несколькими гидрокси группами.
Одноатомные R – OH
Двухатомные R – (OH)2
Трёхатомные R – (OH)3
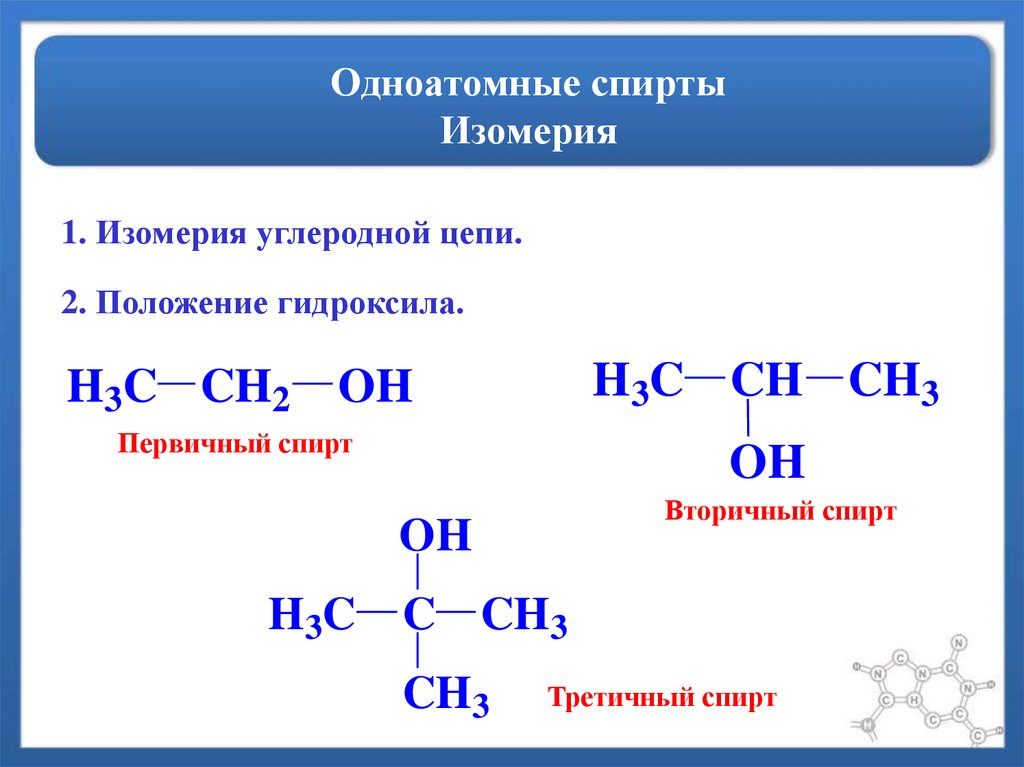
11. Одноатомные спирты Изомерия
1. Изомерия углеродной цепи.2. Положение гидроксила.
H3C CH CH3
H3C CH2 OH
Первичный спирт
OH
Вторичный спирт
OH
H3C C CH3
CH3
Третичный спирт
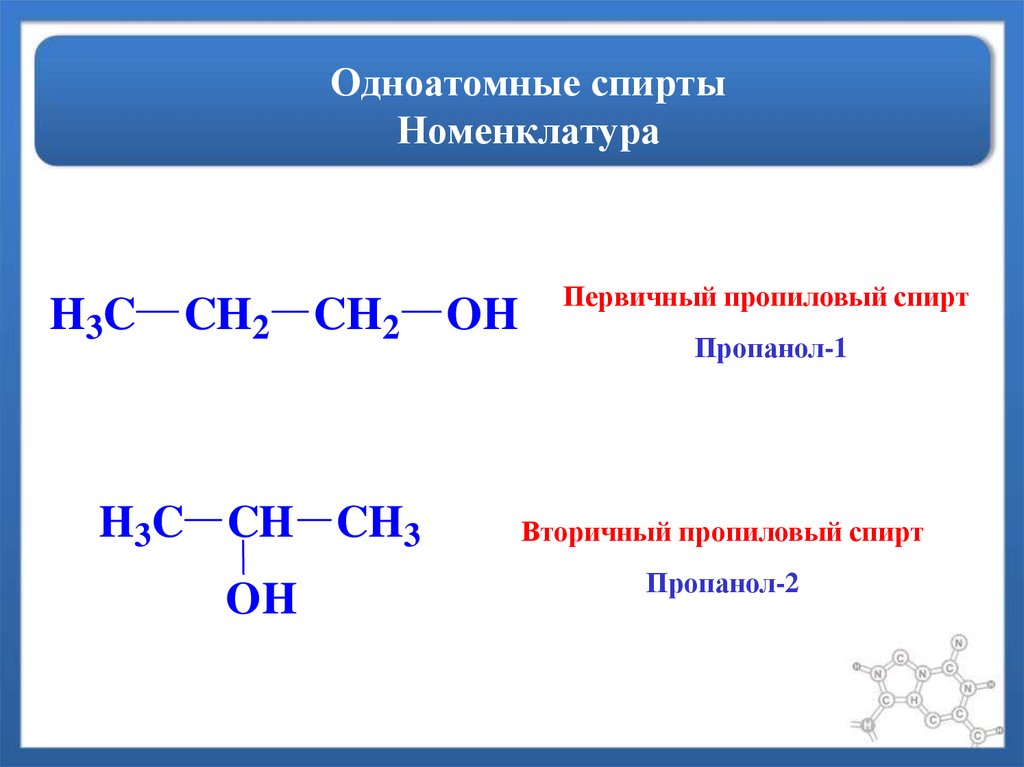
12. Одноатомные спирты Номенклатура
H3CCH2 CH2
H3C CH CH3
OH
OH
Первичный пропиловый спирт
Пропанол-1
Вторичный пропиловый спирт
Пропанол-2
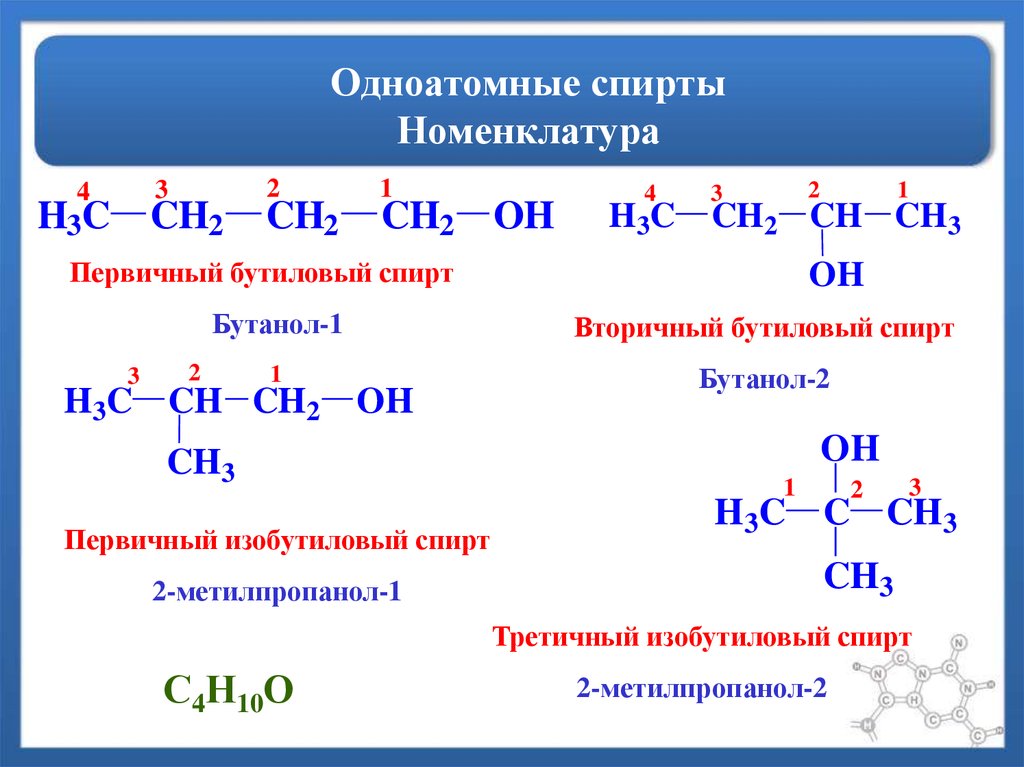
13. Одноатомные спирты Номенклатура
34
H3C CH2
2
CH2
1
CH2 OH
4
H 3C
2
3
CH2 CH CH3
Первичный бутиловый спирт
3
1
OH
Бутанол-1
Вторичный бутиловый спирт
1
Бутанол-2
2
H3C CH CH2 OH
CH3
Первичный изобутиловый спирт
2-метилпропанол-1
OH
1
2
3
H3C C CH3
CH3
Третичный изобутиловый спирт
С4Н10О
2-метилпропанол-2
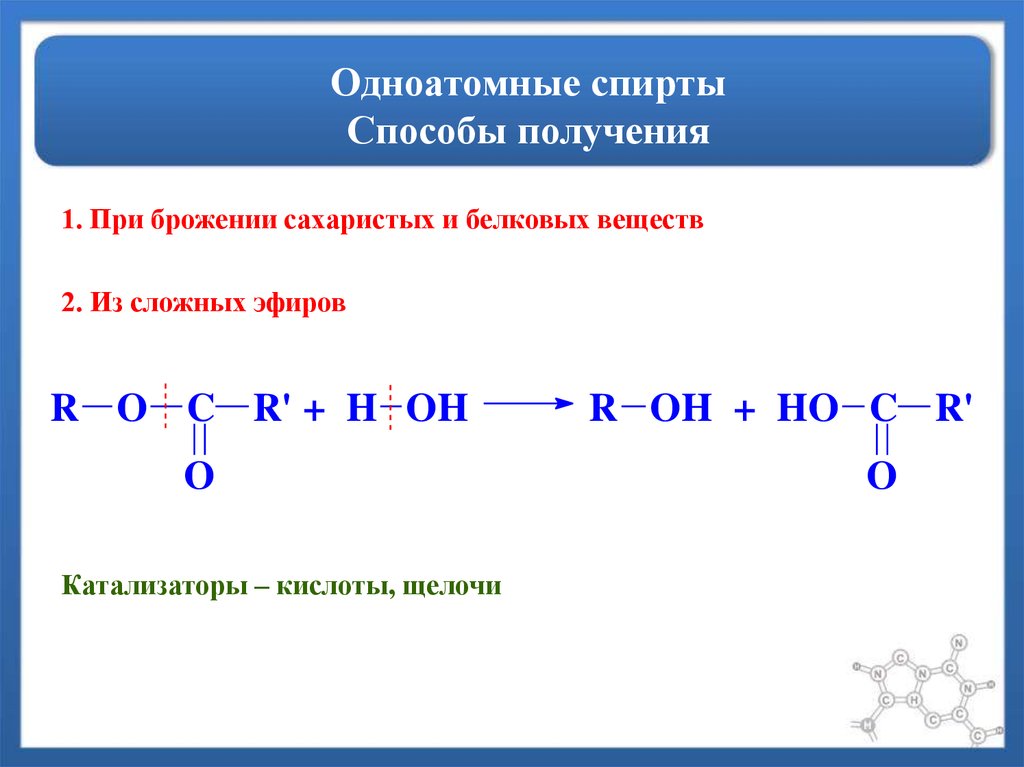
14. Одноатомные спирты Способы получения
1. При брожении сахаристых и белковых веществ2. Из сложных эфиров
R O C R' + H OH
O
Катализаторы – кислоты, щелочи
R OH + HO C R'
O
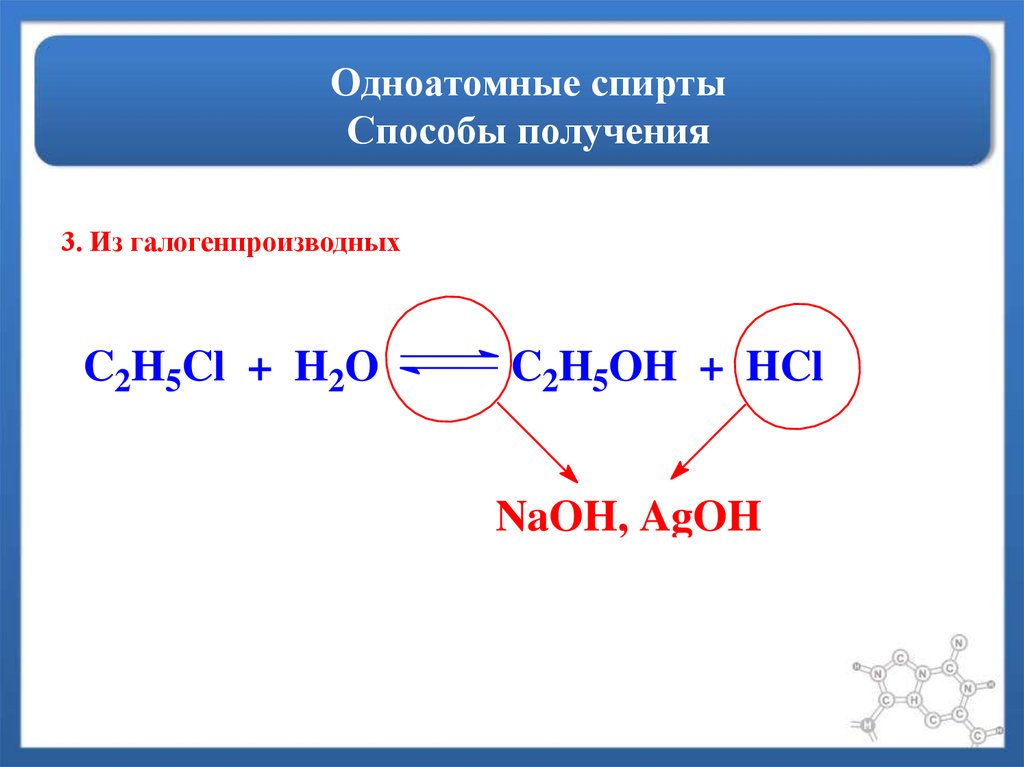
15. Одноатомные спирты Способы получения
3. Из галогенпроизводныхC2H5Cl + H2O
C2H5OH + HCl
NaOH, AgOH
16. Одноатомные спирты Способы получения
4. Присоединение воды к алкенамH2C CH2 + HOH
H3C CH2OH
Катализатор – разбавленная серная кислота
H2C CH CH3 + H OH
H3C CH CH3
OH
Правило Марковникова
17. Одноатомные спирты Способы получения
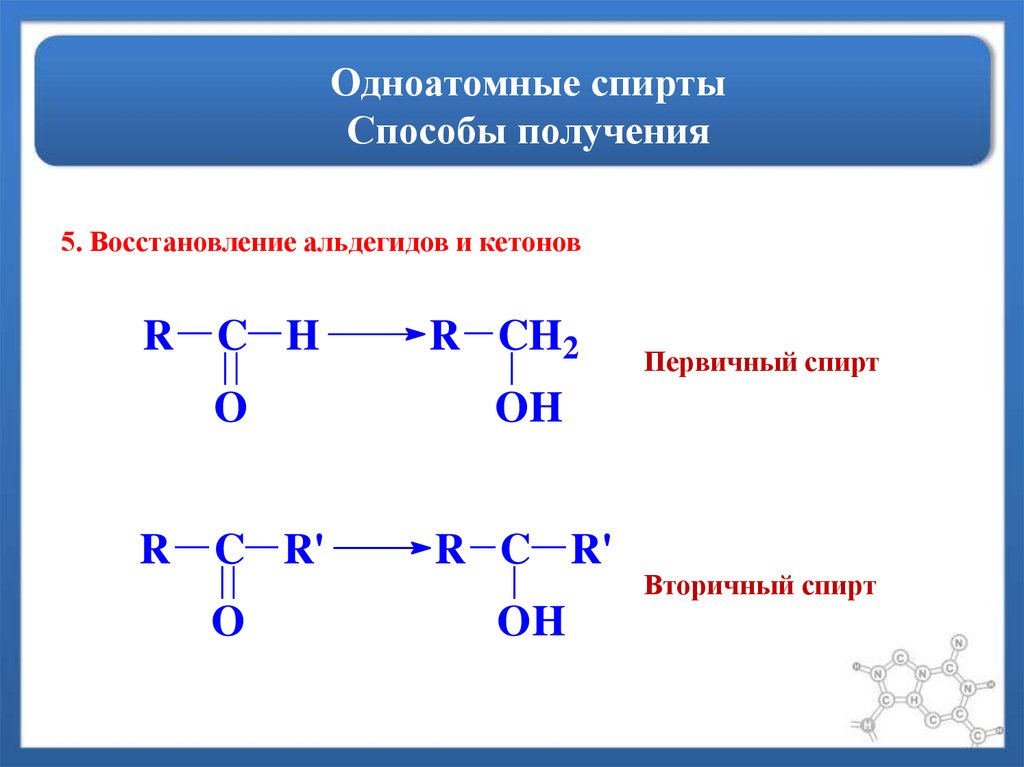
5. Восстановление альдегидов и кетоновR C H
R CH2
O
OH
R C R'
R C R'
O
OH
Первичный спирт
Вторичный спирт
18. Одноатомные спирты Химические свойства
Реакции, обусловленные свойствами водорода в гидроксиле.Реакции, обусловленные свойствами самого гидроксила.
Реакции, состоящие в изменениях в радикале.
Реакции окисления.
19. Одноатомные спирты Химические свойства
1. Свойства атома водорода в гидроксиле2 R OH + 2 Na
2 R ONa + H2
Соль
H3C OH + H O CH3
H3C O CH3 + H2O
Простой эфир
H3C O H + HO C CH3
O
H3C O C CH3 + H2O
O
Сложный эфир
20. Одноатомные спирты Химические свойства
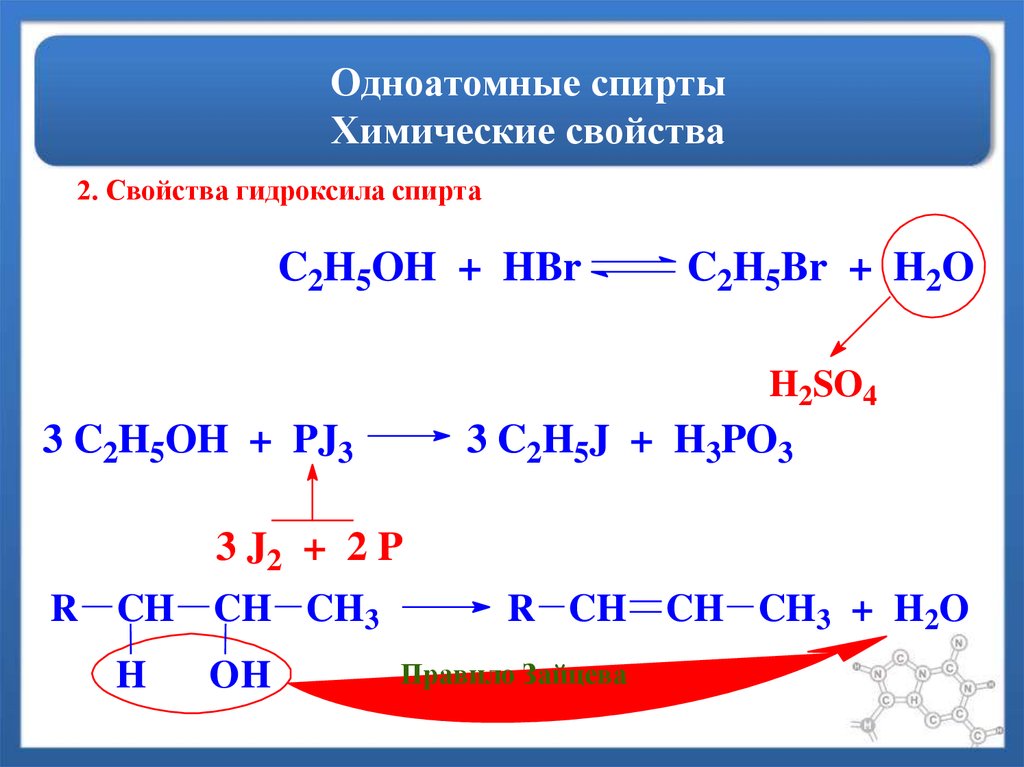
2. Свойства гидроксила спиртаC2H5OH + HBr
C2H5Br + H2O
H2SO4
3 C2H5OH + PJ3
3 C2H5J + H3PO3
3 J2 + 2 P
R CH CH CH3
H
OH
R CH CH CH3 + H2O
Правило Зайцева
21. Одноатомные спирты Химические свойства
3. Свойства радикала спиртаH3C CH2OH
+ 3 Br2
- 3 HBr
Br3C CH2OH
22. Одноатомные спирты Химические свойства
4. Реакции окисления спиртовH
R
C H
+O
- H 2O
R C H
OH
+O
R C OH
O
Перв. спирт
O
альдегид
кислота
H
R
C R'
OH
Втор. спирт
+O
- H 2O
R C R'
O
кетон
23. Простые эфиры
24. Простые эфиры
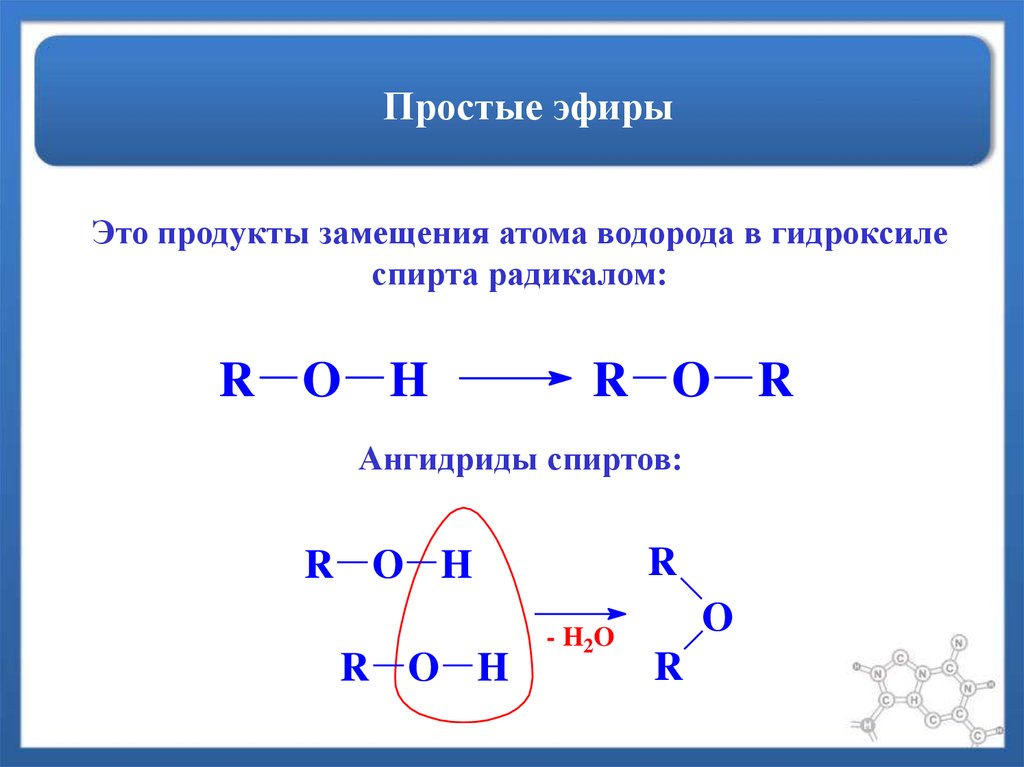
Это продукты замещения атома водорода в гидроксилеспирта радикалом:
R O H
R O R
Ангидриды спиртов:
R
R O H
R O H
- H2O
O
R
25. Простые эфиры Номенклатура и изомерия
H3C O CH3диметиловый эфир
метоксиметан
диэтиловый эфир
H3C CH2 O CH2 CH3
этоксиэтан
H3C O CH CH2 CH3
CH3
метил-втор-бутиловый эфир
2-метоксибутан
26. Простые эфиры Способы получения
1. Дегидратация спиртовH3C OH + H O CH3
1 стадия
2 стадия
H3C OH + H OSO3H
H 3C O
H3C O CH3 + H2O
- H 2O
SO3H + H O CH3
H 3C O
- H2SO4
SO3H
H3C O CH3
27. Простые эфиры Способы получения
2. Реакция ВильямсонаH3C CH2 O Na + J CH2 CH3
- NaJ
H5C2 O C2H5
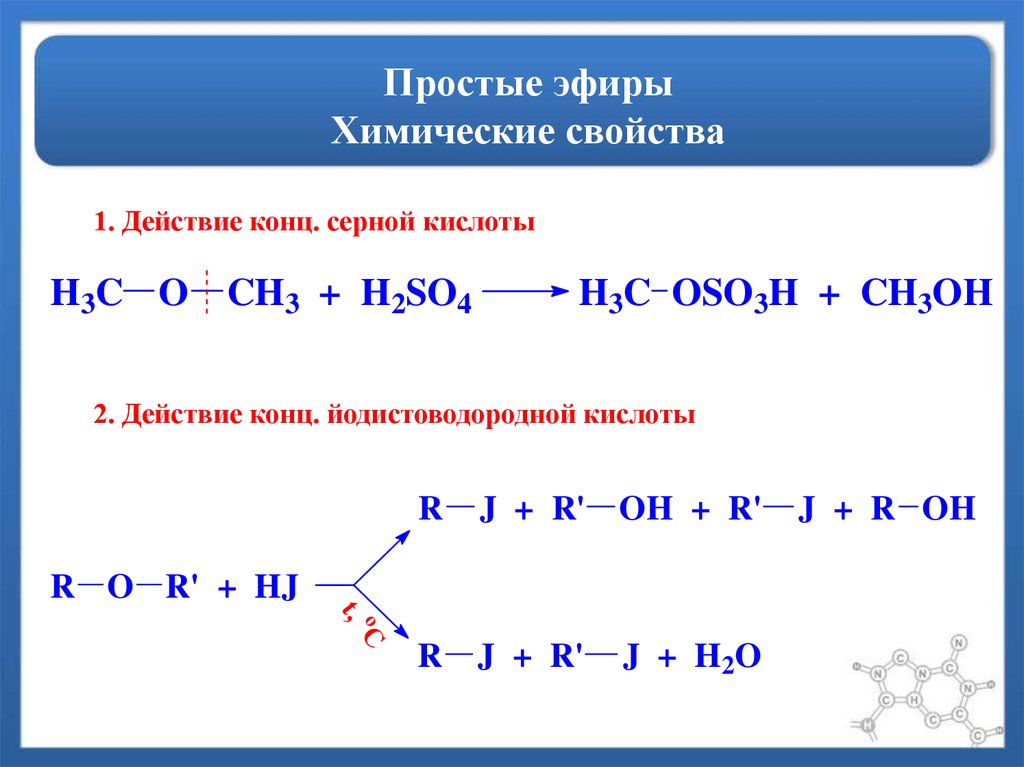
28. Простые эфиры Химические свойства
1. Действие конц. серной кислотыH3C O CH3 + H2SO4
H3C OSO3H + CH3OH
2. Действие конц. йодистоводородной кислоты
R
J + R' OH + R'
R
J + R'
R O R' + HJ
o
t,
C
J + H 2O
J + R OH
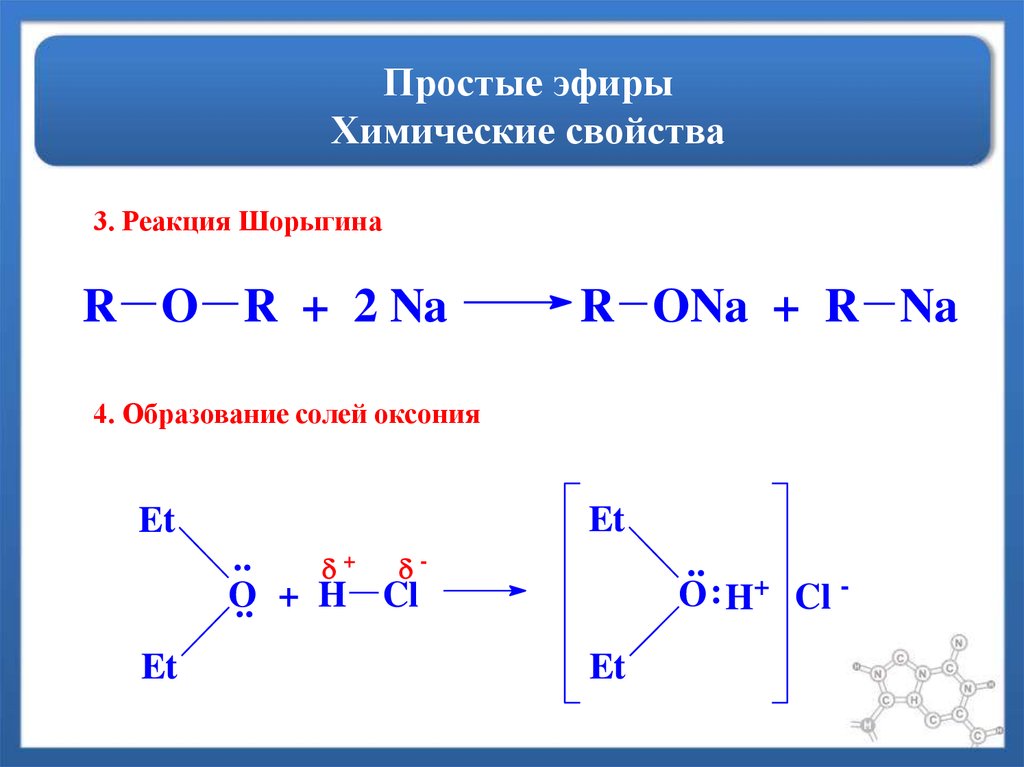
29. Простые эфиры Химические свойства
3. Реакция ШорыгинаR O R + 2 Na
R ONa + R Na
4. Образование солей оксония
Et
Et
..
+
O
.. + H Cl
Et
..
O : H+ Cl Et
30. Альдегиды
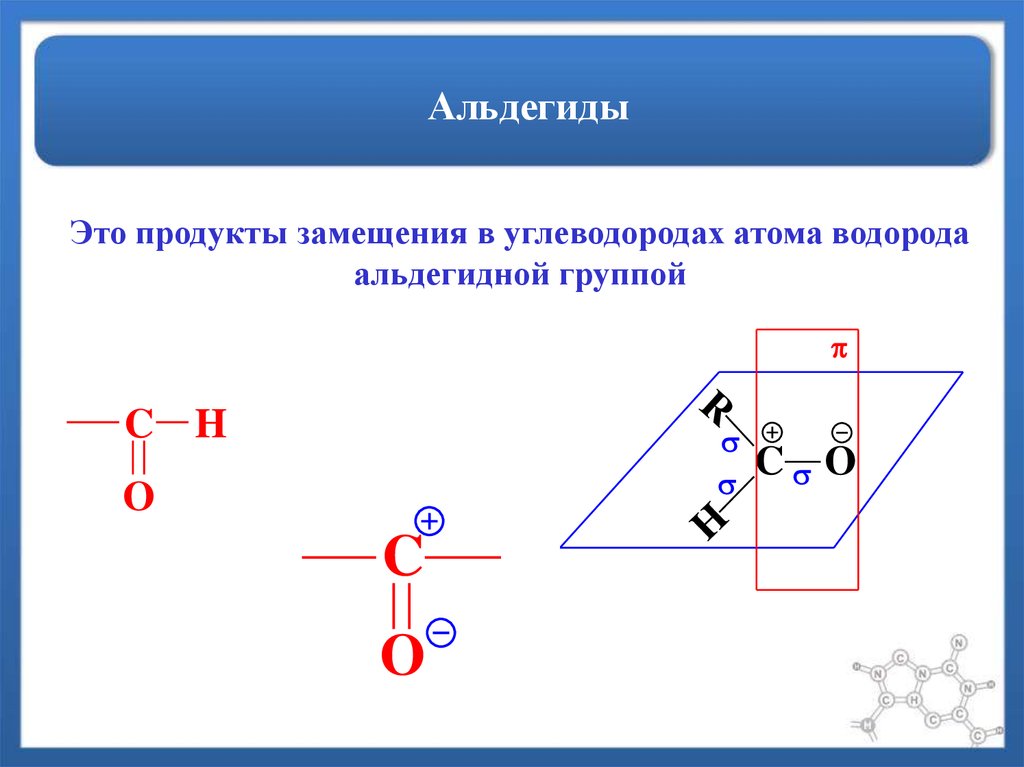
31. Альдегиды
Это продукты замещения в углеводородах атома водородаальдегидной группой
R
C H
O
C
O
H
C O
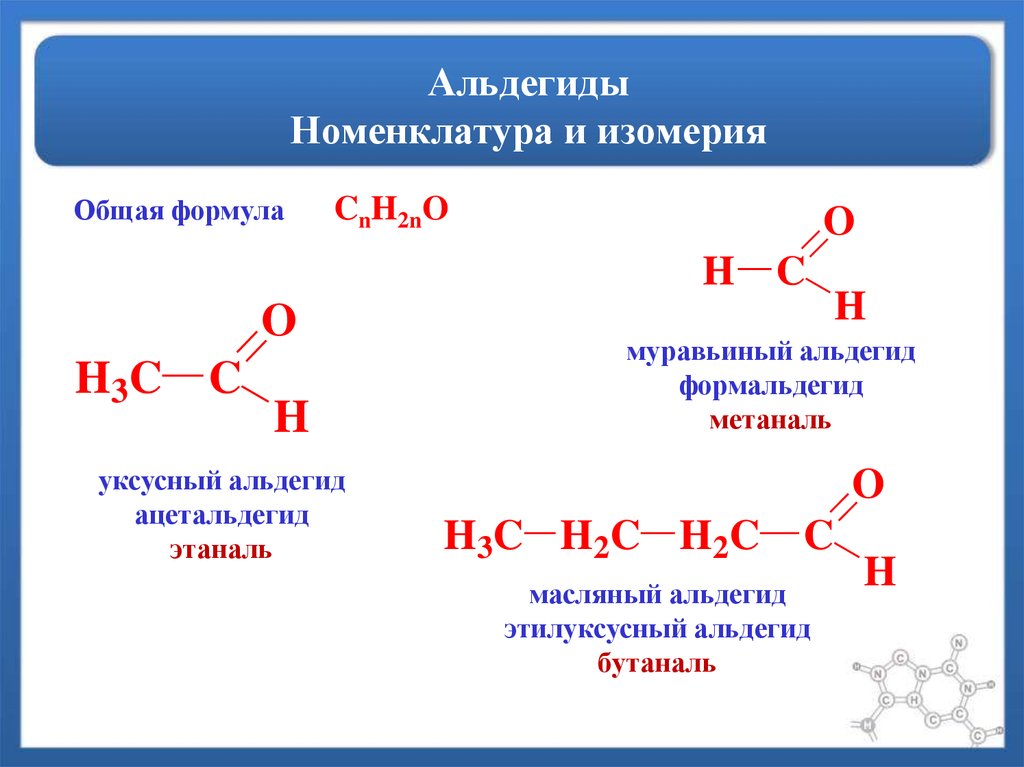
32. Альдегиды Номенклатура и изомерия
Общая формулаCnH2nO
O
H C
O
H 3C
C
H
уксусный альдегид
ацетальдегид
этаналь
H
муравьиный альдегид
формальдегид
метаналь
O
H 3C H 2C H 2C
C
масляный альдегид
этилуксусный альдегид
бутаналь
H
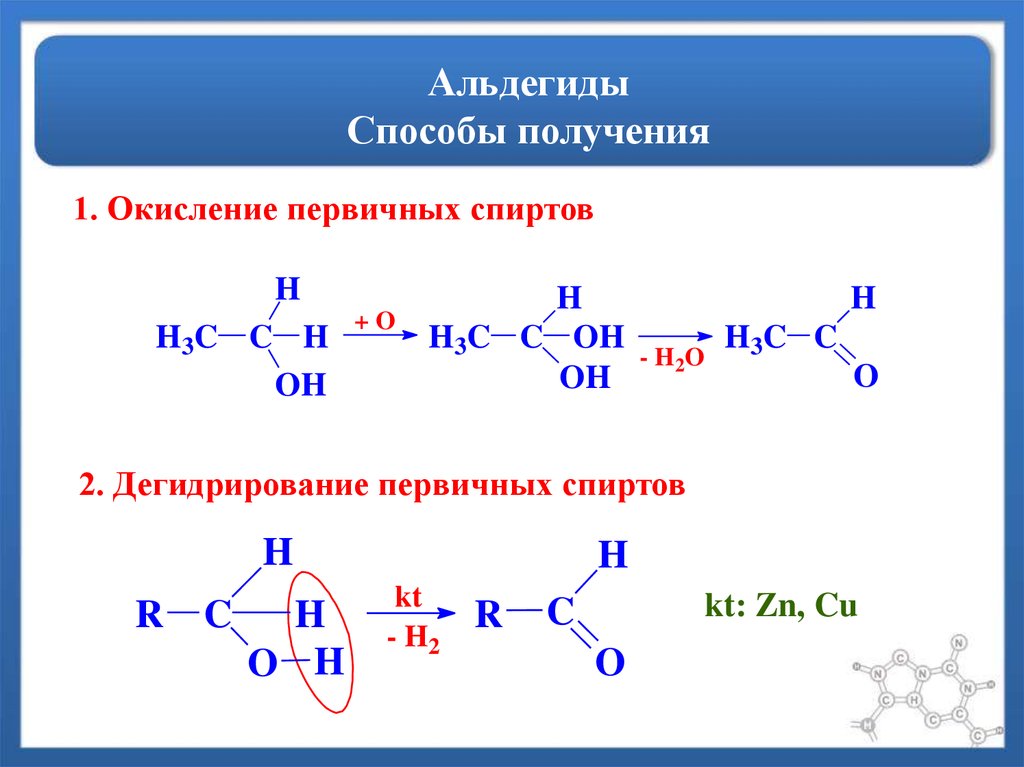
33. Альдегиды Способы получения
1. Окисление первичных спиртовH
H 3C C H
OH
+O
H
H3C C OH
OH
H
- H 2O
H 3C C
O
2. Дегидрирование первичных спиртов
H
R
C
H
O H
H
kt
- H2
R
kt: Zn, Cu
C
O
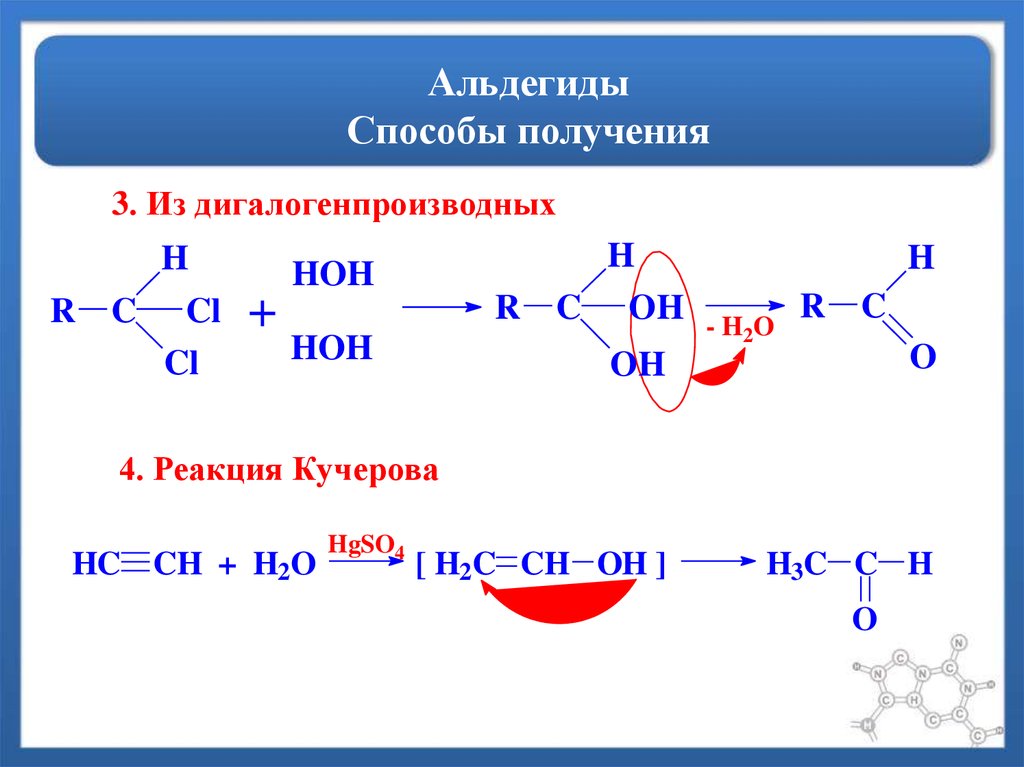
34. Альдегиды Способы получения
3. Из дигалогенпроизводныхR
H
C Cl
Cl
+
HOH
R
HOH
H
C OH
H
- H 2O
R
C
OH
O
[ H2C CH OH ]
H3C C H
4. Реакция Кучерова
HC CH + H2O
HgSO4
O
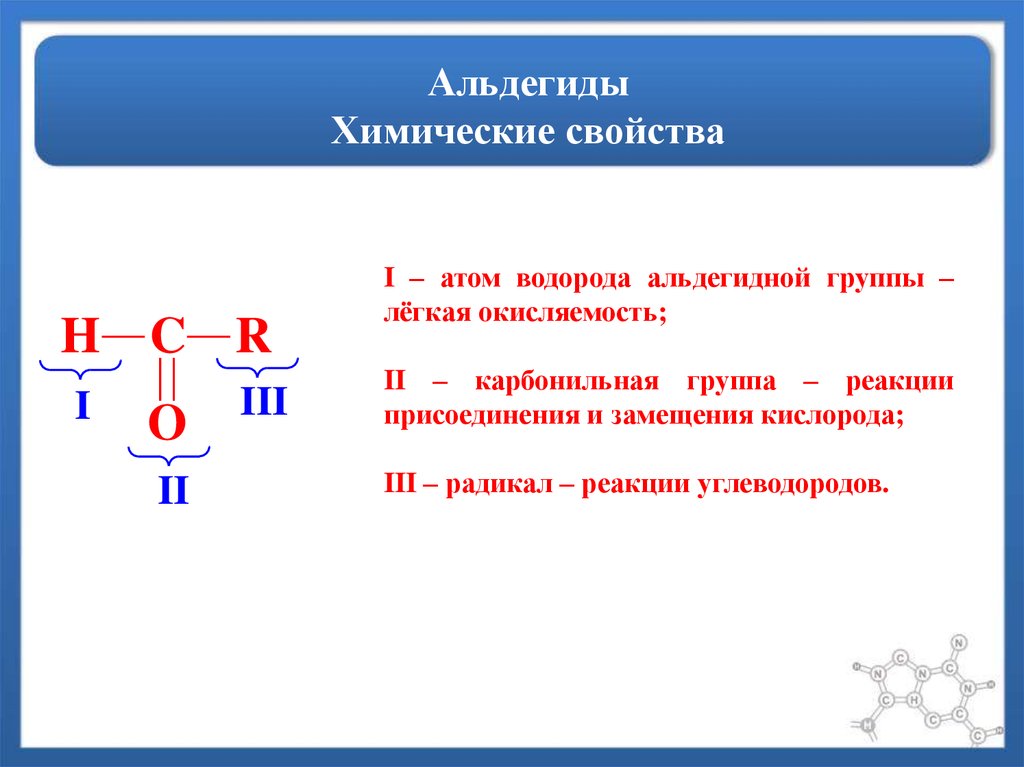
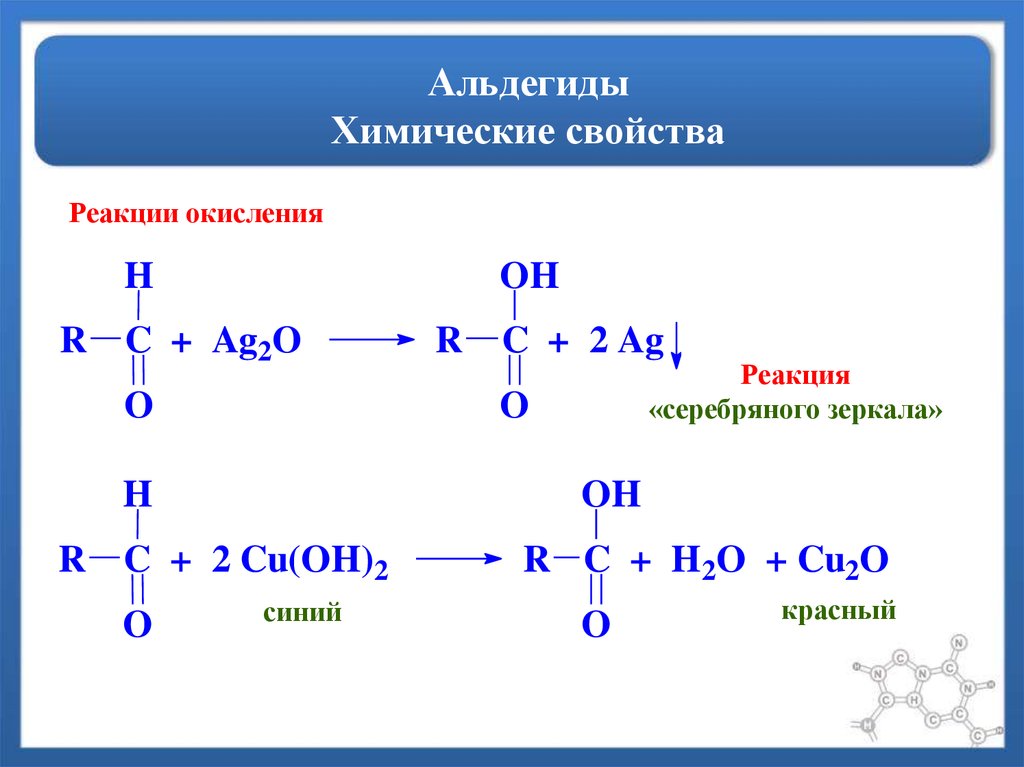
35. Альдегиды Химические свойства
H C RI
O
II
III
I – атом водорода альдегидной группы –
лёгкая окисляемость;
II – карбонильная группа – реакции
присоединения и замещения кислорода;
III – радикал – реакции углеводородов.
36. Альдегиды Химические свойства
Реакции окисленияH
OH
R C + Ag2O
O
C + 2 Ag
Реакция
«серебряного зеркала»
O
H
OH
R C + 2 Cu(OH)2
O
R
синий
R C + H2O + Cu2O
O
красный
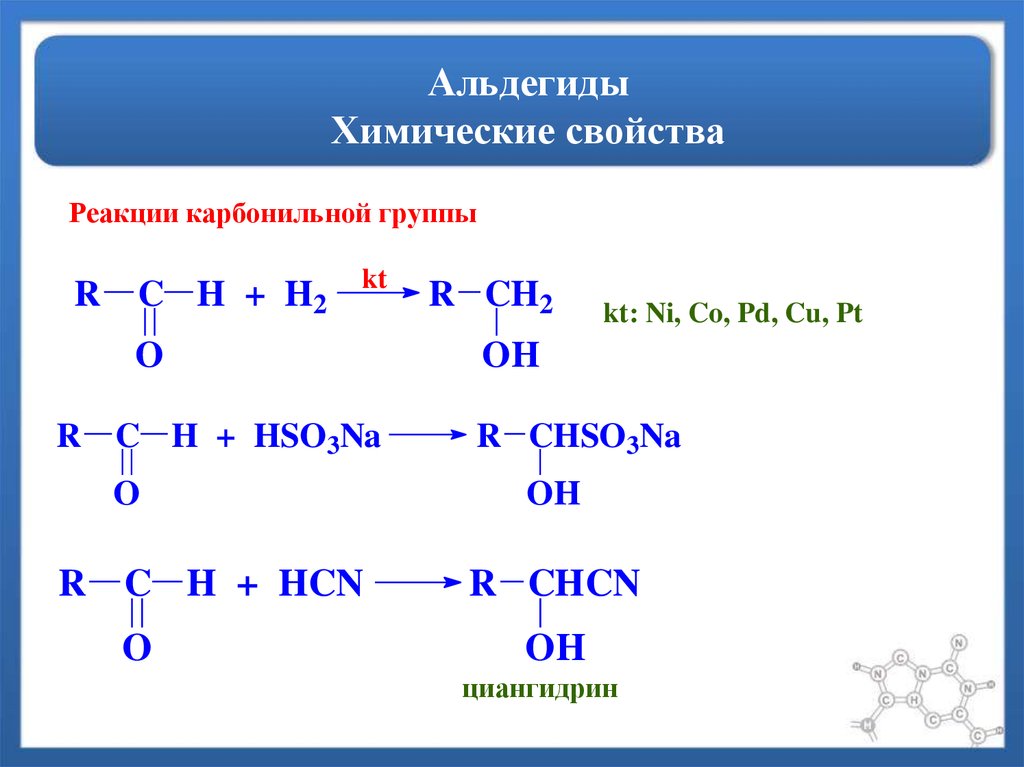
37. Альдегиды Химические свойства
Реакции карбонильной группыR C H + H2
kt
O
R C H + HSO3Na
O
R C H + HCN
O
R CH2
kt: Ni, Co, Pd, Cu, Pt
OH
R CHSO3Na
OH
R CHCN
OH
циангидрин
38. Альдегиды Химические свойства
Реакции карбонильной группыR C H + PCl5
O
R
C H + H2 N NH2
O
R CCl2
H
R C H
N NH2
гидразон
39. Альдегиды Химические свойства
Реакции в радикалеH3C C H + Cl2
O
Cl H2C C H + HCl
O
40. Кетоны
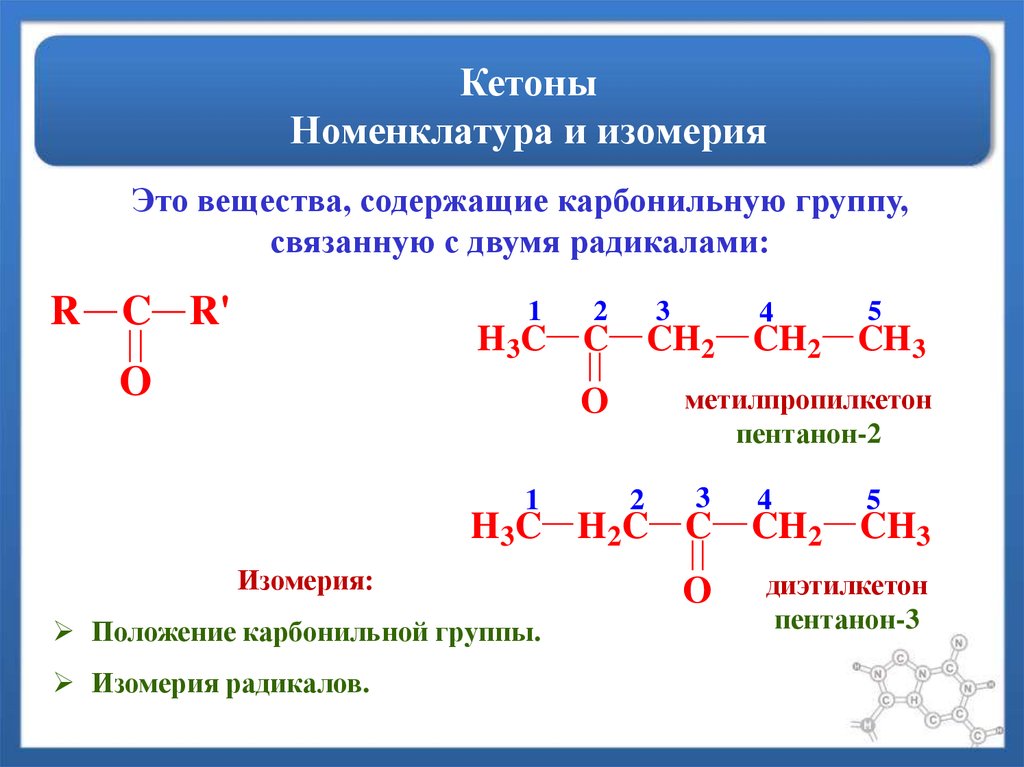
41. Кетоны Номенклатура и изомерия
Это вещества, содержащие карбонильную группу,связанную с двумя радикалами:
R C R'
1
2
3
H 3C C
O
CH2
CH2 CH3
2
3
4
5
H 3C H 2C C
CH2 CH3
O
диэтилкетон
пентанон-3
Изомерия:
Положение карбонильной группы.
Изомерия радикалов.
5
метилпропилкетон
пентанон-2
O
1
4
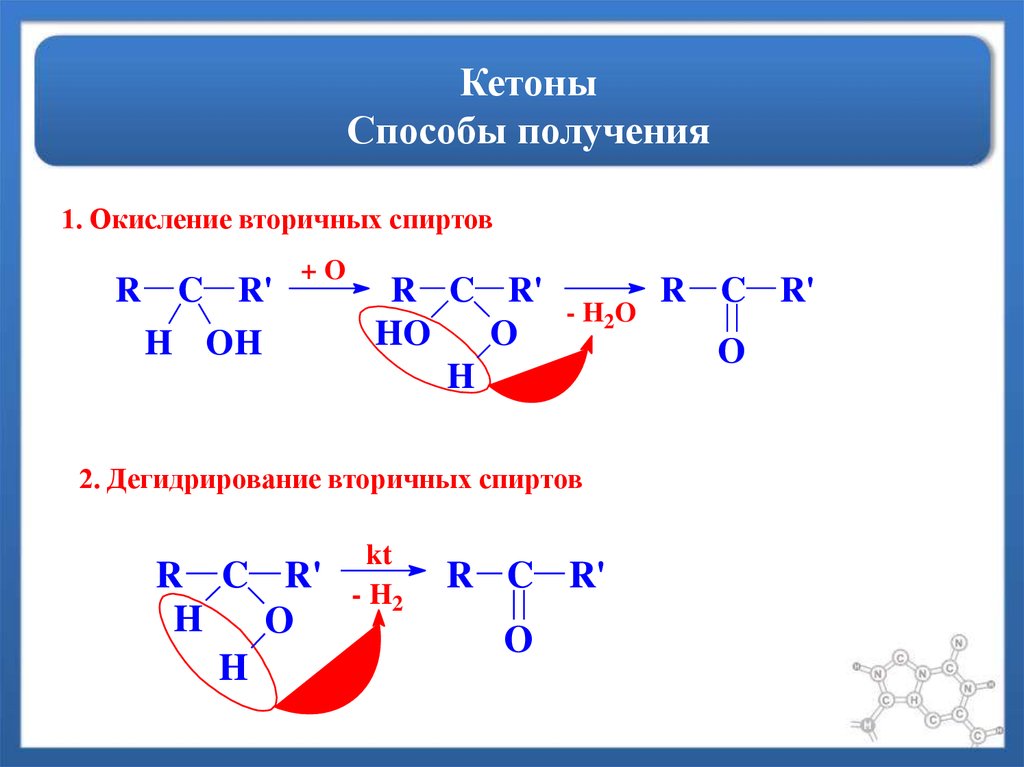
42. Кетоны Способы получения
1. Окисление вторичных спиртовR
C R'
H OH
+O
R C R'
HO
O
H
- H 2O
2. Дегидрирование вторичных спиртов
R C R'
H
O
H
kt
- H2
R C R'
O
R C R'
O
43. Кетоны Способы получения
3. Получение из дигалогенпроизводныхH OH
Cl
R
C
R'
+
Cl
H OH
- 2 HCl
R
OH
R
C
R'
OH
- H 2O
C O
R'
4. Получение из кальциевых солей карбоновых кислот
H3C C O Ca
O
O C CH3
O
t
H3C C CH3 + CaCO3
O
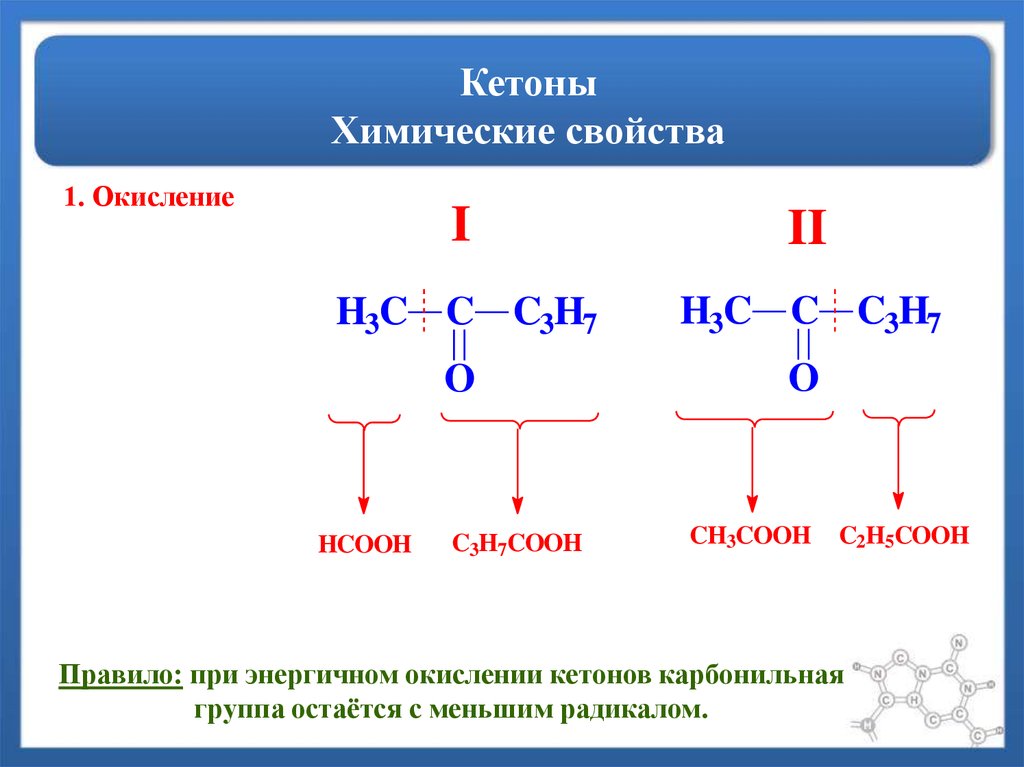
44. Кетоны Химические свойства
1. ОкислениеI
II
H3C C C3H7
H3C C C3H7
O
O
HCOOH
C3H7COOH
CH3COOH
C2H5COOH
Правило: при энергичном окислении кетонов карбонильная
группа остаётся с меньшим радикалом.
45. Одноосновные карбоновые кислоты
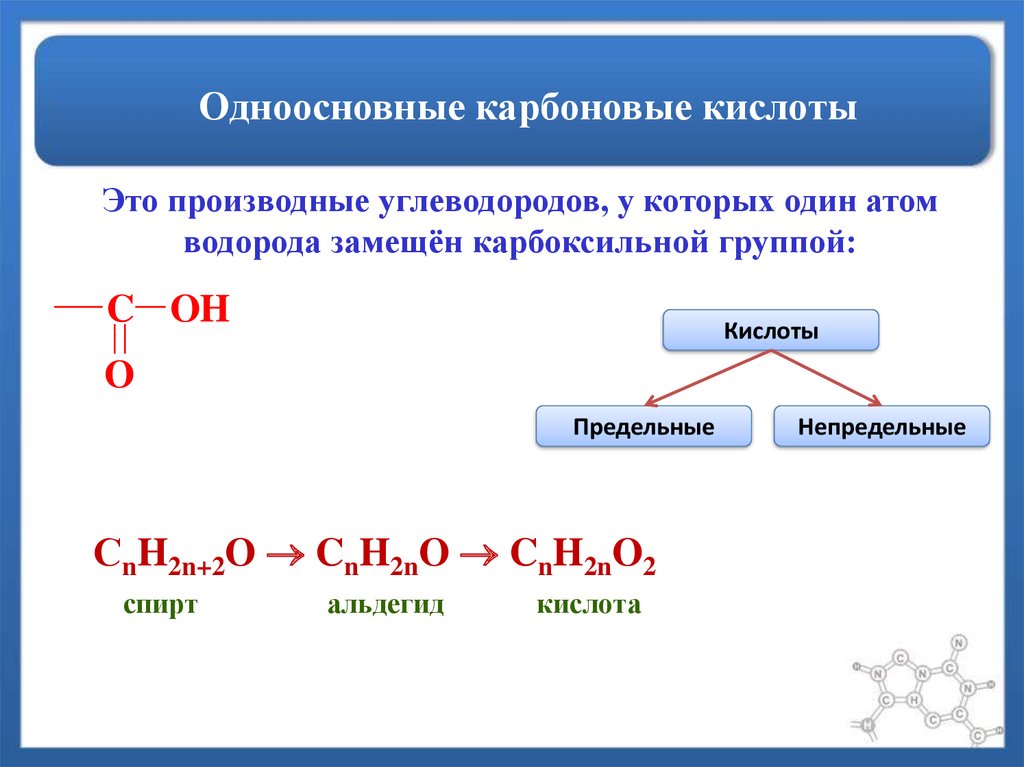
46. Одноосновные карбоновые кислоты
Это производные углеводородов, у которых один атомводорода замещён карбоксильной группой:
C OH
Кислоты
O
Предельные
СnH2n+2O CnH2nO CnH2nO2
спирт
альдегид
кислота
Непредельные
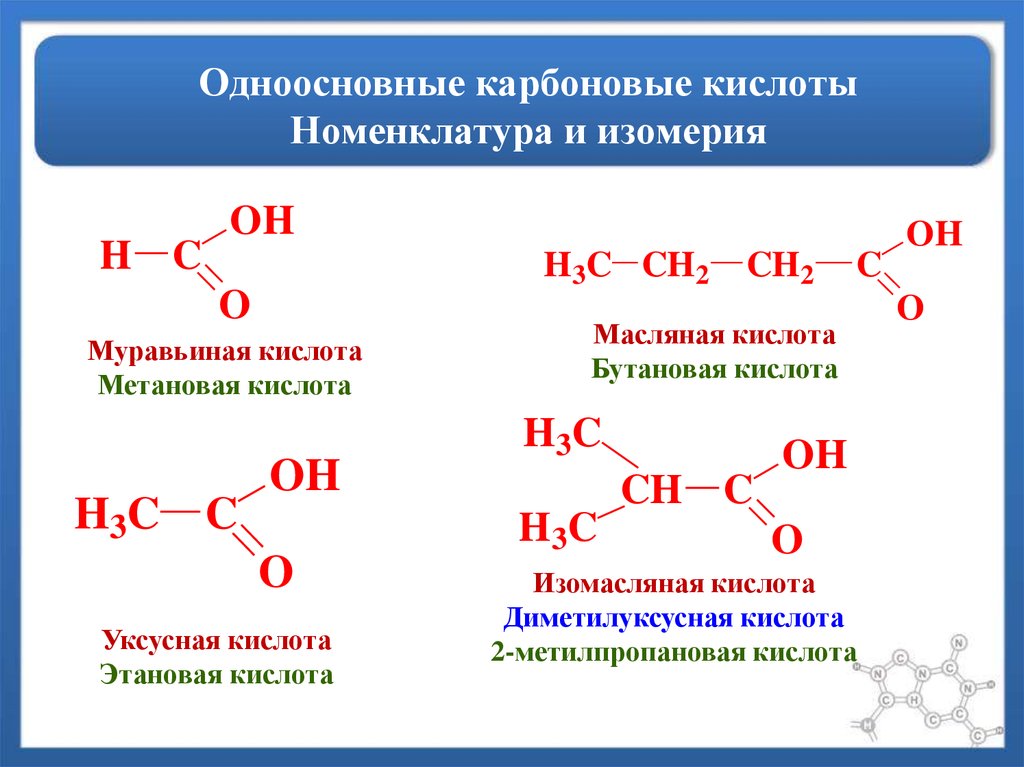
47. Одноосновные карбоновые кислоты Номенклатура и изомерия
H COH
H3C CH2
O
Муравьиная кислота
Метановая кислота
H 3C C
OH
O
Уксусная кислота
Этановая кислота
CH2
C
Масляная кислота
Бутановая кислота
H 3C
H 3C
CH C
OH
O
Изомасляная кислота
Диметилуксусная кислота
2-метилпропановая кислота
OH
O
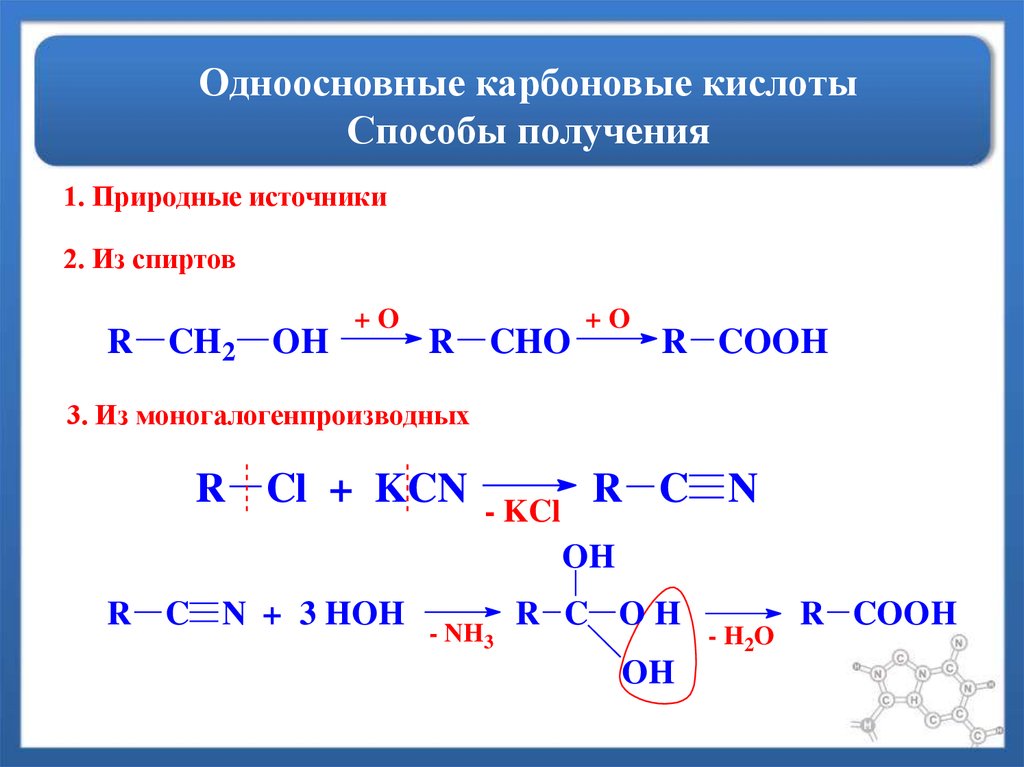
48. Одноосновные карбоновые кислоты Способы получения
1. Природные источники2. Из спиртов
R CH2
OH
+O
R CHO
+O
R COOH
3. Из моногалогенпроизводных
R Cl + KCN
- KCl
R C N
OH
R
C N + 3 HOH
- NH3
R C OH
OH
- H 2O
R COOH
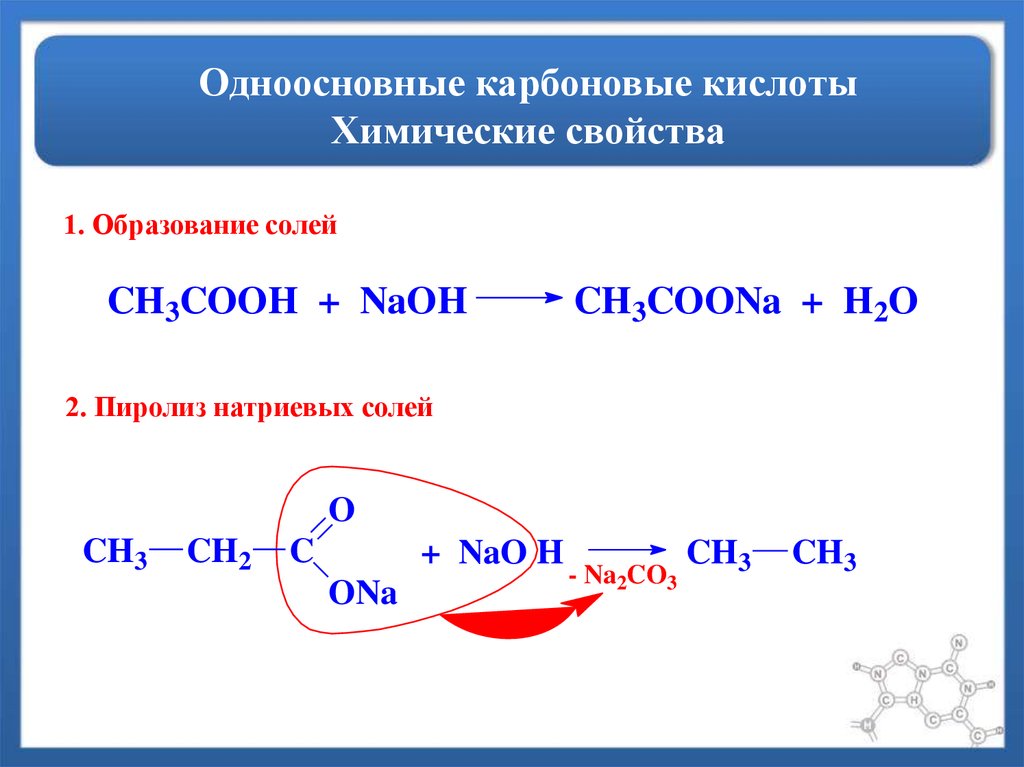
49. Одноосновные карбоновые кислоты Химические свойства
1. Образование солейCH3COOH + NaOH
CH3COONa + H2O
2. Пиролиз натриевых солей
O
CH3
CH2
C
+ NaO H
ONa
- Na2CO3
CH3
CH3
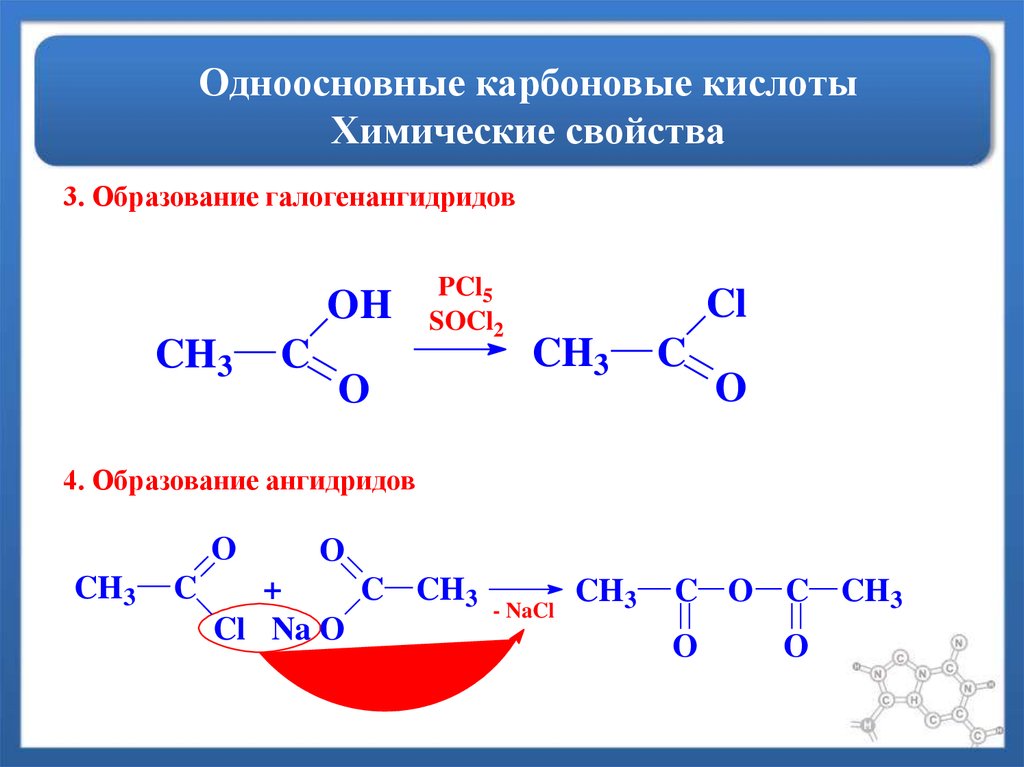
50. Одноосновные карбоновые кислоты Химические свойства
3. Образование галогенангидридовOH
CH3
C
PCl5
SOCl2
O
Cl
CH3
C
O
4. Образование ангидридов
O
CH3
C
O
+
C CH3
Cl Na O
- NaCl
CH3
C O C CH3
O
O
51. Одноосновные карбоновые кислоты Химические свойства
5. Образование амидов кислотR
COOH
+ NH3
R COONH4
- H2O
R C
NH2
O
6. Образование сложных эфиров
H3C O H + HO C CH3
O
H2SO4
H3C O C CH3 + H2O
O
52. Сложные эфиры
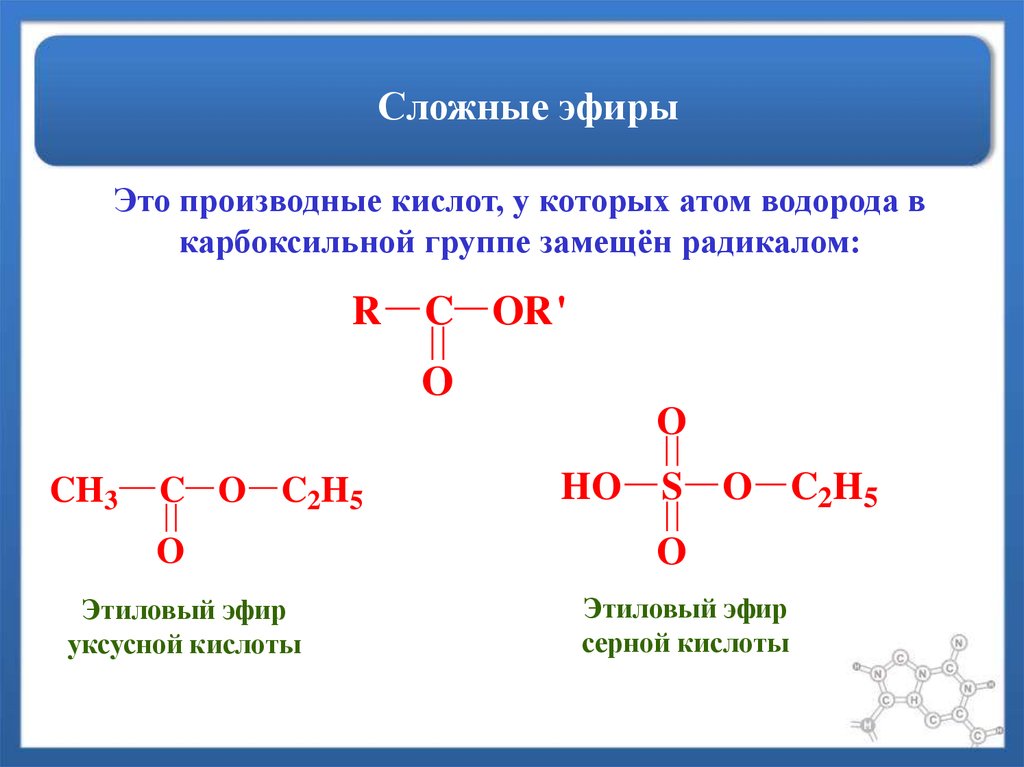
53. Сложные эфиры
Это производные кислот, у которых атом водорода вкарбоксильной группе замещён радикалом:
R
C OR'
O
O
CH3
C O C2H5
O
Этиловый эфир
уксусной кислоты
HO
S
O C2H5
O
Этиловый эфир
серной кислоты
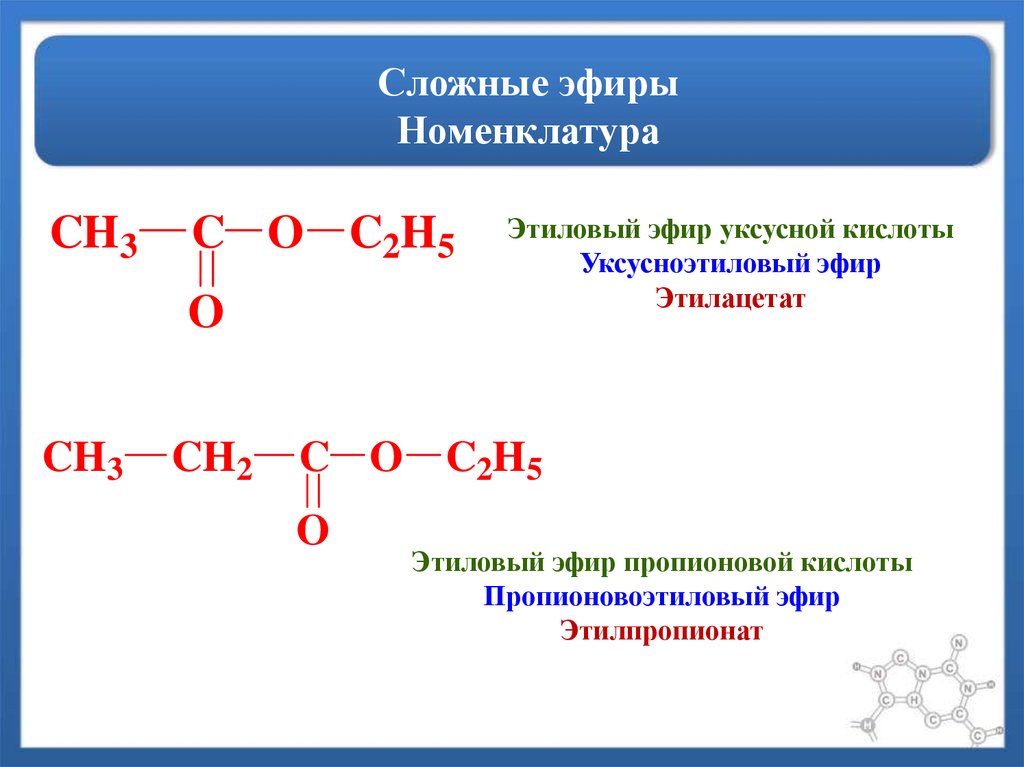
54. Сложные эфиры Номенклатура
CH3C O C2H5
O
CH3
CH2
Этиловый эфир уксусной кислоты
Уксусноэтиловый эфир
Этилацетат
C O C2H5
O
Этиловый эфир пропионовой кислоты
Пропионовоэтиловый эфир
Этилпропионат
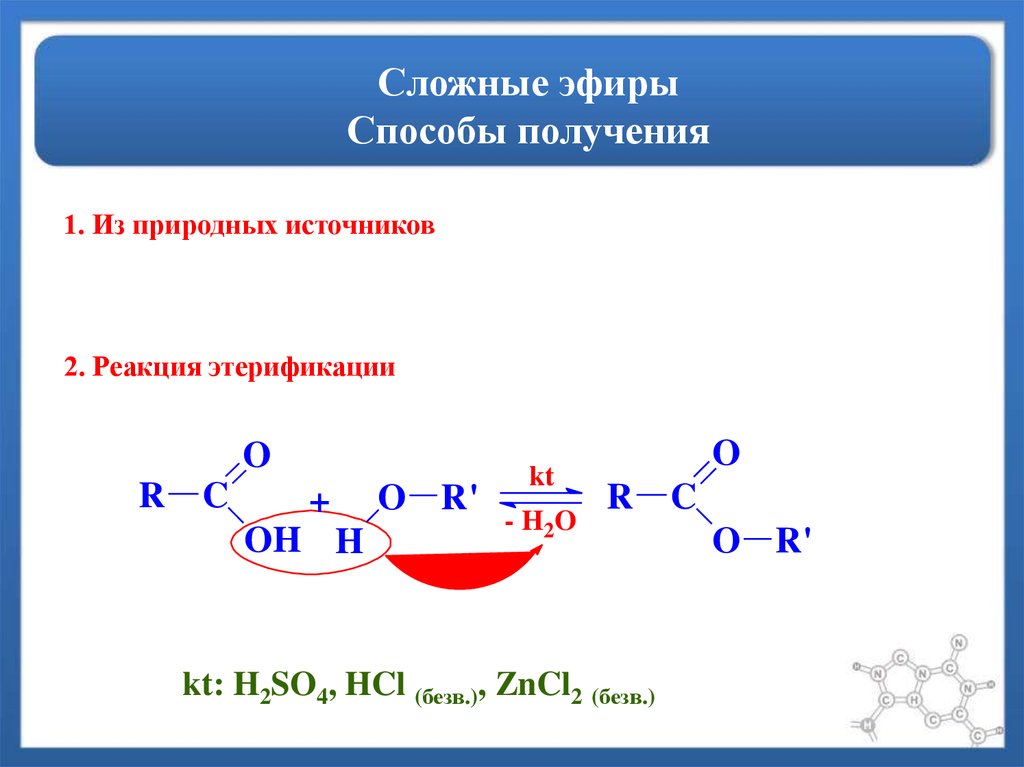
55. Сложные эфиры Способы получения
1. Из природных источников2. Реакция этерификации
O
R
C
+
OH H
O R'
kt
- H 2O
O
R
kt: H2SO4, HCl (безв.), ZnCl2 (безв.)
C
O R'
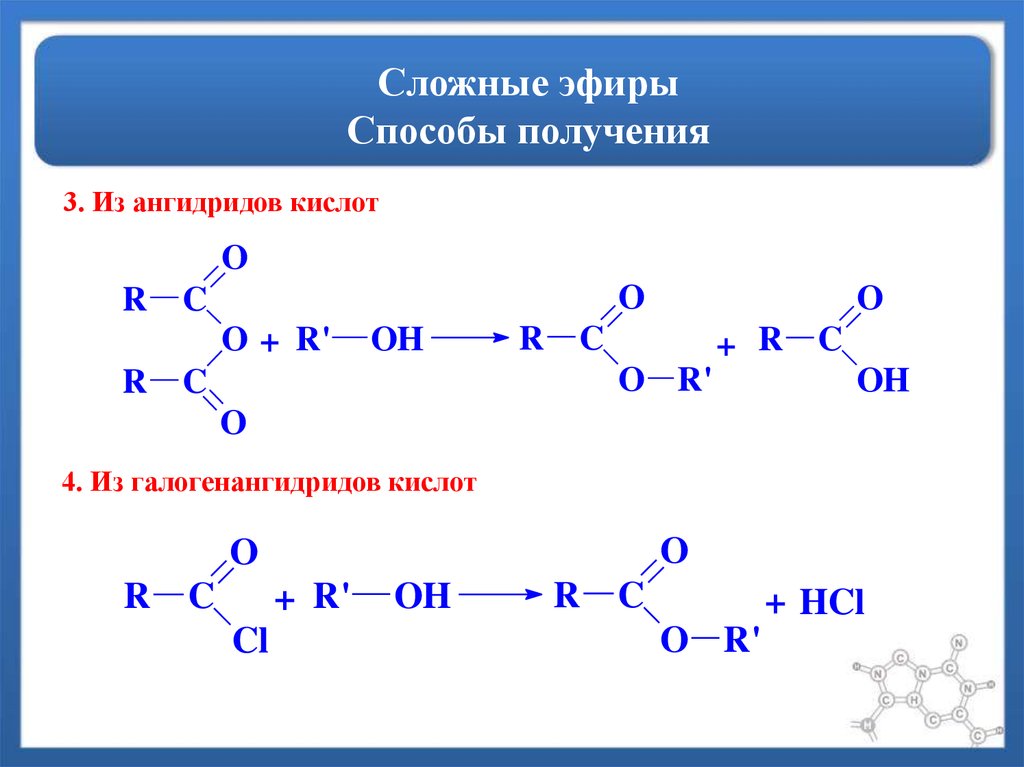
56. Сложные эфиры Способы получения
3. Из ангидридов кислотO
R
O
C
O + R'
R
OH
R
O
C
+ R
O R'
C
C
OH
O
4. Из галогенангидридов кислот
O
O
R
+ R'
C
Cl
OH
R
C
+ HCl
O R'
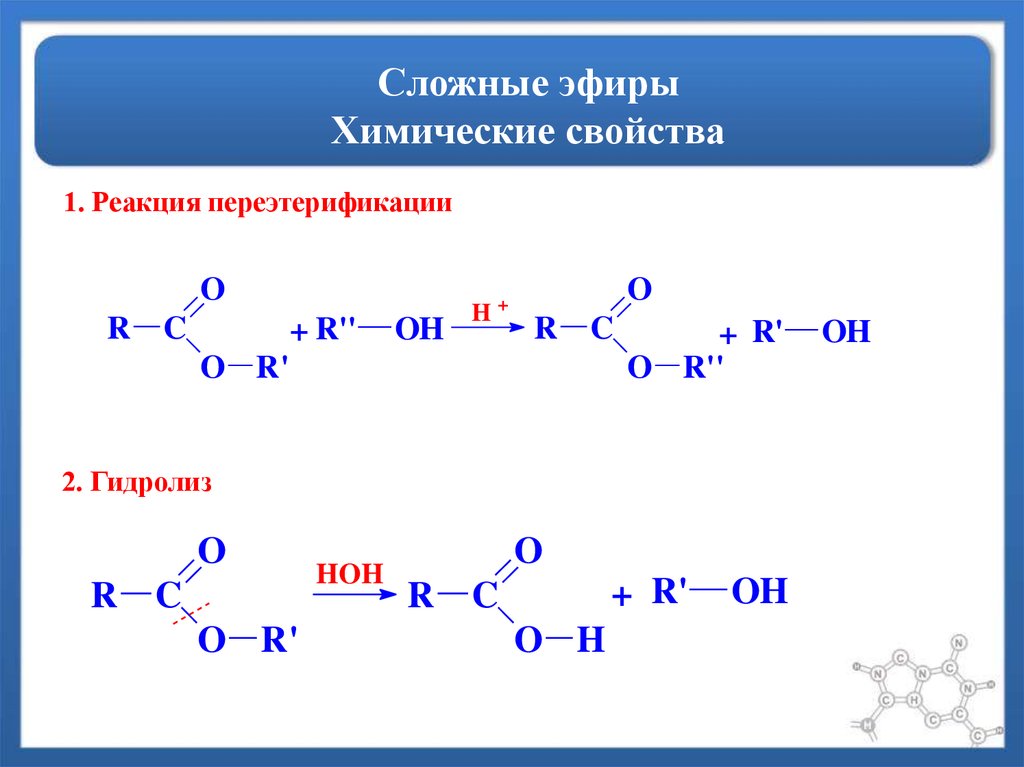
57. Сложные эфиры Химические свойства
1. Реакция переэтерификацииO
R
C
+ R''
OH
H
O
+
R
C
O R'
+ R'
O R''
2. Гидролиз
O
R
C
O R'
HOH
O
R
+ R'
C
O H
OH
OH
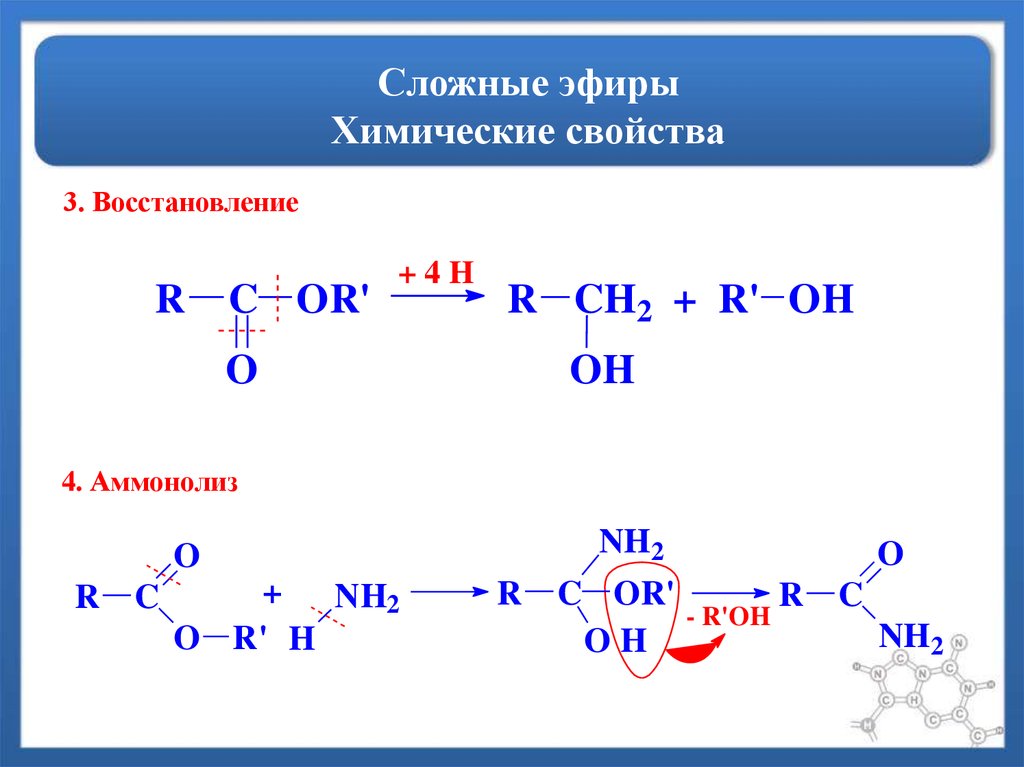
58. Сложные эфиры Химические свойства
3. ВосстановлениеR
C OR'
+4H
R CH2 + R' OH
O
OH
4. Аммонолиз
O
R
C
+
NH2
O R' H
R
NH2
C OR'
OH
O
- R'OH
R
C
NH2
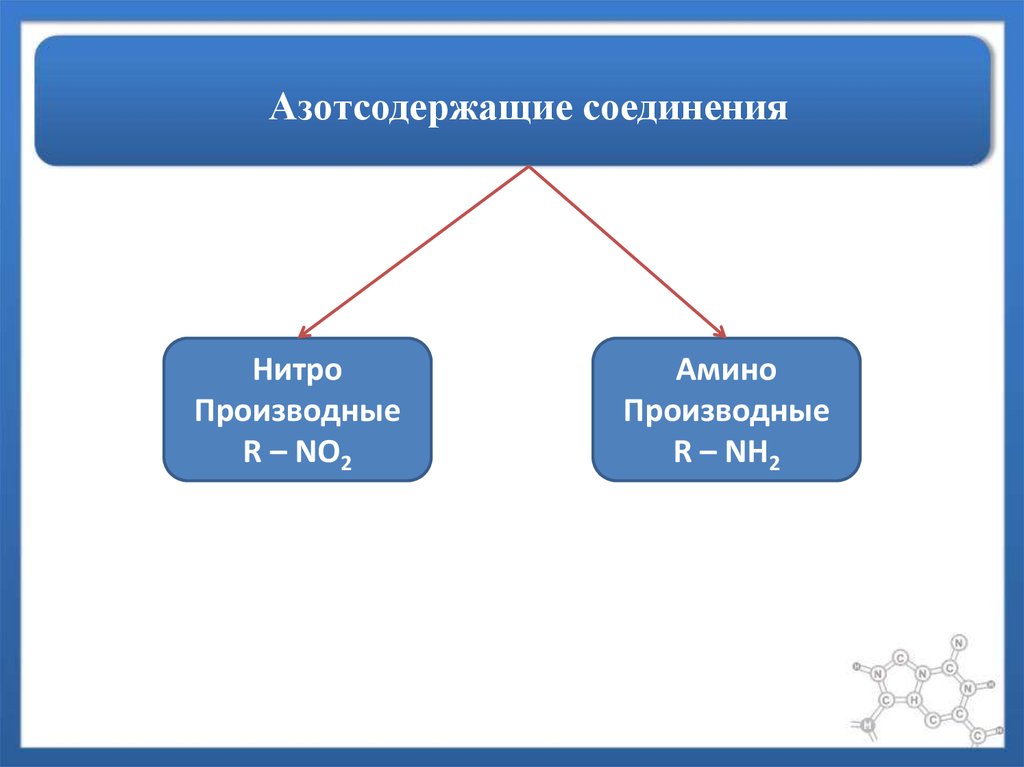
59. Азотсодержащие соединения
60. Азотсодержащие соединения
НитроПроизводные
R – NO2
Амино
Производные
R – NH2
61. Алифатические амины
62. Алифатические амины
Это производные аммиака или гидроксида аммония, укоторых один или несколько атомов водорода замещены
углеводородными радикалами:
R
H N H
H N R
H N R
H
H
R
R N
R
R
+
R N R OH R
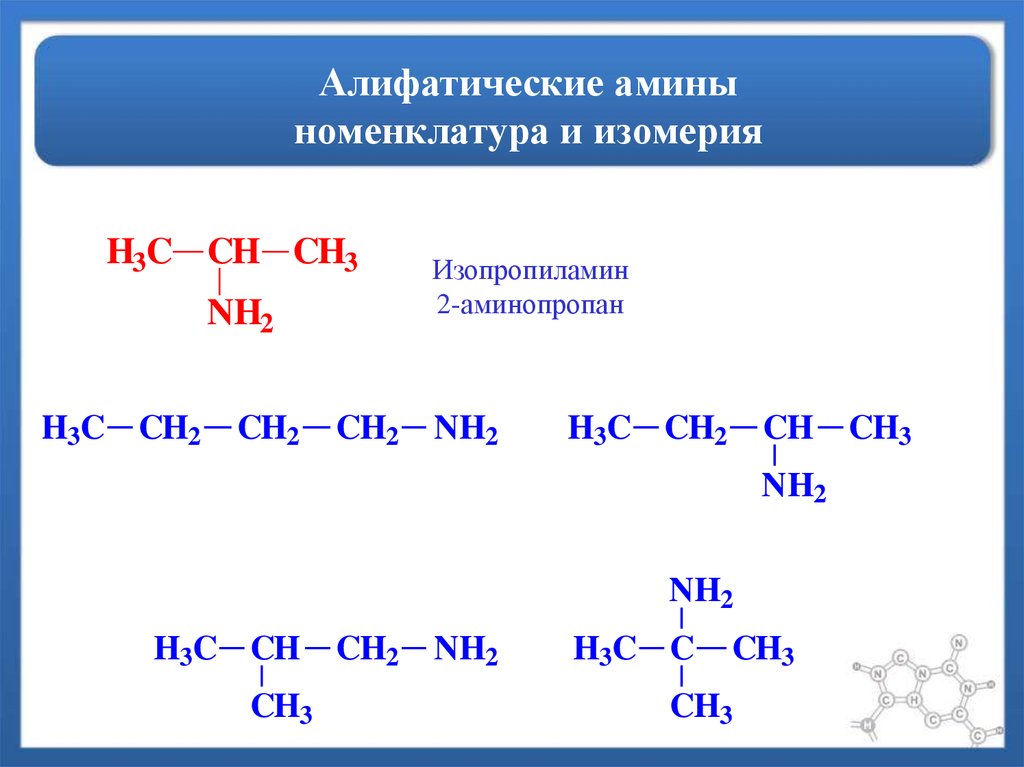
63. Алифатические амины номенклатура и изомерия
H3C CH CH3NH2
H3C CH2
CH2
CH2
Изопропиламин
2-аминопропан
NH2
H3C CH2
CH
NH2
NH2
H3C CH
CH3
CH2
NH2
H3C C
CH3
CH3
CH3
64. Алифатические амины способы получения
NH2CH31. из галогенпроизводных
NH3 + CH3J
NH(CH3)2
N(CH3)3
+
N(CH3)4 J -
2. из амидов кислот
O
R C
+ NaBr O
NH2
R NH2 + CO2 + NaBr
65. Алифатические амины способы получения
3. из карбоновых кислот (промышленный способ)R COOH + 2 H2 + NH3
R CH2
Условия процесса:
Температура 300 – 340 С
Давление 15 – 22 МПа
Алюмокобальтмолибденовый катализатор
NH2 + 2 H2O
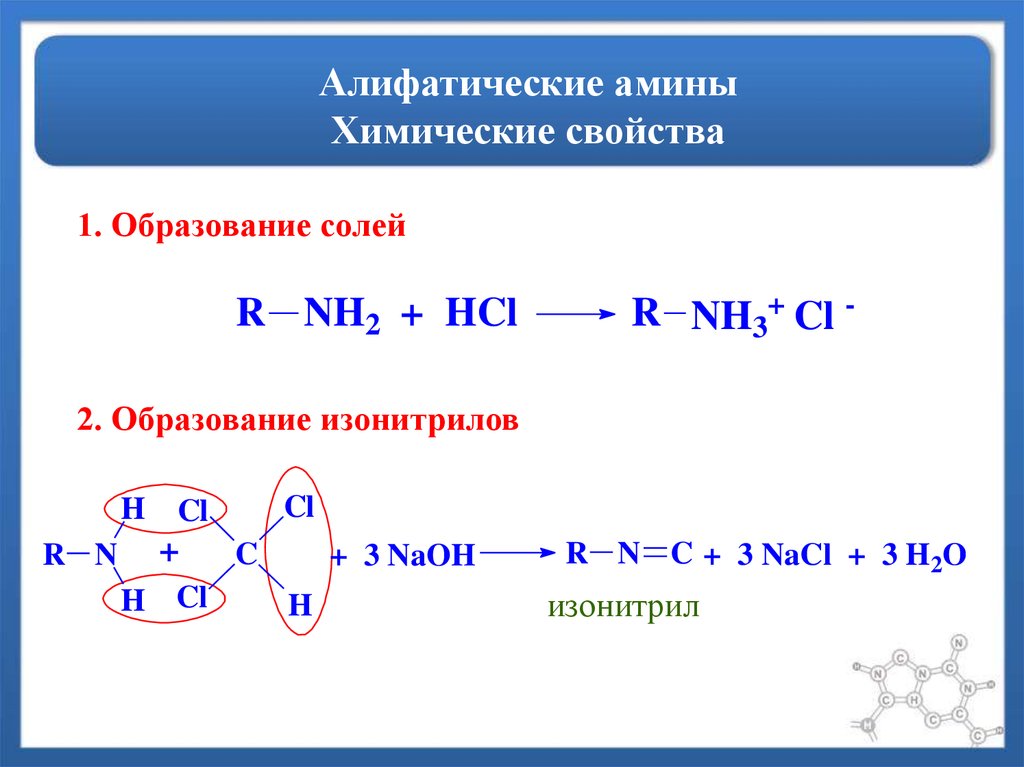
66. Алифатические амины Химические свойства
1. Образование солейR NH2 + HCl
R NH3+ Cl -
2. Образование изонитрилов
H
R N
Cl
Cl
+
H Cl
C
+ 3 NaOH
H
R N C + 3 NaCl + 3 H2O
изонитрил
67. Алифатические амины Химические свойства
3. Реакция с азотистой кислотойR NH2 + HNO2
R
R OH + N2 + H2O
R
NH + HNO2
R
R
R
NR + HNO2
R
N N O + H 2O
























 chemistry
chemistry








