Similar presentations:
Гидролиз. Граф структуры
1.
Кафедра общей и медицинской химии"Гидролиз"
1
2.
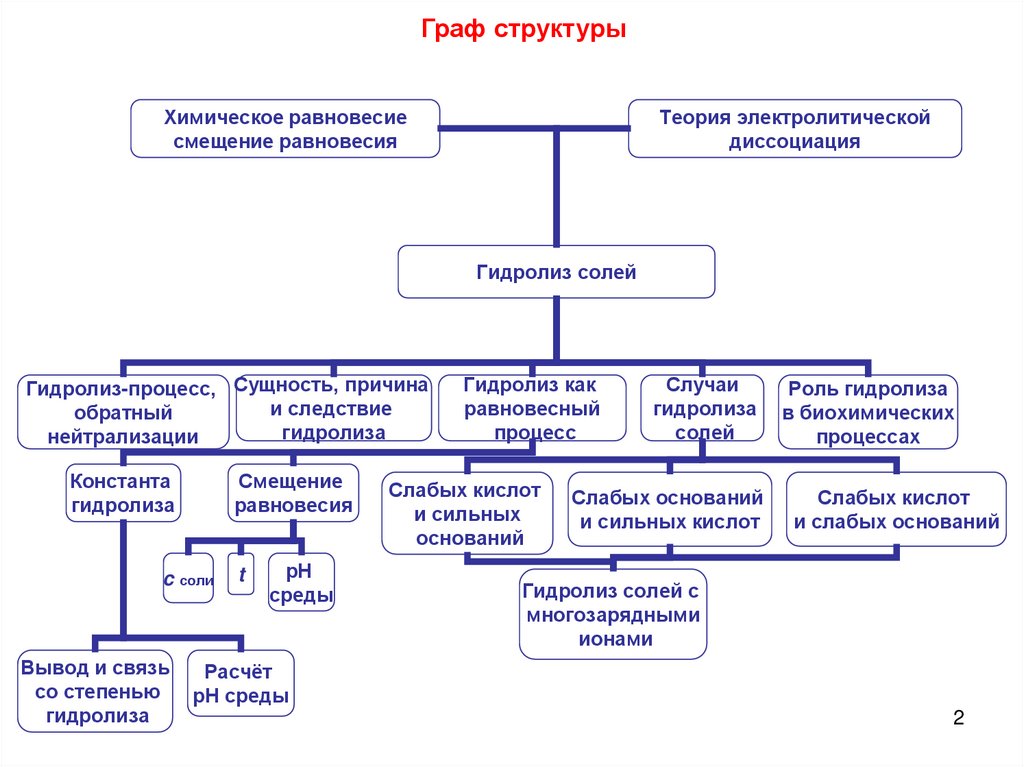
Граф структурыХимическое равновесие
смещение равновесия
Теория электролитической
диссоциация
Гидролиз солей
Гидролиз-процесс, Сущность, причина
и следствие
обратный
гидролиза
нейтрализации
Константа
гидролиза
Смещение
равновесия
c соли
Вывод и связь
со степенью
гидролиза
t
рН
среды
Гидролиз как
равновесный
процесс
Слабых кислот
и сильных
оснований
Случаи
гидролиза
солей
Слабых оснований
и сильных кислот
Роль гидролиза
в биохимических
процессах
Слабых кислот
и слабых оснований
Гидролиз солей с
многозарядными
ионами
Расчёт
рН среды
2
3.
Гидролиз солей – реакция обмена между солью и водой(взаимодействие ионов соли с молекулами воды).
Причина – образование слабых электролитов.
Следствие – смещение равновесия диссоциации воды,
которое сопровождается изменением кислотности среды
вследствие образования избытка ионов Н+ или ОН–.
Гидролиз – процесс:
чаще всего обратимый
ступенчатый (если это возможно)
эндотермический, т. к. обратен реакции нейтрализации.
Количественно гидролиз характеризуется константой
равновесия, которая называется константой гидролиза Кh (Кг),
и степенью гидролиза h – отношением количества вещества
подвергшихся гидролизу ионов соли к исходному количеству
вещества этих ионов.
3
4.
45.
Варианты гидролиза:1. с M раствор соли, образованной слабой кислотой HyAn с
константой диссоциации Ka (при y > 1 используется константа
последней ступени диссоциации кислоты Ka,y) и сильным
основанием. Гидролиз по аниону, среда щелочная.
Выражение константы гидролиза (равновесная концентрация
жидкой воды [H2O] не входит в выражение)
[OH ] [HAn ( y 1) ]
Кh
y
[An ]
Домножим числитель и знаменатель на [H+] и перегруппируем:
[OH ] [HAn ( y 1) ] [H ] [H ] [OH ]
Kw
Кh
y
y
[H
]
[An
] Ka
[An ]
[H ]
[HAn ( y 1) ]
5
6.
Соли KF и Na3PO4К h (KF)
Kw
K a (HF)
К h ( Na 3PO4 )
Kw
K a , III (H 3PO4 )
Если y > 1, то теоретически кроме 1-ой ступени гидролиз
возможен еще в несколько (y-1) ступеней, каждая из которых –
это последовательное взаимодействие образующегося на
предыдущей ступени аниона с молекулой воды:
В обычных условиях заметно протекает только 1-ая ступень (газ
CO2 из раствора карбоната не выделяется). Нагреванием и
разбавлением раствора иногда можно добиться реализации
6
гидролиза по 2-ой и даже по 3-ей ступени.
7.
[OH ] [HAn ( y 1) ], [An y ] q с [OH ],где q индекс при формуле аниона в формуле соли
2
K
[OH ]2
h 4 Kh q c Kh
Кh
[OH ]
q с [OH ]
2
При c/Kh > 100 используют более простые уравнения:
Kw
[OH ] K h q c
q c
Ka
lg [OH ] 0,5 (lg Kw lg q c lg Ka ); pOH 7 0,5 (lg q c pKa ).
pH 7 0,5 (lg q c pK a )
0,05 M раствор Sr(CN)2; pKa(HCN) = 9,31
pH = 7 + 0,5·[lg (2·0,05) + 9,31] = 11,16.
7
8.
22
[OH ]
(
q
c
h
)
q
c
h
h
[OH ] q c·h; К h
q c
q c q c h
1 h
При c/Kh > 100 (h ≤ 0,05):
Кh
Кw
К h q c h h
q c
q c Ka
2
Чем слабее кислота, образующая соль (меньше Ka), тем больше h.
2. с M раствор соли, образованной слабым основанием M(OH)x с
константой диссоциации Kb (при x > 1 используется константа
последней ступени диссоциации кислоты Kb,x) и сильной
кислотой. Гидролиз по катиону, среда кислая.
8
9.
Выражение константы гидролиза (равновесная концентрацияжидкой воды [H2O] не входит в выражение)
[H ] [MOH ( x 1) ]
Kh
[M x ]
Домножим числитель и знаменатель на [OH–] и перегруппируем:
[H ] [MOH ( x 1) ] [OH ] [H ] [OH ]
Kw
Кh
x
x
[
M
]
[OH
] Kb
[M ]
[OH ]
[MOH ( x 1) ]
Соли AgNO3 и MgSO4
K h (AgNO 3 )
Kw
K b (AgOH)
K h (MgSO 4 )
Kw
K b ,II (Mg(OH ) 2 )
9
10.
Если x > 1, то теоретически кроме 1-ой ступени гидролизвозможен еще в несколько (x-1) ступеней, каждая из которых –
это последовательное взаимодействие образующегося на
предыдущей ступени катиона с молекулой воды:
В обычных условиях заметно протекает только 1-ая ступень
(осадок Mg(OH)2 из раствора соли магния не выпадает).
Нагреванием и разбавлением раствора иногда можно добиться
реализации гидролиза по 2-ой и даже по 3-ей ступени.
[H ] [MOH ( x 1) ], [M x ] p с [H ],
где p индекс при формуле катиона в формуле соли
2
K
[H ]2
h 4 Kh p c Kh
Кh
[H ]
p с [H ]
2
10
11.
При c/Kh > 100 используют более простые уравнения:Kw
[H ] K h p c
p c
Kb
lg [H ] 0,5 (lg Kw lg p c lg Kb ).
pH 7 0,5 (lg p c pK b ).
0,04 M раствор AlCl3; pKb,III(Al(OH)3) = 8,98
pH = 7 – 0,5·[lg (1·0,04) + 8,98] = 3,21.
[H ]
( p c h) 2
p c h2
h
[H ] p c·h; К h
p c
p c p c h
1 h
При c/Kh > 100 (h ≤
0,05):
К h p c h h
2
Кh
p c
Кw
p c Kb
Чем слабее основание, образующее соль (меньше Kb), тем больше h.
11
12.
3. с M раствор соли, образованной слабым основанием M(OH)x сконстантой диссоциации Kb (при x > 1 используется константа
последней ступени диссоциации кислоты Kb,x) и слабой
кислотой HyAn с константой диссоциации Ka (при y > 1
используется константа последней ступени диссоциации
кислоты Ka,y). Гидролиз по катиону и аниону (обоим ионам).
среда зависит от соотношения Kb и Ka.
Выражение константы гидролиза (равновесная концентрация
жидкой воды [H2O] не входит в выражение)
12
13.
[MOH ( x 1) ] [HAn ( y 1) ]Kh
[M x ] [An y ]
Умножим числитель и знаменатель на [H+]·[OH–] и перегруппируем:
[MOH ( x 1) ] [HAn ( y 1) ] [H ] [OH ]
Кh
x
y
[M ] [An ]
[H ] [OH ]
[H ] [OH ]
Kw
x
y
[M ] [OH ] [H ] [An ] K b K a
( x 1)
( y 1)
] [HAn
]
[MOH
Соли AgF и Mg(NO2)2
К h (AgF)
Kw
K b (AgOH) K a (HF)
К h (Mg(NO 2 ) 2 )
Kw
K b ,II (Mg(OH ) 2 ) K a (HNO 2 )
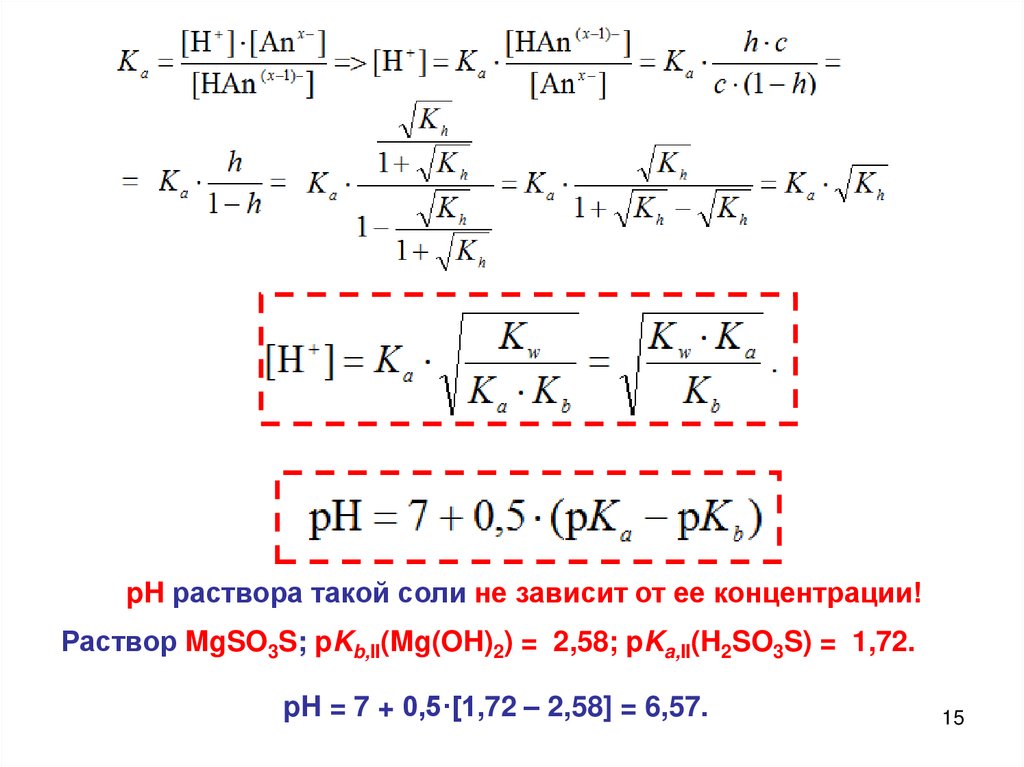
Вывод уравнения для расчета pH раствора такой соли
в общем виде очень громоздкий, поэтому рассмотрим
только случай p = q = 1 (при с > 10–5 моль/л):
13
14.
h раствора такой соли не зависит от ее концентрации!14
15.
pH раствора такой соли не зависит от ее концентрации!Раствор MgSO3S; pKb,II(Mg(OH)2) = 2,58; pKa,II(H2SO3S) = 1,72.
pH = 7 + 0,5·[1,72 – 2,58] = 6,57.
15
16.
4. с M раствор кислой соли, образованной слабой кислотой HyAn(y > 1) и сильным основанием. В растворах таких солей
одновременно
протекают
гидролиз
и
диссоциация
гидроанионов, поэтому среда зависит от соотношения
констант равновесия этих процессов Kh и Kd.
[H ] K a(H( r 1) An ( z 1) ) Kd
pH 0,5 [pK a(H ( r 1) An ( z 1) ) pK d ]
16
17.
10 147
13
Кh
1
,
6
10
К
4
,
6
10
d
8
6,2 10
среда слабощелочная.
[H ] 6,2 10 8 4,6 10 13 1,69 10 10 моль/л;
pH lg1,69 10 10 9,77 0,5 [7,21 12,34] 9,77
17
18.
Раствор NaH2PO4 обладает слабокислой реакциейрН 0,5 (2,14 7,21) 4,67.
Раствор питьевой соды NaHCO3 имеет слабощелочную среду и
используется в медицине для предотвращения ацидозов
рН 0,5 (6,37 10,33) 8,35.
Раствор NaHSO3 имеет слабокислую среду
рН 0,5 (1,78 7,20) 4,49.
pH раствора кислой соли не зависит от ее концентрации!
18
19.
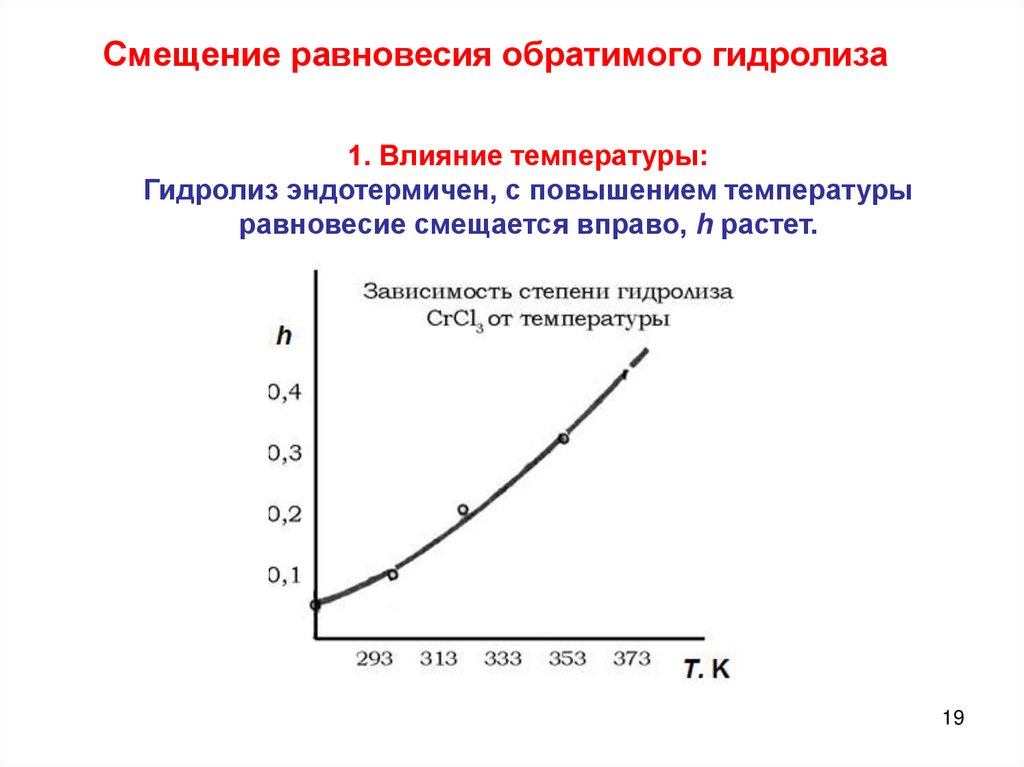
Смещение равновесия обратимого гидролиза1. Влияние температуры:
Гидролиз эндотермичен, с повышением температуры
равновесие смещается вправо, h растет.
19
20.
2. Добавление сильных кислот (H+) и щелочей (ОН–).а) В случае обратимого гидролиза по катиону одним из
продуктов реакции является Н+, поэтому при добавлении Н+
(подкислении) равновесие смещается влево (гидролиз
подавляется). При добавлении ОН– (подщелачивании)
последние связывают Н+ в H2O, смещая равновесие вправо
(гидролиз усиливается).
б) В случае обратимого гидролиза по аниону одним из
продуктов реакции является ОН–, поэтому при добавлении
ОН– (подщелачивании) равновесие смещается влево
(гидролиз подавляется). При добавлении Н+ (подкислении)
последние связывают ОН– в H2O, смещая равновесие
вправо (гидролиз усиливается).
20
21.
3. Разбавление раствора.Оно смещает вправо равновесие обратимого гидролиза
по одному виду ионов (по катиону, по аниону), h растет.
Добавление соли в раствор тоже смещает равновесие вправо, но
h при этом падает.
по катиону :
h
Кh
p c
по аниону :
Кh
h
q c
При обратимом гидролизе по обоим ионам и при гидролизе
кислой соли разбавление не влияет на равновесие.
21
22.
Необратимый гидролизЕсли продукт гидролиза накапливается в растворе в таком
количестве, что может выпасть в осадок или выделиться в виде
газа, то гидролиз будет необратимым.
Возможные случаи:
а) соли очень слабых оснований и сильных кислот –
необратимый гидролиз по катиону [это относится к
разбавленным растворам солей Bi(III), Hg(II), Pd(II), Sb(III), Sn(II),
Tl(III) и всех металлов(IV)]
б) соли многокислотных слабых оснований и многоосновных
слабых кислот, не являющиеся нерастворимыми в воде –
необратимый гидролиз по обоим ионам
22
23.
Частным случаем последнего варианта является взаимноеусиление гидролиза, протекающее при попытке получить по
обменной реакции в растворе соль вышеуказанного типа
(многокислотного слабого основания и слабой кислоты, не
являющаяся нерастворимой в воде) – тоже необратимый
гидролиз по обоим ионам. Его продукты не обязательно
кислота (или продукт ее распада) и основание/амфотерный
гидроксид, могут образовываться и оснóвные соли:
23
24.
Роль гидролиза биоорганических соединенийв процессах жизнедеятельности
пепсин желудочного сока активен при рН = 1,5–2,0;
каталаза крови – при рН = 7,0;
тканевые катепсины в среде, близкой к нейтральной,
катализируют синтез белка, а в кислой – расщепляют его.
24
25.
1. Каждый из ферментов активен при строго определенныхзначениях рН.
Без ферментативного гидролиза невозможно усвоение пищевых
продуктов (жиры, углеводы, белки), так как всасываться в
кишечнике способны только относительно небольшие
молекулы.
Жиры в желудочно-кишечном тракте расщепляются водой на
более мелкие фрагменты. Катионы водорода катализируют
гидролиз жиров.
Усвоение полисахаридов и дисахаридов становится
возможным лишь после полного их гидролиза ферментами до
моносахаридов. Катионы водорода катализируют гидролиз
сахарозы.
Белки гидролизуются до веществ, которые лишь потом могут
усваиваться.
25
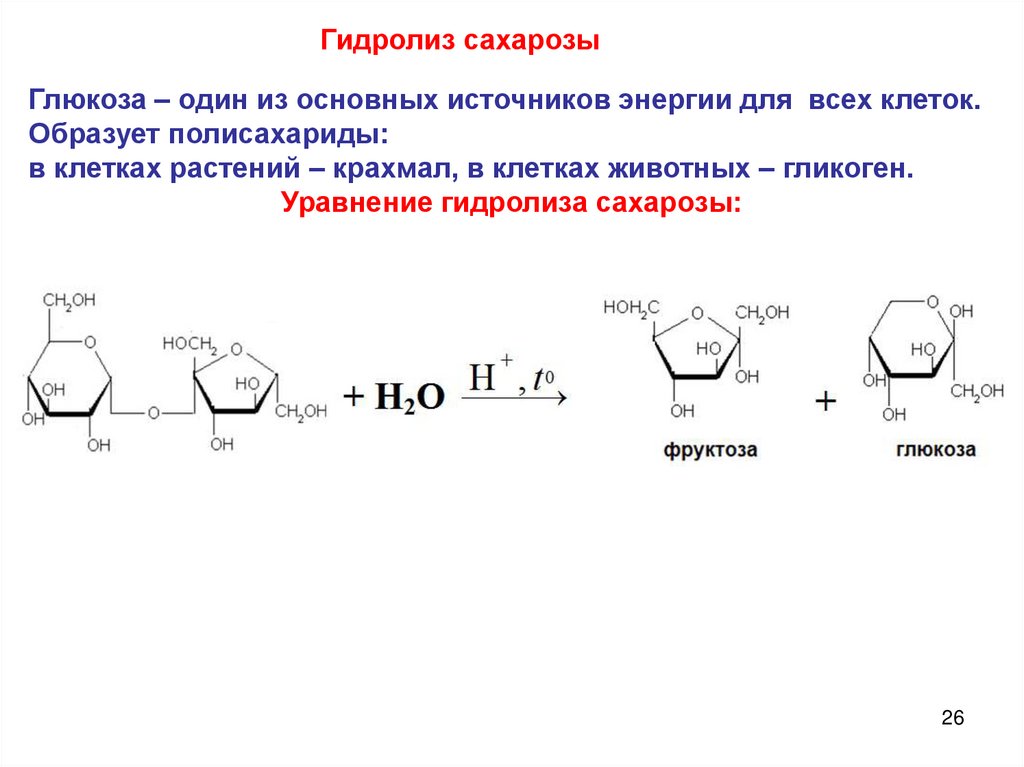
26.
Гидролиз сахарозыГлюкоза – один из основных источников энергии для всех клеток.
Образует полисахариды:
в клетках растений – крахмал, в клетках животных – гликоген.
Уравнение гидролиза сахарозы:
26
27.
Белки – основной строительный материал клеток(рыба, творог, сыр, говядина, крупы)
Вещества, молекулы которых состоят из остатков
-аминокислот, связанных в длинные цепи пептидными связями.
Конечными продуктами окисления являются СО2 и Н2О, а также
мочевина, аммонийные соли, мочевая кислота, аспарагин и
некоторые другие, выводимые из организма с мочой и потом.
Жиры – сложные эфиры глицерина и жирных кислот (масло
растительное и животное, яйцо, говядина).
CH2
O
CO R
CH
O
CO R'
CH2
O
CO R''
где R, R' и R" — радикалы жирных кислот, наибольшее значение
из которых имеют стеариновая С17Н35СООН, пальмитиновая
27
С15Н31СООН и олеиновая С17Н33СООН.
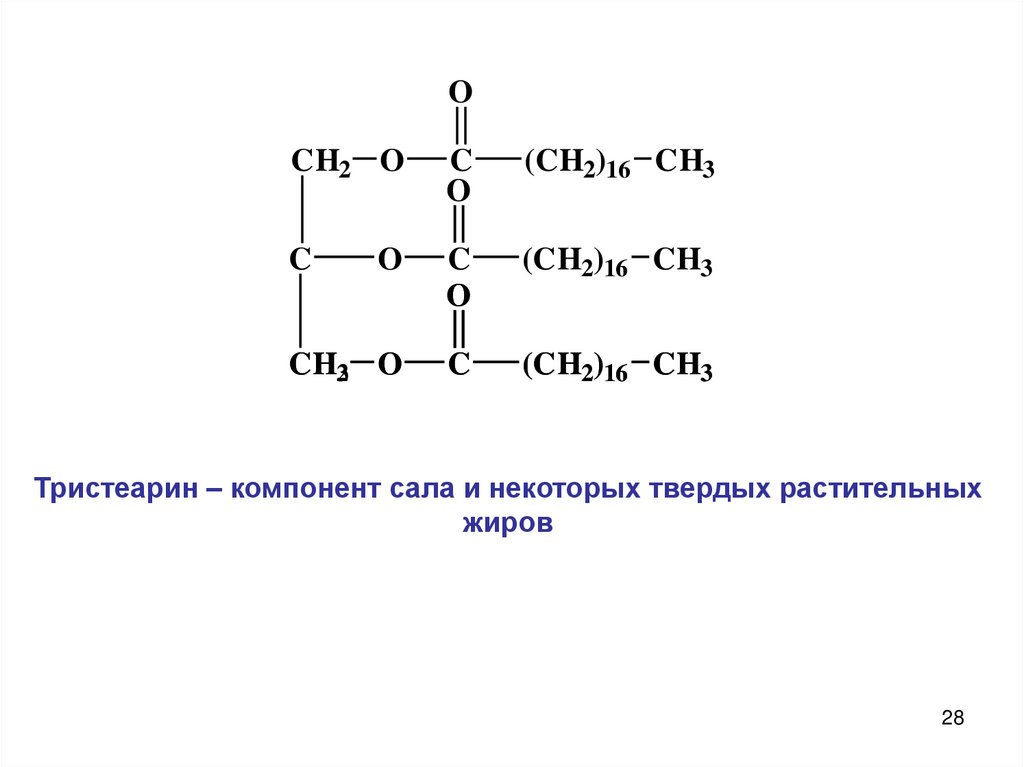
28.
OCH2 O
C
O
(CH2)16 CH3
C
O
C
O
(CH2)16 CH3
CH23 O
C
(CH2)16 CH3
Тристеарин – компонент сала и некоторых твердых растительных
жиров
28
29.
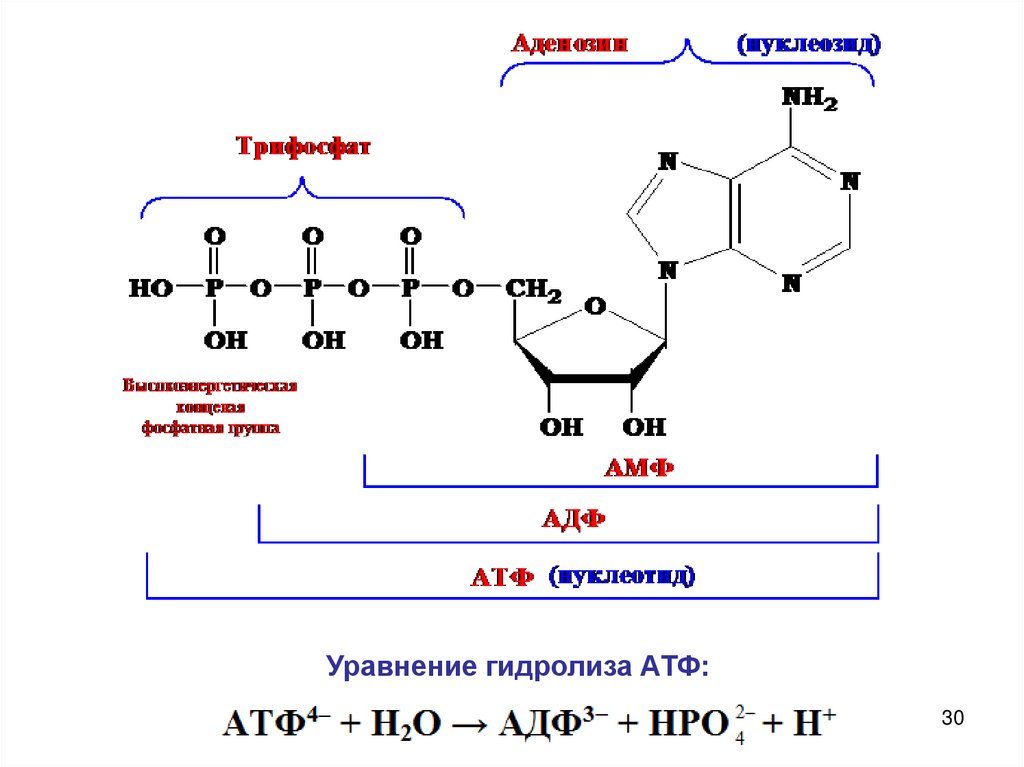
2. Гидролиз АТФ – источник энергии в организме.Человек получает энергию как за счет многостадийного
процесса окисления пищи, так и за счет гидролиза некоторых
сложных эфиров, амидов, пептидов и гликозидов.
АТФ – главный источник энергии для биологических процессов
синтеза белка, ионного транспорта, сокращения мышц,
электрической активности нервных клеток
29
30.
Уравнение гидролиза АТФ:30
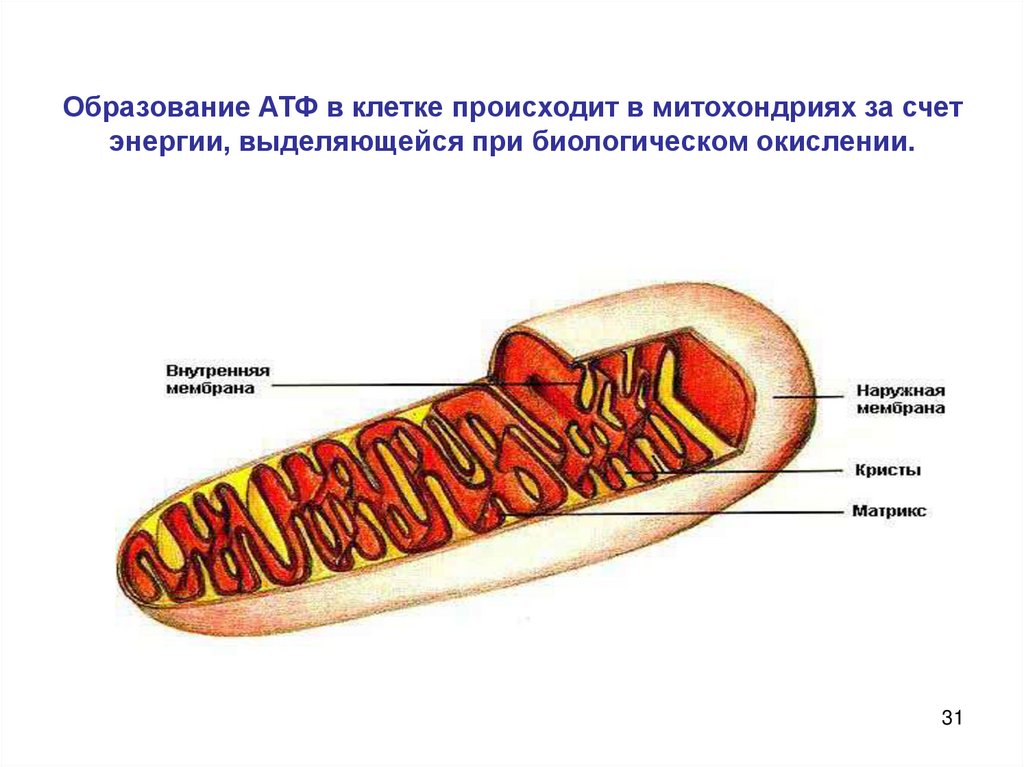
31. Образование АТФ в клетке происходит в митохондриях за счет энергии, выделяющейся при биологическом окислении.
3132.
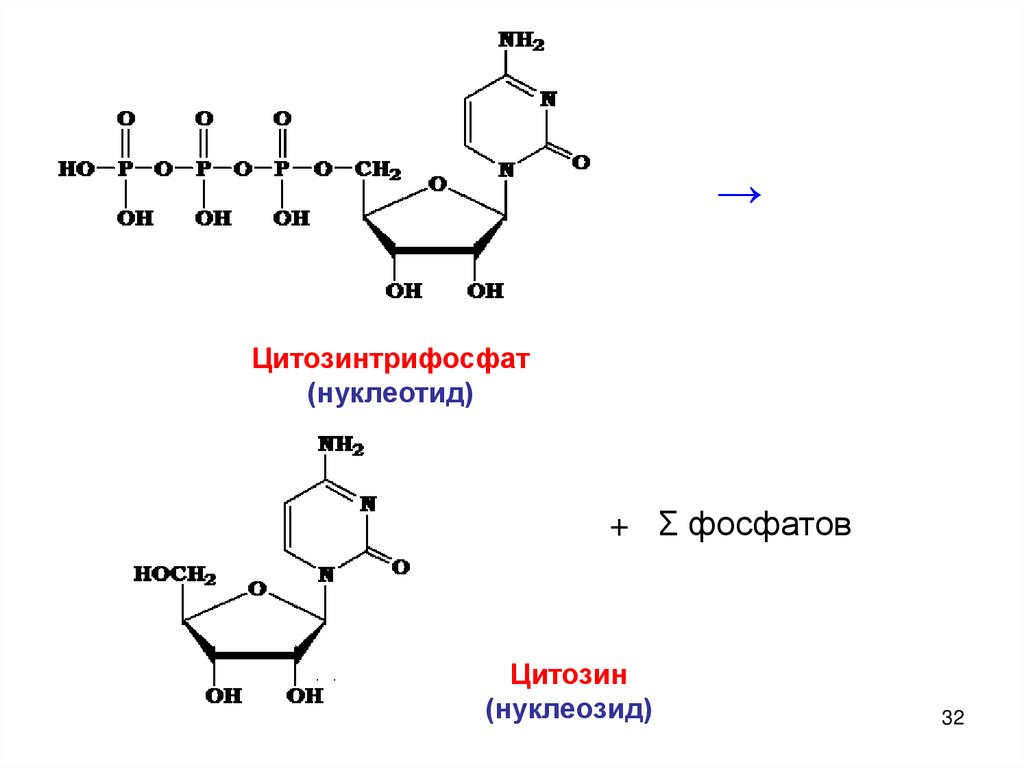
→Цитозинтрифосфат
(нуклеотид)
+ Σ фосфатов
Цитозин
(нуклеозид)
32
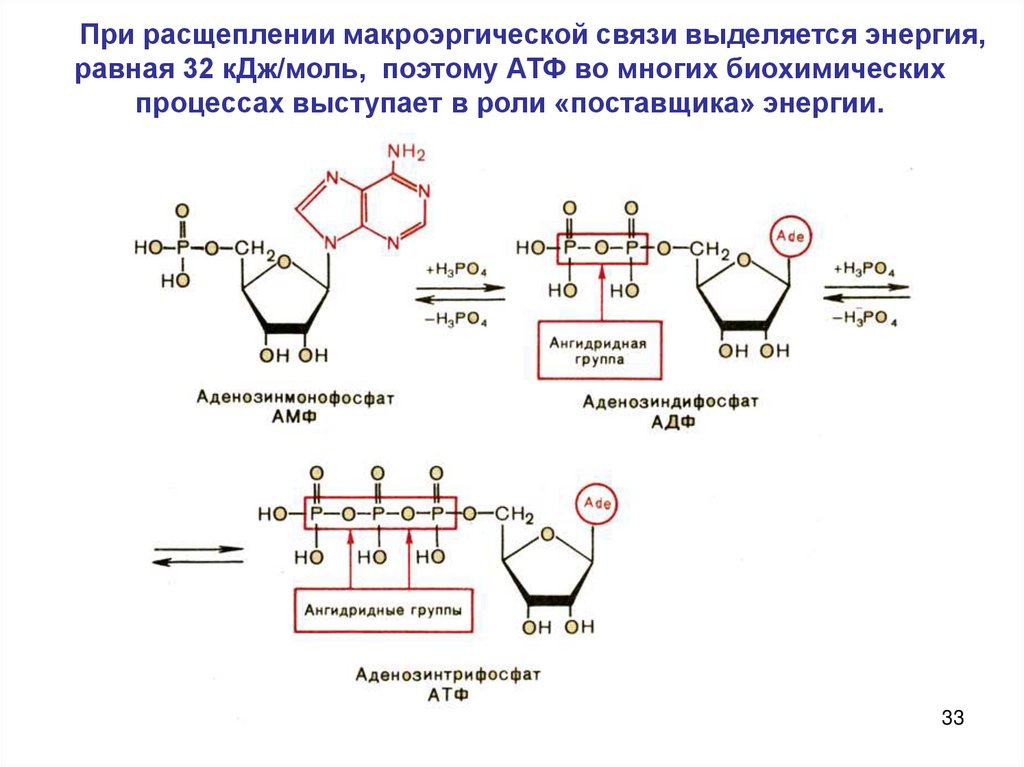
33.
При расщеплении макроэргической связи выделяется энергия,равная 32 кДж/моль, поэтому АТФ во многих биохимических
процессах выступает в роли «поставщика» энергии.
33
34.
3. Гидролиз – один из важнейших путей метаболизмалекарственных препаратов и пищевых продуктов
Процесс гидролиза может
идти:
В плазме крови
На клеточных мембранах
В цитоплазме клеток
Во внутренних органеллах,
в частности в лизосомах
34
35.
Большинство лекарственных веществ метаболизируются впечени, располагающей для этого набором ферментных систем
весьма большой мощности.
Эти ферментные системы локализованы либо в митохондриях,
либо в микросомах, либо в гиалоплазме.
35
36.
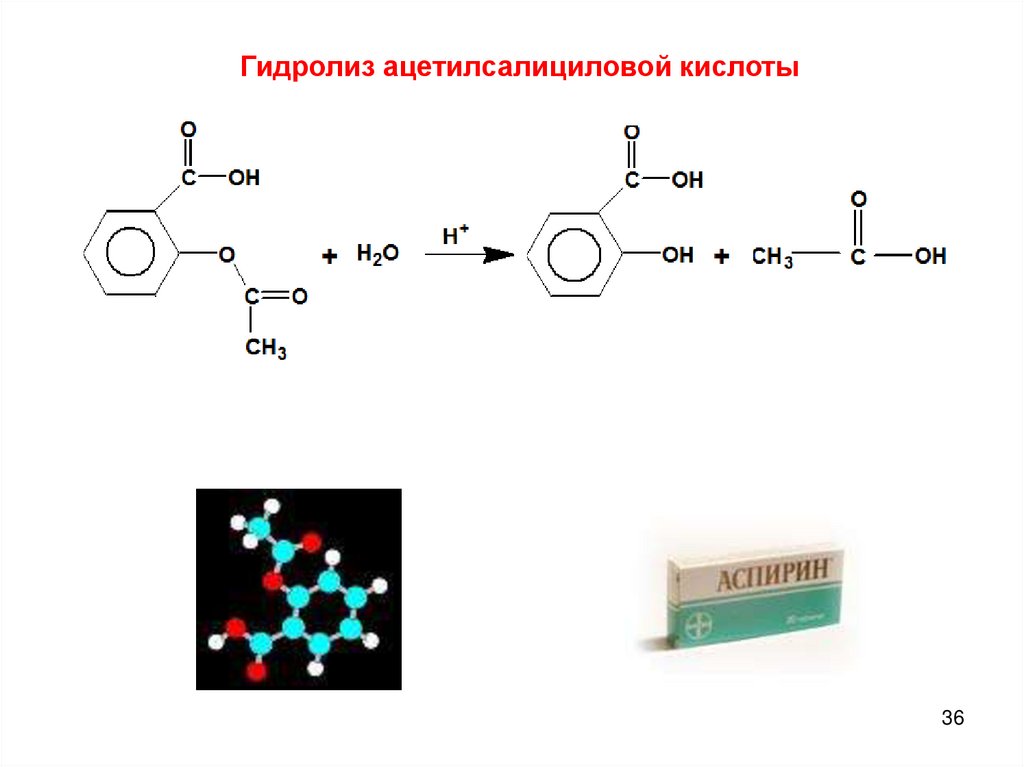
Гидролиз ацетилсалициловой кислоты36
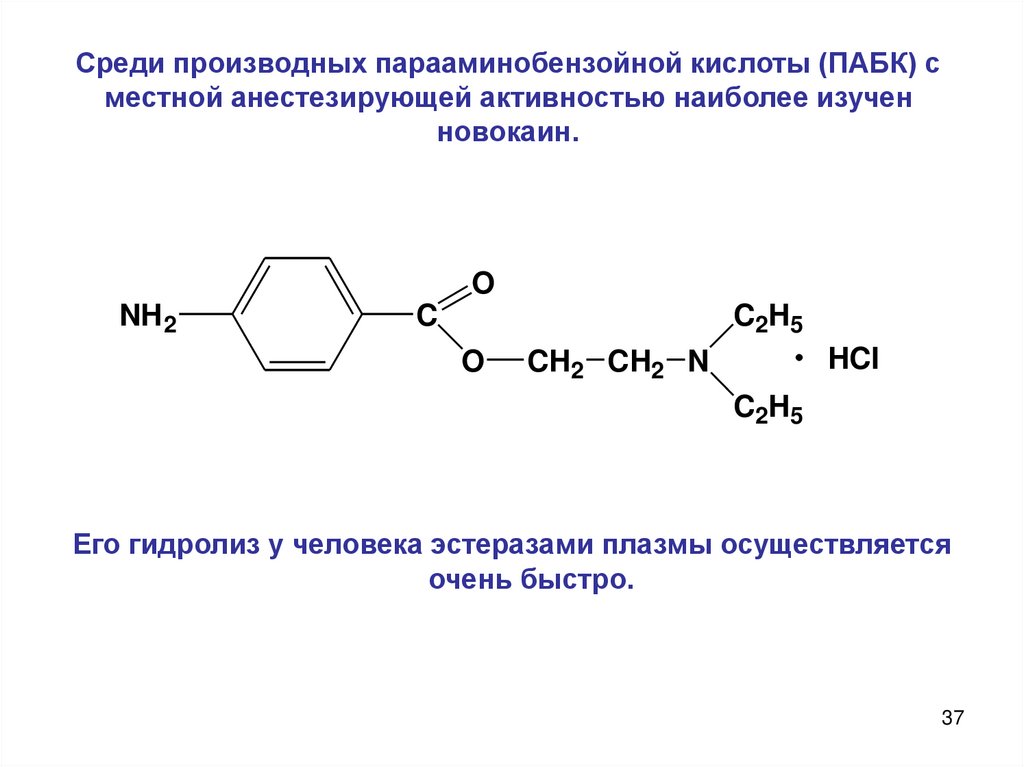
37. Среди производных парааминобензойной кислоты (ПАБК) с местной анестезирующей активностью наиболее изучен новокаин.
ONH 2
C
C 2H 5
O
HCI
CH2 CH2 N
C 2H 5
Его гидролиз у человека эстеразами плазмы осуществляется
очень быстро.
37
38.
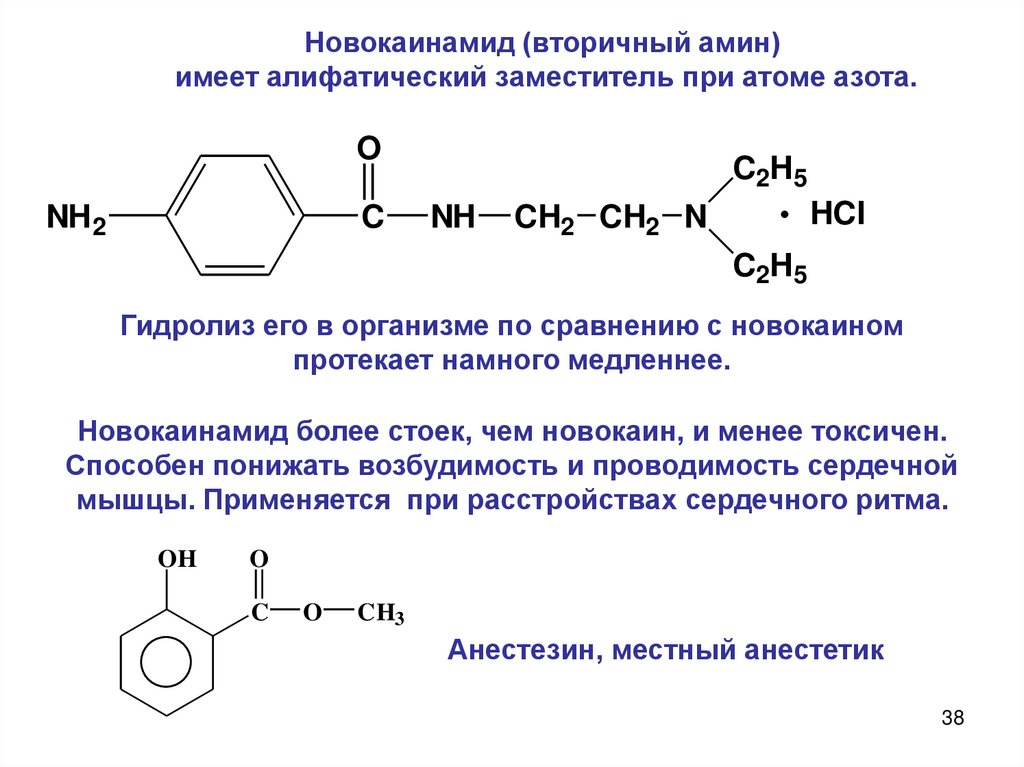
Новокаинамид (вторичный амин)имеет алифатический заместитель при атоме азота.
O
NH 2
C
C 2H 5
NH
HCI
CH2 CH2 N
C 2H 5
Гидролиз его в организме по сравнению с новокаином
протекает намного медленнее.
Новокаинамид более стоек, чем новокаин, и менее токсичен.
Способен понижать возбудимость и проводимость сердечной
мышцы. Применяется при расстройствах сердечного ритма.
OH
O
C
O
CH3
Анестезин, местный анестетик
38
39.
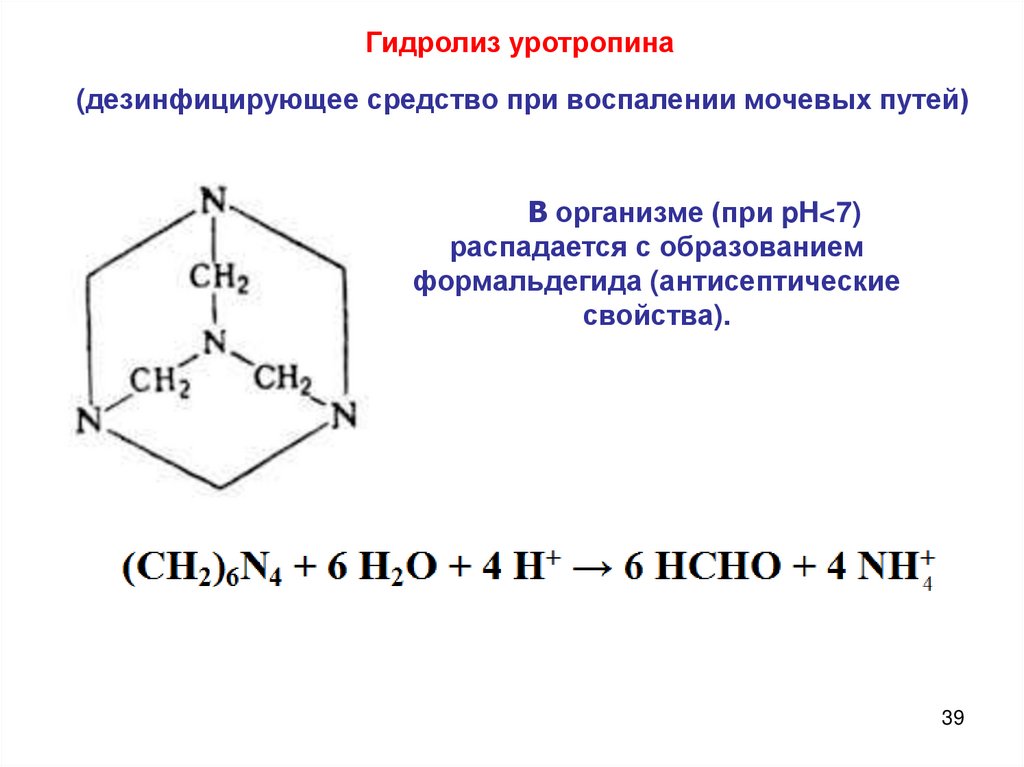
Гидролиз уротропина(дезинфицирующее средство при воспалении мочевых путей)
В организме (при pH<7)
распадается с образованием
формальдегида (антисептические
свойства).
39
40.
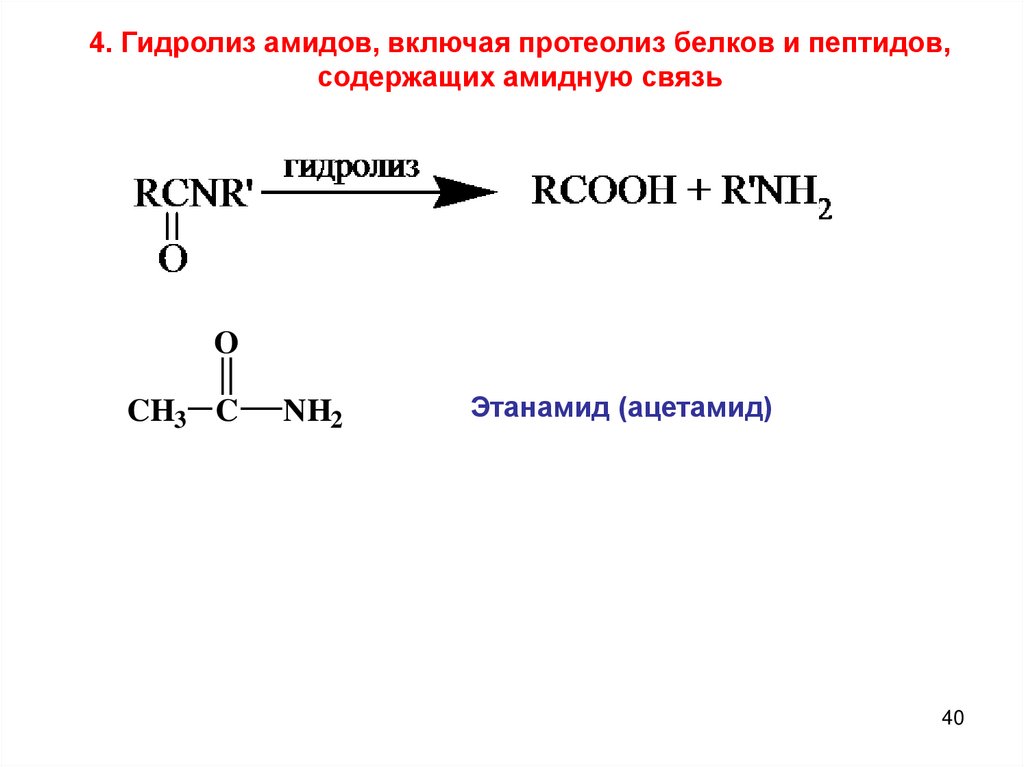
4. Гидролиз амидов, включая протеолиз белков и пептидов,содержащих амидную связь
O
CH3 C
NH2
Этанамид (ацетамид)
40
41.
OCH3CH2 C
N – циклобутилпропанамид
N
H
O
Br
CH2 C
NH
CH3
2-бром-N-метилэтанамид
N-метилциклопентанамид
N,N-диэтилбензамид
41
42.
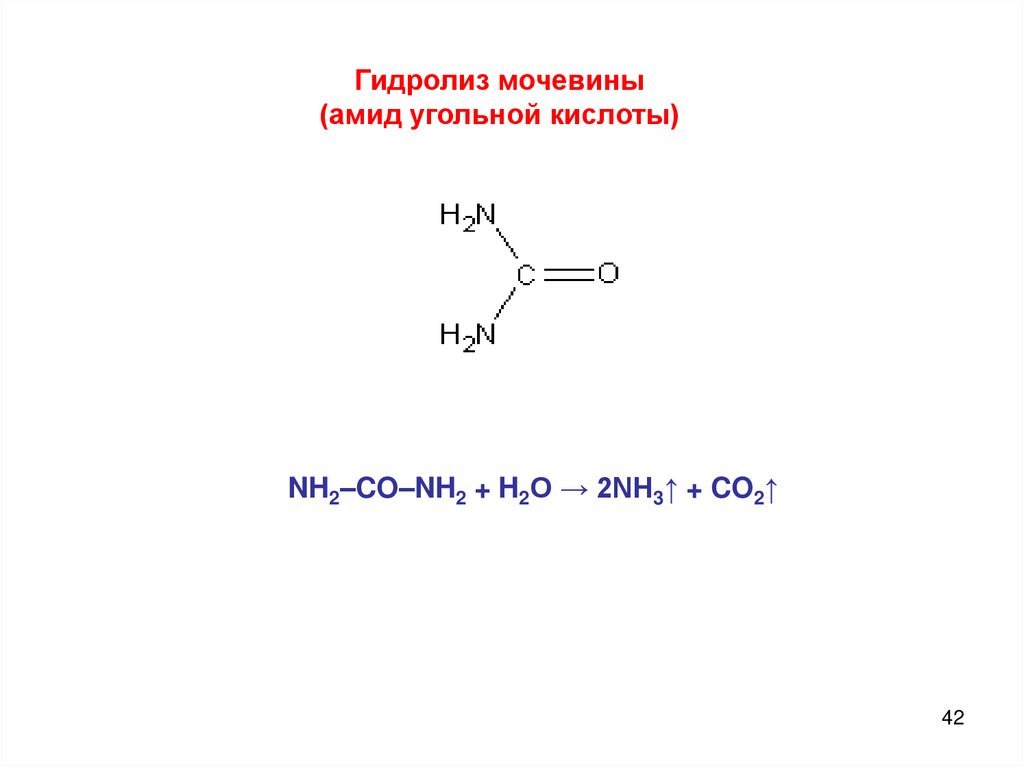
Гидролиз мочевины(амид угольной кислоты)
NH2–CO–NH2 + H2O → 2NH3↑ + CO2↑
42
43.
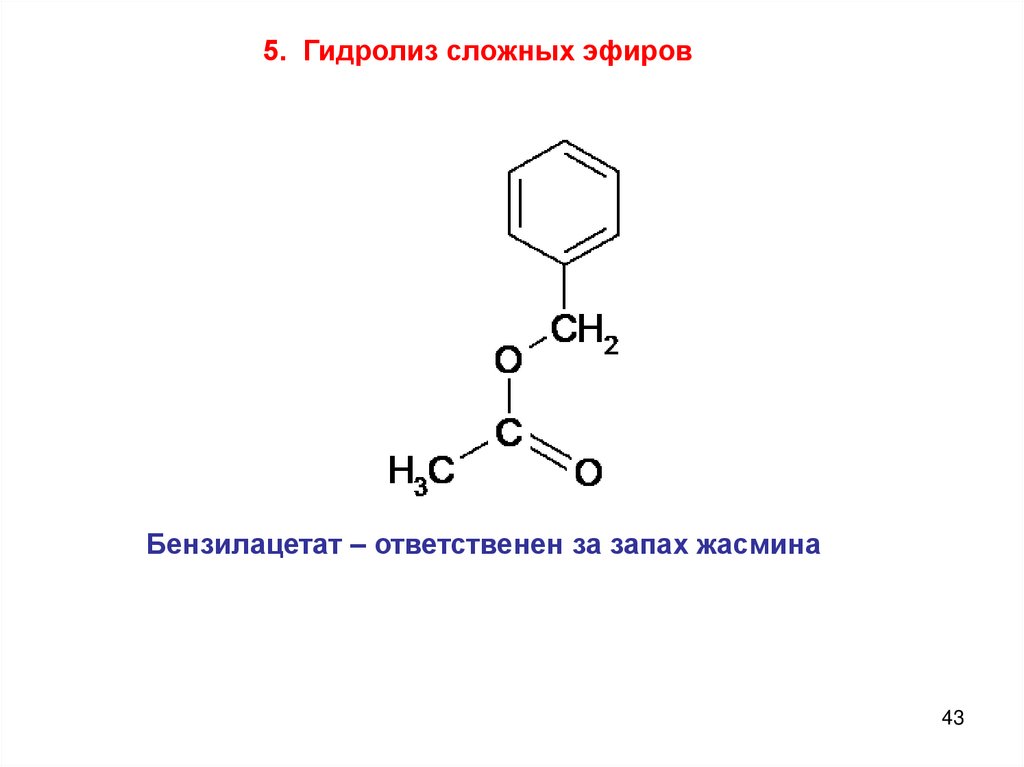
5. Гидролиз сложных эфировБензилацетат – ответственен за запах жасмина
43




























 chemistry
chemistry








