Similar presentations:
Растворы электролитов
1.
Часть 2 курса«Неорганическая химия» 1 семестра
Растворы электролитов
(продолжение)
Лекционный материал №2
2.
План лекции 2:1. первая кислотно-основная теория:
теория Аррениуса – Брёнстеда;
2. реакции нейтрализации и гидролиза;
3. реакции с участием малорастворимых
электролитов, в т. ч., с малорастворимыми
кислотами и основаниями;
4. вторая кислотно-основная теория:
теория Брёнстеда – Лоури.
3.
1. Первая кислотно-основная теория:теория Аррениуса – Брёнстеда (по умолчанию ей
уже пользовались на прошлой лекции).
Кислота – это соединение, при
ионизации которого образуются
сольватированные ионы водорода
H+ и кислотного остатка A–.
HA H+ + A–. Пример:
+ + HSO – (A– = HSO –)
H
SO
H
2
3
3
3
С. Аррениус
Основание – это соединение, которое при
ионизации дает анионы гидроксила OH – и
катионы M+.
NH3 H2O NH4+ + OH – (M+ = )
4.
Сила кислот и оснований определяется ихконстантами диссоциации. В основном имеют
значение ступенчатые константы. Пример:
H3AsO4 = H+ + H2AsO4– ;
5.
Сила кислот и оснований определяется ихконстантами диссоциации. В основном имеют
значение ступенчатые константы. Пример:
H3AsO4 =
H+
+ H2AsO4
–;
K a1
CH CH AsO
2
CH3AsO4
4
; K a1 6,0 10 3
6.
Сила кислот и оснований определяется ихконстантами диссоциации. В основном имеют
значение ступенчатые константы. Пример:
H3AsO4 =
H+
H2AsO4–
H+
=
–;
+ H2AsO4
+
HAsO42– ;
K a1
K a2
CH CH AsO
2
4
CH3AsO4
CH CHAsO2
4
CH AsO
2
4
; K a1 6,0 10 3
; K a2 1,1 10 7
7.
Сила кислот и оснований определяется ихконстантами диссоциации. В основном имеют
значение ступенчатые константы. Пример:
H3AsO4 =
H+
H2AsO4–
H+
2–
=
HAsO4 =
H+
–;
+ H2AsO4
+
HAsO42– ;
+ AsO4
3–
;
K a1
CH CH AsO
K a2
2
CH3AsO4
CH CHAsO2
4
CH AsO
2
K a3
4
; K a2 1,1 10 7
4
CH CAsO3
4
CH AsO2
2
; K a1 6,0 10 3
4
; K a3 3,9 10 12
8.
Сила кислот и оснований определяется ихконстантами диссоциации. В основном имеют
значение ступенчатые константы. Примеры:
H3AsO4 =
H+
H2AsO4–
H+
=
2–
HAsO4 =
H+
–;
+ H2AsO4
+
HAsO42– ;
3–
+ AsO4
Pb(OH)2 =
Pb(OH)+
Pb(OH)+
Pb2+
+
;
K a1
CH CH AsO
K a2
2
CH3AsO4
OH –
; K a2 1,1 10 7
4
CH AsO
4
CH CAsO3
4
CH AsO2
2
OH – ;
; K a1 6,0 10 3
CH CHAsO2
2
K a3
4
K b1
K b2
; K a3 3,9 10 12
4
CPb(OH) COH
CPb(OH)2
CPb2 COH
; K b1 9,6 10 4
; K b2 4,0 10 8
=
+
;
C
Константы диссоциации кислот (Ka) и оснований
(Kb) – частные случаи константы ионизации KC.
Ka – от англ. acid (кислота), Kb – basis (основание)
Pb(OH)
9.
Продукты реакции нейтрализации – это соль +вода. В ионном виде реакция нейтрализации имеет вид
H+ + OH – H2O.
Образование солей в реакциях нейтрализации имеет
подчиненный характер, поскольку катион и анион
остаются в растворе в ионном виде (для реакции с
участием сильных электролитов).
Средние соли – это вещества, которые при ионизации в
растворе (обычно практически полной) образуют катионы
и анионы кислотных остатков: NaI Na+ + I –.
Кислые соли диссоциируют ступенчато, давая вначале
катионы основных остатков, а затем – катионы водорода.
KHCO3 K+ + HCO3 –;
HCO3 – H+ + CO3 2–.
Не всегда кислая соль придает раствору кислую реакцию!
9
10.
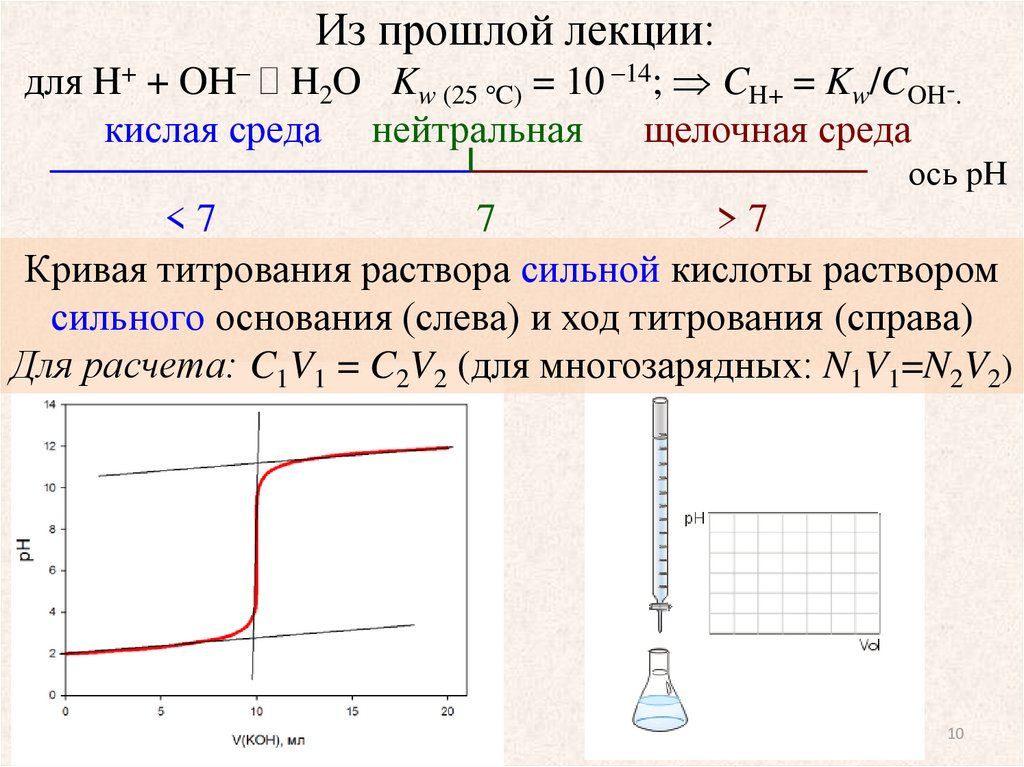
Из прошлой лекции:для H+ + OH– H2O Kw (25 C) = 10 –14; CH+ = Kw/COH-.
кислая среда нейтральная
щелочная среда
ось pH
<7
7
>7
Кривая титрования раствора сильной кислоты раствором
сильного основания (слева) и ход титрования (справа)
Для расчета: C1V1 = C2V2 (для многозарядных: N1V1=N2V2)
10
11.
Задача о нейтрализации слабой кислотой слабогооснования
Предположим, смешали равные объемы растворы аммиака и
муравьиной кислоты с одинаковыми исходными концентрациями.
Требуется найти pH раствора, если известно, что для диссоциации
аммиака Kb = 1,76 10 –5, а для муравьиной кислоты Ka = 1,80 10 –4.
Решение. Кислота и основание взяты в стехиометрических
количествах. Тогда можно записать:
NH3 H2O + HCOOH H2O + NH4+ + HCOO–.
Равновесные концентрации:
С0 – x
С0 – x
const
x
x
Запишем возможные равновесия в растворе и выражения констант:
NH3 H2O NH4+ + OH–
HCOOH H+ + HCOO–
H2O H+ + OH–
Kb
Ka
CNH COH
4
CNH3 H2O
;
CH CHCOO
CHCOOH
Kb
; Ka
x COH
C0 x
x CH
C0 x
K w CH COH
В результате получаем систему из трех уравнений с тремя неизвестными.
11
12.
Задача о нейтрализации слабой кислотой слабогооснования (продолжение)
Решение этой системы дает:
СH
x (
Ka Kw
;
Kb
CH 3,16 10 7 pH 6,5;
1
) C0 ; x 0,998 C0
Kw
1
K a Kb
Итого завершенность реакции составляет 99,8 (не 100 %)!
Вывод: даже нейтрализация кислот и оснований, близких
к электролитам средней силы (не говоря уже
нейтрализации совсем слабых кислот очень слабыми
основаниями) не дает 100% нейтрализации. Часть
непрореагировавших кислоты и основания остаются в
растворе. А при разных константах диссоциации кислоты
12
и основания эта часть заметно отклоняет pH от 7.
13.
Гидролиз солейПредположим, что имеется водный раствор муравьинокислого
аммония с концентрацией С0. Требуется рассчитать, какая часть
этой соли превратиться в свободную кислоту и основание.
Требуется также найти pH раствора.
Решение. Реакция оказывается противоположной той, что записана
на пред-предыдущей странице. Обозначим концентрацию
образующихся кислоты и основания за x. Тогда можно записать:
NH4+ + HCOO– + H2O NH3 H2O + HCOOH.
Равновесные концентрации: С0 – x
С0 – x
const
x
x
Как и в задаче обратной этой, запишем равновесия и связи констант
с концентрациями:
NH3 H2O NH4 +
OH–
Kb
HCOOH H+ + HCOO–
Ka
+
H2O H+ + OH–
CNH COH
4
;
CNH3 H2O
CH CHCOO
CHCOOH
Kb
; Ka
(С0 x) COH
x
(С0 x) CH
x
K w CH COH
13
14.
Гидролиз солей (продолжение)Итак, как и в предыдущем случае получаем систему из трех
уравнений с тремя неизвестными. :
NH3 H2O NH4 +
+
HCOOH
H+
+
OH–
HCOO–
H2O H+ + OH–
Kb
Ka
CNH COH
4
CNH3 H2O
;
CH CHCOO
CHCOOH
Kb
; Ka
(С0 x) COH
x
(С0 x) CH
x
K w CH COH
Решение для CH+ оказывается аналогичным предыдущему случаю:
СH
Ka Kw
;
Kb
CH 3,16 10 7 pH 6,5;
Для концентраций исходных ионов (С0 – x) и концентраций
продуктов гидролиза соответственно получаем:
С0 x (
1
) C0 ; С0 x 0,998 C0 x 0,002 C0 .
Kw
1
На самом деле в рассмотренном примере
K a Kb
мы сталкиваемся с гидролизом.
14
15.
Гидролиз солейГидролиз (вообще) – это реакция взаимодействия
вещества с водой, протекающая без изменения
степеней окисления элементов.
Например, гидролиз сахарозы:
C12H22O11 +H2O = C6H12O6 (глюкоза) + C6H12O6 (фруктоза)
Гидролиз соли – это реакция обменного
взаимодействия с водой, в результате которой
образуются кислота и основание. Гидролиз соли –
это реакция, обратная нейтрализации.
15
16.
Случай 1. Гидролиз соли MA, образованной в простейшемслучае слабой кислотой HA и слабым основанием MOH.
Катион M+ и анион A– однозарядны. Имеем равновесие:
CMOH CHA
Kh
M+ + A– + H2O MOH + HA
CM C A . (1)
Kh – константа гидролиза.
Но Kh не является табличной константой, поскольку
может быть выражена через другие константы. Умножим
числитель и знаменатель в (1) на CH+ и на COH–.
CH COH
CMOH
CHA
Kw
Kh
Kh
CM СOH CH CA
1
Kb K a
Отклонения pH от нейтральности в растворе такой соли
проявляются за счет разной ионизации MOH и HA
Ka Kw
С
(см. вывод на стр. 14):
H
16
Kb
17.
Случай 2. Гидролиз соли MA, образованной сильнымоснованием MOH и слабой кислотой HA.
M+ + HOH MOH + H+ (MOH – сильное основание,
равновесие смещено влево, его вкладом пренебрегаем.
Вывод: гидролиз идет только по аниону, среда щелочная:
CHA COH
A– + HOH HA + OH – (2) K h
. (2 )
C A
Умножим числитель и знаменатель в (2) на CH+:
CHA COH CH
K w . (3)
Kh
Kh
C A С H
Ka
K w CHA COH
Комбинируем (2 ) и (3) для расчета pH: K
.
C
a
A
2
C
Kw
OH
Из стехиометрии (2) CHA COH–
17
Ka
C A
18.
Итак2
COH
Kw
K a CA
.
(4)
Но из ионного произведения воды СOH
Подставляя (5) в (4) получаем:
СH
Kw Ka
CA
Kw
. (5)
CH
Kw Ka
Cсоли .
(6)
Выражение (6) позволяет рассчитывать pH (величина
должна быть всегда > 7).
Пример реального обратимого гидролиза:
CH3COONa CH3COO– + Na+; далее
CH3COO– + HOH CH3COOH + OH–
Кa для CH3COOH 10–5. Для 0,1 М раствора ацетата Na
18
формула (6) дает pH 9.
19.
Случай 3. Гидролиз соли MA, образованной слабымоснованием MOH и сильной кислотой HA.
Вкладом гидролиза по аниону пренебрегаем, поскольку
кислота HA - сильная.
CMOH CH
Kh
M+ + HOH MOH + H+ (7)
.
(7 )
CM
Вывод: гидролиз идет только по катиону, среда кислая.
Для определения Kh с другими константами умножим (7 )
числитель и знаменатель на концентрацию СOH–.
CMOH CH COH
Kw
.
.
(8)
Kh
Kh
CM COH
Kb
Исходя из стехиометрии (7) имеем СMOH CH+.
(9)
Комбинируем (7), (8) и (9):
СH
K w CM
Kb
K w Cсоли
. (10)
Kb
19
20.
Пример гидролиза для случая (3):LiCl Li+ + Cl– ;
Li+ + HOH LiOH + H+.
Ступенчатый гидролиз:
AlCl3 Al3+ + Cl–;
Al3+ + HOH Al(OH)2+ + H+;
Kh = Kw/Kb3: Kb3 для Al(OH)2+ = Al3+ + OH–
Al(OH)2+ + HOH Al(OH)2+ + H+; Kh = Kw/Kb2: Al(OH)2+ = Al(OH)2+ + OH–
Al(OH)2+ + HOH Al(OH)3 + H+; Kh = Kw/Kb1: Al(OH)3+ = Al(OH)2+ + OH–
Исходя из связи между Kh, Ka или (и) Kb делаем вывод о
наиболее сильном вкладе в гидролиз его 1-ой ступени.
Аналогично и для ступенчатого гидролиза солей,
образованных сильным основанием и слабой кислотой:
K2S 2K+ + S2–; S2– + HOH HS– + OH–;
20
HS– + HOH H2S + OH–.
21.
Предельные случаи гидролиза1. Полный гидролиз.
Очень слабое основание и очень слабая кислота.
Al2S3 2Al3+ + 3S2–;
2Al3+ + 2HOH = 2Al(OH)2+ + 2H+;
3S2–+3HOH = 3HS– + 3OH–;
2Al(OH)2++ 2HOH = 2Al(OH)2+ + 2H+; 3S2–+3HOH = 3HS– + 3OH–
2Al(OH)2+ + 2HOH = 2Al(OH)3 + 2H+; 6H+ +3OH– = 6 HOH
Итог:
Al2S3 + 6HOH 2Al(OH)3 + 3H2S
1а. В некоторых случаях даже очень сильная кислота или
основание не могут удержать соль (или «соль») от полного
гидролиза:
BCl3 + 3H2O 3HCl + B(OH)3 = H+ + Cl– + H3BO3;
C2H5OK + H2O C2H5OH + KOH = C2H5OH + K+ + OH– 21
22.
Предельные случаи гидролиза:2. Совместный гидролиз
3K2CO3+ 2FeCl3+ 6HOH = 2Fe(OH)3 + 3H2CO3 + 6K++ 6Cl3CO2+3H2O
Совместный гидролиз формально можно представить как
образование соли, образованной очень слабыми основанием и
кислотой с последующим полным гидролизом этой соли.
3K2CO3 + 2FeCl3 = «Fe2(CO3)3» + 6 KCl и далее
«Fe2(CO3)3» + 3H2O = 2Fe(OH)3 + 3CO2 .
3. Отщепление воды в ходе гидролиза
TiCl4 = Ti4+ + 4Cl–;
Ti4+ + 2H2O Ti(OH)22+ + 2H+;
Ti(OH)22+ = TiO2+ + H2O
TiO2+ – ион титанила; TiOCl2 – хлорид титанила
22
В названия катионов добавляется суффикс «ил».
23.
Вопросы по лекции1. Какими способами можно подавить гидролиз
цианистого калия, не устраняя ионы CN– из раствора?
2. Почему константа гидролиза очень сильно зависит от
температуры, хотя константы кислот и оснований
весьма вяло меняются с температурой?
3. Почему в справочниках не приводятся величины
констант гидролиза?
4. Может ли в водном растворе величина pH достигать
занчения 100? Почему?
5. * Почему не подвергается полному гидролизу сульфид
меди CuS? Хотя по силе кислоты и основания – должен
был бы...
23





















 chemistry
chemistry








