Similar presentations:
Теория растворов. Семинар
1.
ТЕОРИЯ РАСТВОРОВСеминар
Семинар подготовили доц. Солодова Е.В., доц. Зайцева Ю.Н.
2.
Процесс распада вещества на ионы,протекающий под действием молекул
растворителя, называется
электролитической диссоциацией
К электролитам относятся:
Соли, кислоты, основания
К неэлектролитам относятся:
Простые вещества;
Оксиды;
Газы;
Большинство органических веществ;
3.
Степень диссоциации:n
n0
< 3% Слабый электролит
HCN, H2S, H2CO3, CH3COOH, NH3 H2O и др.
3% < < 30% Средний электролит
HCOOH, HF, H2SO3, H3PO4, Mg(OH)2 и др.
30% < Сильный электролит
4.
Растворы сильных электролитовKtnAnm
nKtm+ mAnn
1) некоторые неорганические кислоты (HCl, HBr, HI,
HNO3, H2SO4, HClO4 и ряд других);
2) гидроксиды щелочных (Li, Na, K, Rb, Cs) и
щелочноземельных (Ca, Sr, Ba) металлов;
3) все растворимые соли.
HCl
H+ + Cl
Ba(OH)2
Ba2+ + 2OH
Al2(SO4)3
2Al3+ + 3SO42
5.
Слабые и средние электролиты:KtnAnm ⇄ nKtm+ mAnn
Константа диссоциации:
HCN ⇄ H+ CN
[H ] [CN ]
Ka
[HCN]
NH3 H2O ⇄ NH4+ OH
[ NH 4 ] [OH ]
Kb
[ NH3 H 2O]
6.
Ступенчатая диссоциация:1) H3PO4 ⇄ H+ + H2PO4
[H ] [H 2 PO4 ]
Ka
7,6 10 3
[H 3 PO4 ]
1
2) H2PO4 ⇄ H+ + HPO42
[H ] [HPO42 ]
8
Ka
5,9
10
2
[H 2 PO4 ]
3) HPO42 ⇄ H+ + PO43
[H ] [PO43 ]
13.
K a3
3,5
10
[HPO42 ]
7.
Реакции ионного обмена протекаютпрактически необратимо (до конца),
если образуется неэлектролит
или мало диссоциируемое вещество
8.
Составьте молекулярное и ионно-молекулярные уравнения реакций:а) серная кислота + гидроксид натрия
H2SO4 + 2NaOH Na2SO4 + 2H2O
2H+ + SO42 + 2Na+ + 2OH 2Na+ + SO42 + 2H2O
H+ + OH H2O
б) гидросульфид калия + гидроксид калия
KHS + KOH K2S + H2O
К+ + НS + К+ + OH 2К+ + S2 + H2O
НS + OH S2 + H2O
8
9.
в) хлорид гидроксоцинка + соляная кислотаZnOHCl + HCl ZnCl2 + H2O
ZnOH+ + Cl + H+ + Cl Zn2+ +2Cl + H2O
ZnOH+ + H+ Zn2+ +H2O
г) нитрат алюминия + избыток гидроксида калия
Al(NO3)3 + 6KOH (изб.) K3[Al(OH)6] + 3KNO3
Al3+ + 3NO3 + 6К+ + 6OH 3К+ + [Al(OH)6] 3 + 3К+ + 3NO3
Al3+ + 6OH [Al(OH)6] 3
10.
Закон разбавления Оствальда:C(э( - та) α
K дисс
.
1 α
2
Для слабых электролитов ( << 1):
K дисс C (эл та) 2 или
K дисс
C (эл та)
Степень диссоциации слабого электролита
возрастает с разбавлением раствора.
11.
H2O ⇄ Н+ ОНK д (H 2O)
[H ] [OH ]
[H 2O]
Kд(H 2O) [H 2O] [H ] [OH ] KW
Константу Kw называют
ионным произведением воды
При 220С
KW = 10 14
12.
Водородный показательpH lg[ H ]
Гидроксидный показатель
pOH lg[OH ]
pH pOH 14
13.
Расчёт значений рН в разбавленныхрастворах сильных и слабых кислот и
оснований
Сильные кислоты
Сильные основания
1
к С( z осн)
[H ] α
[OH ] α
Слабые кислоты
Слабые основания
[H ] α C(к та)
[OH ] α C(осн)
[H ] K a C(к та)
[OH ] Kb C(осн)
1
C(
к
та)
к
z
14.
Рассчитать рН растворов азотной и уксусной кислот смолярной концентрацией 10-4М
10–4M HNO3
HNO3 → H+ + NO3– α = 1 сильный электролит
[H+] =10–4 pH = – lg 10–4 = 4
10-4M CH3COOH
CH3COOH ⇄ H+ + CH3COO – α ≠ 1 слабый электролит
[H+] = √Кд∙ С = √1,8 ∙ 10-5 ∙ 10-4 = 4,2 ∙ 10-5
pH = – lg (4,2 ∙ 10–5)= 5 – 0,6 = 4,4
14
15.
Рассчитать рН растворов уксусной гидроксиданатрия и гидроксида аммония с молярной
концентрацией 10-4М
10–4M NaOH
NaOH → Na+ + OH – α = 1 сильный электролит
[OH –]=10 – 4 pОH = – lg 10–4 = 4
рН = 14 – pОH = 10
10–4M NH4OH
NH4OH ⇄ NH4+ + OH – α ≠ 1 слабый электролит
[OH –] = √Кд ∙ С = √1,8 ∙ 10-5 ∙ 10-4 = 4,2 ∙ 10–5
pОH = – lg (4,2 ∙ 10–5)= 5 – 0,6 = 4,4
рН = 14 – pОH = 14 – 4,4 = 9,6
15
16.
Гидролизом солей называется обменноевзаимодействие ионов соли с водой,
приводящее к образованию
малодиссоциированных соединений
Соли, образованные катионами сильных
оснований и анионами сильных кислот
(Na2SO4, CaCl2, KI, Sr(NO3)2 и др.),
не гидролизуются
Водные растворы таких солей имеют
нейтральную реакцию среды (рН = 7)
17.
Гидролиз по анионуСоль образована сильным основанием и слабой кислотой
Na2CO3
CO32 H OH ⇄ HCO3 ОН
Na2CO3 H OH ⇄ NaHCO3 NaОН
KNO2
NO2 H OH ⇄ HNO2 ОН
KNO2 H OH ⇄ HNO2 KОН
Среда щелочная, pH > 7
18.
Гидролиз по катионуСоль образована сильным основанием и слабой кислотой
NH4Cl
NH4+ H OH ⇄ NH4OH H+
NH4Cl H OH ⇄ NH4OH HCl
Al(NO3)3
Al3+ H OH ⇄ AlOH2+ H+
Al(NO3)3 H OH ⇄ AlOH(NO3)2 HNO3
Среда кислая, pH < 7
19.
Гидролиз по аниону и по катионуCH3COONH4 H OH ⇄ NH3 H2O CH3COOH
CH3COO NH4+ H OH ⇄ NH3 H2O CH3COOH
среда нейтральная, pH 7
Необратимый гидролиз
Al2S3 6H2O 2Al(OH)3 3H2S
Совместный гидролиз солей
3Na2CO3 2FeCl3 3H2O 2Fe(OH)3 3CO2 6NaCl
20.
Количественные характеристикигидролиза
Константа гидролиза
Гидролиз по аниону Гидролиз по катиону
KW
KГ
Ka
KW
KГ
Kb
Ступенчатый гидролиз
KW
KГ
K a Kb
1) СO32 H OH ⇄ HСO3 + ОН
KW
KГ 1
Ka 2
2) HСO3 H OH ⇄ H2СO3 + ОН
KГ 2
Чем слабее кислота (основание), тем в
большей степени гидролизуется соль
KW
Ka
1
21.
Степень гидролизаСтепень гидролиза (h) отношение количества
гидролизованной части соли к общему количеству
растворённой соли, обычно выражаемое в процентах
KW
KГ
h
C(соль)
K a C(соль)
Чем меньше концентрация раствора соли,
гидролизующейся по катиону или по аниону,
тем больше степень гидролиза
Чем выше температура, тем больше
степень гидролиза
22.
Расчет pH в растворе гидролизующейся соли1. Записать уравнение диссоциации соли
2. Записать краткое ионно-молекулярное уравнение гидролиза соли
3. Определить среду в растворе соли
KW
4. Рассчитать константу гидролиза: K Г
K д (слабого электролита)
5. Рассчитать степень гидролиза:
h
KГ
C(соли)
6. Рассчитать концентрацию ионов H+ (или OH ) в растворе:
[H ] h C(соли)
[OH ] h C(соли)
7. Рассчитать pH раствора:
pH lg[H ]
pOH lg[OH ]
pH 14 pOH
23.
Рассчитать pH в растворе хлорида аммонияс концентрацией 0,001 моль/л (KД = 1,8·10 5)
NH4+ + Cl
1. NH4Cl
2. NH4+ H OH ⇄ NH4OH H+
3. pH < 7
14
KW
10
10
4. K Г
5
,
6
10
K д (NH4OH) 1,8 10 5
5. h
KГ
C(NH 4Cl)
5,6 10 10
10 3
7,5 10 4
6. [H ] h C(соли) 7,5 10 4 10 3 7,5 10 7 моль/л
7. pH lg[H ] lg 7,5 10 4 6,13
24.
Рассчитать pH в растворе карбоната натрияс концентрацией 0,01 моль/л
(для угольной кислоты KД1 = 4·10 7; KД2 = 5·10 11)
2Na+ + CO32
1. Na2CO3
2. CO32 H OH ⇄ HCO3 OH
3. pH > 7
14
KW
10
4
4. K Г
2
10
KД2(H2СO3) 5 10 11
5. h
KГ
2 10 4
1,4 10 1
10 2
6. [OH ] h C 1,4 10 1 10 2 1,4 10 3 моль/л
C
7. pOH lg[OH ] lg1,4 10 3 2,85
pH 14 pH 14 2,85 11,15











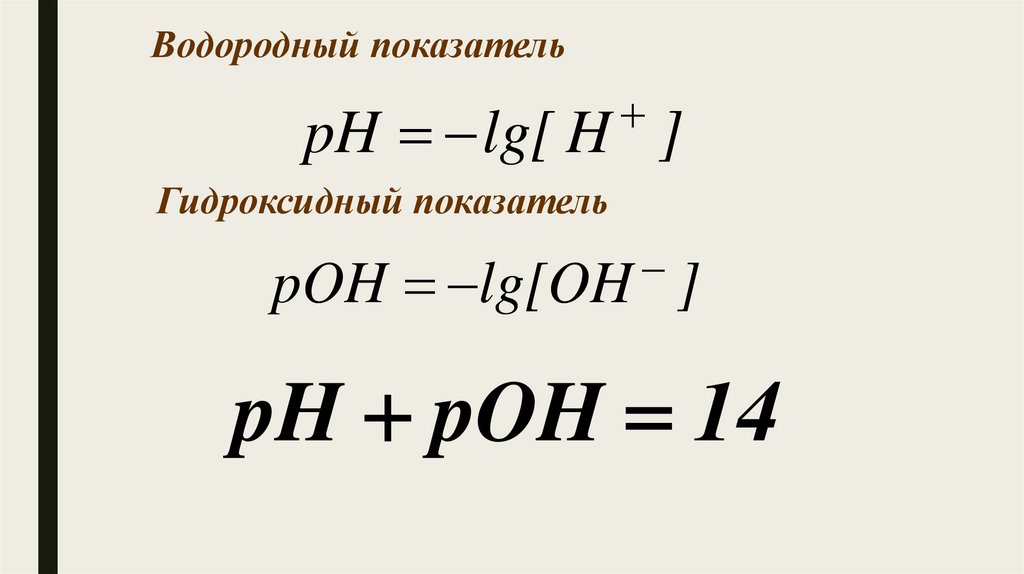












 chemistry
chemistry








