Similar presentations:
Гидролиз солей
1.
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЛекция 10
ГИДРОЛИЗ СОЛЕЙ
2. Содержание
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСодержание
Общие понятия
Количественные характеристики гидролиза солей
Константа гидролиза
Степень гидролиза
Расчет степени гидролиза и рН водных растворов
солей
Примеры гидролиза солей
Гидролиз солей слабых кислот и сильных оснований
Гидролиз солей слабых оснований и сильных кислот
Гидролиз солей слабых оснований и слабых кислот
Необратимый гидролиз
Модуль 2. Лекция 10. Гидролиз солей
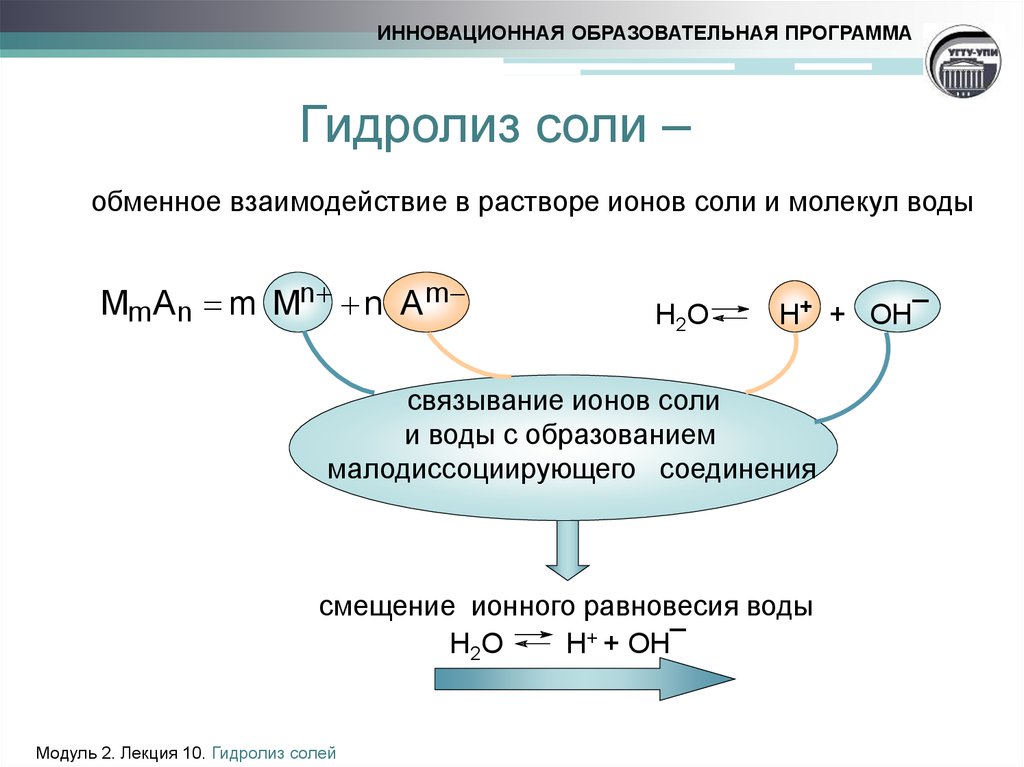
3. Гидролиз соли –
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАГидролиз соли –
обменное взаимодействие в растворе ионов соли и молекул воды
Mm A n m Mn n A m
Н 2О
Н+ + ОН¯
связывание ионов соли
и воды с образованием
малодиссоциирующего соединения
смещение ионного равновесия воды
Н 2О
Н+ + ОН¯
Модуль 2. Лекция 10. Гидролиз солей
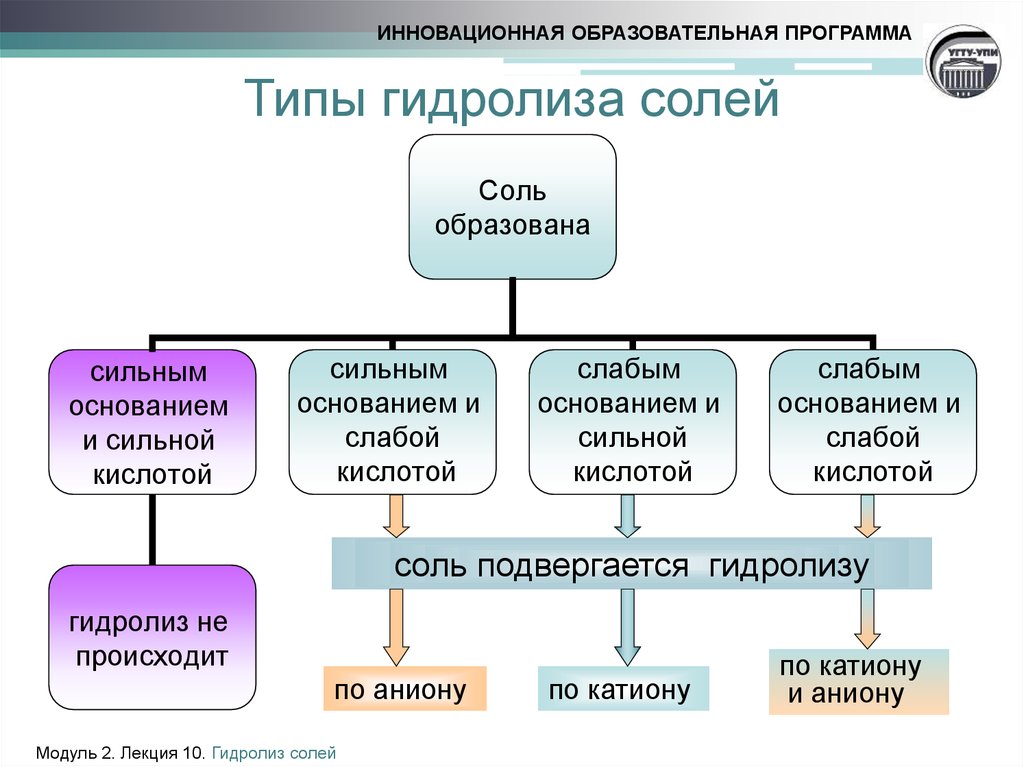
4. Типы гидролиза солей
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАТипы гидролиза солей
Соль
образована
сильным
основанием
и сильной
кислотой
сильным
основанием и
слабой
кислотой
слабым
основанием и
сильной
кислотой
слабым
основанием и
слабой
кислотой
соль подвергается гидролизу
гидролиз не
происходит
по аниону
Модуль 2. Лекция 10. Гидролиз солей
по катиону
по катиону
и аниону
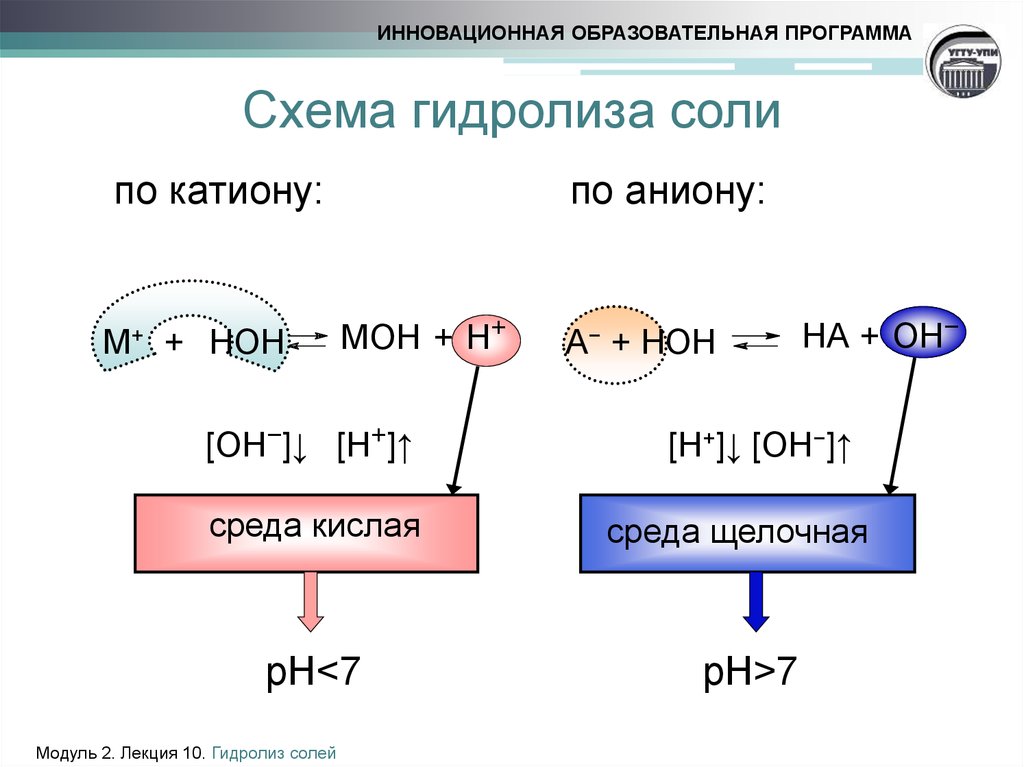
5. Схема гидролиза соли
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСхема гидролиза соли
по катиону:
М+ + НОН
по аниону:
MOH + H+
[ОН−]↓ [H+]↑
среда кислая
pH<7
Модуль 2. Лекция 10. Гидролиз солей
А− + НОН
HА + OH−
[H+]↓ [ОН−]↑
cреда щелочная
pH>7
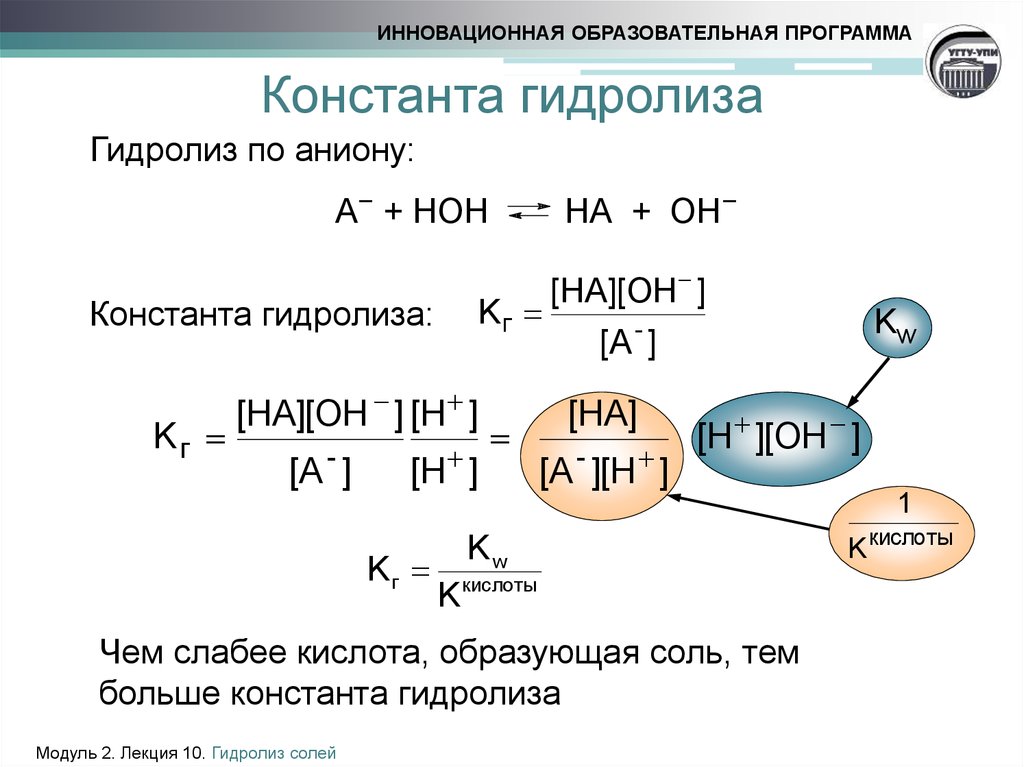
6. Константа гидролиза
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАКонстанта гидролиза
Гидролиз по аниону:
А− + НОН
Константа гидролиза:
Kг
Kг
[HA][OH ] [H ]
[A - ]
НА + ОН−
[H ]
[HA][OH ]
Kw
-
[A ]
[HA]
[A - ][H ]
[H ][OH ]
1
Kг
Kw
K кислоты
Чем слабее кислота, образующая соль, тем
больше константа гидролиза
Модуль 2. Лекция 10. Гидролиз солей
K кислоты
7. Константа гидролиза
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАКонстанта гидролиза
Гидролиз по катиону:
R+ + НОН
Константа гидролиза:
Kг
ROН + Н+
Kг
[ROH][H ] [OH ]
[R ]
[OH ]
[ROH][H ]
Kw
[R ]
[ROH]
[R ][OH ]
[H ][OH ]
1
Kг
Kw
K основания
Чем слабее основание, образующее соль, тем
больше константа гидролиза
Модуль 2. Лекция 10. Гидролиз солей
К основания
8. Степень гидролиза соли -
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСтепень гидролиза соли отношение количества вещества (соли), подвергшегося
гидролизу, к общему количеству растворенного вещества
Cгидр
h
С
Размерность – доли ед., %
При комнатной температуре степень гидролиза соли обычно
невелика:
Формула соли
Концентрация
раствора, моль/л
h,%
при 298 К (250С)
NH4Cl
Na2CO3
CН3СООNH4
0,01
0,1
0,1
0,01
2,7
0,5
Модуль 2. Лекция 10. Гидролиз солей
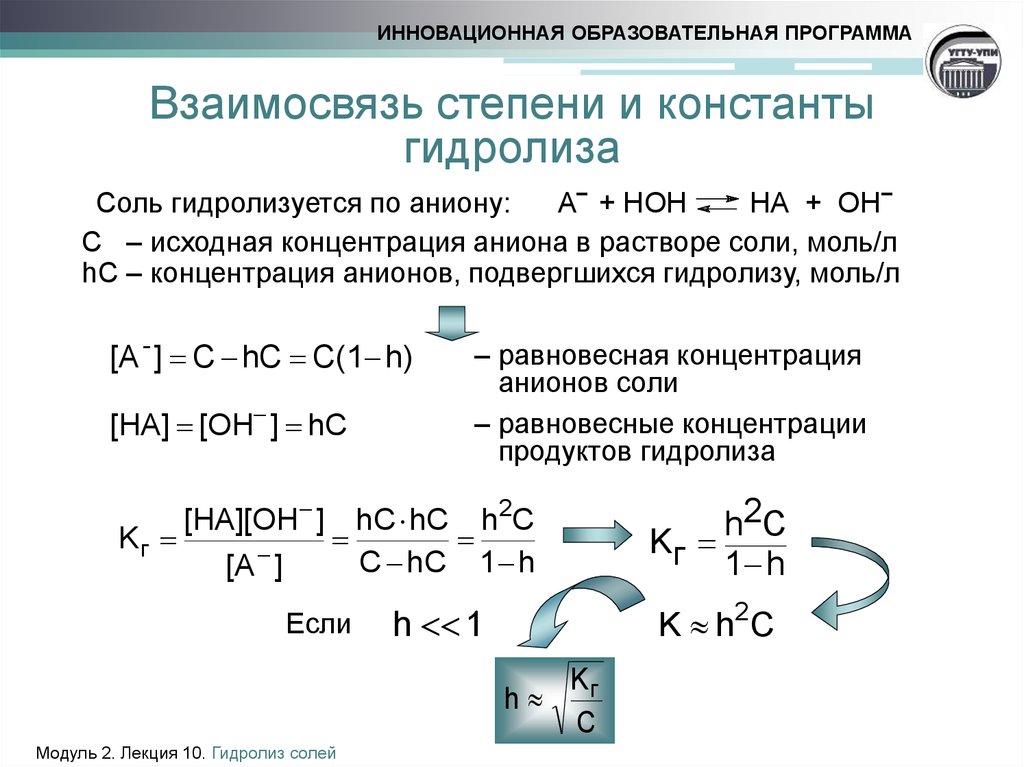
9. Взаимосвязь степени и константы гидролиза
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАВзаимосвязь степени и константы
гидролиза
Соль гидролизуется по аниону:
А− + НОН
НА + ОН−
С – исходная концентрация аниона в растворе соли, моль/л
hС – концентрация анионов, подвергшихся гидролизу, моль/л
[A - ] C hC C(1 h)
[HA] [OH ] hC
Kг
[HA][OH ]
[A ]
– равновесная концентрация
анионов соли
– равновесные концентрации
продуктов гидролиза
hC hC h2C
C hC 1 h
h2C
Kг
1 h
h 1
K h 2C
Если
h
Модуль 2. Лекция 10. Гидролиз солей
Kг
C
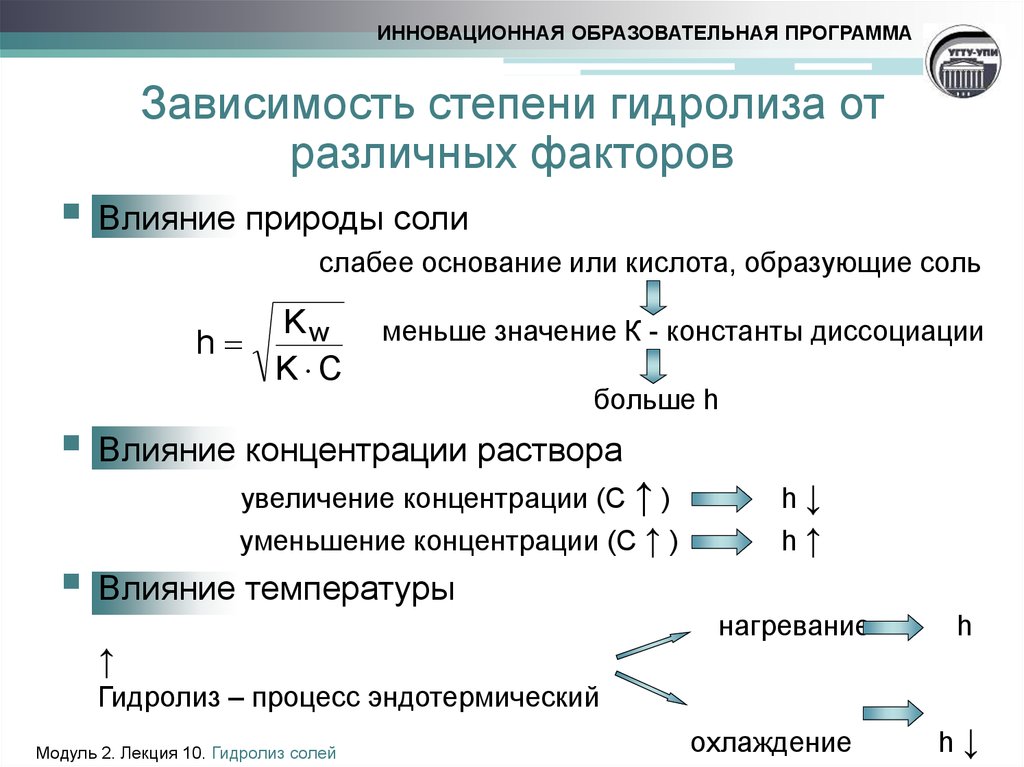
10. Зависимость степени гидролиза от различных факторов
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЗависимость степени гидролиза от
различных факторов
Влияние природы соли
слабее основание или кислота, образующие соль
Kw
h
K С
меньше значение К - константы диссоциации
больше h
Влияние концентрации раствора
увеличение концентрации (С ↑ )
уменьшение концентрации (С ↑ )
Влияние температуры
↑
h↓
h↑
нагревание
h
Гидролиз – процесс эндотермический
Модуль 2. Лекция 10. Гидролиз солей
охлаждение
h↓
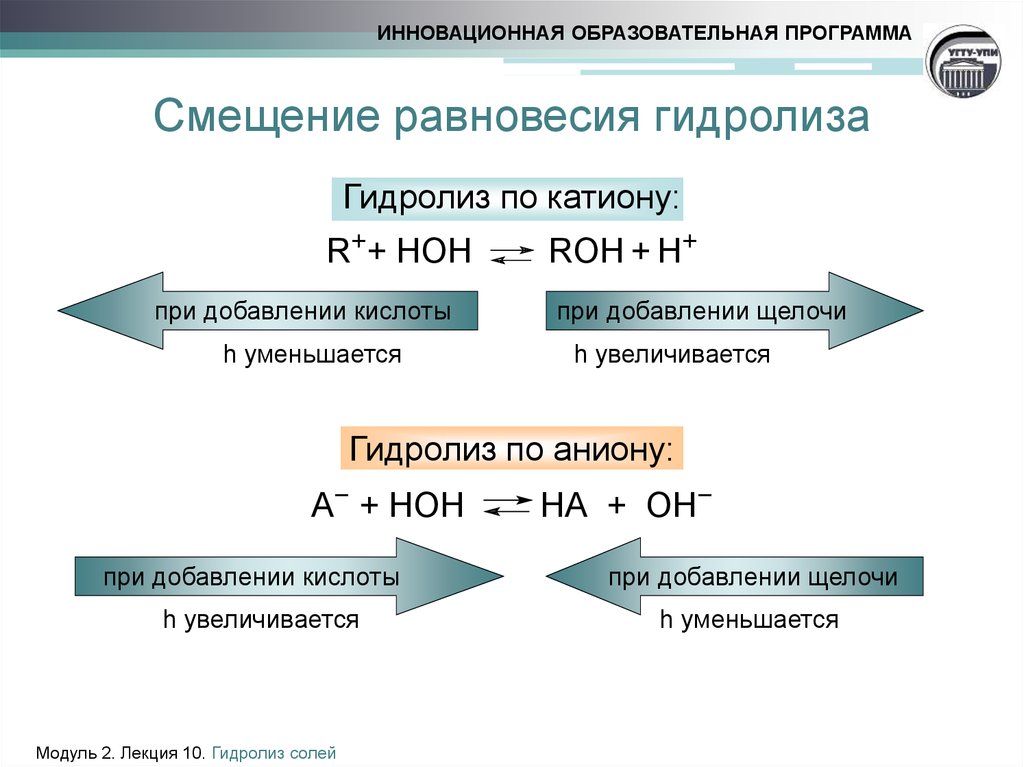
11. Смещение равновесия гидролиза
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАСмещение равновесия гидролиза
Гидролиз по катиону:
R++ HOH
при добавлении кислоты
h уменьшается
ROH + H+
при добавлении щелочи
h увеличивается
Гидролиз по аниону:
А− + НОН
при добавлении кислоты
h увеличивается
Модуль 2. Лекция 10. Гидролиз солей
НА + ОН−
при добавлении щелочи
h уменьшается
12. Расчет степени гидролиза CH3COONa в 0,1М растворе и pH раствора
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАРасчет степени гидролиза CH3COONa в
0,1М растворе и pH раствора
Ионное уравнение гидролиза
СH3COO + HOH
Степень гидролиза
h
СH3COOH + OH
Kw
K CH3 COOH С
10 14
1,8 10 - 5 0,1
7,5 10 5
Концентрация ионов Н+ и рН
[OH ] hC 7,5 10 5 0,1 7,5 10 6 моль/л
[H ]
Kw
[OH ]
10 14
7,5 10 6
1,3 10 9 моль/л
pH lg(1,3 10 9 ) 8,9
Модуль 2. Лекция 10. Гидролиз солей
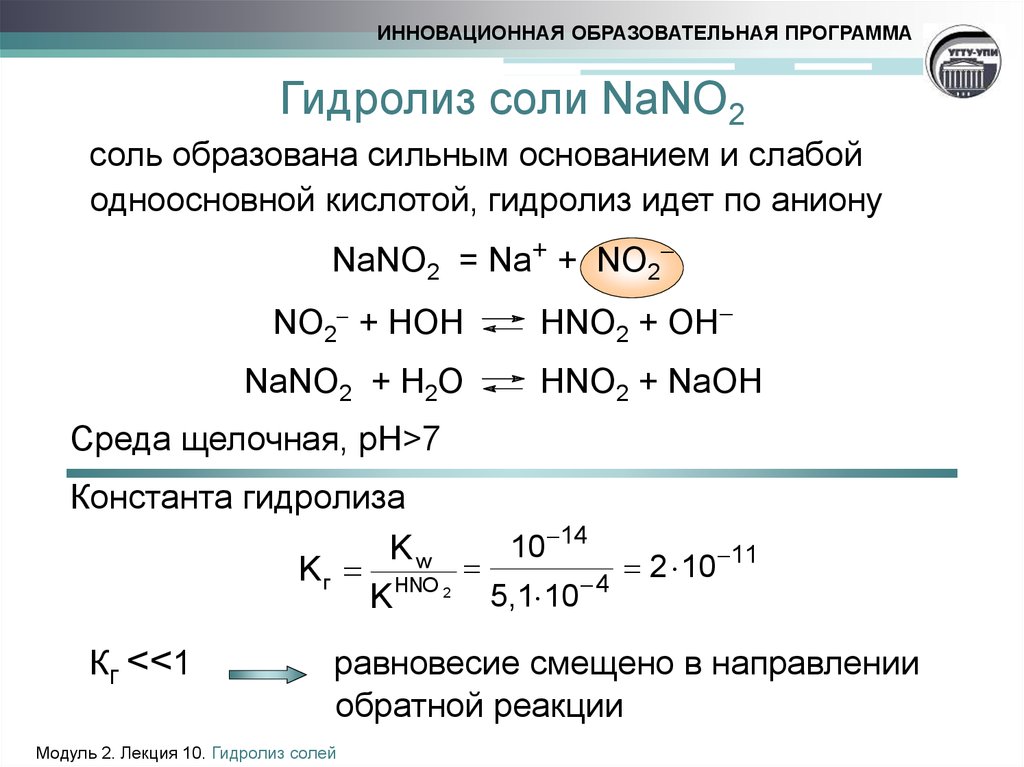
13. Гидролиз соли NaNO2
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАГидролиз соли NaNO2
соль образована сильным основанием и слабой
одноосновной кислотой, гидролиз идет по аниону
NaNO2 = Na+ + NO2
NO2 + HOH
NaNO2 + H2O
HNO2 + OH
HNO2 + NaOH
Среда щелочная, рН>7
Константа гидролиза
10 14
Kw
11
2
10
K г HNO 2
5,1 10 4
K
Кг <<1
равновесие смещено в направлении
обратной реакции
Модуль 2. Лекция 10. Гидролиз солей
14. Гидролиз соли К2СО3
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАГидролиз соли К2СО3
K2CO3 = 2K+ + CO32
Соль образована сильным основанием и слабой
двухосновной кислотой. Гидролиз идет по аниону,
возможны две ступени гидролиза
Уравнения гидролиза по I ступени:
CO32 + HOH
HCO3 + OH
K2CO3 + H2O
KHCO3 + KOH
Уравнения гидролиза по II ступени:
HCO3 + HOH
KHCO3 + HOH
Среда щелочная, рН>7
Модуль 2. Лекция 10. Гидролиз солей
H2CO3 + OH
H2CO3 + KOH
15. Расчет констант гидролиза К2СО3
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАРасчет констант гидролиза К2СО3
По первой ступени:
[HCO3 ] [OH ]
K г1
[CO32 ]
[HCO3 ][OH ][H ]
[CO32 ][H ]
Kw
2CO 3
KH
2
10 14
4,8 10
4
2,1
10
11
По второй ступени:
Kг2
[H2CO3 ][OH ]
[HCO3 ]
10 14
4,5 10 7
Кг1 Кг
2
[H2CO3 ][OH ][H ]
[HCO3 ][H ]
Kw
K1H2CO3
2,2 10 8
гидролиз протекает преимущественно по I ступени
Модуль 2. Лекция 10. Гидролиз солей
16. Гидролиз соли Cd(NO3)2
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАГидролиз соли Cd(NO3)2
Cd(NO3)2 = Cd2+ + 2NO3
Соль образована слабым основанием и сильной
кислотой. Гидролиз идет по катиону
Уравнение гидролиза по I ступени:
Cd2+ + HOH
Cd(NO3)2 + H2O
CdOH+ + H+
CdOHNO3 + HNO3
Уравнение гидролиза по II ступени:
CdOH+ + HOH
Cd(OH)2 + H+
CdOHNO3 + H2O
Cd(OH)2 + HNO3
Среда кислая, pH<7
Гидролиз идет преимущественно по I ступени
Модуль 2. Лекция 10. Гидролиз солей
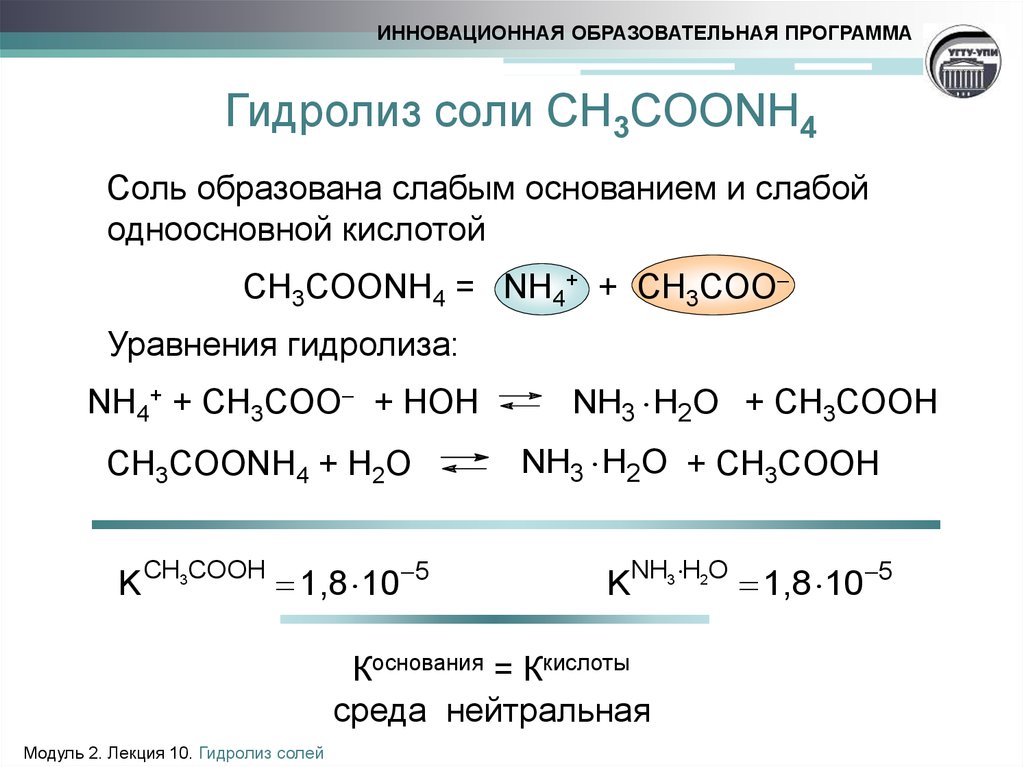
17. Гидролиз соли CH3COONH4
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАГидролиз соли CH3COONH4
Соль образована слабым основанием и слабой
одноосновной кислотой
CH3COONH4 = NH4+ + CH3COO
Уравнения гидролиза:
NH4+ + CH3COO + HOH
CH3COONH4 + H2O
K CH3COOH 1,8 10 5
NH3 H2O + CH3COOH
NH3 H2O + CH3COOH
KNH3 H2O 1,8 10 5
Коснования = Ккислоты
среда нейтральная
Модуль 2. Лекция 10. Гидролиз солей
18. Гидролиз солей слабых кислот и слабых оснований
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАГидролиз солей слабых кислот и
слабых оснований
Соли слабого основания и слабой многоосновной кислоты в
растворе полностью гидролизованы
(NH4)2S + H2O
NH4HS + HOH
NH3 H2O + H2S
Соли слабых одноосновных кислот и слабых оснований при
гидролизе образуют осадки основных солей:
Al(CH3COO)3 + HOH
NH4HS + NH3 H2O
Al(OH)(CH3COO)2 + HOH
Al(OH)(CH3COO)2↓ + CH3COOH
Al(OH)2CH3COO↓ + CH3COOH
Гидролиз некоторых солей, образованных летучими или
малорастворимыми слабыми кислотами и слабыми
основаниями протекает необратимо:
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
Такие соли в водных растворах не существуют
Модуль 2. Лекция 10. Гидролиз солей
19. Необратимый совместный гидролиз
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАНеобратимый совместный гидролиз
- с участием катионов Al3+, Fe3+, Cr3+, NH4+ и анионов
2
2 2
CO3 , SiO3 , S проходит с образованием слабого основания и
кислоты
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3↓ + 3H2S↑+ 6NaCl
2Al3+ + 3S2 + 6H2O = 2Al(OH)3 + 3H2S
2NH4Cl + Na2SiO3 + (H2O) = 2NH3↑ + H2SiO3↓ + 2NaCl
2NH4+ + SiO32 + (H2O) = 2NH3 + H2SiO3
- солей слабых оснований типа M(OH)2 и солей угольной кислоты
проходит с образованием основных солей и угольной кислоты
2CuSO4 + 2Na2CO3 + H2O = (CuOH)2CO3↓ + CO2↑ + 2Na2SO4
2Cu2+ + 2CO32 + H2O = (CuOH)2CO3 + CO2
Модуль 2. Лекция 10. Гидролиз солей
20. Заключение
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАЗаключение
Гидролиз соли - процесс обменного взаимодействия ионов соли
с молекулами воды
Гидролизу подвергаются соли, образованные
– слабыми кислотами и сильными основаниями
– слабыми основаниями и сильными кислотами
– слабыми кислотами и слабыми основаниями
Количественные характеристики гидролиза солей - константа
гидролиза и степень гидролиза
Чем слабее основание или кислота, образующие соль, тем
больше степень гидролиза соли
Степень гидролиза увеличивается при повышении температуры
и разбавлении раствора
Гидролиз солей, образованных многоосновными слабыми
кислотами (летучими или малорастворимыми) и слабыми
основаниями, протекает необратимо
Модуль 2. Лекция 10. Гидролиз солей
21. Рекомендуемая литература
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММАРекомендуемая литература
Никольский А.Б., Суворов А.В. Химия. - СПб: Химиздат, 2001
Карапетьянц М.Х. Общая и неорганическая химия. - М.: Химия,
2000
Угай Я.А. Общая и неорганическая химия. - М.: Высш. шк.,
2007
Неорганическая химия. В 3 т. Т. 1: Физико-химические основы
неорганической химии. Под ред. Ю. Д. Третьякова. - М.:
Академия, 2004
Гаршин А.П. Неорганическая химия в схемах, рисунках,
таблицах, формулах, химических реакциях. - СПб.: Лань, 2000
Степин Б.Д., Цветков А.А. Неорганическая химия. - М.: Высш.
шк., 1994
Модуль 2. Лекция 10. Гидролиз солей












 chemistry
chemistry








