Similar presentations:
Процессы нитрозирования и основные реакции диазосоединений
1. ПРОЦЕССЫ НИТРОЗИРОВАНИЯ И ОСНОВНЫЕ РЕАКЦИИ ДИАЗОСОЕДИНЕНИЙ
C HN H,
O H
NaNO2, 2H+
+
Na , H2O
C NO
N NO,
O NO
• Замещение атома водорода в молекуле органического
соединения у атомов углерода, азота, кислорода на
нитрозогруппу, называется, соответственно, С-, N-, и Онитрозированием.
• Нитрозирование первичных аминов, с образованием
солей диазония (R–N+ NX–), называется реакцией
диазотирования.
• Диазотирование и нитрозирование являются
быстрыми, необратимыми, экзотермическими и
очень «капризными» процессами.
1
2. Химизм нитрозирования
• Формально большинство процессов нитрозированияможно отнести к реакциям электрофильного замещения,
т.к. нитрит натрия в кислой среде образует электрофильные
частицы:
NaNO2
H+
Na+
HNO2
H+
–
NO+ + H2O (в конц. H2SO4)
NO2
–
N2O3 + H2O (в разб. H2SO4)
Hlg
NOHlg + H2O (в кислоте HHlg)
H2NO2+
–
H+ + NO2
•Нитрит натрия с минеральными кислотами образует
азотистую кислоту, которая протонируется с образованием
активного нитрозацидий-катиона (H2NO2+). В воде он
гораздо быстрее реагирует с неорганическими анионами, чем
с амином. При этом в среде серной кислоты в основном
образуется азотистый ангидрид (N2O3), в соляной кислоте
— нитрозилхлорид (NOCl), в концентрированной H2SO4
заметные количества катиона нитрозония (NO+), которые и
нитрозируют субстрат.
Активность частиц уменьшается в ряду: NO+> NOCl > N2O3. 2
3. Механизм реакции диазотирования
ArNH2 + NaNO2 + 2 H+ArNH2 + O N X
медленно
ArN2+ + Na+ + 2 H2O
H....X
Ar
+
N N
–
H O
быстро
Ar NH N O
нитрозамин
Ar
+
N N
Ar
диазокатион
Ar N N OH
диазогидрат
быстро
– HX
H+
Ar
Ar
+
–
NH N O
+
N N OH2
быстро
– H2O
+
N N
+
где X = H2O , NO2, Hlg
• Лимитирующей
стадией
процесса
является
нитрозирование, поэтому скорость реакции зависит от
рКа амина и кислотности среды. Реакция идет тем
быстрее, чем в большей степени равновесие смещено в
сторону свободного основания.
+
+
ArNH2 + H
ArNH3
• Различают арен- и алкандиазокатионы
3
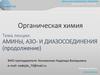
4. Соли арендиазония (ArN2+X-)
• относительноустойчивые
и
полностью
диссоциированы в водных растворах минеральных кислот
при 0—10 °С. Это связывают с устойчивостью катиона,
граничные структуры которого имеют вид:
Ph
N N
+
+
Ph
–
N N
N N
N N
+
+
+
–
N N
+
–
N N
+
• электронодонорные заместители в о- и п-положениях
участвуют в распределении положительного заряда и
увеличивают
устойчивость
диазокатиона,
а
электроноакцепторные — уменьшают:
+
A
N N <
+
N N<D
+
N N
устойчивость катионов увеличивается
• в сухом кристаллическом состоянии при нагревании или
ударе соли диазония иногда разлагаются со взрывом. При
необходимости они могут быть стабилизированы.
4
5. Алифатические соли диазония (RN2+X-)
RCH2CH2-N N+
– N2
RCH2CH2
H2O
– H+
RCH2CH2OH + RCH=CH2
• неустойчивые (радикал плохо распределяет заряд),
поэтому отщепляется азот, образуется карбокатион и далее
спирт, алкен и другие стабильные продукты.
В случае метиламина и соединений с сильными
электроноакцепторами в α-положение к аминогруппе,
образуются устойчивые алифатические биполярные ионы
диазония за счет отщепления протона от радикала. В
качестве примеров приведены структуры диазометана и
диазоуксусного эфира:
CH3NH2
NaNO2, H+
– Na+, H2O
–
+
CH3N N
– H+
+
CH2N N
NaNO2, H+
+ –
H2N–CH2–COOEt
N N–CH–COOEt
– Na+, H2O
+
–
H2C = N = N
O–
+
N N–CH=C OEt
5
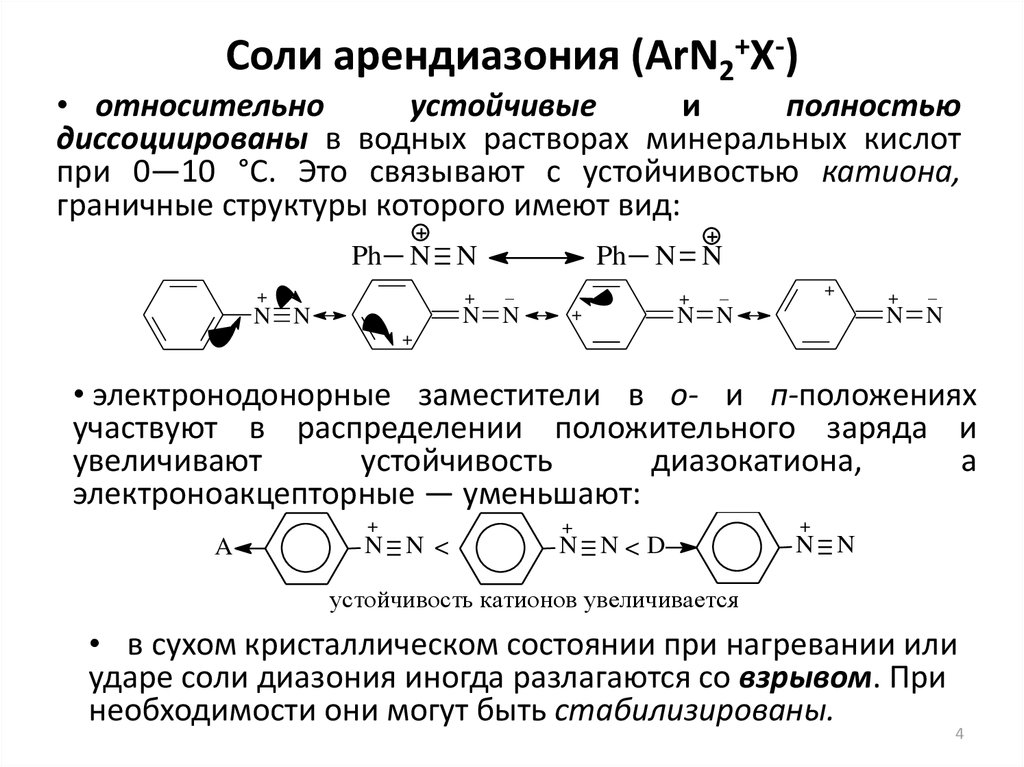
6. N-Нитрозирование вторичных аминов
HR N + O=N X
R'
R
- HX
N N=O
R'
N-Нитрозамины — не могут изомеризоваться в
диазогидрат. Это токсичные, неустойчивые соединения.
Они разлагаются уже при комнатной температуре.
N-нитрозарилалкиламины могут изомеризоваться в Снитрозосоединения (перегруппировка Фишера-Хеппа).
Перегруппировка хорошо идет только под действием
HCl. При этом образуются исключительно паразамещенные производные бензола.
HCl
N NO
ON
эфиры, спирты
Alk
CH3COOH
NHAlk
6
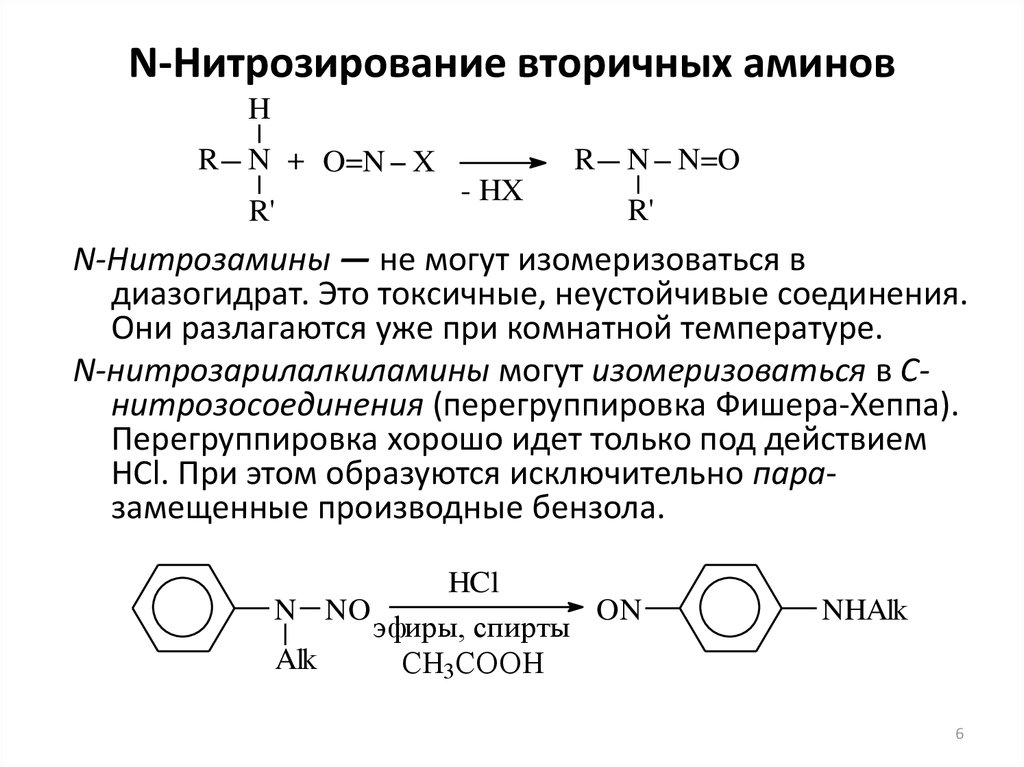
7. С-Нитрозирование аренов
• Механизм - электрофильного замещения (SE).• Нитрозируются только активированные арены: фенолы и
N,N-диалкил амины (слабый E+).
• Производные
бензола
в
п-положение,
нафталина – образуют смесь веществ.
• Продукты реакции интенсивно окрашены:
HO
R2N
O=N
X
– HX
O=N
– HX
OH
X
HO
NO
O
NOH
–
N O
+
R2N
R2N
N=O
OH
OH
NO
HNO2
+
NO
7
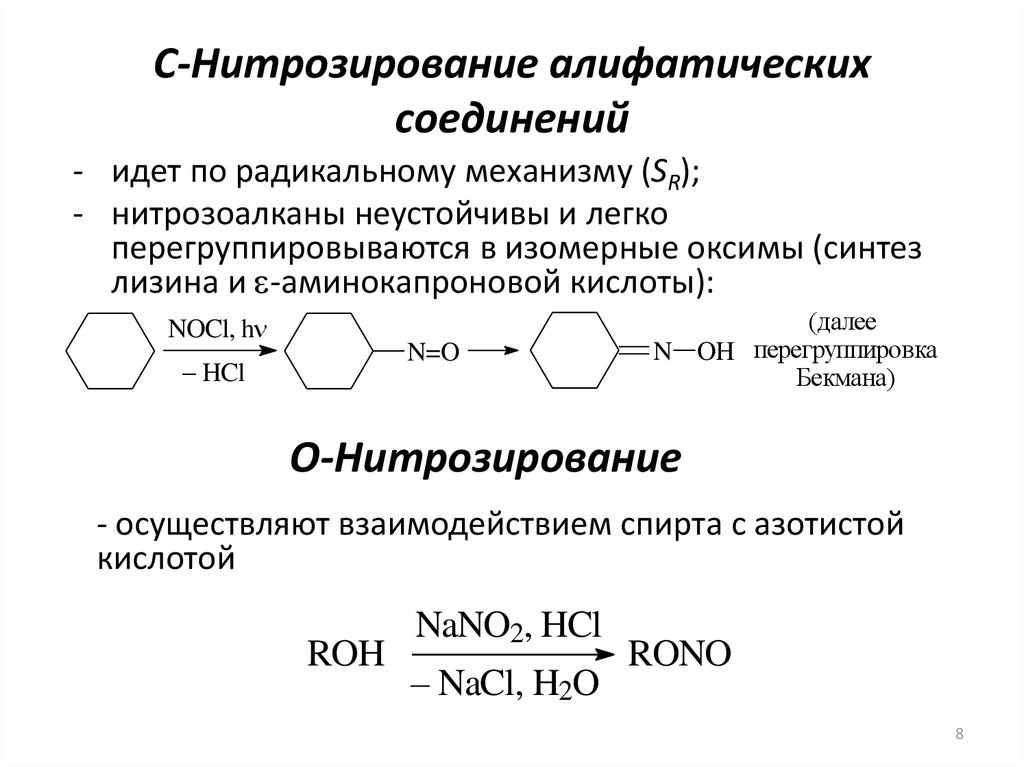
8. С-Нитрозирование алифатических соединений
- идет по радикальному механизму (SR);- нитрозоалканы неустойчивы и легко
перегруппировываются в изомерные оксимы (синтез
лизина и e-аминокапроновой кислоты):
NOCl, h
N=O
– HCl
(далее
N OH перегруппировка
Бекмана)
O-Нитрозирование
- осуществляют взаимодействием спирта с азотистой
кислотой
ROH
NaNO2, HCl
– NaCl, H2O
RONO
8
9. Параметры процесса диазотирования. Температура
Обычно диазотирование ведут при температуре (0—5 °С).При ее повышении:
• увеличивается скорость разложения соли диазония;
• уменьшается растворимость азотистой кислоты;
• выделяются нитрозные газы (окислы азота).
В результате - уменьшается выход целевого продукта.
В случае устойчивого диазосоединения, процесс можно
проводить при более высокой температуре, однако
реакция экзотермическая и требует интенсивного
отвода тепла.
9
10. Кислотность среды - определяется pKb конкретного амина.
• Диазотирование ароматических аминов ведутпри рН < 2.
Избыток кислоты необходим для:
1) растворения амина в виде соли, т.к. свободный амин
плохо растворим в воде, что затрудняет проведение
реакции;
2) стабилизации диазотирующих частиц (H2NO2+, NO+,
NOCl, N2O3), которые при небольшой концентрации протона
переходят в малоактивные и неактивные формы —
свободную HNO2 и NO2–;
3) стабилизация диазосоединения в растворе, которое при
небольшой
концентрации
протона
переходит
в
диазогидрат;
4) предотвращения реакции образующейся соли диазония
с исходным амином, которая ведет к образованию
побочного продукта — диазоаминосоединения (Ar–N=N–
NH–Ar).
10
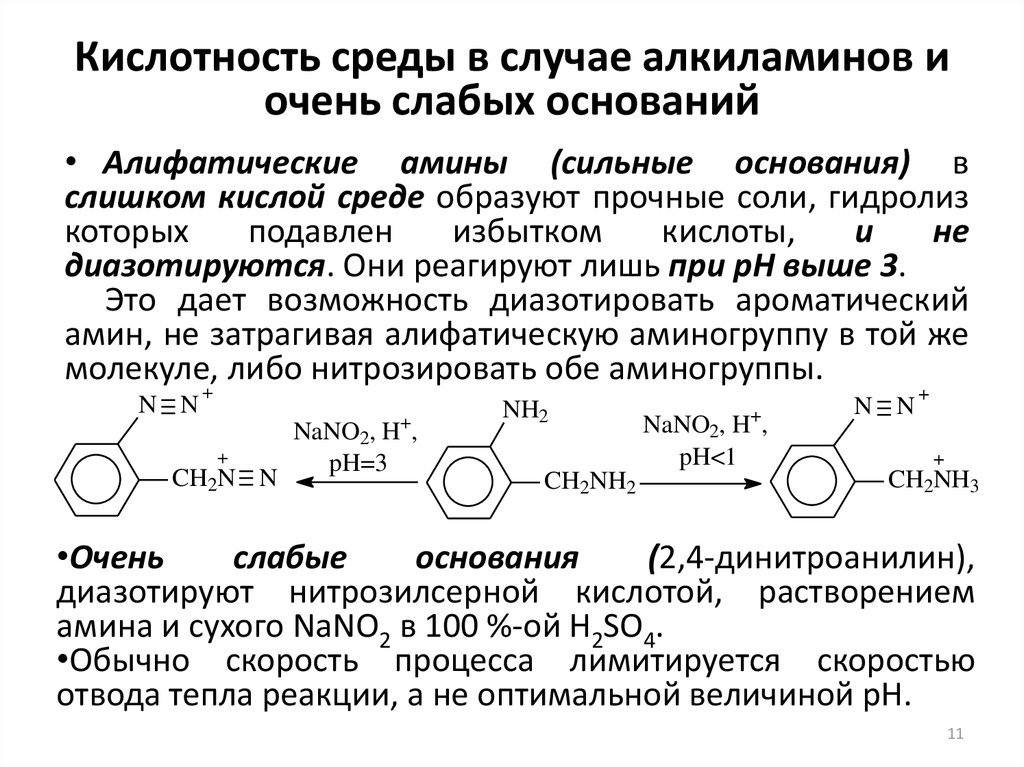
11. Кислотность среды в случае алкиламинов и очень слабых оснований
• Алифатические амины (сильные основания) вслишком кислой среде образуют прочные соли, гидролиз
которых
подавлен
избытком
кислоты,
и
не
диазотируются. Они реагируют лишь при рН выше 3.
Это дает возможность диазотировать ароматический
амин, не затрагивая алифатическую аминогруппу в той же
молекуле, либо нитрозировать обе аминогруппы.
N N
+
+
CH2N N
NaNO2, H+,
pH=3
NH2
CH2NH2
NaNO2, H+,
pH<1
N N
+
+
CH2NH3
•Очень
слабые
основания
(2,4-динитроанилин),
диазотируют нитрозилсерной кислотой, растворением
амина и сухого NaNO2 в 100 %-ой H2SO4.
•Обычно скорость процесса лимитируется скоростью
отвода тепла реакции, а не оптимальной величиной рН.
11
12. Концентрация нитрита натрия в процессе диазотирования
• изменяется в широких пределах до 20 %.• Нитрит натрия не применяется в избытке, т.к. реакция
практически
количественная.
При
правильно
проведенном диазотировании сразу после окончания
процесса реакционная масса должна давать слабую
реакцию
на
азотистую
кислоту
(фиолетовое
окрашивание иодкрахмальной бумаги).
• Избыток азотистой кислоты (неисчезающее темное
окрашивание иодкрахмальной бумаги) удаляется
добавлением мочевины или сульфаминовой кислоты:
H2NCONH2 + 2 HNO2
H2NSO3H + HNO2
2N2 + CO2 + 3H2O
H2SO4 + N2 + H2O
12
13. Другие параметры процесса диазотирования
• Перемешивание реакционной массы должно бытьинтенсивное, поскольку выделяется большое количество
тепла и требуется точное соотношение реагентов. Поэтому
используются
быстроходные
пропеллерные
или
турбинные мешалки.
• Порядок смешения реагентов может быть разный.
Обычно, к раствору амина в кислоте приливают раствор
нитрита со скоростью, обеспечивающей поддержание
заданной температуры.
• Амин, имеющий кислотные группы (SO3H, COOH),
обычно растворяют в воде, добавляя NaOH или Na2CO3.
При выливании раствора соли в кислоту образуется
мелкодисперсный осадок и диазотирование, несмотря на
гетерогенность среды, проходит нацело.
• Как и при нитровании, скорость ведения процесса
диазотирования во многих случаях регламентируется
скоростью отвода тепла реакции.
13
14. Кислотно-основные превращения ароматических диазосоединений
Ar+
N
N
–
HO
+
H
I
Ar
+
N OHN
Ar N HO–/– H2O Ar N Ar N
–
–
H+
N O
HO N
O N
II
III
IV
• Строение и свойства диазосоединений зависят от
значения рН среды: катион диазония (I) в водно-щелочной
среде образует гидроксид диазония, затем обратимо
превращается в амфотерный син-диазогидрат (II) и в синдиазотат (III), который изомеризуется в анти-форму (IV).
•Превращение анти-диазотата в диазоний катион
сопровождается разложением и образованием побочных
продуктов. Это необходимо учитывать при выборе
условий хранения и реакций солей диазония.
•Наибольшая стабильность и реакционная способность
соли диазония наблюдается в кислой среде, поэтому
необходимо обеспечить минимальное время пребывания
их в других средах .
14
15. Реакции замены диазониевой группы
РЕАКЦИИ ЗАМЕНЫ ДИАЗОНИЕВОЙ ГРУППЫ• Диазониевую группу можно заместить на
гидроксил, галоген, циано-, нитро- и другие
группы.
• Часть этих реакций представляет собой
обычное нуклеофильное замещение и
проходит по механизму SN1, другие
протекают по гомолитическому
механизму в присутствии соответствующих
инициаторов.
15
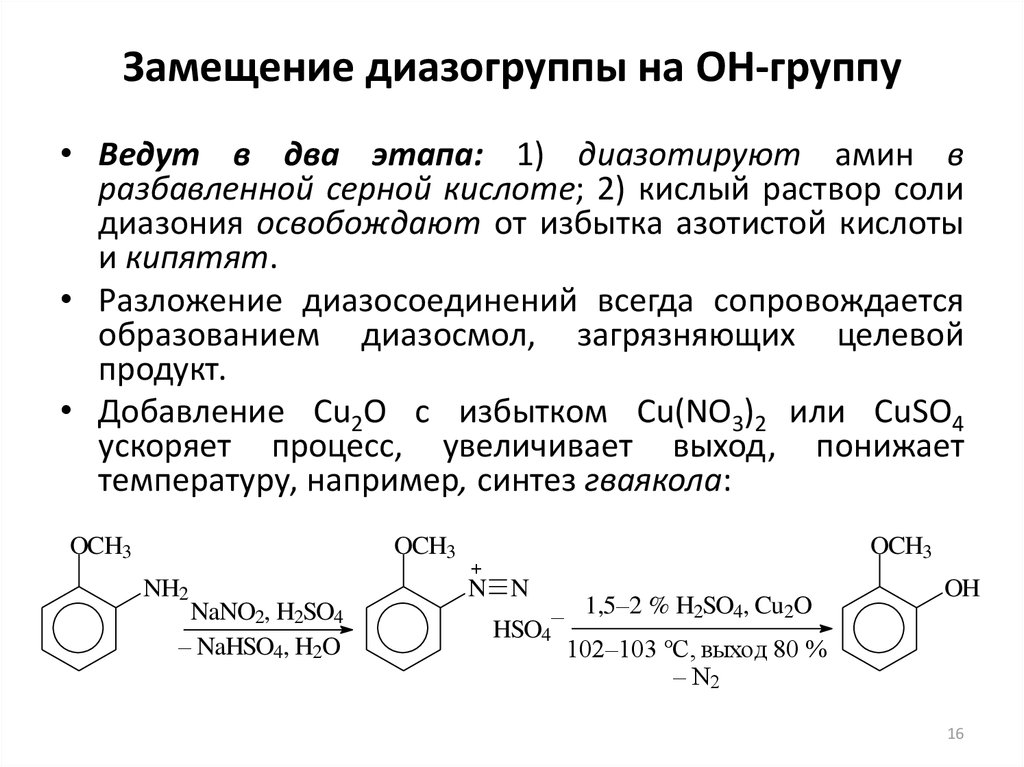
16. Замещение диазогруппы на ОН-группу
• Ведут в два этапа: 1) диазотируют амин вразбавленной серной кислоте; 2) кислый раствор соли
диазония освобождают от избытка азотистой кислоты
и кипятят.
• Разложение диазосоединений всегда сопровождается
образованием диазосмол, загрязняющих целевой
продукт.
• Добавление Cu2O с избытком Cu(NO3)2 или CuSO4
ускоряет процесс, увеличивает выход, понижает
температуру, например, синтез гваякола:
OCH3
OCH3
NH2
NaNO2, H2SO4
– NaHSO4, H2O
OCH3
+
N N
– 1,5–2 % H2SO4, Cu2O
HSO4
102–103 °С, выход 80 %
– N2
OH
16
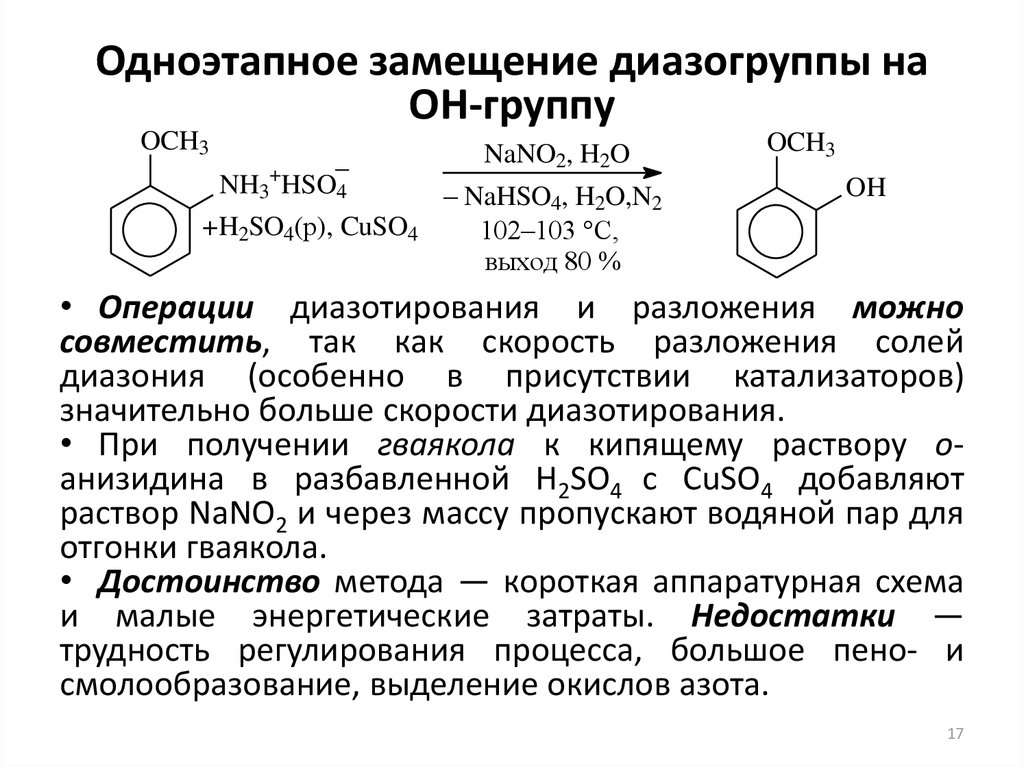
17. Одноэтапное замещение диазогруппы на ОН-группу
OCH3_
+
NH3 HSO4
+H2SO4(р), CuSO4
NaNO2, H2O
– NaHSO4, H2O,N2
102–103 °С,
выход 80 %
OCH3
OH
• Операции диазотирования и разложения можно
совместить, так как скорость разложения солей
диазония (особенно в присутствии катализаторов)
значительно больше скорости диазотирования.
• При получении гваякола к кипящему раствору оанизидина в разбавленной H2SO4 с CuSO4 добавляют
раствор NaNO2 и через массу пропускают водяной пар для
отгонки гваякола.
• Достоинство метода — короткая аппаратурная схема
и малые энергетические затраты. Недостатки —
трудность регулирования процесса, большое пено- и
смолообразование, выделение окислов азота.
17
18. Замена диазогруппы на галоген и другие группы (реакция Зандмейра-Гаттермана)
–ArN2+Hlg
Cu2Hlg2
ArHlg где Hlg = Cl и Br
– N2
•Целевой продукт получается с высоким выходом.
•Побочные продукты - гидроксисоединения.
•Считают, что механизм - радикальный. Галогенид меди (I)
регенерируется и служит катализатором:
–
+
2Ar . + 2N2 + 2CuHlg2
2ArN2 Hlg + Cu2Hlg2
2ArHlg + Cu2Hlg2
• По методу Зандмейера раствор соли диазония
обрабатывают хлоридом или бромидом меди (I) при 0—5 °С.
• По методу Гаттермана — используют медь с HCl или HBr
при температуре около 50 °С, однако выходы продукта ниже
и порошок меди должен быть свежеприготовленным
(водный раствор CuSO4 + цинковая пыль). Имеются и другие
модификации этого метода.
18
19. Реакция Зандмейра
ArN2X + KCNArN2X + NaNO2
Cu2(CN)2, pH=7
ArCN + KX + N2
Cu2(NO2)2, pH > 7
ArNO2 + KX + N2
• При замене диазониевой группы на циано- и
нитро-группу
необходимо
поддерживать
нейтральную среду или щелочную среду.
• Для замены диазогруппы на сульфохлоридную,
соли диазония обрабатывают диоксидом серы в
присутствии хлорида меди (II):
+ –
ArN2 Cl
+ SO2
CuCl2
HCl
ArSO2Cl
19
20. Замена диазогруппы на иод
–ArN2+X + KI
–
2I
[O]
–
I2
I
–
I3
ArI + KX + N2
ArN2X
–
–X
ArN2I3
t
ArI + N2 + I2
• Реакцию осуществляют солями иода в отсутствие
катализатора и с хорошими выходами.
• По-видимому, под действием окислителей иодидион превращается в иод, который с иодид-ионом
образует I3–. Это подтверждается выделением солей
ArN2+I3–, которые при стоянии превращаются в
продукты реакции.
• Исследователи
не
исключают
и
свободнорадикальный механизм.
20
21. Замена диазогруппы на фтор (реакция Шимана)
NaBF4(HBF4,NH4BF4)
ArN2X
NaX
+
Ar +
–
BF4
+ N2
–
ArN2+BF4
t
ArF + BF3
• К растворам солей диазония добавляют холодный
водный раствор NaBF4, HBF4 или NH4BF4. Выпавший
осадок высушивают и сухую соль ArN2+BF4– нагревают.
• Борфториды арилдиазония разлагаются с высокими
выходами целевого продукта.
• Реакция идет по механизму SN1, промежуточным
продуктом является фенил-катион.
21
22. Гидридное замещение диазониевой группы
— метод удаления аминогруппы из ароматическогокольца. Используется фосфорноватистая кислота (H3PO2)
и другие восстановители (формальдегид, метанол):
+
ArN2X + H3PO2 (CH2O, CH3OH)
Cu , H2O
ArH + H3PO3 + HX + N2
Восстановление солей диазония
—
Используют сернистую кислоту и ее соли, цинк в
кислой среде, боргидрид натрия в ДМФА и др. методы.
Образуются монозамещенные гидразины:
+
–
PhN2 Cl
+
Na2SO3, H , H2O
– H2SO4
PhNHNH2
22
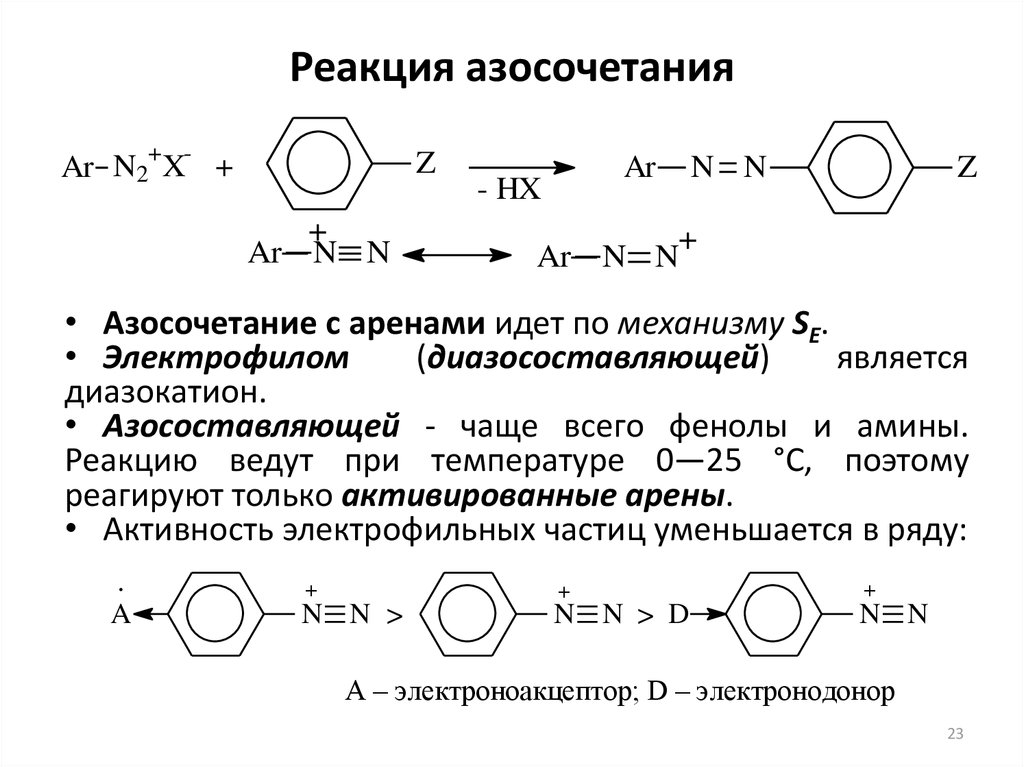
23. Реакция азосочетания
+ Ar N2 X +Z
+
Ar N N
Ar
- HX
N N
Z
+
Ar N N
• Азосочетание с аренами идет по механизму SE.
• Электрофилом
(диазосоставляющей)
является
диазокатион.
• Азосоставляющей - чаще всего фенолы и амины.
Реакцию ведут при температуре 0—25 °С, поэтому
реагируют только активированные арены.
• Активность электрофильных частиц уменьшается в ряду:
.
A
+
+
+
N N >
N N > D
N N
A – электроноакцептор; D – электронодонор
23
24. Азосочетание с фенолами и нафтолами
- чаще всего проводят в слабощелочной среде (растворысоды, ацетата натрия), в которой они хорошо
растворяются и находятся в активной фенолятной
форме.
- Сильнощелочные растворы переводят соли диазония в
неактивные формы (диазогидрат и диазотат):
–
OH
ArOH
H2O
–
ArO >> ArOH
активность в реакции SE повышается
–
OH
ArN2X
–
X
–
OH
Ar–N=N–OH
H2O
Ar–N=N–O
–
электрофилами не являются
24
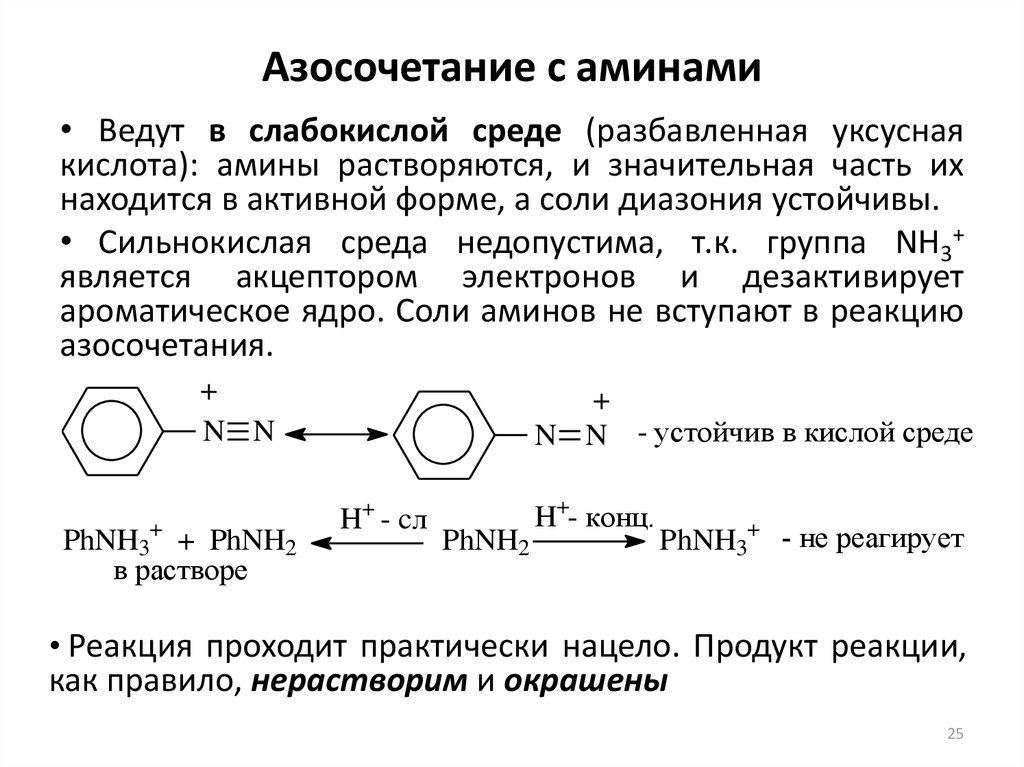
25. Азосочетание с аминами
• Ведут в слабокислой среде (разбавленная уксуснаякислота): амины растворяются, и значительная часть их
находится в активной форме, а соли диазония устойчивы.
• Сильнокислая среда недопустима, т.к. группа NH3+
является акцептором электронов и дезактивирует
ароматическое ядро. Соли аминов не вступают в реакцию
азосочетания.
+
N N
PhNH3+ + PhNH2
в растворе
+
N N - устойчив в кислой среде
H+ - cл
PhNH2
H+- конц.
PhNH3+ - не реагирует
• Реакция проходит практически нацело. Продукт реакции,
как правило, нерастворим и окрашены
25
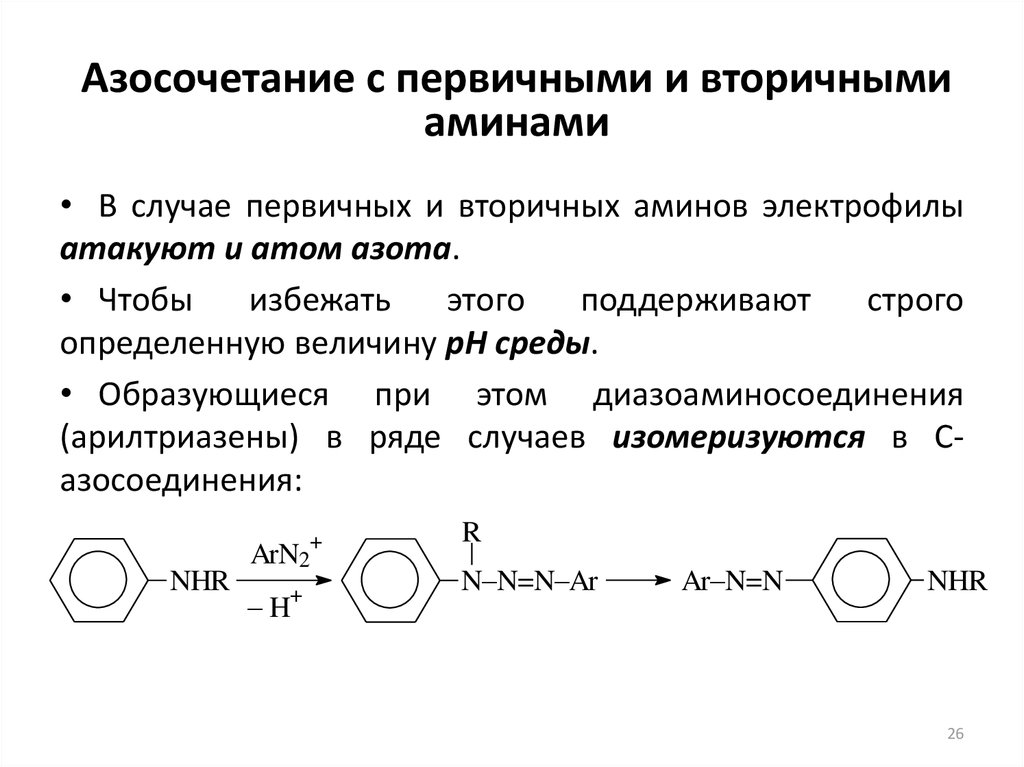
26. Азосочетание с первичными и вторичными аминами
• В случае первичных и вторичных аминов электрофилыатакуют и атом азота.
• Чтобы
избежать
этого
поддерживают
строго
определенную величину рН среды.
• Образующиеся при этом диазоаминосоединения
(арилтриазены) в ряде случаев изомеризуются в Сазосоединения:
+
NHR
ArN2
+
–H
R
N–N=N–Ar
Ar–N=N
NHR
26
27. Сочетание солей диазония с алифатическими азосоставляющими
Z'Z'
+
–
ArN2
–
OH
Z–CH N=N–Ar
Z–CH2–Z'
Z–CH–Z'
Z–C N–NH–Ar
– H2O
R
R
–
HO
CH3-C C N=N Ar
C N NHAr
–
– AcO
O Z
Z
• лишь с соединениями общей формулы Z–CH2–Z' или Z'–
CHR–Z, где Z и Z' ацильные, карбоксильные и др.
электроноакцепторные заместители;
• вероятный механизм SE1;
• азосоединение неустойчиво и изомеризуется в
гидразон; соединения типа Z'–CHR–Z отщепляют одну из Z
групп (особенно, если это ацил или карбоксил);
• при наличии ацильной и карбоксильной групп
преимущественно отщепляется карбоксильная.
• при отсутствии ацильных и карбоксильных групп в
молекуле алифатического субстрата азосоединение
сохраняется.
27

















 chemistry
chemistry