Similar presentations:
Полиэлектролиты. (Тема 3)
1.
1. Что такое полиэлектролиты?Полиэлектролиты – это полимеры, мономерные звенья которых способны к электролитической
диссоциации. При этом в растворе образуются макроионы (полианионы или поликатионы) и
низкомолекулярные противоионы (катионы или анионы)
H2O
Полиэлектролиты (классификация)
Природа выделяемых в
раствор противоионов
Глубина (степень)
диссоциации
Сильные
Слабые
(диссоциируют
нацело)
(диссоциируют
частично)
Поликислоты
генерируют
H+
Полиамфолиты
генерируют и H+, и
OH-
Полиоснования
генерируют OHПолисоли
НЕТ ни H+, ни OH-
2.
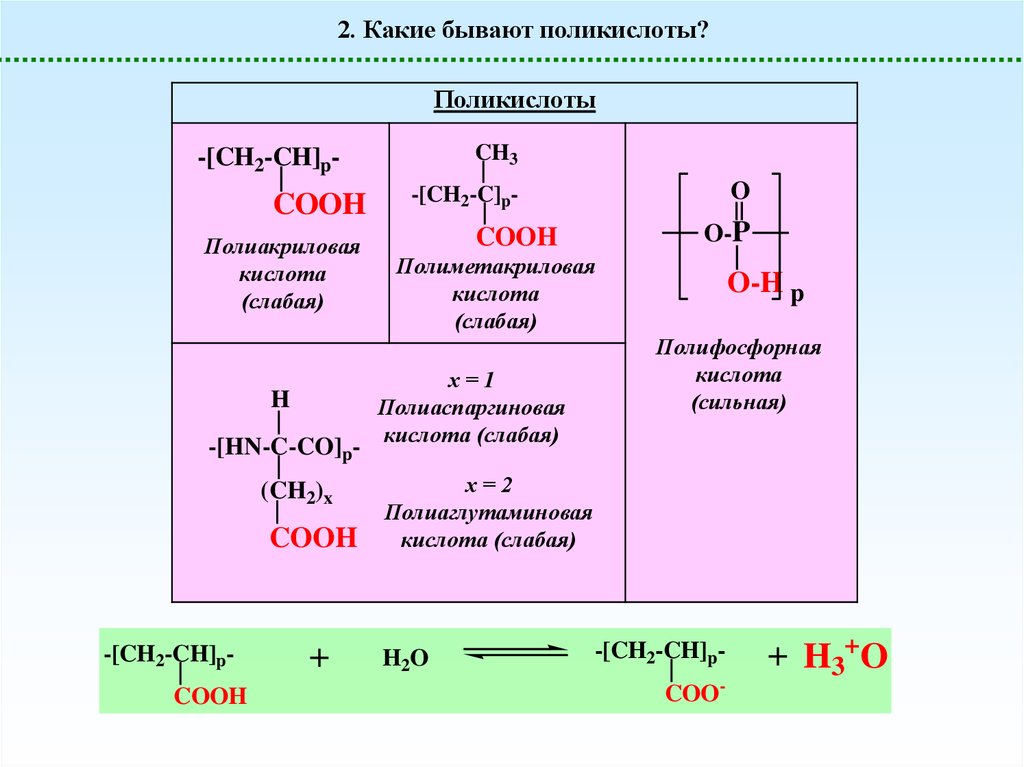
2. Какие бывают поликислоты?Поликислоты
CH3
-[CH2-CH]p-
COOH
Полиакриловая
кислота
(слабая)
H
-[HN-C-CO]p(CH2)x
COOH
-[CH2-CH]pCOOH
+
O
-[CH2-C]p-
O-P
COOH
Полиметакриловая
кислота
(слабая)
х=1
Полиаспаргиновая
кислота (слабая)
O-H p
Полифосфорная
кислота
(сильная)
х=2
Полиаглутаминовая
кислота (слабая)
H2O
-[CH2-CH]pCOO-
+ H3+O
3.
2. Какие бывают поликислоты?Поликислоты
-[CH2-CH]p-
-[CH2-CH]p-
SO3H
Поливинилсульфоновая кислота
(сильная)
SO3H
Полистирол-сульфоновая
кислота
(сильная)
-[CH2-CH]p-
CH3
O=C-NH
-[CH2-C]p-
H3C-C-CH3
CH2
SO3H
Поли-2-акриламидо-2метилпропансульфоновая
кислота (сильная)
O=C-O
(CH2)2
SO3H
Поли-2метакрилоксиэтансульфонова
я кислота
4.
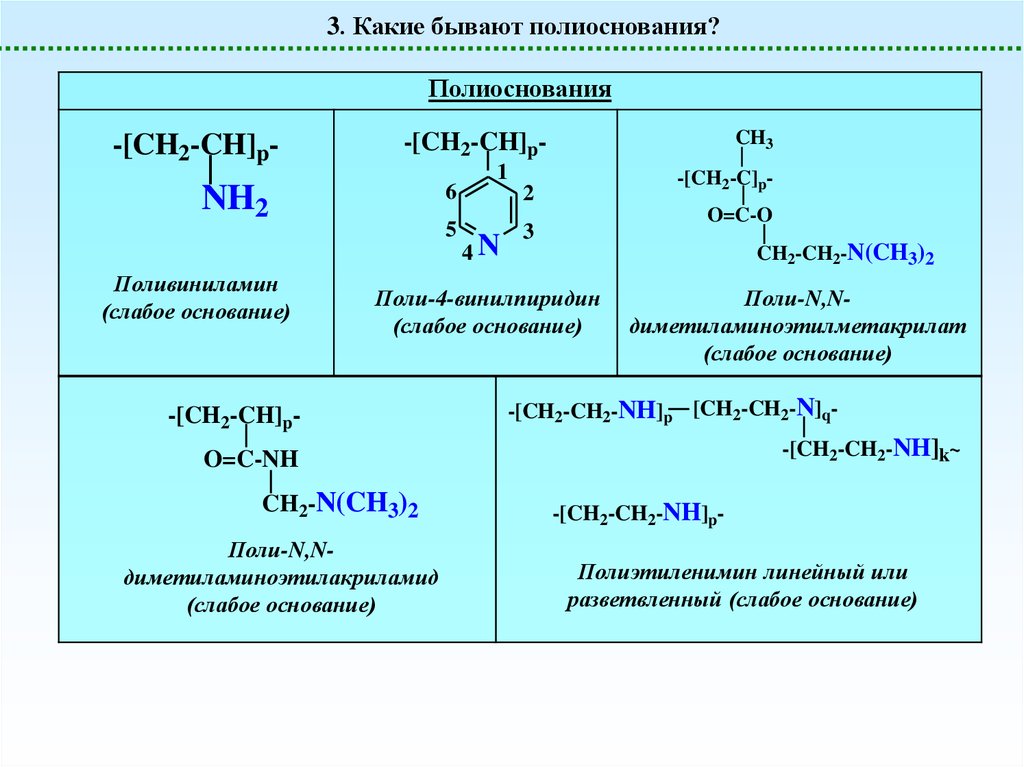
3. Какие бывают полиоснования?Полиоснования
-[CH2-CH]p-
6
NH2
Поливиниламин
(слабое основание)
CH3
-[CH2-CH]p5
1
-[CH2-C]p-
2
4N
O=C-O
3
CH2-CH2-N(CH3)2
Поли-4-винилпиридин
(слабое основание)
-[CH2-CH]p-
Поли-N,Nдиметиламиноэтилметакрилат
(слабое основание)
-[CH2-CH2-NH]p [CH2-CH2-N]q-[CH2-CH2-NH]k~
O=C-NH
CH2-N(CH3)2
Поли-N,Nдиметиламиноэтилакриламид
(слабое основание)
-[CH2-CH2-NH]p-
Полиэтиленимин линейный или
разветвленный (слабое основание)
5.
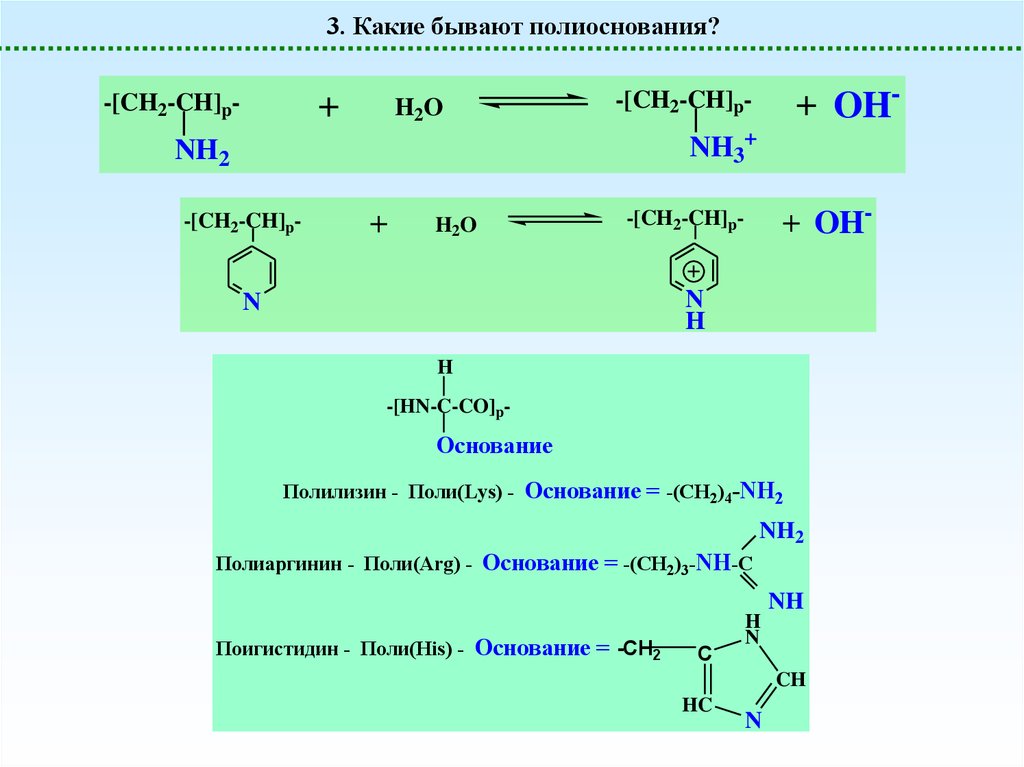
3. Какие бывают полиоснования?+
-[CH2-CH]p-
H2O
+ OH-
-[CH2-CH]p-
NH3+
NH2
-[CH2-CH]p-
+
H2O
+ OH-
-[CH2-CH]p-
N
H
N
H
-[HN-C-CO]p-
Основание
Полилизин - Поли(Lys) - Основание = -(CH2)4-NH2
NH2
Полиаргинин - Поли(Arg) - Основание = -(CH2)3-NH-C
NH
Поигистидин - Поли(His) - Основание = -CH2
C
H
N
CH
HC
N
6.
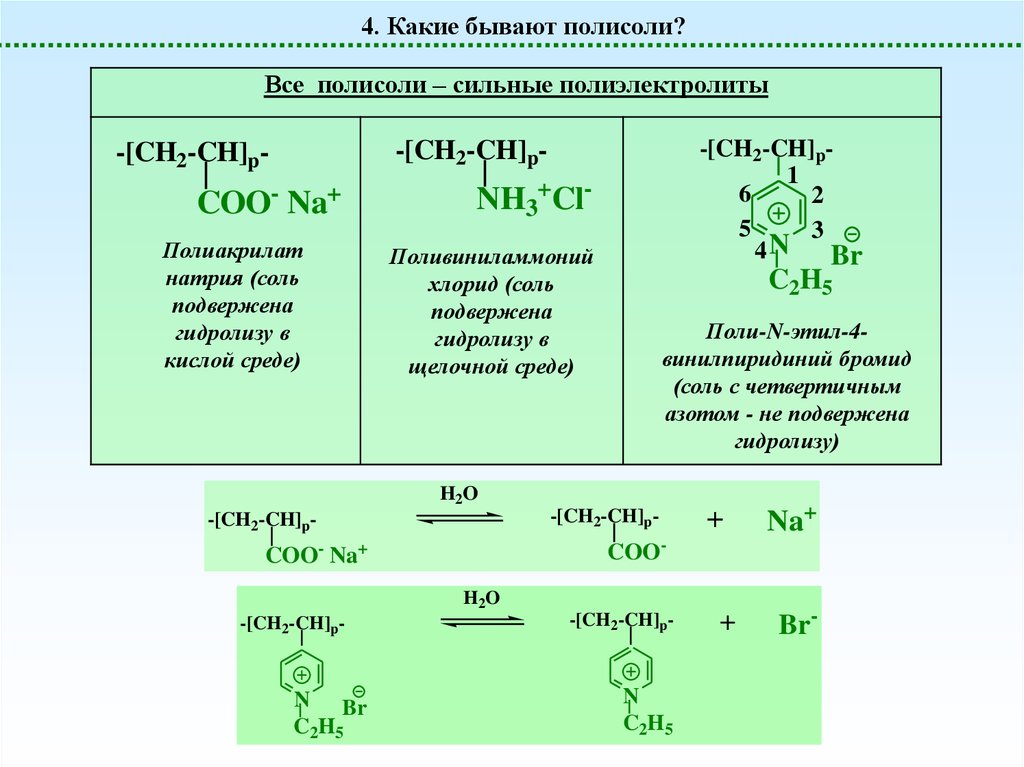
4. Какие бывают полисоли?Все полисоли – сильные полиэлектролиты
-[CH2-CH]p1
6
2
5
3
4N
Br
-[CH2-CH]p-
-[CH2-CH]p-
COO- Na+
Полиакрилат
натрия (соль
подвержена
гидролизу в
кислой среде)
NH3+ClПоливиниламмоний
хлорид (соль
подвержена
гидролизу в
щелочной среде)
C2H5
Поли-N-этил-4винилпиридиний бромид
(соль с четвертичным
азотом - не подвержена
гидролизу)
H2O
-[CH2-CH]p-
-[CH2-CH]p-
H2 O
N Br
C2H5
Na+
COO-
COO- Na+
-[CH2-CH]p-
+
-[CH2-CH]p-
N
C2H5
+
Br-
7.
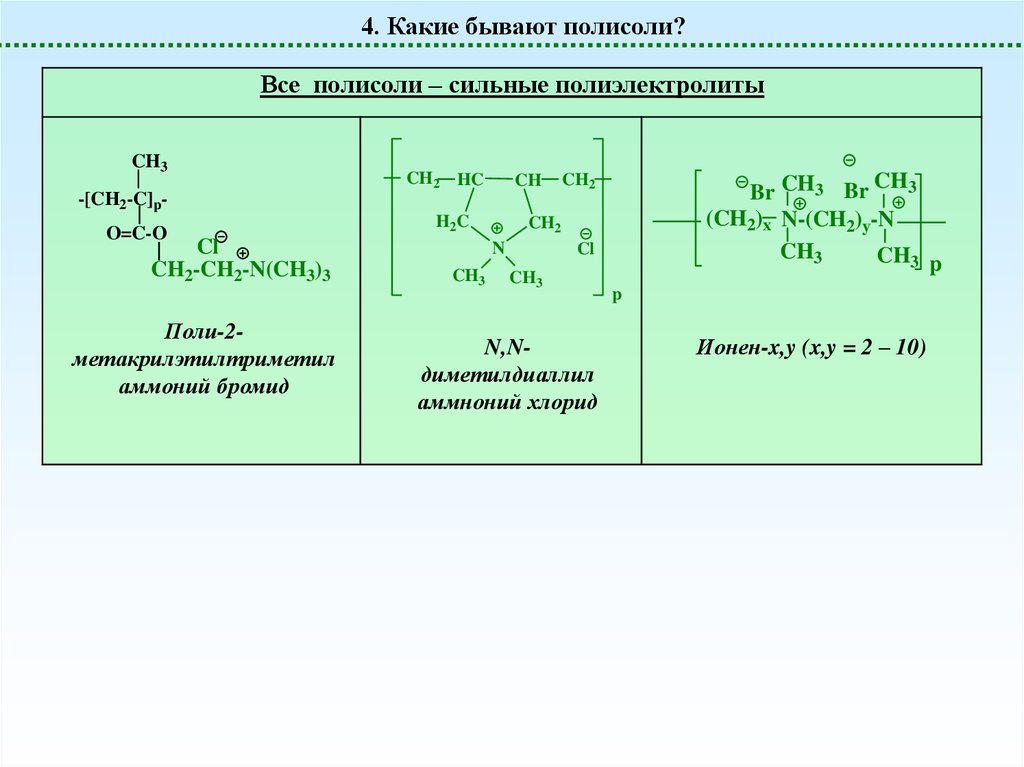
4. Какие бывают полисоли?Все полисоли – сильные полиэлектролиты
CH3
CH2 HC
CH
CH3
Br CH3 Br
(CH2)x N-(CH2)y-N
CH3
CH3
CH2
-[CH2-C]pO=C-O
Cl
CH2-CH2-N(CH3)3
Поли-2метакрилэтилтриметил
аммоний бромид
H2C
CH2
N
CH3
Cl
CH3
N,Nдиметилдиаллил
аммноний хлорид
p
Ионен-x,y (x,y = 2 – 10)
p
8.
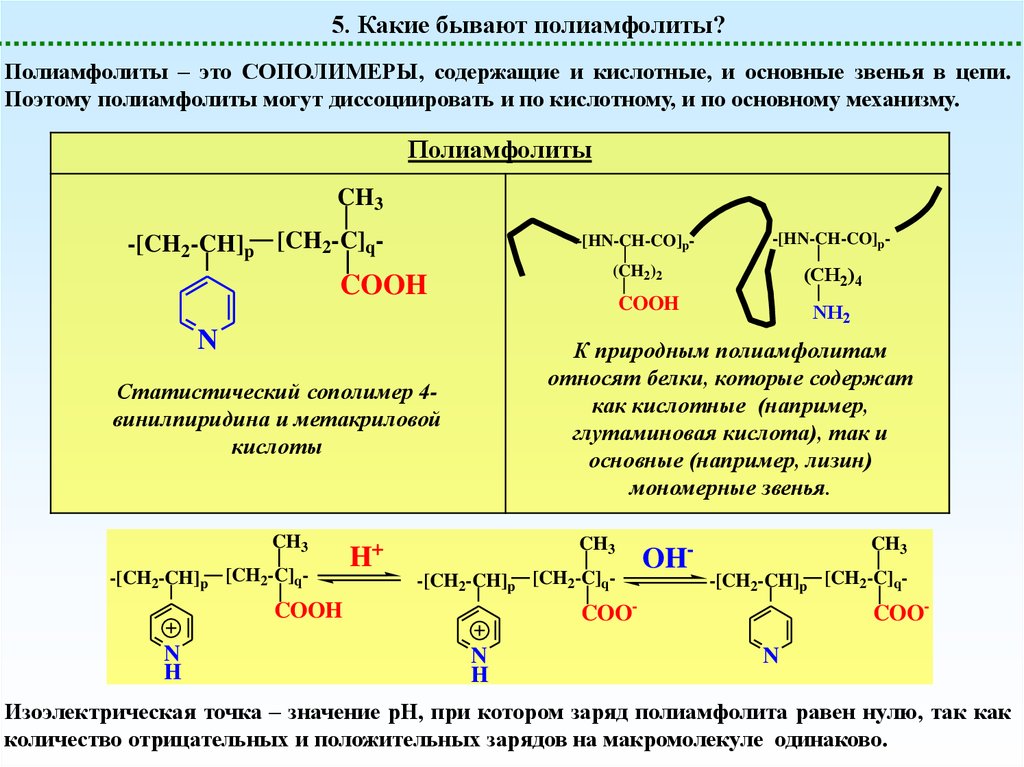
5. Какие бывают полиамфолиты?Полиамфолиты – это СОПОЛИМЕРЫ, содержащие и кислотные, и основные звенья в цепи.
Поэтому полиамфолиты могут диссоциировать и по кислотному, и по основному механизму.
Полиамфолиты
CH3
-[CH2-CH]p [CH2-C]q-
COOH
-[CH2-CH]p [CH2-C]q-
(CH2)4
CH3
-[CH2-CH]p [CH2-C]q-
NH2
OH-
CH3
-[CH2-CH]p [CH2-C]q-
COO-
COOH
N
H
(CH2)2
К природным полиамфолитам
относят белки, которые содержат
как кислотные (например,
глутаминовая кислота), так и
основные (например, лизин)
мономерные звенья.
Статистический сополимер 4винилпиридина и метакриловой
кислоты
H+
-[HN-CH-CO]p-
COOH
N
CH3
-[HN-CH-CO]p-
N
H
COON
Изоэлектрическая точка – значение рН, при котором заряд полиамфолита равен нулю, так как
количество отрицательных и положительных зарядов на макромолекуле одинаково.
9.
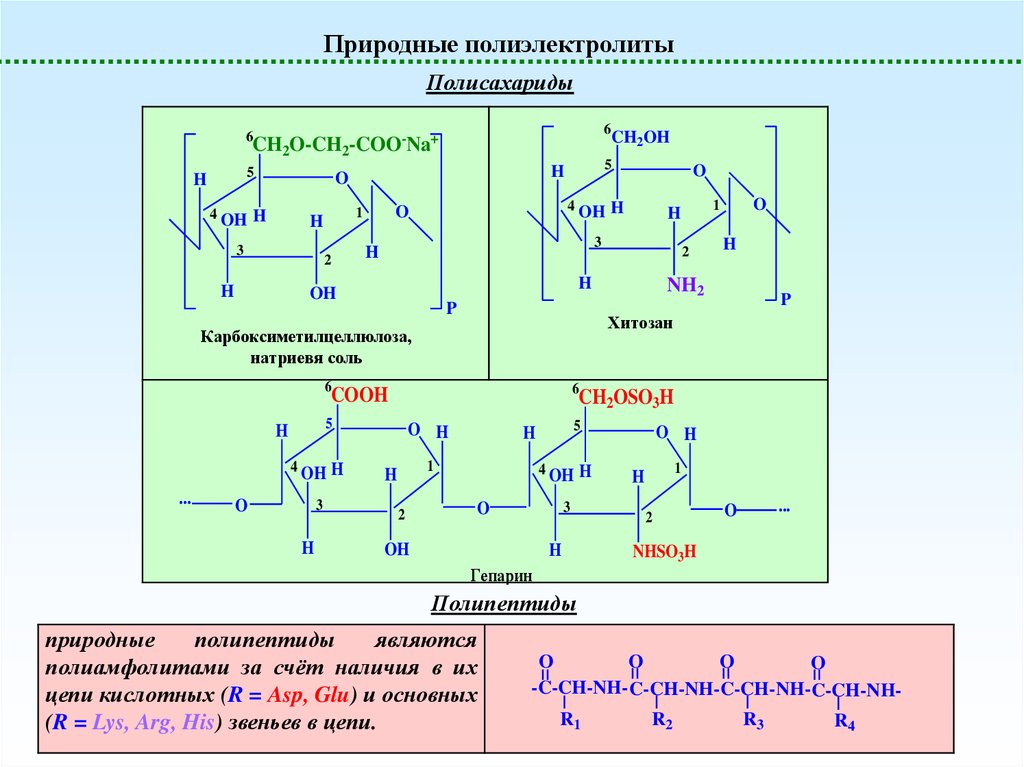
Природные полиэлектролитыПолисахариды
6
6
CH2O-CH2-COO-Na+
5
H
4 OH H
3
2
H
P
6
3
H
P
CH2OSO3H
5
O
NH2
6
COOH
...
H
Хитозан
Карбоксиметилцеллюлоза,
натриевя соль
4 OH H
2
H
O
1
H
3
H
OH
H
O
4 OH H
O
1
H
5
H
O
CH2OH
O H
1
H
2
5
H
4 OH H
O
3
OH
H
O H
1
H
2
...
O
NHSO3H
Гепарин
Полипептиды
природные
полипептиды
являются
полиамфолитами за счёт наличия в их
цепи кислотных (R = Asp, Glu) и основных
(R = Lys, Arg, His) звеньев в цепи.
O
O
O
O
-C-CH-NH- C-CH-NH-C-CH-NH-C-CH-NHR1
R2
R3
R4
10.
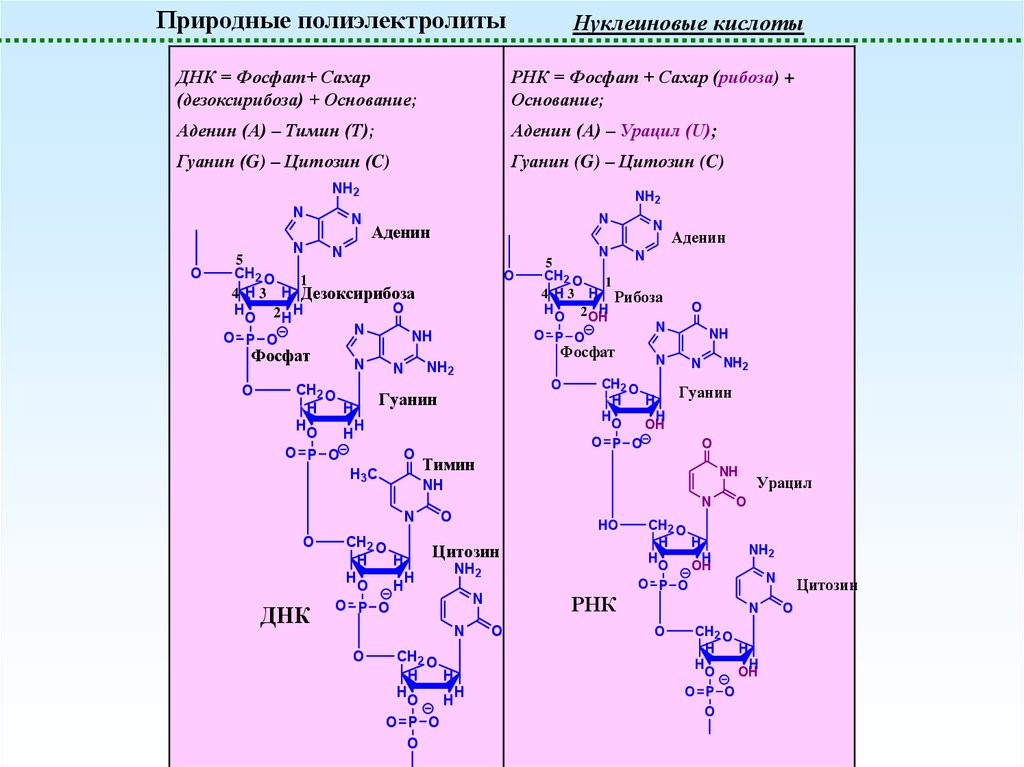
Природные полиэлектролитыНуклеиновые кислоты
ДНК = Фосфат+ Сахар
(дезоксирибоза) + Основание;
РНК = Фосфат + Сахар (рибоза) +
Основание;
Аденин (A) – Тимин (T);
Аденин (A) – Урацил (U);
Гуанин (G) – Цитозин (C)
Гуанин (G) – Цитозин (C)
NH2
N
N
O
N
NH2
N
Аденин
N
N
5
CH2 O
1
4 H 3 H Дезоксирибоза
O
H
H
O 2H
N
NH
O P O
Фосфат
O
N
O
Фосфат
O
CH2 O
Гуанин
H
H
H
H
O
H
O P O
O
Тимин
H3C
NH
Аденин
N
5
CH2 O
1
4 H 3 H Рибоза
H
H
O 2 OH
N
O P O
NH2
N
N
N
O
NH
NH2
N
CH2 O
Гуанин
H
H
H
H
O
OH
O P O
O
NH
N
N
O
ДНК
CH2 O
H
H
H
H
O
H
O P O
O
HO
Цитозин
NH2
N
O
РНК
N
CH2 O
H
H
H
H
O
H
O P O
O
O
CH2 O
H
H
H
H
O
OH
O P O
Урацил
O
NH2
N
N
O
CH2 O
H
H
H
H
O
OH
O P O
O
Цитозин
O
11.
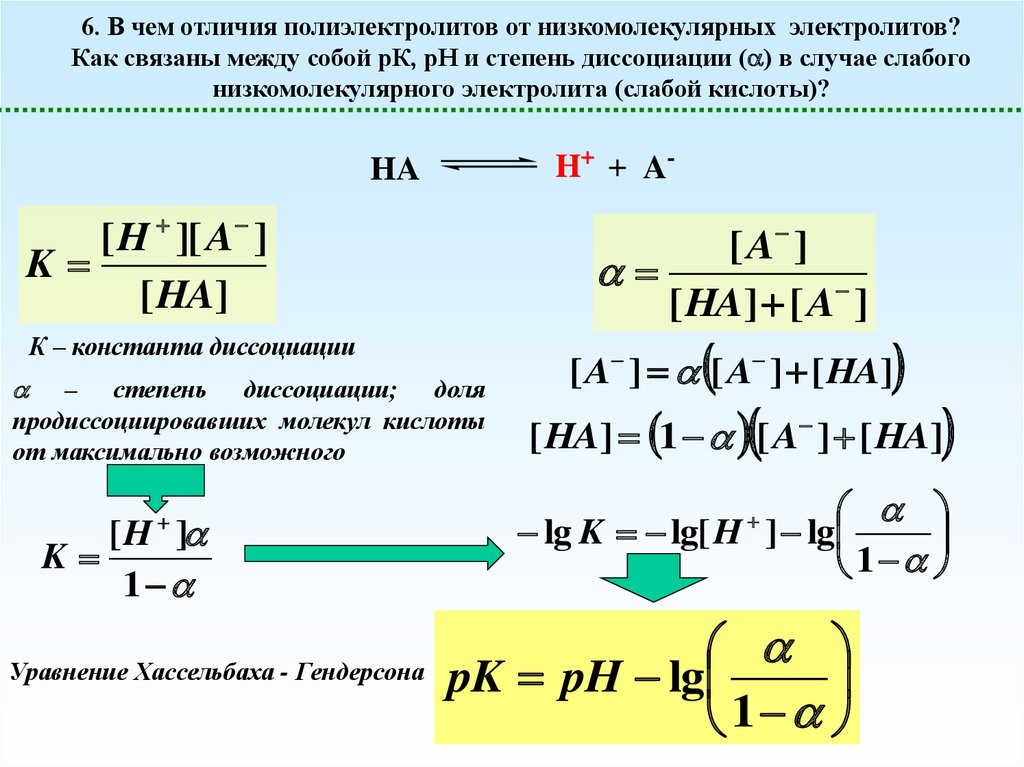
6. В чем отличия полиэлектролитов от низкомолекулярных электролитов?Как связаны между собой рК, рН и степень диссоциации ( ) в случае слабого
низкомолекулярного электролита (слабой кислоты)?
H+ + A-
HA
[ A ]
[ HA] [ A ]
[ H ][ A ]
K
[ HA]
К – константа диссоциации
– степень диссоциации; доля
продиссоциировавших молекул кислоты
от максимально возможного
[H ]
K
1
Уравнение Хассельбаха - Гендерсона
[ A ] [ A ] [ HA]
[ HA] 1 [ A ] [ HA]
lg K lg[ H ] lg
1
pK pH lg
1
12.
7. Как выглядят кривая титрования и зависимость pK от длянизкомолекулярного электролита? Какую информацию несут эти графики?
Кривая титрования
низкомолекулярной кислоты
щелочью (NaOH).
pK есть константа, не зависимая от ;
S1 – площадь под прямой pK ( ).
Gдисс - свободная энергия диссоциации кислоты
до степени диссоциации
pK
pH
Зависимость рК от ..
S1
VNaOH(total)
VNaOH
VNAOH/VNaOH(total).
VNaOH - объём добавленной щелочи
VNaOH(total)
объём щелочи,
необходимый
для
полной
нейтрализации кислоты. Есть
выраженный скачок титрования.
Gдисс 2.3 RT S1 2.3 RT pK ( )d
0
2.3 RT * pK *
13.
8. Как выглядят кривая титрования и зависимость pK от для полиэлектролита(полиакриловой кислоты)?
Кривая титрования
полимерной кислоты щелочью
(NaOH)
pH
pK НЕ константа, а возрастающая функция от
степени диссоциации
pK
Зависимость рК от ..
VNaOH(total)
VNaOH
НЕТ выраженного скачка
титрования
pH pK эфф ( ) lg
pK 0 pK ( ) lg
1
1
14.
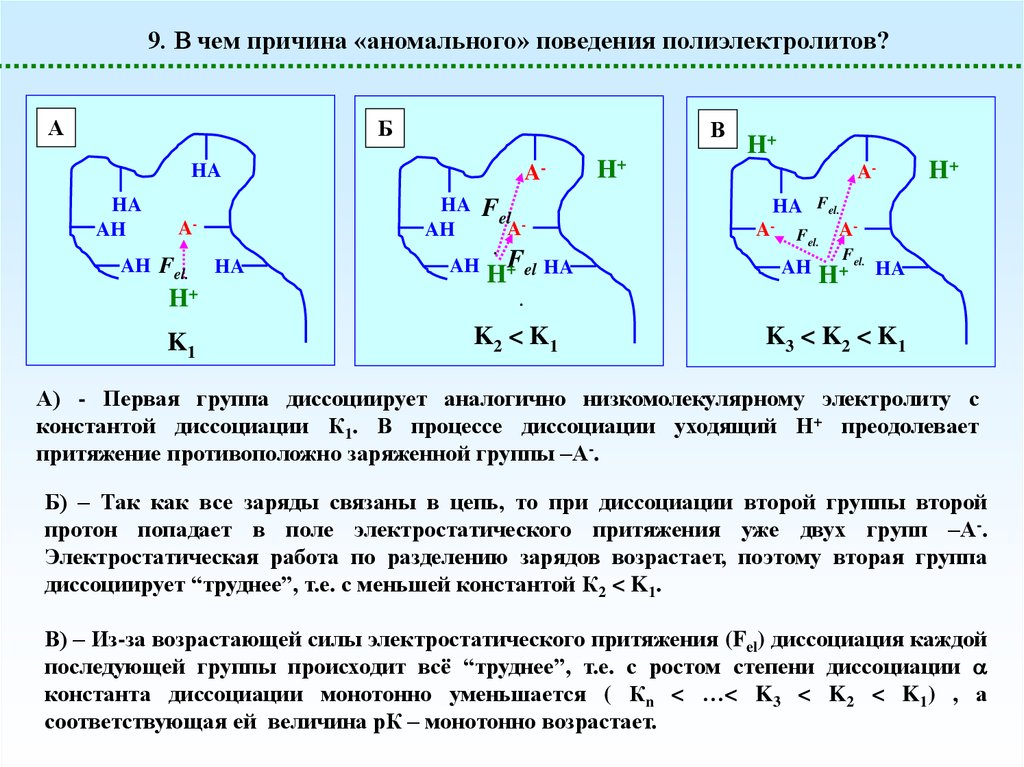
9. В чем причина «аномального» поведения полиэлектролитов?А
Б
В
A-
HA
HA
AH
HA
AH
A-
AH Fel.
H+
K1
Fel
A-
.
HA
AH
F
H+ el HA
H+
H+
A-
H+
HA Fel.
A- Fel. AAH
Fel.
+
H HA
.
K2 < K 1
K3 < K 2 < K 1
А) - Первая группа диссоциирует аналогично низкомолекулярному электролиту с
константой диссоциации К1. В процессе диссоциации уходящий Н+ преодолевает
притяжение противоположно заряженной группы –А-.
Б) – Так как все заряды связаны в цепь, то при диссоциации второй группы второй
протон попадает в поле электростатического притяжения уже двух групп –А-.
Электростатическая работа по разделению зарядов возрастает, поэтому вторая группа
диссоциирует “труднее”, т.е. с меньшей константой К2 < K1.
В) – Из-за возрастающей силы электростатического притяжения (Fel) диссоциация каждой
последующей группы происходит всё “труднее”, т.е. с ростом степени диссоциации
константа диссоциации монотонно уменьшается ( Кn < …< K3 < K2 < K1) , а
соответствующая ей величина рК – монотонно возрастает.
15.
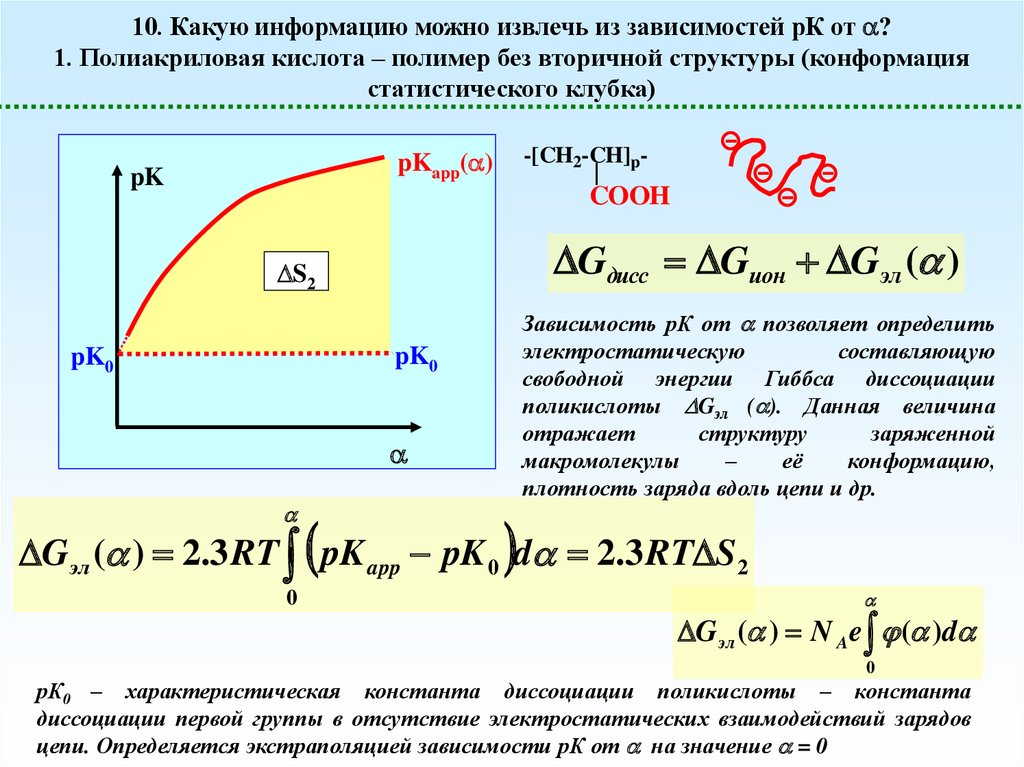
10. Какую информацию можно извлечь из зависимостей рК от ?1. Полиакриловая кислота – полимер без вторичной структуры (конформация
статистического клубка)
-[CH2-CH]p-
pKapp( )
pK
COOH
Gдисс Gион Gэл ( )
S2
Зависимость рК от позволяет определить
электростатическую
составляющую
свободной энергии Гиббса диссоциации
поликислоты Gэл ( ). Данная величина
отражает
структуру
заряженной
макромолекулы
–
её
конформацию,
плотность заряда вдоль цепи и др.
pK0
pK0
Gэл ( ) 2.3 RT pK app pK 0 d 2.3 RT S 2
0
G эл ( ) N Ae ( )d
0
рК0 – характеристическая константа диссоциации поликислоты – константа
диссоциации первой группы в отсутствие электростатических взаимодействий зарядов
цепи. Определяется экстраполяцией зависимости рК от на значение = 0
16.
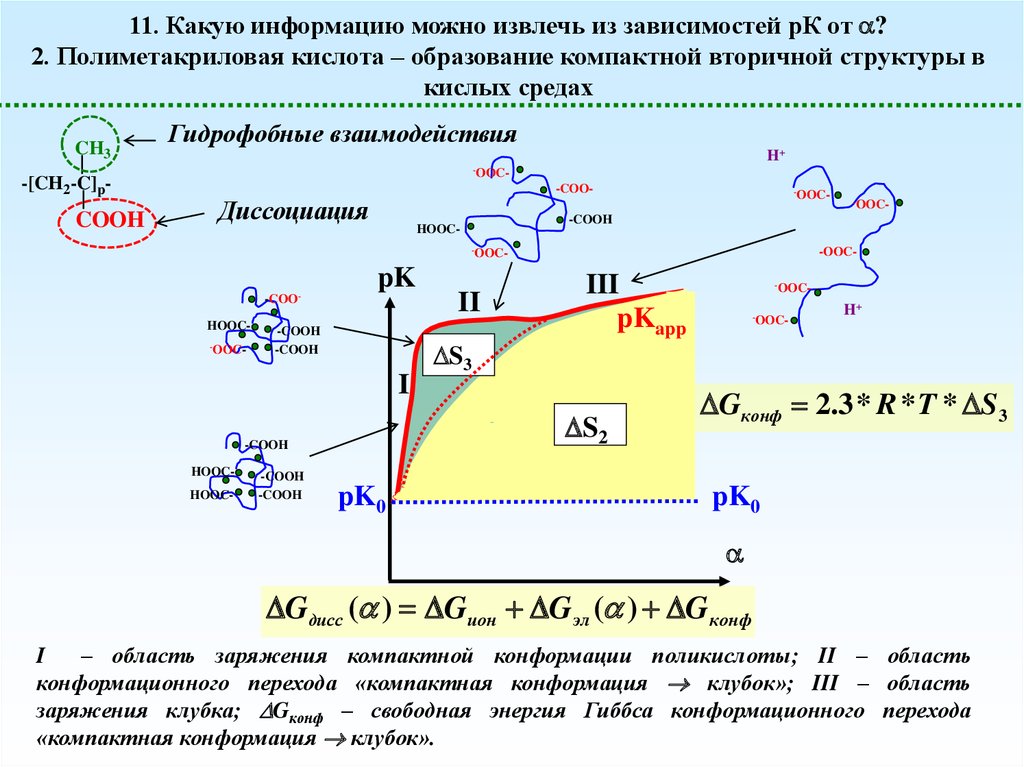
11. Какую информацию можно извлечь из зависимостей рК от ?2. Полиметакриловая кислота – образование компактной вторичной структуры в
кислых средах
CH3
-[CH2-C]p-
COOH
Гидрофобные взаимодействия
H+
-OOC-
-COO-
Диссоциация
-OOC-
HOOC-
-OOC-
-OOC-
pK
-COOHOOC-OOC-
-COOH
-COOH
I
HOOCHOOC-
-COOH
-COOH
II
S3
III
pKapp
S2
-COOH
pK0
-OOC-
-COOH
-OOC-OOC-
H+
Gконф 2.3 * R * T * S 3
pK0
Gдисс ( ) Gион Gэл ( ) Gконф
I
– область заряжения компактной конформации поликислоты; II – область
конформационного перехода «компактная конформация клубок»; III – область
заряжения клубка; Gконф – свободная энергия Гиббса конформационного перехода
«компактная конформация клубок».
17.
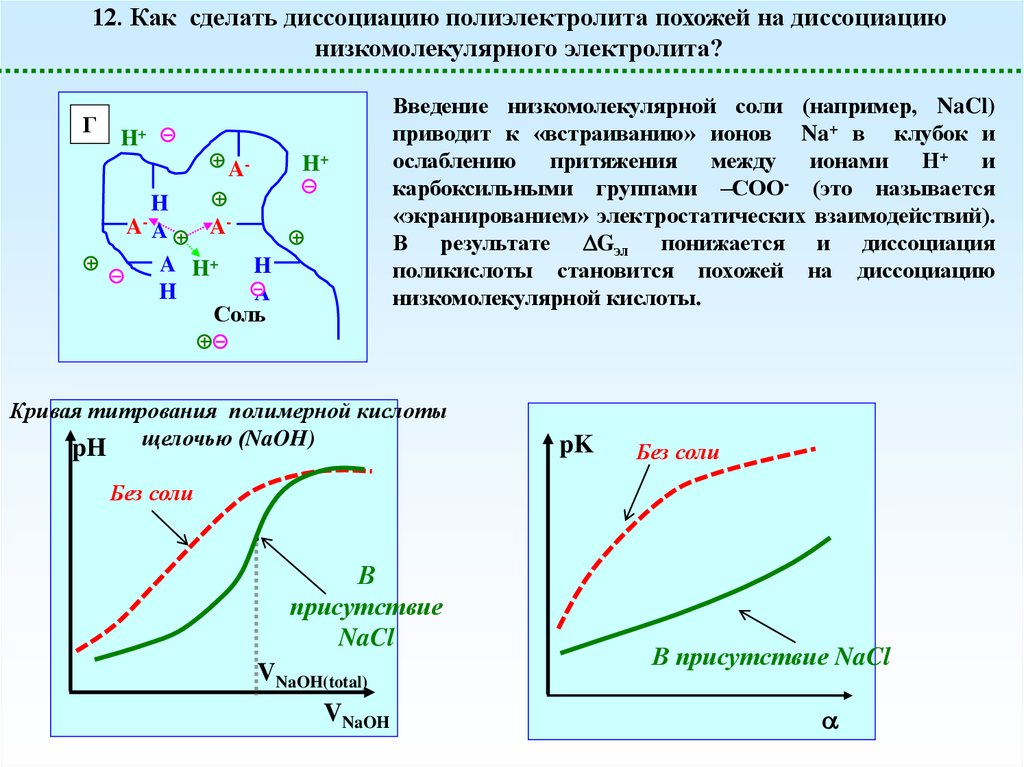
12. Как сделать диссоциацию полиэлектролита похожей на диссоциациюнизкомолекулярного электролита?
Г
H+
H+
AA-
H
AA
A H+
H
H
A
Соль
Введение низкомолекулярной соли (например, NaCl)
приводит к «встраиванию» ионов Na+ в клубок и
ослаблению притяжения между ионами Н+ и
карбоксильными группами –СОО- (это называется
«экранированием» электростатических взаимодействий).
В результате Gэл понижается и диссоциация
поликислоты становится похожей на диссоциацию
низкомолекулярной кислоты.
Кривая титрования полимерной кислоты
pH щелочью (NaOH)
pK
Без соли
Без соли
В
присутствие
NaCl
VNaOH(total)
VNaOH
В присутствие NaCl
18.
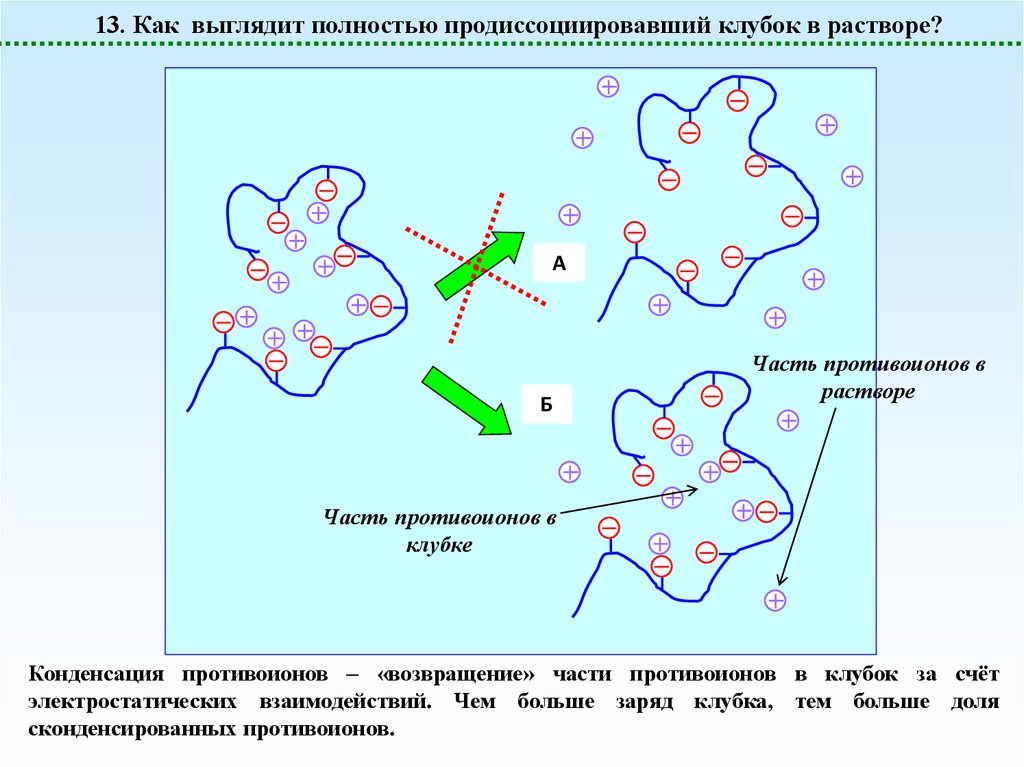
13. Как выглядит полностью продиссоциировавший клубок в растворе?A
Б
Часть противоионов в
растворе
Часть противоионов в
клубке
Конденсация противоионов – «возвращение» части противоионов в клубок за счёт
электростатических взаимодействий. Чем больше заряд клубка, тем больше доля
сконденсированных противоионов.
19.
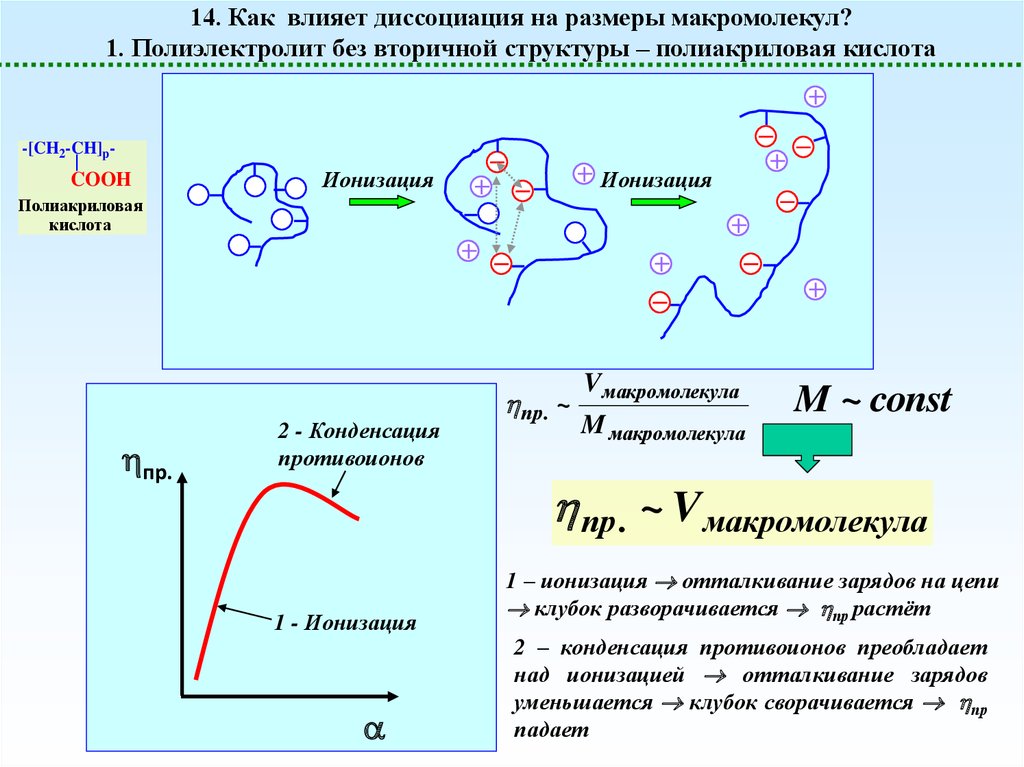
14. Как влияет диссоциация на размеры макромолекул?1. Полиэлектролит без вторичной структуры – полиакриловая кислота
-[CH2-CH]p-
COOH
Ионизация
Ионизация
Полиакриловая
кислота
пр.
2 - Конденсация
противоионов
пр. ~
Vмакромолекула
M макромолекула
M ~ const
пр. ~ Vмакромолекула
1 - Ионизация
1 – ионизация отталкивание зарядов на цепи
клубок разворачивается пр растёт
2 – конденсация противоионов преобладает
над ионизацией отталкивание зарядов
уменьшается клубок сворачивается пр
падает
20.
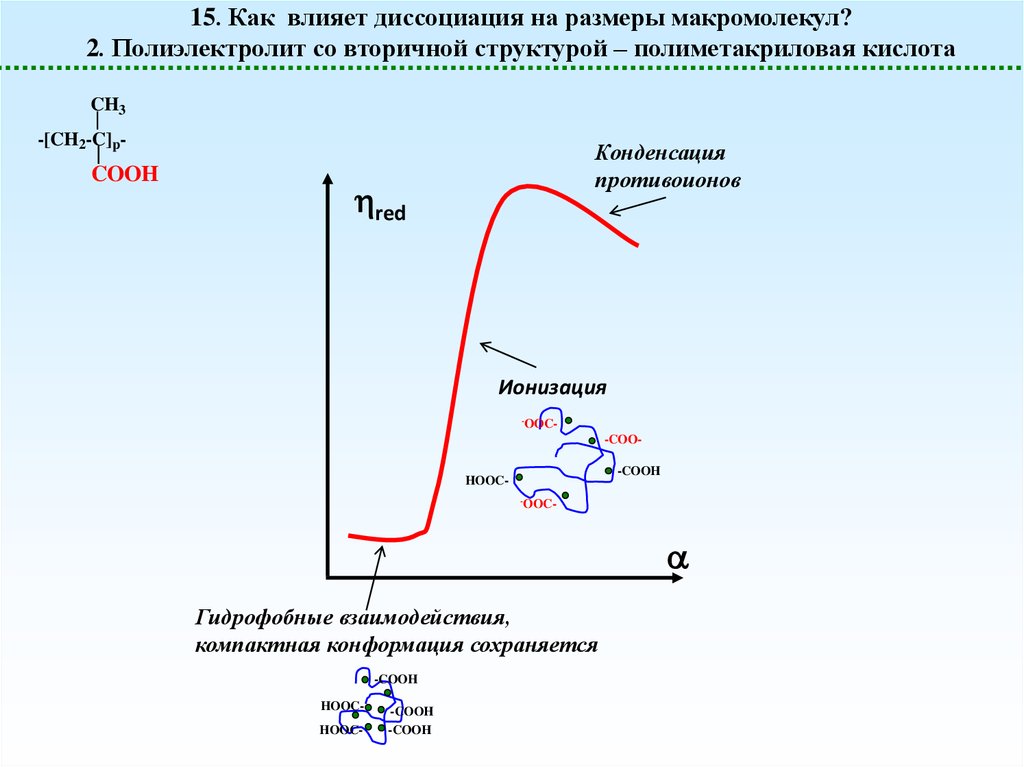
15. Как влияет диссоциация на размеры макромолекул?2. Полиэлектролит со вторичной структурой – полиметакриловая кислота
CH3
-[CH2-C]p-
COOH
Конденсация
противоионов
red
Ионизация
-OOC-
-COO-COOH
HOOC-OOC-
Гидрофобные взаимодействия,
компактная конформация сохраняется
-COOH
HOOCHOOC-
-COOH
-COOH
21.
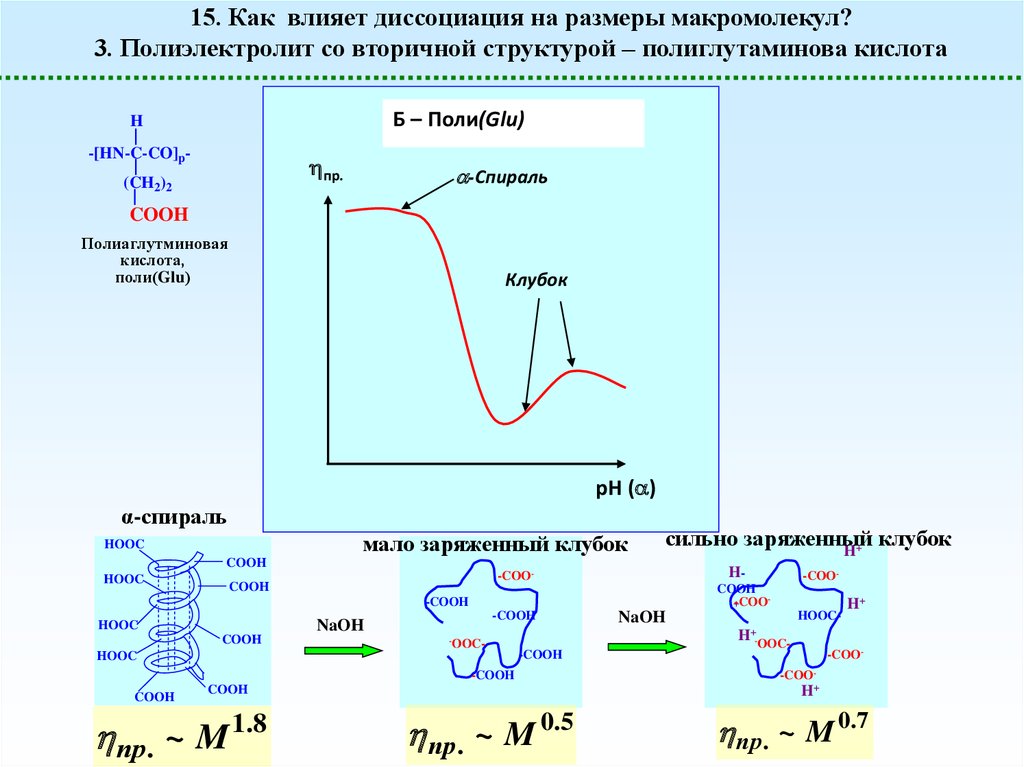
15. Как влияет диссоциация на размеры макромолекул?3. Полиэлектролит со вторичной структурой – полиглутаминова кислота
Б – Поли(Glu)
H
-[HN-C-CO]p-
пр.
(CH2)2
-Спираль
COOH
Полиаглутминовая
кислота,
поли(Glu)
Клубок
рН ( )
α-спираль
мало заряженный клубок
HOOC
COOH
HOOC
сильно заряженный
клубок
H+
HCOOH
-COO+
-COO-
COOH
-COOH
-COOH
NaOH
HOOC
COOH
-OOC-
HOOC
-COOH
-COOH
COOH
пр. ~ M
NaOH
HOOC-
H+-OOC-
H+
-COO-
-COO-
H+
COOH
1.8
-COO-
пр . ~ M 0.5
пр. ~ M 0.7
22.
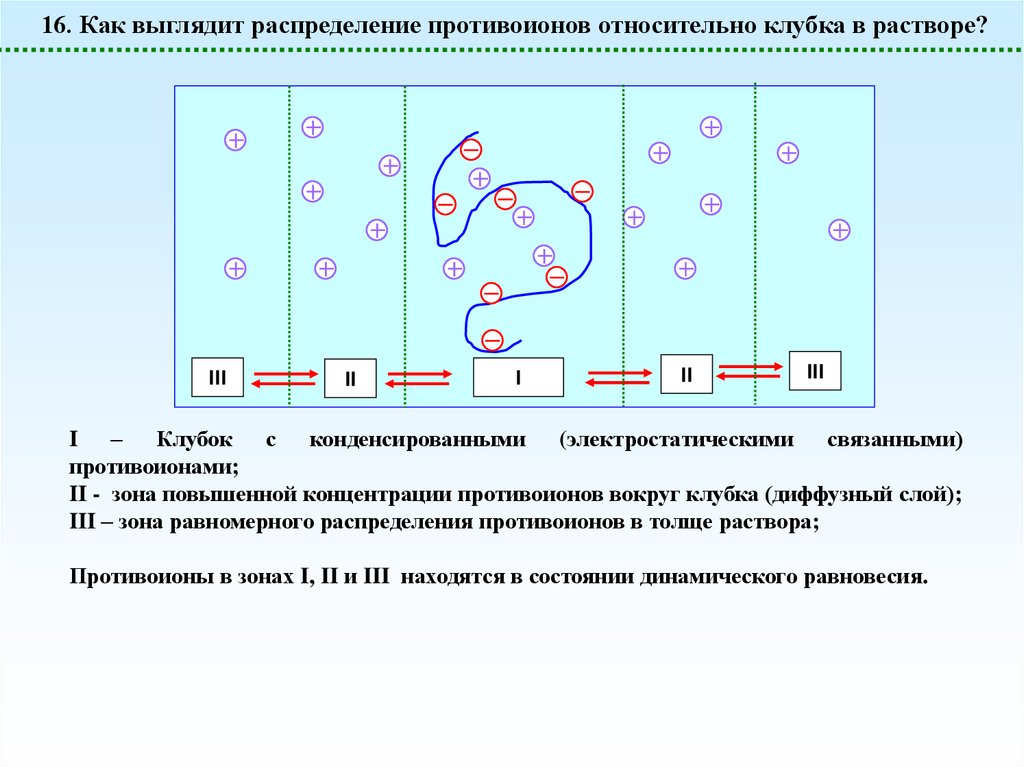
16. Как выглядит распределение противоионов относительно клубка в растворе?III
II
I
II
III
I – Клубок с конденсированными (электростатическими связанными)
противоионами;
II - зона повышенной концентрации противоионов вокруг клубка (диффузный слой);
III – зона равномерного распределения противоионов в толще раствора;
Противоионы в зонах I, II и III находятся в состоянии динамического равновесия.
23.
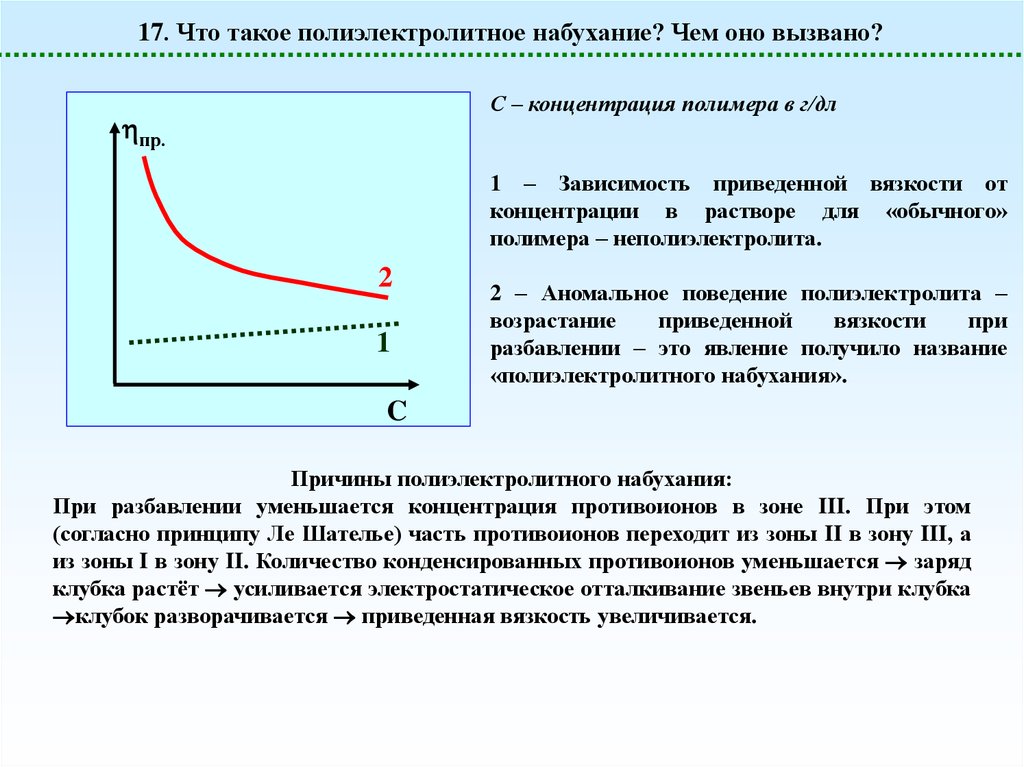
17. Что такое полиэлектролитное набухание? Чем оно вызвано?С – концентрация полимера в г/дл
пр.
1 – Зависимость приведенной вязкости от
концентрации в растворе для «обычного»
полимера – неполиэлектролита.
2
1
2 – Аномальное поведение полиэлектролита –
возрастание
приведенной
вязкости
при
разбавлении – это явление получило название
«полиэлектролитного набухания».
C
Причины полиэлектролитного набухания:
При разбавлении уменьшается концентрация противоионов в зоне III. При этом
(согласно принципу Ле Шателье) часть противоионов переходит из зоны II в зону III, а
из зоны I в зону II. Количество конденсированных противоионов уменьшается заряд
клубка растёт усиливается электростатическое отталкивание звеньев внутри клубка
клубок разворачивается приведенная вязкость увеличивается.
24.
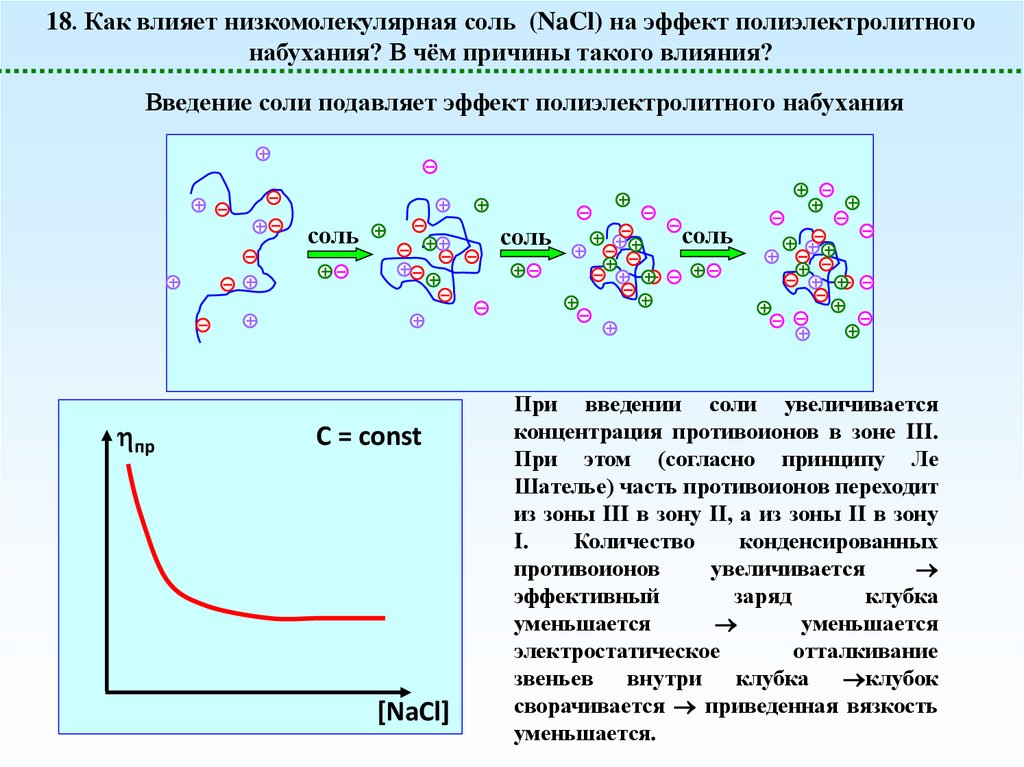
18. Как влияет низкомолекулярная соль (NaCl) на эффект полиэлектролитногонабухания? В чём причины такого влияния?
Введение соли подавляет эффект полиэлектролитного набухания
соль
пр
соль
C = const
[NaCl]
соль
При введении соли увеличивается
концентрация противоионов в зоне III.
При этом (согласно принципу Ле
Шателье) часть противоионов переходит
из зоны III в зону II, а из зоны II в зону
I.
Количество
конденсированных
противоионов
увеличивается
эффективный
заряд
клубка
уменьшается
уменьшается
электростатическое
отталкивание
звеньев внутри
клубка
клубок
сворачивается приведенная вязкость
уменьшается.
25.
19. Что такое изоионное разбавление?red
-[CH2-CH]p-
COO- Na+
Полиакрилат
натрия
1
2
3
4
5
C
1 – [NaCl] = 0 (эффект полиэлектролитного набухания);
2 - [NaCl] < [Na+]полимер; (концентрация соли меньше мольной концентрации
противоионов полиэлектролита в растворе);
3 - [NaCl] = [Na+]полимер –изоионное разбавление (концентрация соли РАВНА
мольной концентрации противоионов полиэлектролита в растворе)
4 - [NaCl] > [Na+]полимер; (концентрация соли больше мольной концентрации
противоионов полиэлектролита в растворе)
5 - [NaCl] >> [Na+]полимер; (полное подавление полиэлектролитного эффекта в
избытке соли)
26.
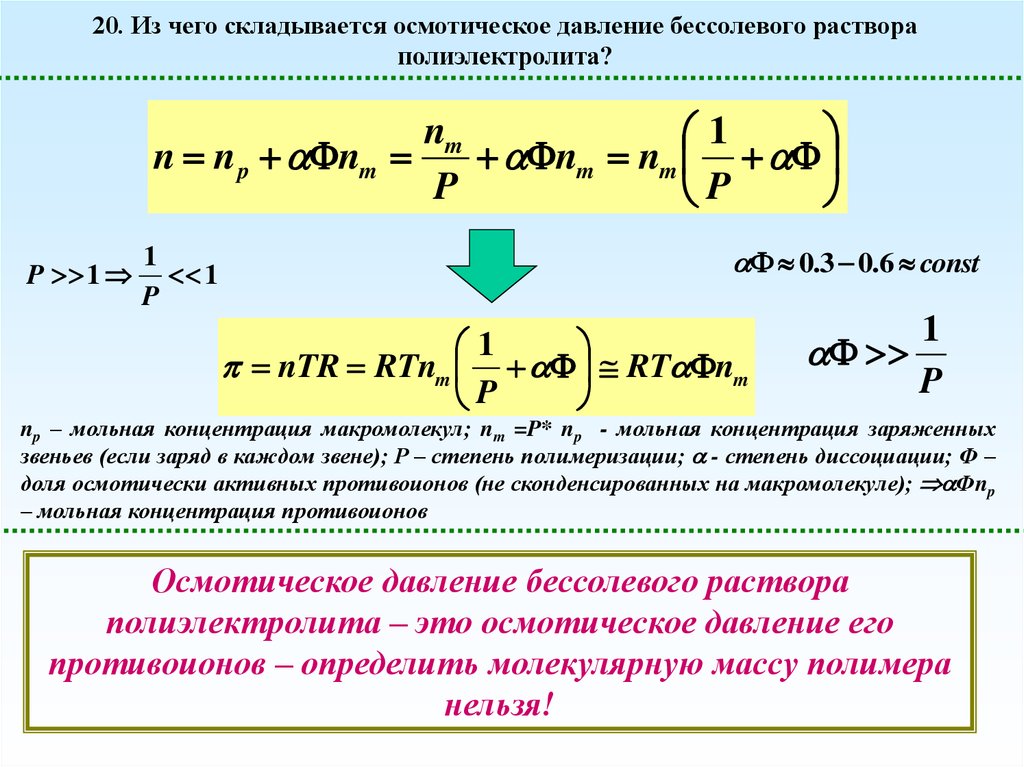
20. Из чего складывается осмотическое давление бессолевого раствораполиэлектролита?
= gh
h
Растворитель
Полупроницаемая мембрана
Рассмотрим для простоты случай псевдоидеального ( ) растовора
nRT
n – мольная концентрация всех частиц в растворе.
27.
20. Из чего складывается осмотическое давление бессолевого раствораполиэлектролита?
nm
1
n n p nm
nm nm
P
P
P 1
1
1
P
0.3 0.6 const
1
nTR RTnm RT nm
P
1
P
np – мольная концентрация макромолекул; nm =P* np - мольная концентрация заряженных
звеньев (если заряд в каждом звене); Р – степень полимеризации; - степень диссоциации; Ф –
доля осмотически активных противоионов (не сконденсированных на макромолекуле); Фnp
– мольная концентрация противоионов
Осмотическое давление бессолевого раствора
полиэлектролита – это осмотическое давление его
противоионов – определить молекулярную массу полимера
нельзя!
28.
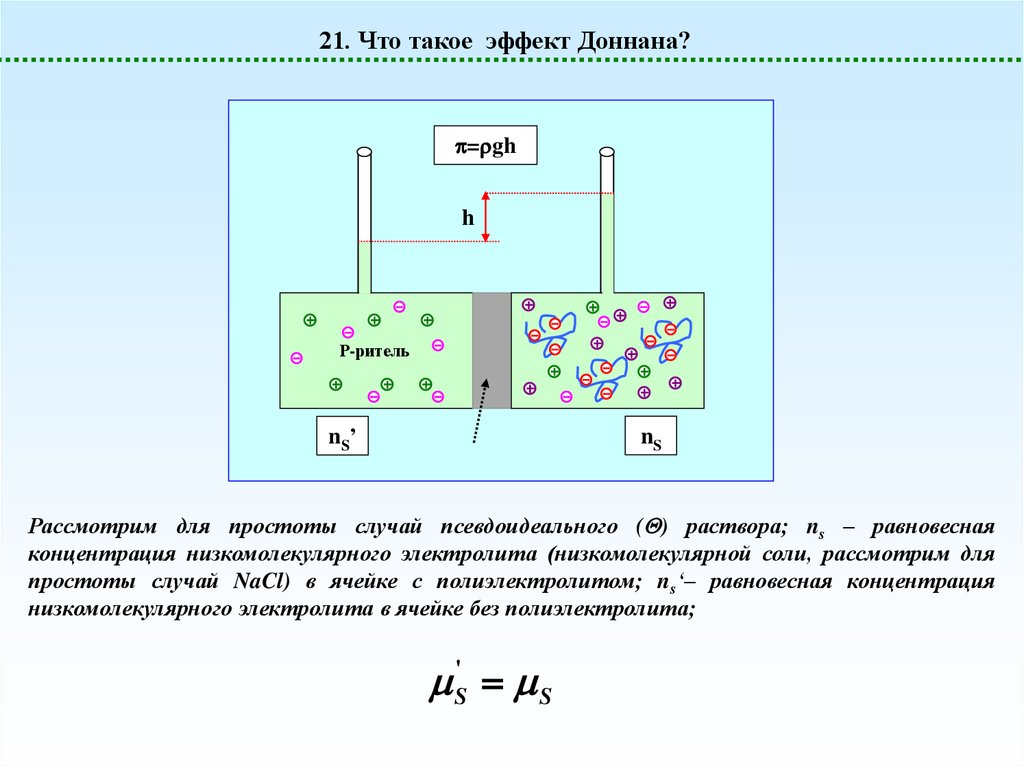
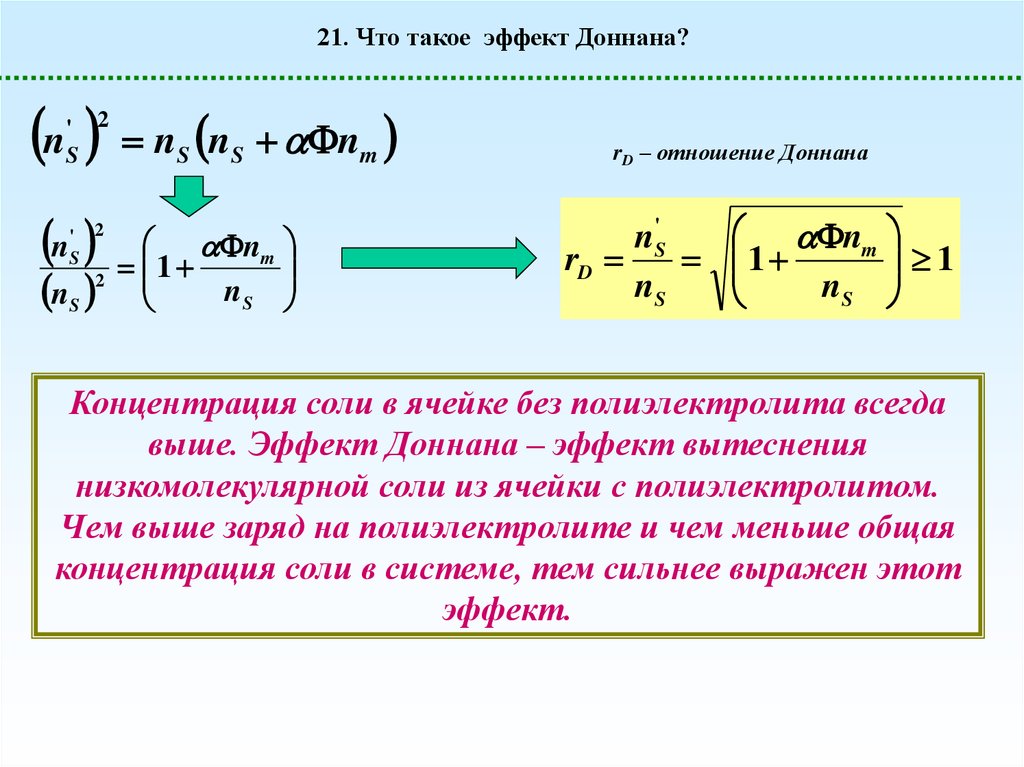
21. Что такое эффект Доннана?= gh
h
Р-ритель
nS’
nS
Рассмотрим для простоты случай псевдоидеального ( ) раствора; ns – равновесная
концентрация низкомолекулярного электролита (низкомолекулярной соли, рассмотрим для
простоты случай NaCl) в ячейке с полиэлектролитом; ns‘– равновесная концентрация
низкомолекулярного электролита в ячейке без полиэлектролита;
S' S
29.
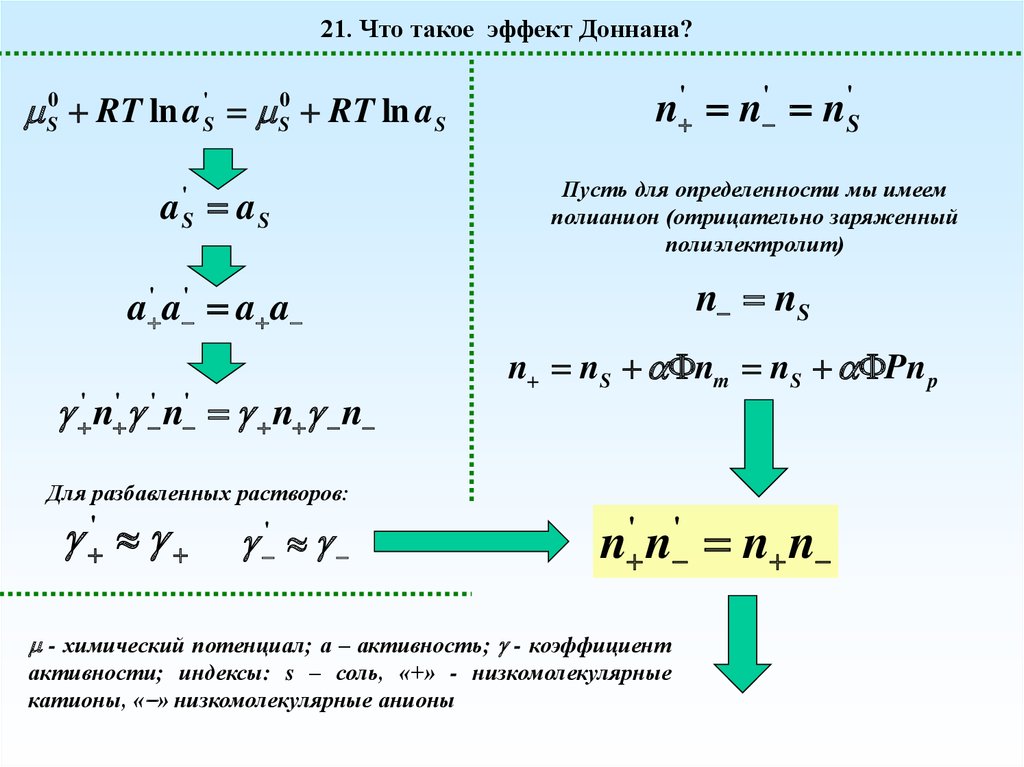
21. Что такое эффект Доннана?S0 RT ln a 'S S0 RT ln a S
n ' n ' n'S
a aS
Пусть для определенности мы имеем
полианион (отрицательно заряженный
полиэлектролит)
a ' a ' a a
n nS
'
S
' n ' ' n ' n n
n nS nm nS Pn p
Для разбавленных растворов:
'
'
n ' n ' n n
- химический потенциал; а – активность; - коэффициент
активности; индексы: s – соль, «+» - низкомолекулярные
катионы, « » низкомолекулярные анионы
30.
21. Что такое эффект Доннана?n
' 2
S
n
' 2
S
2
S
n
nS nS nm
nm
1
nS
rD – отношение Доннана
nm
n'S
1
rD
1
nS
nS
Концентрация соли в ячейке без полиэлектролита всегда
выше. Эффект Доннана – эффект вытеснения
низкомолекулярной соли из ячейки с полиэлектролитом.
Чем выше заряд на полиэлектролите и чем меньше общая
концентрация соли в системе, тем сильнее выражен этот
эффект.
31.
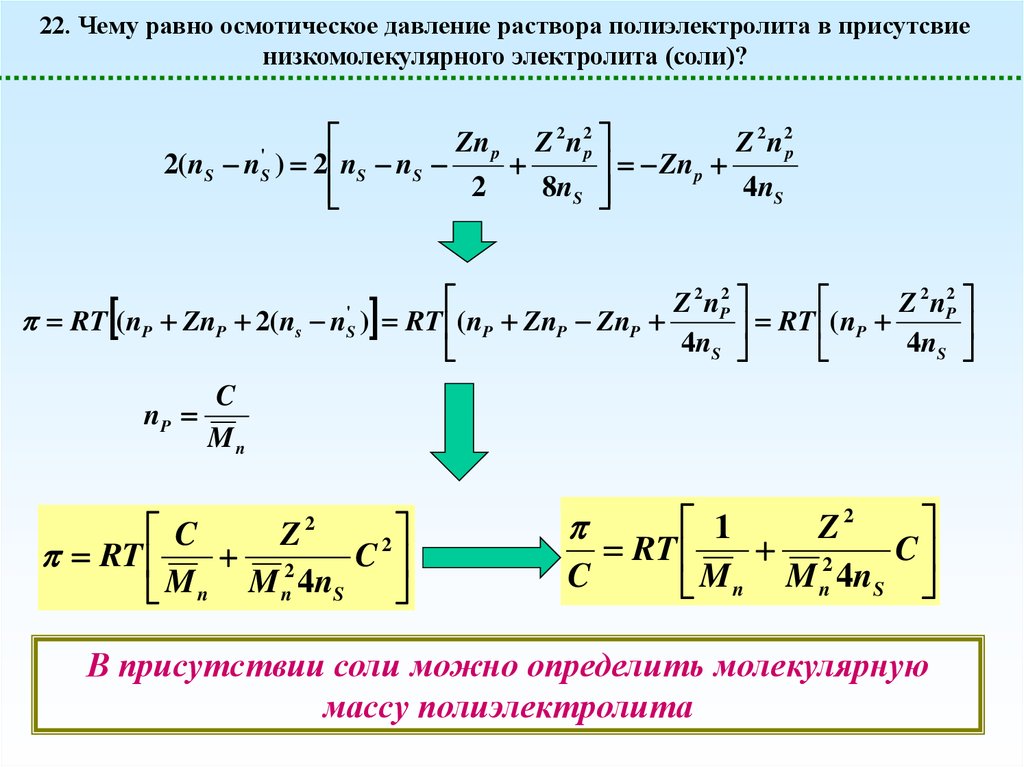
22. Чему равно осмотическое давление раствора полиэлектролита в присутсвиенизкомолекулярного электролита (соли)?
Для простоты опять примем, что в отсутствие диссоциации раствор был бы псевдоидеальным
RT ( nP nm 2( ns n'S )
nm Pn p Zn p
Z = РФ – заряд макромолекулы
RT ( nP ZnP 2( ns n'S )
1
2
Zn p
Zn p Z n
n
1
1
nS
nS
2 ns
8nS2
'
S
n nS
'
S
2
Zn p
2
Z 2 n2p
8n S
2
p
1 x
1
2
x x2
1
2 8
Zn p
nS
x 1
1
Считаем, что добавили избыток соли
32.
22. Чему равно осмотическое давление раствора полиэлектролита в присутсвиенизкомолекулярного электролита (соли)?
2 2
2 2
Zn
Z
n
Z
np
p
p
'
2( nS nS ) 2 nS nS
Zn p
2
8nS
4 nS
Z 2 nP2
Z 2 nP2
RT (nP ZnP 2(ns n ) RT (nP ZnP ZnP
RT ( nP
4
n
4
n
S
S
'
S
nP
C
Mn
C
Z
2
RT
2
C
M n M n 4n S
2
1
Z2
RT
2
C
C
M n M n 4n S
В присутствии соли можно определить молекулярную
массу полиэлектролита
33.
23. Чему равен второй вириальный коэффициент полиэлектролита?2
2
1
Z
A2
0
2
4n S M n 4n S
Z
плотность заряда макромолекулы
Mn
Для полиэлектролитов А2 > 0; Чем больше плотность
заряда на макромолекуле и чем ниже концентрация
низкомолекулярного электролита, тем выше значение
второго вириального коэффициента
34.
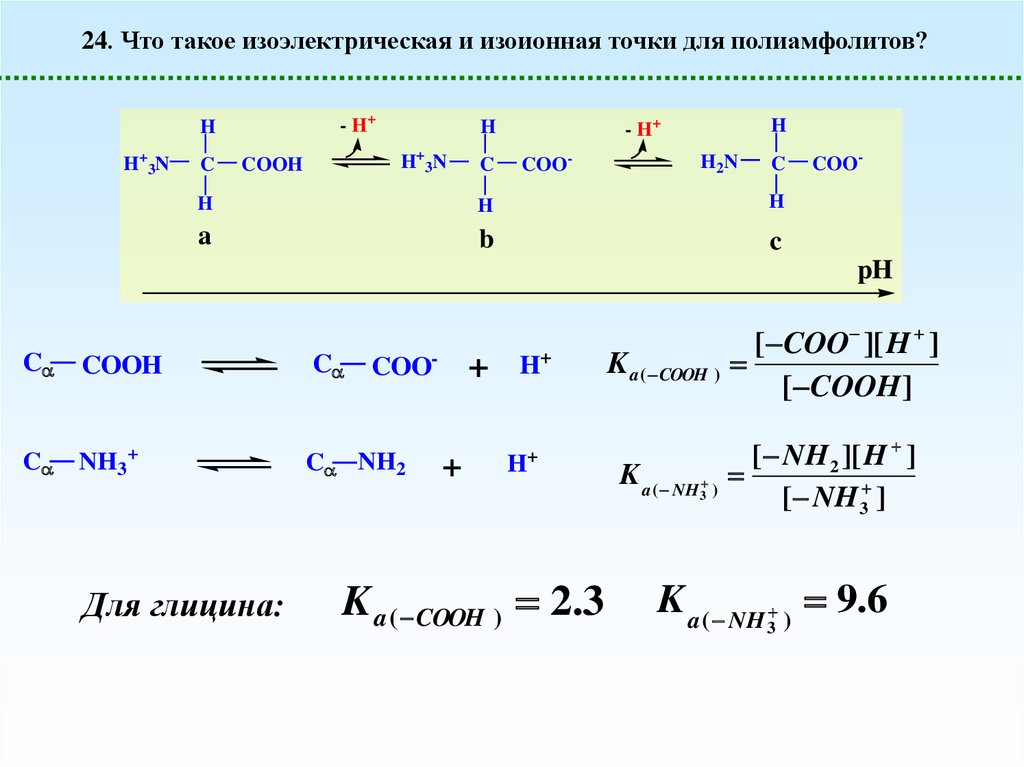
24. Что такое изоэлектрическая и изоионная точки для полиамфолитов?- H+
H
H+3N
C
H+3N
COOH
- H+
H
C
COO-
H
H2N
C
H
H
H
a
b
c
COO-
pH
COO-
C
COOH
C
C
NH3+
C NH2
+
+
H+
H+
K a ( COOH )
K a ( NH )
3
Для глицина:
K a ( COOH ) 2.3
[ COO ][ H ]
[ COOH]
[ NH 2 ][ H ]
[ NH 3 ]
K a ( NH ) 9.6
3
35.
24. Что такое изоэлектрическая и изоионная точки для полиамфолитов?Изоэлектрическая точка (pI, ИЭТ) – значение рН раствора,
при котором суммарный заряд амфолита равен нулю.
Для простого амфолита с двумя диссоциирующими группами:
pI
Для глицина:
pI
pK a ( COOH ) pK a ( NH )
2.3 9.6
5.95
2
3
2
H
H
H+3N
C
H
COO-
H2N
C
COOH
H
ИЭТ – константа для данного полиамфолита,
определяемая значениями констант диссоциации
индивидуальных групп
36.
Физическая модель глобулярного белка в нативной конформации.COOH
Ионные
группы
HOOC
NH2
H2N
HOOC
Гидрофобное
ядро
Гидрофильная
периферия
COOH
COOH
NH2
37.
Изоэлектрическая точка белковN+:H
H:+N
COO-
COO-
COOH
N+:H
H:+N
N:
:N
V
III
I
COOH
HOOC
COO-
-OOC
COO-
-OOC
N:
N+:H
N+:H
COO-
COON+:H
H:+N
II
IV
COOH
HOOC
N:
H:+N
COO-
-OOC
N+:H
N:
pH
+
-
pI
Белок
Пепсин
Яичный альбумин
Сывороточный альбумин
pI
1.4
4.71
4.59
Белок
-Лактоглобулин
Гемоглобин
Рибонуклеаза
pI
5.1
6.87
9.4
-казеин
4.50
Цитохром-C
10.6
38.
24. Как экспериментально определить изоэлектрическую точку?Желатина (денатурированный
белок)
Растворимость
pI
pH
pI
В ИЭТ многие свойства (осмотическое давление,
электропроводность, растворимость, удельная вязкость
(для клубков) и др.) принимают минимальные значения
39.
24. Что такое изоионная точка? Как она связана с изоэлектрической точкой?Изоионная точка (pS, ИИТ) – собственное значение рН
раствора полиамфолита.
Для бессолевого раствора полиамфолита справедливо уравнение
электронейтральности:
Znp [ H ] [OH ] 0
[OH ] [ H ]
Z
np
1. Если ИИТ лежит в щелочной области, то ИЭТ лежит
правее, если ИИТ лежит в кислой области, то ИЭТ лежит
левее на шкале рН. Если ИИТ = 7, то и ИЭТ = 7.
2. Если концентрация полиамфолита не очень мала и ИИТ
лежит не в очень кислой или щелочной области, то ИИТ ИЭТ
40.
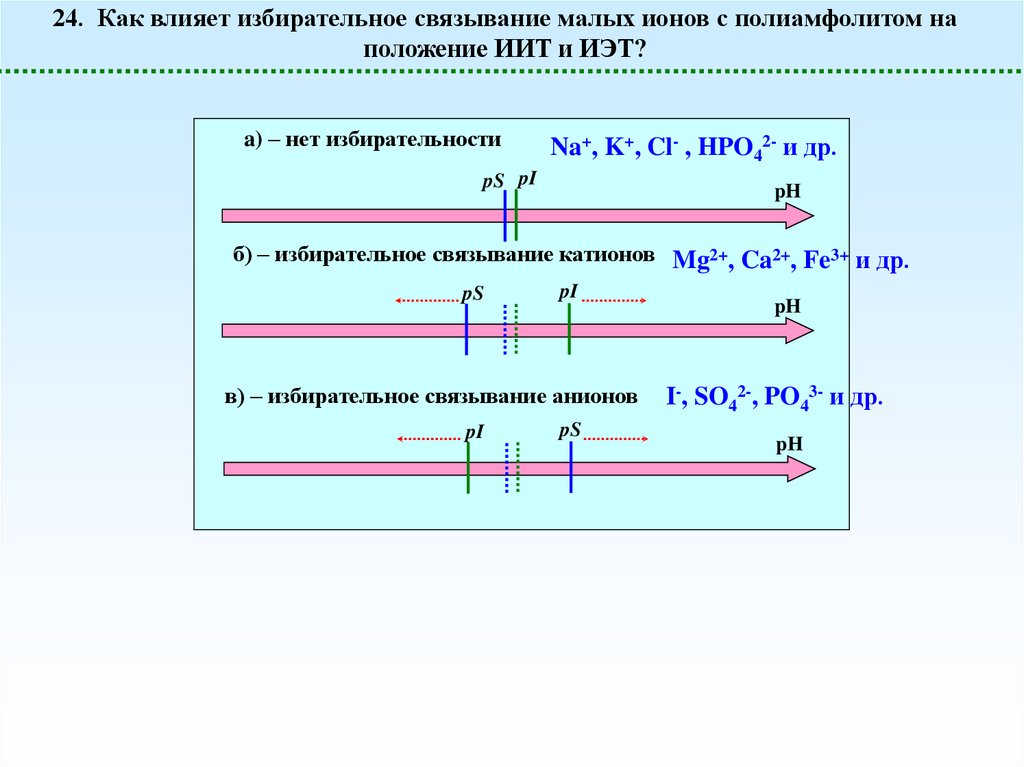
24. Как влияет избирательное связывание малых ионов с полиамфолитом наположение ИИТ и ИЭТ?
a) – нет избирательности
Na+, K+, Cl- , HPO42- и др.
pS pI
pH
б) – избирательное связывание катионов Mg2+, Ca2+, Fe3+ и др.
pS
pI
в) – избирательное связывание анионов
pI
pS
pH
I-, SO42-, PO43- и др.
pH
41.
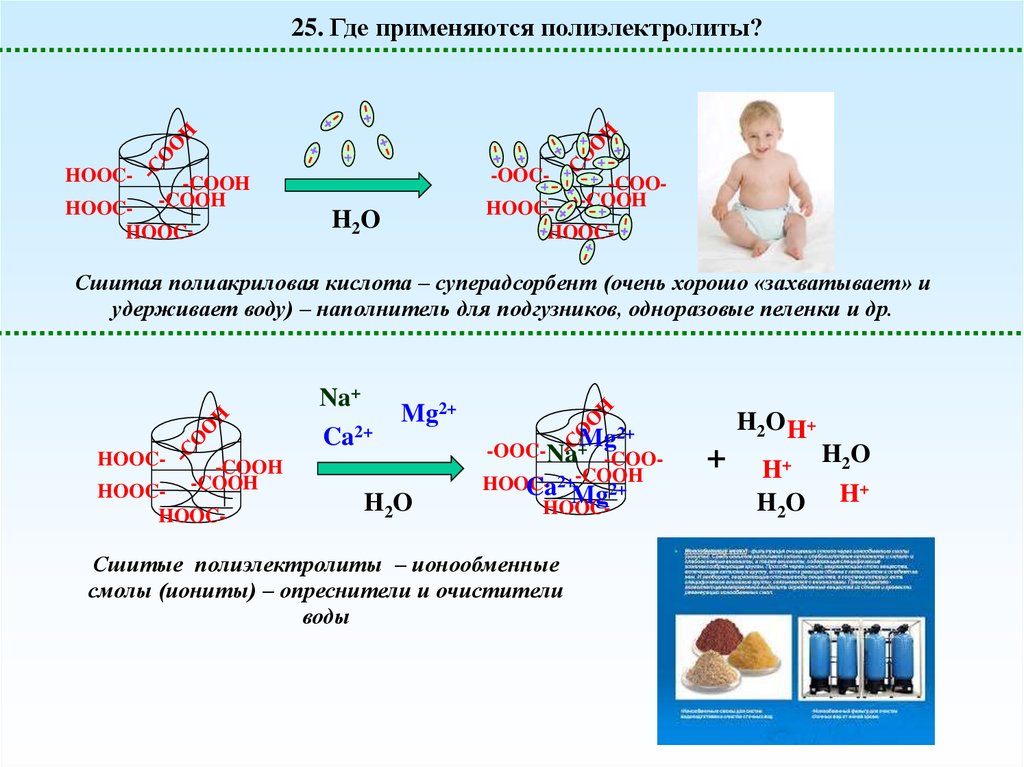
25. Где применяются полиэлектролиты?HOOC-
-COOH
-COOH
HOOCHOOC-
-OOC-
-COO-COOH
HOOCHOOC-
H2O
Сшитая полиакриловая кислота – суперадсорбент (очень хорошо «захватывает» и
удерживает воду) – наполнитель для подгузников, одноразовые пеленки и др.
Na+
Ca2+
HOOC-
-COOH
-COOH
HOOCHOOC-
Mg2+
H2O
2+
+Mg
-OOC-Na -COOHOOC- 2+-COOH
Ca Mg2+
HOOC-
Сшитые полиэлектролиты – ионообменные
смолы (иониты) – опреснители и очистители
воды
H2O H+
+
H+
H2O
H2O
H+
42.
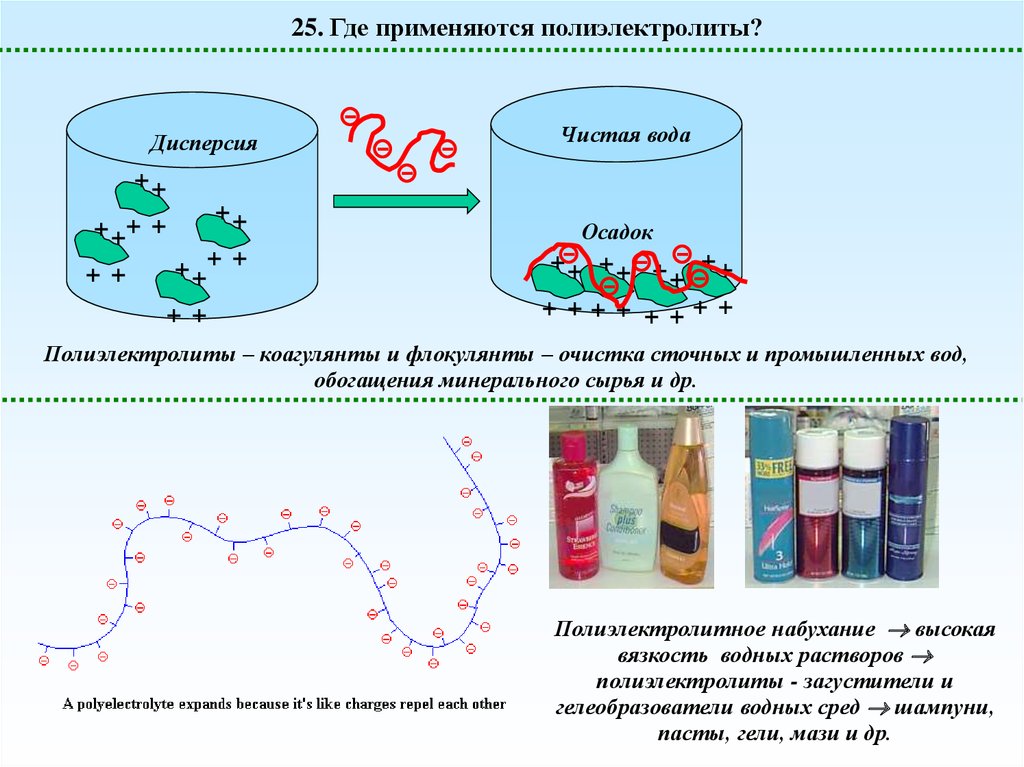
25. Где применяются полиэлектролиты?Дисперсия
Чистая вода
++
+ ++ +
+ +
++
+ ++ +
+ +
Осадок
++ ++ + ++
+
+ ++ + + ++ +
Полиэлектролиты – коагулянты и флокулянты – очистка сточных и промышленных вод,
обогащения минерального сырья и др.
Полиэлектролитное набухание высокая
вязкость водных растворов
полиэлектролиты - загустители и
гелеобразователи водных сред шампуни,
пасты, гели, мази и др.













 chemistry
chemistry