Similar presentations:
Химические элементы O2 и N2
1. Химические элементы O2 и N2
Лупанова Дарья,11 «А» класс
2. Кислород – О2
Кислород - элемент 16-й группы (по устаревшей классификации — главнойподгруппы VI группы), второго периода ПСХЭ, с атомным номером 8.
Кислород (при нормальных условиях) — газ без цвета, вкуса и запаха, молекула
которого состоит из двух атомов кислорода (формула O 2 ), в связи с чем его также
называют дикислород.
3. Получение.
В промышленности кислород получают из воздуха. Основной способ получения криогенная ректификация. Также успешно применяются впромышленности кислородные установки, работающие на основе мембранной
технологии.
Существуют и некоторые другие способы:
4. Физические свойства
При нормальных условиях кислород — это газ без цвета, вкуса и запаха.Немного тяжелее воздуха. 1 л его имеет массу 1,429 г.
Слабо растворяется в воде и спирте, но хорошо растворяется в
расплавленном серебре.
Жидкий кислород (температура кипения − 182,98 °C) — жидкое состояние кислорода,
бледно-голубая жидкость.
Твёрдый кислород (температура плавления − 218,35 °C) — твёрдое состояние
кислорода, синие кристаллы.
5. Химические свойства
Сильный окислитель, самый активный неметалл после фтора, взаимодействует совсеми элементами, кроме гелия, неона, аргона и фтора, образуя оксиды.
Кислород реагирует непосредственно со всеми простыми веществами,
кроме Au и инертных газов (He, Ne, Ar, Kr, Xe, Rn); реакции с галогенами
происходят под воздействием электрического разряда или ультрафиолета.
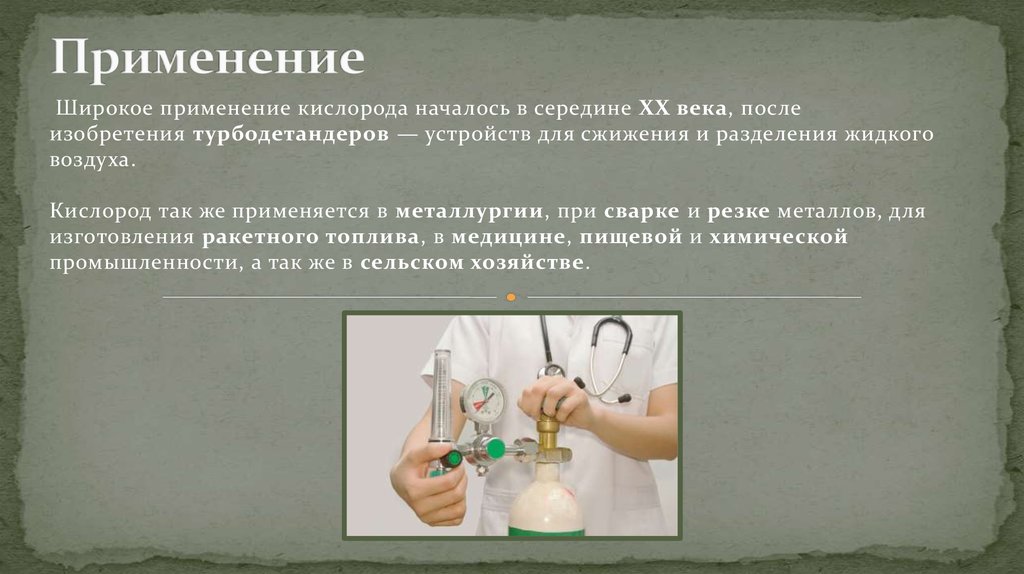
6. Применение
Широкое применение кислорода началось в середине XX века, послеизобретения турбодетандеров — устройств для сжижения и разделения жидкого
воздуха.
Кислород так же применяется в металлургии, при сварке и резке металлов, для
изготовления ракетного топлива, в медицине, пищевой и химической
промышленности, а так же в сельском хозяйстве.
7. Азот – N2
Азот - элемент 15-й группы (по устаревшей классификации — главной подгруппы Vгруппы), второго периода ПСХЭ, с атомным номером 7. Относится к пниктогенам.
Азот — двухатомный газ без цвета, вкуса и запаха. Один из самых
распространённых элементов на Земле. Весьма инертен.
8. Получение.
В лабораториях его получают по реакции разложения нитрита аммония.Наиболее чистый азот можно получить разложением азидов металлов:
Ещё один лабораторный способ получения азота — нагревание смеси дихромата
калия и сульфата аммония.
Один из лабораторных способов — пропускание аммиака над оксидом меди (II)
при температуре ~700 °C.
9. Физические свойства
При нормальных условиях азот — это бесцветный газ, не имеет запаха, мало растворимв воде.
В жидком состоянии (темп. кипения − 195,8 °C) — бесцветная, подвижная, как вода,
жидкость. Плотность жидкого азота 808 кг/м³. При контакте с воздухом поглощает из
него кислород.
При − 209,86 °C азот переходит в твёрдое состояние в виде снегоподобной массы или
больших белоснежных кристаллов. При контакте с воздухом поглощает из него
кислород, при этом плавится, образуя раствор кислорода в азоте.
10. Химические свойства
Азот в свободном состоянии существует в форме двухатомных молекул N 2 . Молекула азотакрайне прочна, способна выдержать реакцию диссоциации N 2 ↔ 2N.
Молекула азота неполярна и слабо поляризуется, силы взаимодействия между молекулами
очень слабые, поэтому в обычных условиях азот газообразен.
Вследствие большой прочности молекулы азота некоторые его соединения эндотермичны
(многие галогениды, азиды, оксиды), соединения азота термически малоустойчивы и
довольно легко разлагаются при нагревании. Именно поэтому азот на Земле находится по
большей части в свободном состоянии.
11. Применение
Жидкий азот применяется как хладагент и для криотерапии.Промышленные применения газообразного азота обусловлены его инертными
свойствами. Газообразный азот пожаро- и взрывобезопасен, препятствует
окислению, гниению.
Важной областью применения азота является его использование для дальнейшего
синтеза самых разнообразных азотосодержащих соединений.











 chemistry
chemistry








