Similar presentations:
Кислород – химический элемент и простое вещество
1. Кислород – химический элемент и простое вещество
Тема: «Кислород.Оксиды. Горение», химия,
8 класс
L/O/G/O
2. ДЕВИЗ УРОКА:
Dum spiro – spero- пока дышу, надеюсь.
3. Кислород – химический элемент
Химический знакО
Химическая формула:
О2
Относительная атомная масса:
Ar = 16
Относительная молекулярная масса:
Мr = 32
Молярная масса:
М = 32 г/ моль
Валентность:
II
4. Историческая справка
Китайцы описали кислород ещев VIII веке до нашей эры;
В
Европе
изобретатель
подводной
лодки
Корнелиус
Дреббель еще в начале XVII века
выделил кислород, выяснил его
роль в дыхании и использовал
это открытие в своей подводной
лодке.
Однако
результаты
этих
исследований
были
засекречены
из-за
их
военной направленности, и
поэтому
они
не
были
известны современникам
5. М.В. Ломоносов
В 1750 году М.В.Ломоносов на основании
своих опыт ов доказал,
чт о в сост ав воздуха
входит вещест во,
окисляющее мет алл.
6.
Карл ШеелеВ
1771
году
исследовал
и
доказал
сложный
состав воздуха;
1772 году впервые
в
истории
сумел
получить
в
лаборатории
чистый
«огневой воздух"
В
7.
8.
Джозеф ПристлиВ 1774 году описал
свойст ва
«дефлогист ированного
воздуха» (кислорода),
нагревая оксид рт ут и,
собирая солнечные лучи
при помощи
увеличит ельного ст екла
9.
Антуан ЛавуазьеИ
все-т аки главная фигура в
ист ории от крыт ии кислорода –
великий
французский
химик
Ант уан
Лоран
Лавуазье,
объяснивший
смысл
опыт ов,
проведенных
эт ими
учеными.
Включил новый элемент в список
прост ых вещест в и дал ему
название
Oxygenium
–
«рождающий кислоты»;
Выяснил роль кислорода в
процессах
горения,
обжига
мет аллов и дыхания.
10.
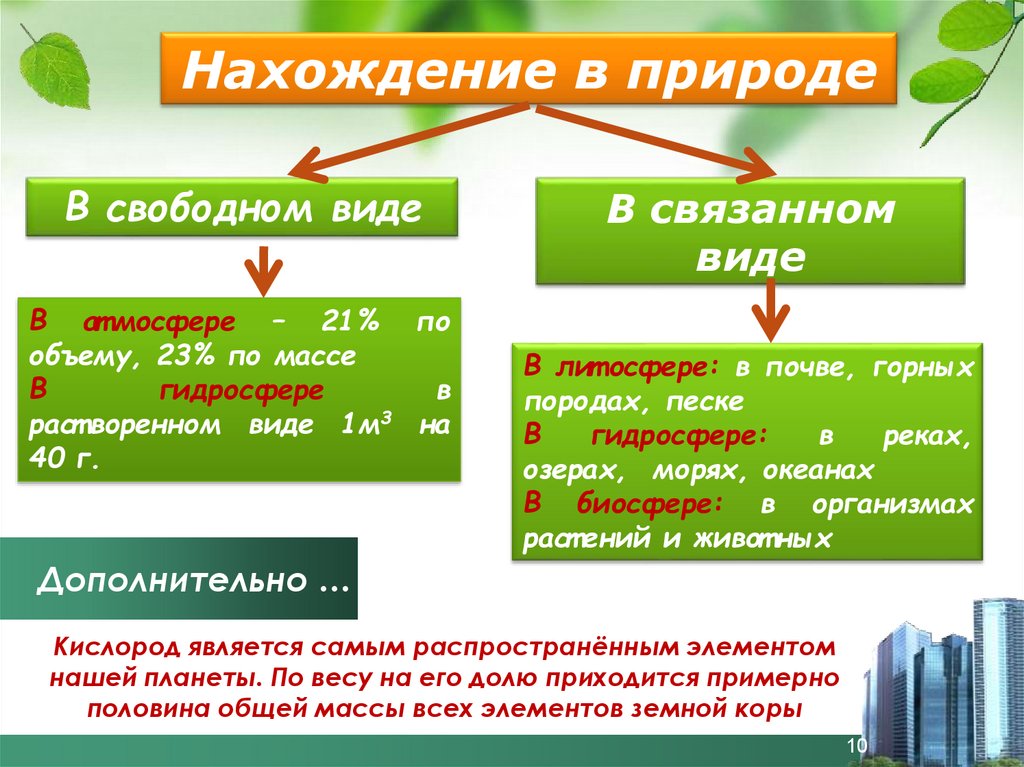
Нахождение в природеВ свободном виде
В ат мосфере – 21% по
объему, 23% по массе
В
гидросфере
в
раст воренном виде 1м3 на
40 г.
В связанном
виде
В лит осфере: в почве, горных
породах, песке
В
гидросфере:
в
реках,
озерах, морях, океанах
В биосфере: в организмах
раст ений и живот ных
Дополнительно …
Кислород является самым распространённым элементом
нашей планеты. По весу на его долю приходится примерно
половина общей массы всех элементов земной коры
10
11.
Если химического элемента наЗемле много, следовательно
этот элемент очень важен. А
важность кислорода
определяется его свойствами
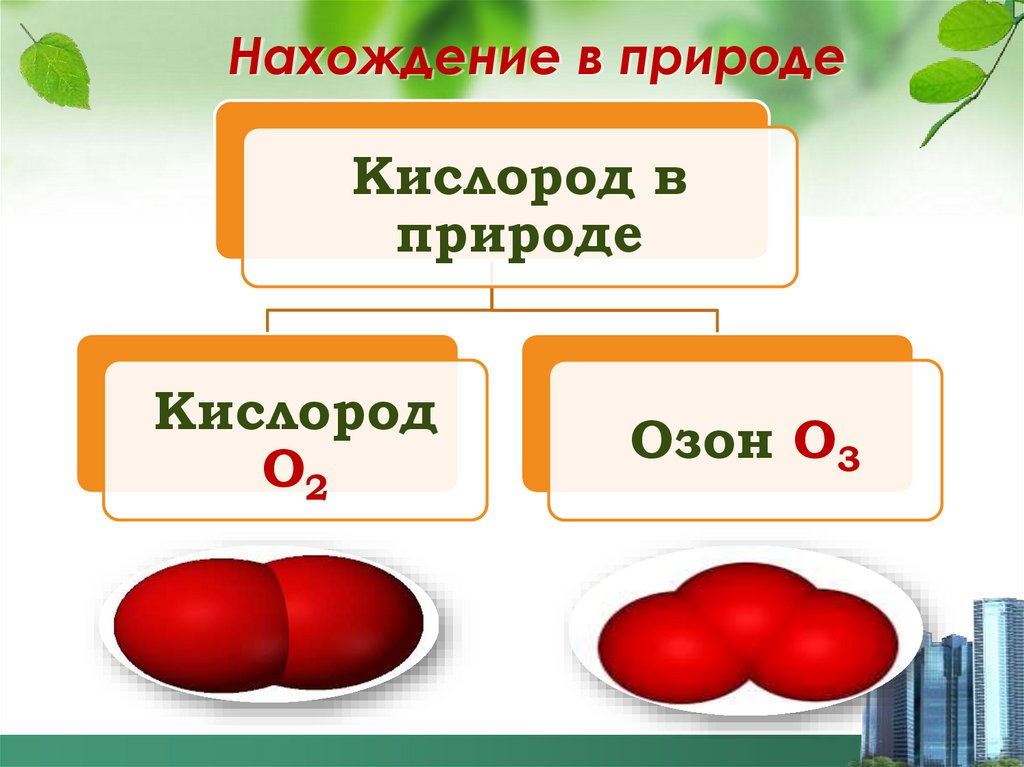
12. Нахождение в природе
Кислород вприроде
Кислород
О2
Озон О3
13.
СловарьАЛЛОТРОПИЯ-
СУЩЕСТВОВАНИЕ У ОДНОГО И
ТОГО ЖЕ ЭЛЕМЕНТА
НЕСКОЛЬКИХ ПРОСТЫХ
ВЕЩЕСТВ
14. Физические свойства
1)2)
3)
4)
5)
газ, без цвета, вкуса и
запаха;
немного тяжелее воздуха;
плохо растворяется в
воде;
жидкий кислород (темп.
кипения −182,98 °C) это
бледно-голубая жидкость;
твердый кислород (темп.
плавления −218,79 °C) —
синие кристаллы;
6) поддерживает
процессы дыхания и
горения
жидкий кислород
Твёрдый
кислород
15. Физические свойства озона
1)при обычных условиях голубой газ;
2)
тяжелее воздуха;
3)
растворимость в воде в 10 раз
выше, чем у кислорода;
4)
жидкий озон (темп. Кипения −111,9
°C) темно-синего цвета;
5)
твердый озон (темп. плавления
−251,4°C)
—
тёмно-синие,
практически чёрные кристаллы;
6)
запах — резкий,
«металлический».
специфический
Озон (от др.-греч. ὄζω —
пахну)
16. Сравнение свойств кислорода и озона
ЭлементыКислород
Озон
сравнения
Химическая формула
Молекулярная масса
Агрегатное состояние
О2
32
газ
О3
48
газ
Цвет
без цвет а
голубоват ый цвет
Запах
без запаха
Запах свежест и
Плотность
Температура кипения
Химическая
активность
1,43 г/л
- 183° С
акт ивен
2,14 г/л
- 112° С
очень акт ивен
17. Значение кислорода в жизни живой природы
Человек в сутки вдыхаетпримерно
750
литров
кислорода.
Основные
поставщики
кислорода - тропические леса
и фитопланктон океана.
Ежегодно
в
результате
фотосинтеза в атмосферу
Земли поступает 3000 млрд.
тонн кислорода.
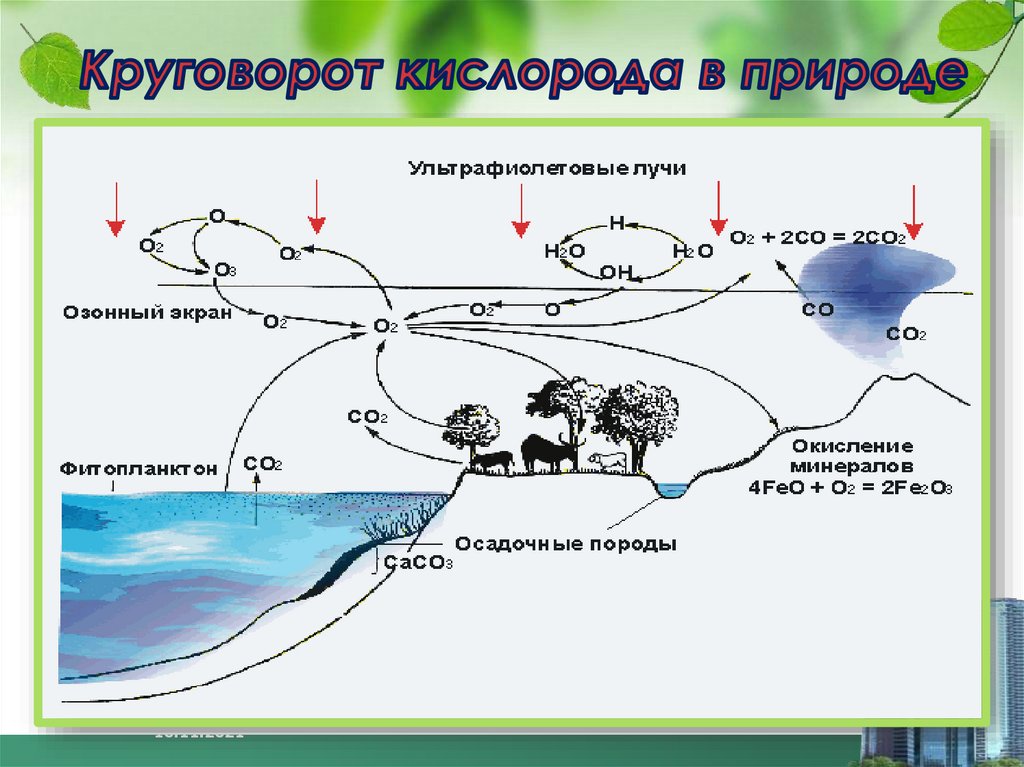
18. Озон в природе
Озон образуется в атмосфере навысоте 10-30 км при действием УФ
излучения на воздух и при грозовых
разрядах.
Содержание озона в воздухе:
Летом- до 7*10-9% (по объему),
зимой- до 2*10-10%
В атмосфере максимальная его
концентрация на высоте 20-25 км ,
где озон образует слой,
защищающий Землю от УФ- лучей.
19.
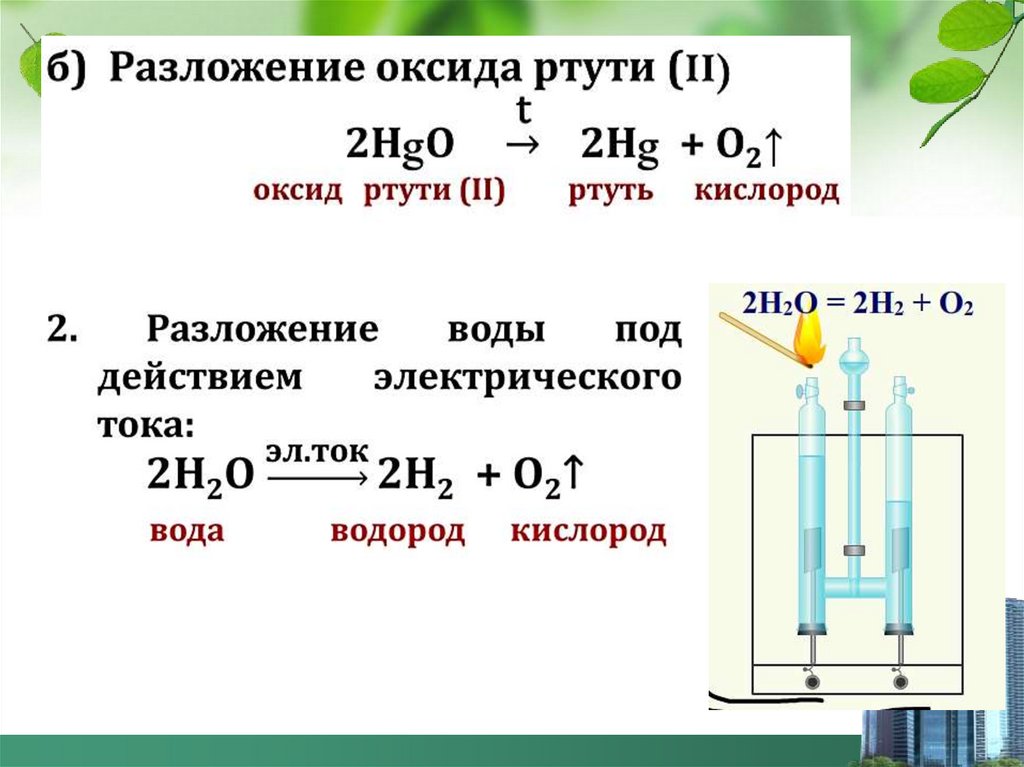
Получениеи собирание кислорода в лаборатории
перманганат
калия
манганат
калия
оксид
марганца
(IV)
кислород
20.
21.
22. Распознавание кислорода: тлеющая лучинка вспыхивает.
23. Способы собирания кислорода:
Метод вытесненияМетод вытеснения воды,
воздуха, т.к. немного
т.к. кислород
тяжелее воздуха,
малорастворим в воде
собирается на дне
сосуда
Распознавание:
тлеющая лучинка
вспыхивает
24. Химические свойства кислорода
25.
Горение железа.Fe + О2 → Fe2O3
уравнять
26.
Горение фосфора.Р + О2 → Р2O5
уравнять
27.
Горение серы.S + О2 → SO2 уравнять
28.
Химическое взаимодействиевещества с кислородом
называется реакцией
окисления.
Реакции окисления,
сопровождающиеся
выделением теплоты и
света, называются
реакциями горения.
Реакции горения веществ —
это примеры быстрого
окисления, а вот гниение,
ржавление и т.п. — это
примеры медленного
окисления веществ
кислородом
29.
16.11.202130. Применение
1. Металлургия: производст во ст али,сжигание т оплива и др.
31. Применение
2. Сварка ирезка
металлов
32. Применение
3.Ракетное топливо: в качест ве окислит еля
для ракет ного т оплива применяет ся жидкий
кислород, пероксид водорода, азот ная кислот а и
другие богат ые кислородом соединения.
33. Применение
4.Медицина:
кислород использует ся для
обогащения дыхат ельных газовых смесей при
нарушении
дыхания,
для
лечения
аст мы,
профилакт ики гипоксии в виде кислородных
кокт ейлей, кислородных подушек.
34. Применение
5.пищевой
промышленности
:
в
пищевой
промышленност и
кислород
зарегист рирован
в
качест ве
пищевой
добавки
E948, как пропеллент
(газ,
находящийся под давлением, выт еснит ель)
и упаковочный газ.
35. Вычеркните неверное суждение
Сложное вещество.При обычных условиях бесцветный газ.
В природе встречается только в составе
сложных веществ.
Газ, имеющий запах.
Поддерживает горение.
Легче воздуха.
Входит в состав минералов, горных
пород, песка, воды.
При обычных условиях жидкость.
Входит в состав воздуха.
Образуется в природе в процессе
фотосинтеза.
36. Дописать и уравнить:
1. Ca + O2 →2. H2 + O2 →
3. Si
+ O2 →
4. N2 + O2 →
5. С2H6 + O2 →
37. Угадать пропущенное вещество
… + O2 → As2O3Li + O2 →…
Mg + … → MgO
… + O2 → NO
Be + O2 → …
38. Итог (рассшифруйте слова-основное предназначение кислорода.Ключ к разгадке- по порядковый номер элемента) :
O7 20 45 63 28 53 63
53
105 Ы 108 13 28 53 63


































 chemistry
chemistry








