Similar presentations:
Азот. Химические свойства
1. Азот
*Азот2.
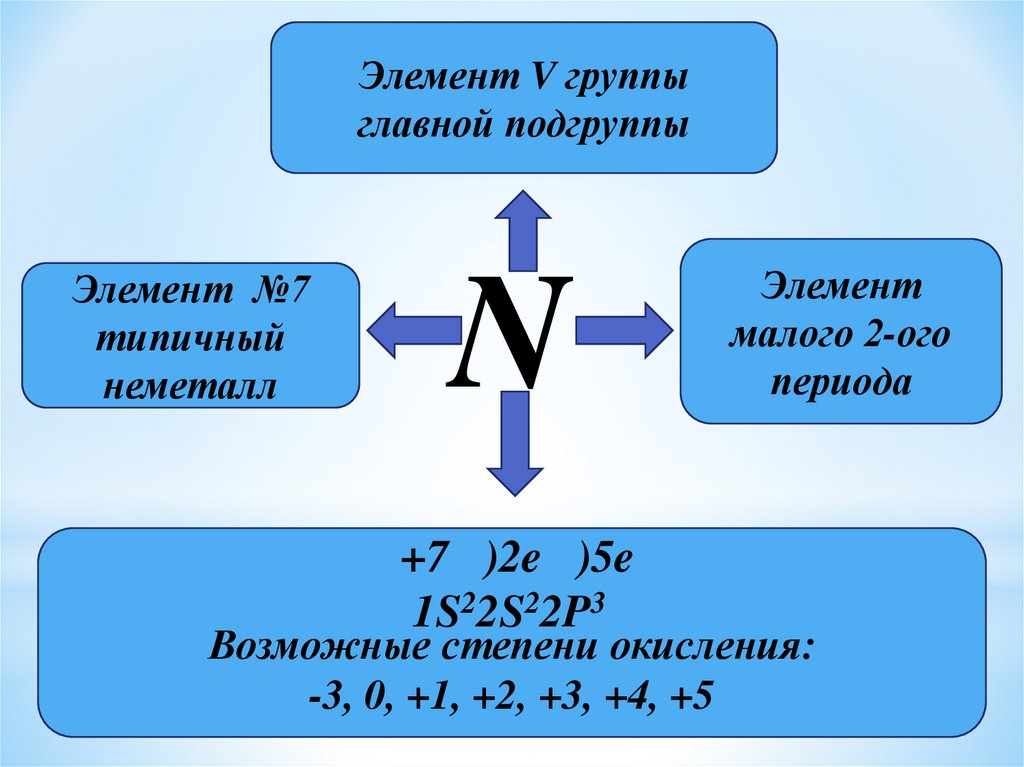
Элемент V группыглавной подгруппы
Элемент №7
типичный
неметалл
N
+7 )2e )5e
1S22S22P3
Элемент
малого 2-ого
периода
Возможные степени окисления:
-3, 0, +1, +2, +3, +4, +5
3. Историческая справка
** В 1772 году выделен из
воздуха Даниэлем
Резерфордом.
* Не поддерживал горение,
дыхание.
* В 1787 году А. Лавуазье
назвал элемент.
* «Азоое» - безжизненный.
* «Нитрогениум» рождающий селитру.
4. Химический элемент.
* Природные изотопы:* 14N (99 ,6%)
* 15N (0,04%)
* Входит в состав:
* NaNO3 натриевой
(чилийской) селитры,
белков и других
органических
веществ.
*
5. Простое вещество
** Азот - газ, без цвета, без
запаха, легче воздуха, плохо
растворим в воде.
* t(с.)=-195,8; t(зам.)=-210.
* Входит в состав воздуха.
N2(78%)
N2
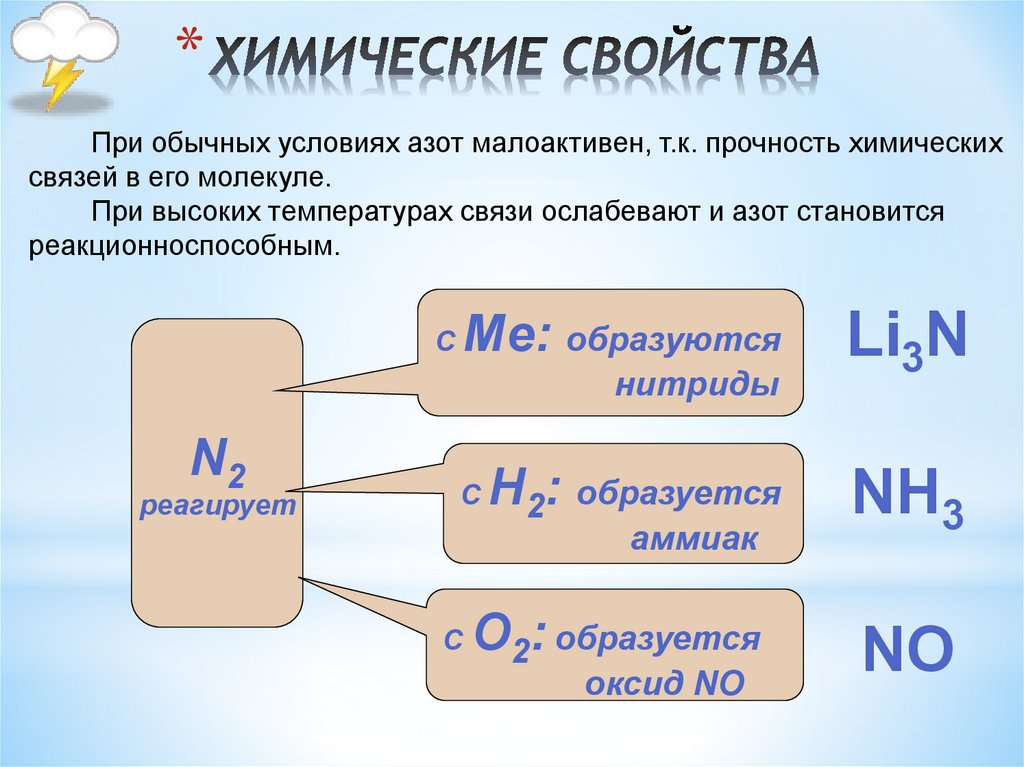
6. ХИМИЧЕСКИЕ СВОЙСТВА
*При обычных условиях азот малоактивен, т.к. прочность химических
связей в его молекуле.
При высоких температурах связи ослабевают и азот становится
реакционноспособным.
Ме: образуются
С
нитриды
N2
реагирует
Н2: образуется
NH3
О2: образуется
NO
С
аммиак
С
Li3N
оксид NО
7. Применение
** Для охлаждения.
* Для создания
инертной среды.
* Получение
удобрений.
8.
9.
Аммиак:состав,
строение,
свойства,
применение
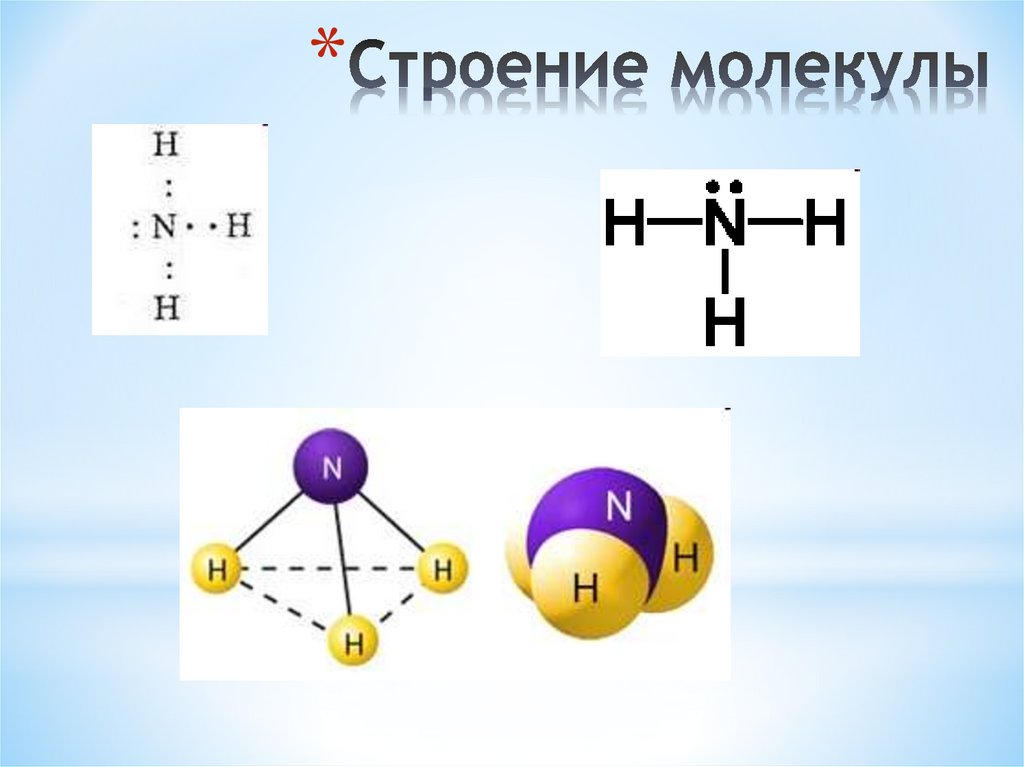
10. Строение молекулы
*11. Физические свойства (при н.у.)
** бесцветный газ
*с резким характерным запахом (запах
нашатырного спирта)
*легче воздуха
*хорошо растворяется в воде
*температура плавления -77.73 °C
*Температура кипения
-33.34 °C
*Токсичен!
12.
Способы получения аммиакаВ промышленности:
проводится при
N2 + 3H2
2NH3 Реакция
нагревании, под давлением,
в присутствии катализатора.
В лаборатории:
-Действием щелочей на соли аммония:
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O
- Гидролиз нитридов:
Mg3N2 + 6H2O = 3Mg(OH)2 + 2NH3
13. Химические свойства
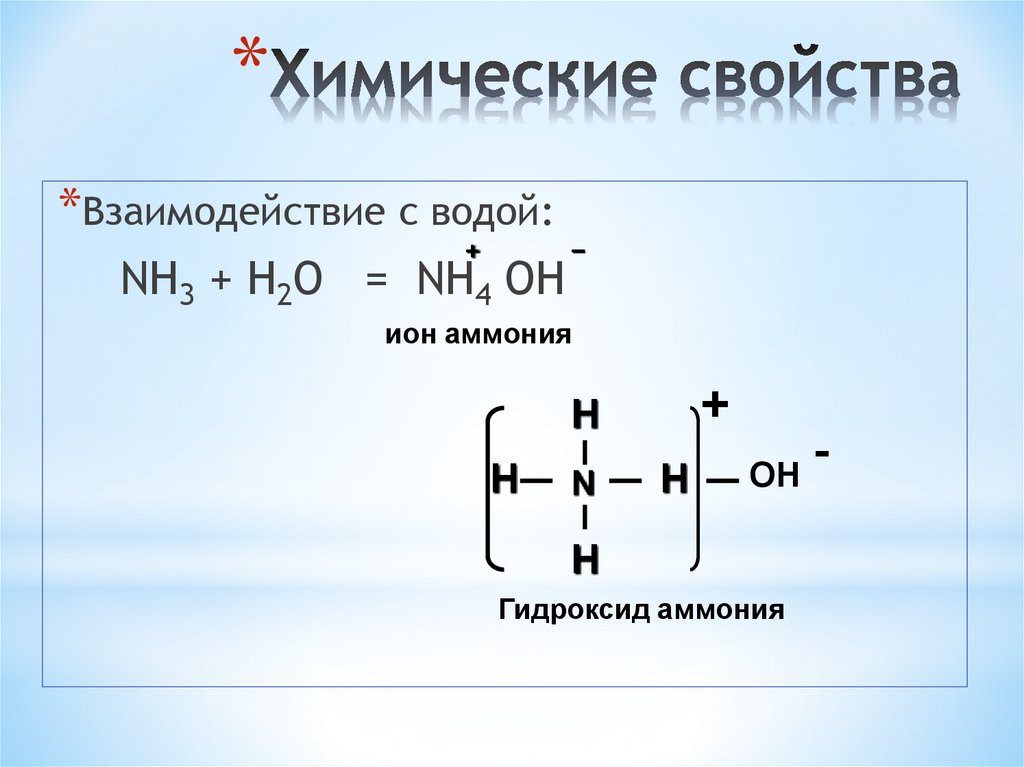
**Взаимодействие с водой:
+
NH3 + Н2O = NH4 ОН
−
ион аммония
+
H
H
N
H
ОН
H
Гидроксид аммония
14. Взаимодействие с кислотами
*4NH3 + 3O 2 = 2N2 + 6H2O
4NH3 + 5O 2 = 4NО + 6H2O
15.
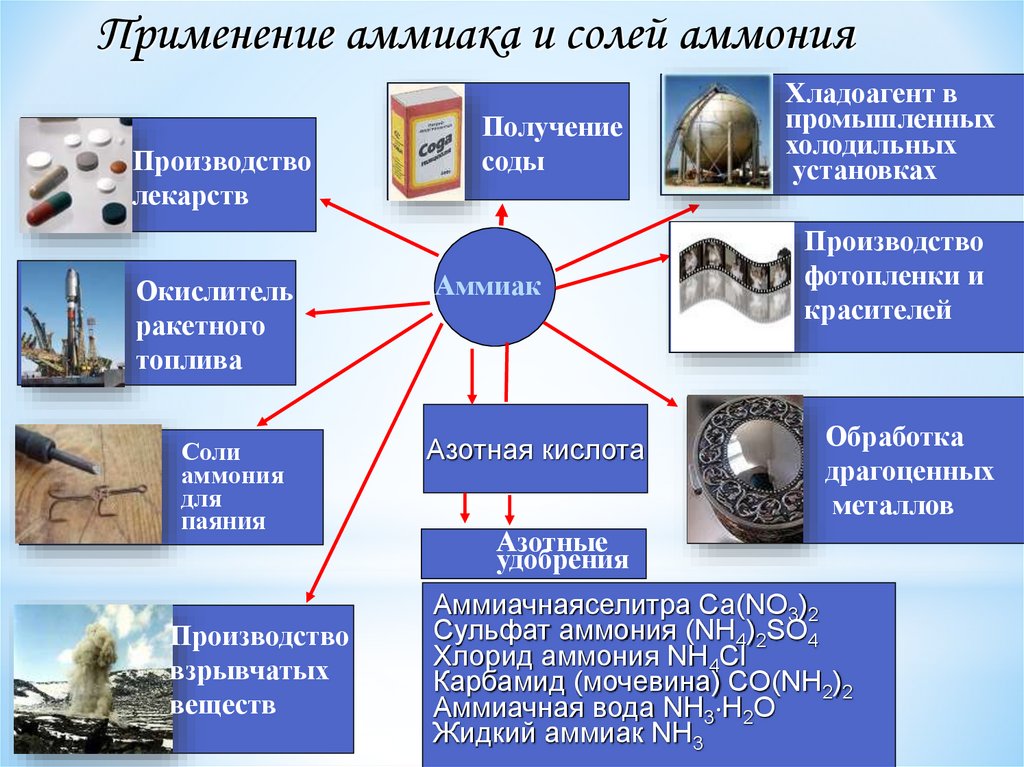
Применение аммиака и солей аммонияПроизводство
лекарств
Окислитель
ракетного
топлива
Соли
аммония
для
паяния
Производство
взрывчатых
веществ
Получение
соды
Аммиак
Азотная кислота
Хладоагент в
промышленных
холодильных
установках
Производство
фотопленки и
красителей
Обработка
драгоценных
металлов
Азотные
удобрения
Аммиачнаяселитра Ca(NO3)2
Сульфат аммония (NH4)2SO4
Хлорид аммония NH4Cl
Карбамид (мочевина) CO(NH2)2
Аммиачная вода NH3 H2O
Жидкий аммиак NH3
16.
Домашнее задание:§ 16-17
17.
* 1. Число электронов в атоме азота* 1) 7
3) 9
* 2) 14 4) 12
*
* 2. Число энергетических уровней в атоме азота
* 1) 3
3) 5
* 2) 2
4) 7
*
* 3.Формула высшего оксида азота
* 1) N2O3 3) N2O
* 2) N2O5
2) NO2
18.
* 4. Степень окисления азота в соединениях N2O5, NH3соответственно равна
* 1) +2 и -3
3) +5 и -3
* 2) +5 и +3
4) -5 и +3
*
* 5. Тип химической связи в молекуле азота
* 1) ковалентная неполярная
* 2) ковалентная полярная
* 3) ионная
* 4) металлическая
*
19.
* 6 Верны ли следующие суждения о свойствах азота?* А. Азот бесцветный газ без вкуса и запаха.
* Б. Азот тяжелее воздуха
* 1) верно только А
3) верны оба суждения
* 2) верно только Б
4) оба суждения неверны
* 7. Верны ли следующие суждения о свойствах азота?
* А. В соединениях с водородом и металлами азот
проявляет степень окисления -3
* Б . В соединениях с кислородом является
восстановителем.
* 1) верно только А
3) верны оба суждения
* 2) верно только Б
4) оба суждения неверны
*













 chemistry
chemistry








