Similar presentations:
Аммиак. Физические и химические свойства
1. Аммиак.
2.
Вариант № 1Вариант № 2
1) Напишите формулы
веществ:
Сульфат железа (II), фторид
кальция, нитрат хрома (III),
сульфид магния, оксид
свинца(II).
2) Назовите вещества, к
какому классу соединений они
относятся?
CH3COONa, K2O, H2SiO3, KOH,
Ni3(PO4)2.
3) Напишите уравнения
реакций:
1) Напишите формулы
веществ:
Сульфит меди, нитрат железа
(III), хлорид свинца (IV),
бромид алюминия,
гидроксид никеля.
2) Назовите вещества, к
какому классу соединений
они относятся?
H2CO3, Mg(OH)2, Na2SiO3,
FeCl3, CaO.
3) Напишите уравнения
реакций:
S → X→ H2SO3
SO3 → X→ K2SO4
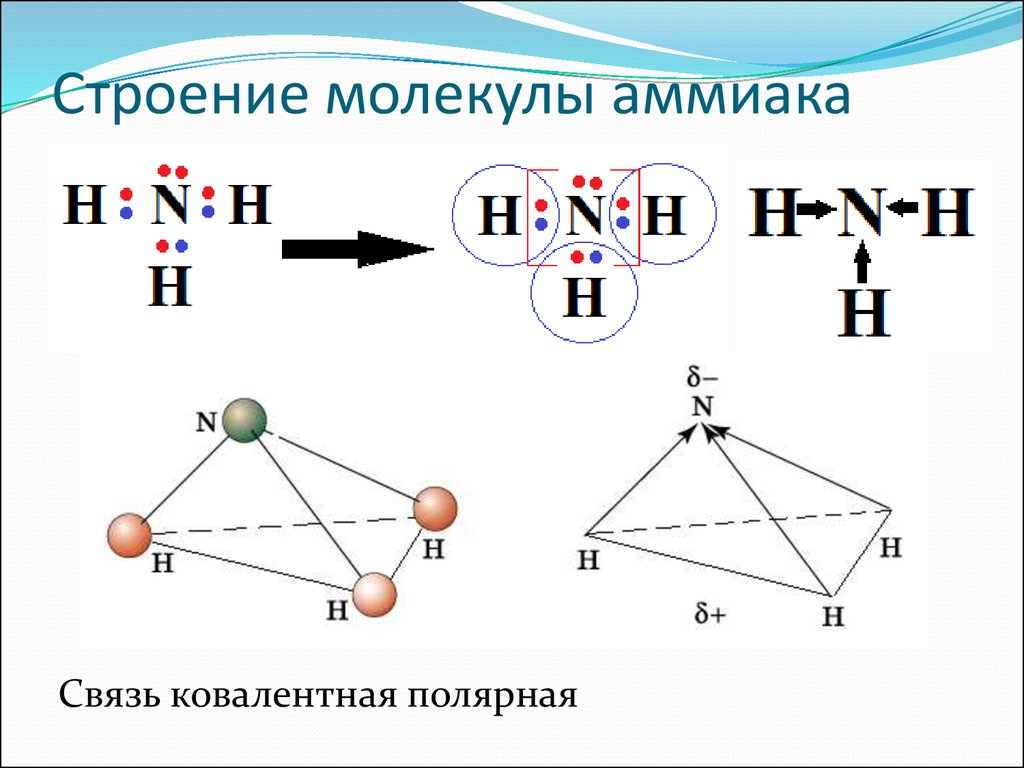
3. Строение молекулы аммиака NH3:
Связь ковалентная полярная4. Водородная связь –
Это химическая связь между атомамиводорода одной молекулы и атомами очень
электроотрицательных элементов (F, O ,N),
имеющих неподеленные электронные пары,
другой молекулы.
5. Физические свойства аммиака:
При нормальных условиях — бесцветныйгаз с резким характерным запахом (запах
нашатырного спирта), почти вдвое легче
воздуха, ядовит. Растворимость NH3 в
воде чрезвычайно велика — около 1200
объёмов (при 0 °C) или 700 объёмов (при
20 °C) в объёме воды.
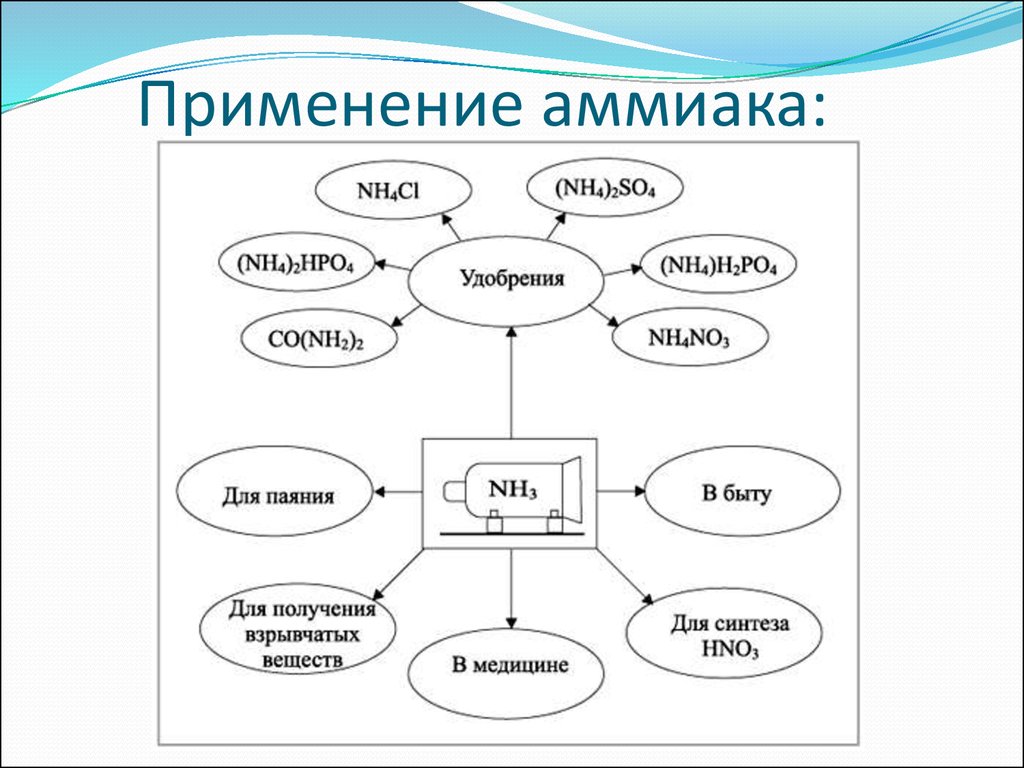
6.
ПО
Л
У
Ч
Е
Н
И
Е
А
М
М
И
А
К
А
7. Химические свойства аммиака:
Реакции с изменением степени окисления атомаазота (реакции окисления) NH3 – сильный
восстановитель. N-3 → N0 → N+2
1. Горение аммиака (при нагревании)
4NH3 + 3O2 → 2N2 + 6H20
2. Каталитическое окисление аммиака
(катализатор Pt – Rh, температура)
4NH3 + 5O2 → 4NO + 6H2O
3. с оксидами металлов
2 NH3 + 3CuO = 3Cu + N2 + 3 H2O
8.
4. с сильными окислителями2NH3 + 3Cl2 = N2 + 6HCl (при нагревании)
5. аммиак – непрочное соединение, при
нагревании разлагается
2NH3↔ N2 + 3H2
6. Реакции без изменения степени
окисления атома азота (присоединение Образование иона
аммония NH4+ по донорно-акцепторному
механизму)
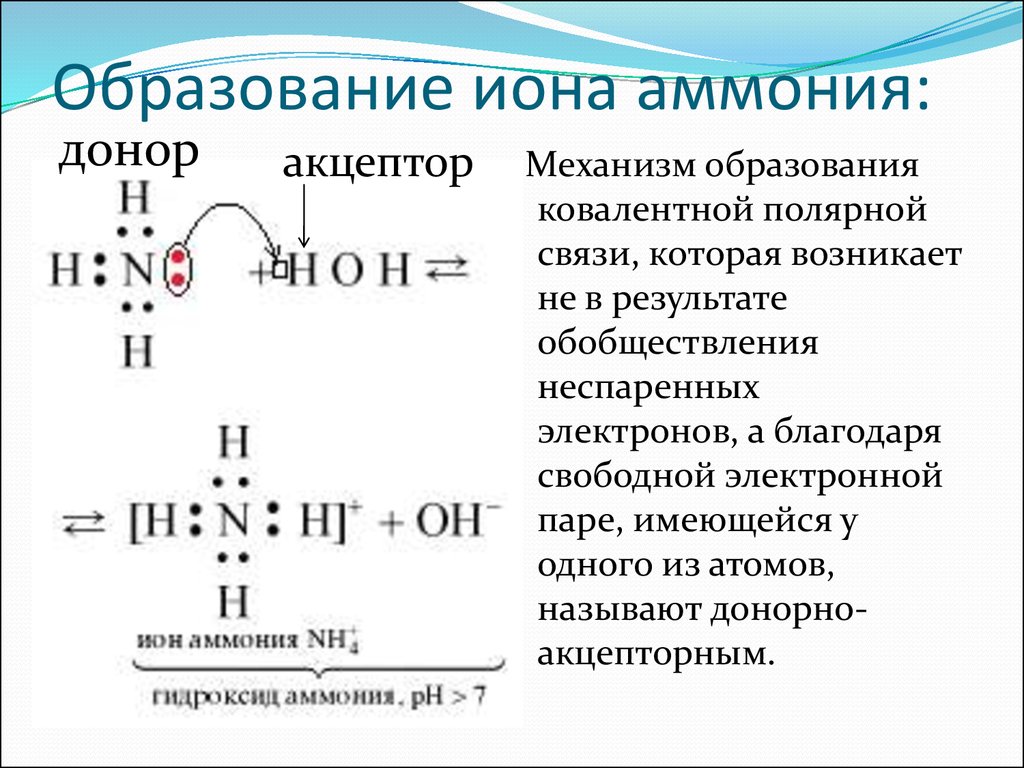
9. Образование иона аммония:
доноракцептор
Механизм образования
ковалентной полярной
связи, которая возникает
не в результате
обобществления
неспаренных
электронов, а благодаря
свободной электронной
паре, имеющейся у
одного из атомов,
называют донорноакцепторным.








 chemistry
chemistry








