Similar presentations:
Аммиак. Физические и химические свойства. Получение, применение
1. Тема урока: Аммиак. Физические и химические свойства. Получение, применение
«Можно не любить химию,но прожить без неё сегодня и завтра нельзя»
О. М. Нефёдов
Тема урока: Аммиак.
Физические и химические
свойства. Получение,
применение
2. История открытия аммиака
Посредине ливийской пустыни стоялхрам, посвященный богу Амон Ра. В
древности арабские алхимики получали
из оазиса Амон, находившегося около
храма,
бесцветные
кристаллы.
Растирали в ступках, нагревали – и
получали едкий газ. Сначала его
именовали
аммониак,
а
потом
сократили название до «аммиак».
В 18 веке аммиак был
получен английским
химиком Джозефом
Пристли.
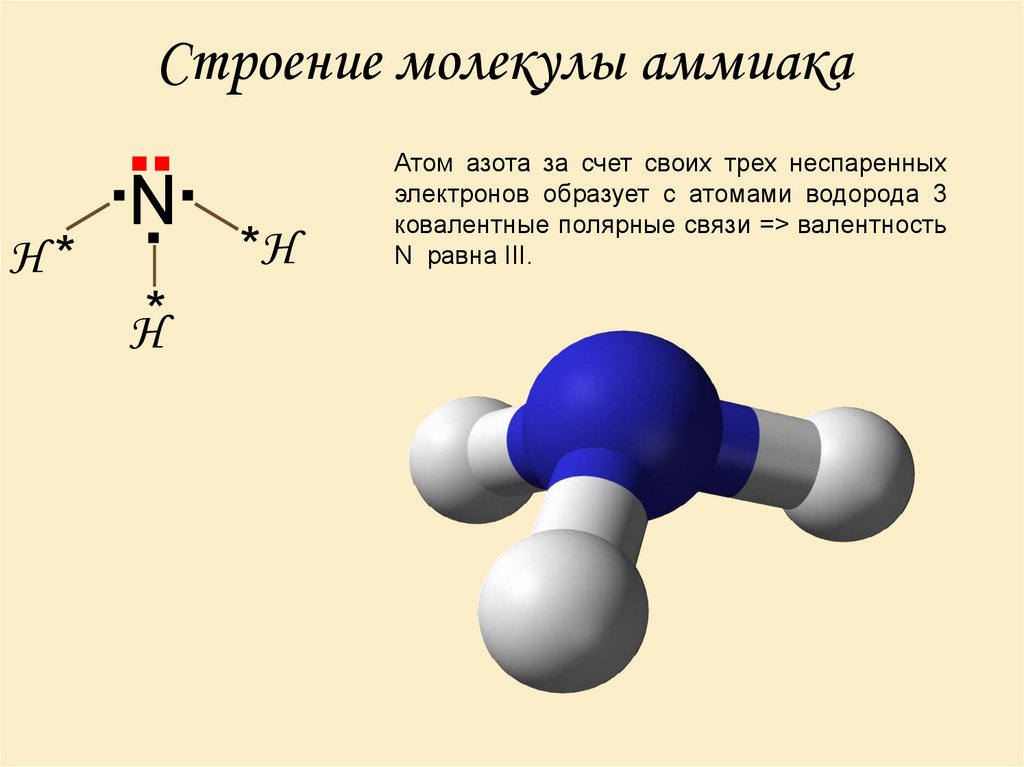
3. Строение молекулы аммиака
▪▪▪ ▪
Н*
N▪
│
*
Н
*Н
Атом азота за счет своих трех неспаренных
электронов образует с атомами водорода 3
ковалентные полярные связи => валентность
N равна ІІІ.
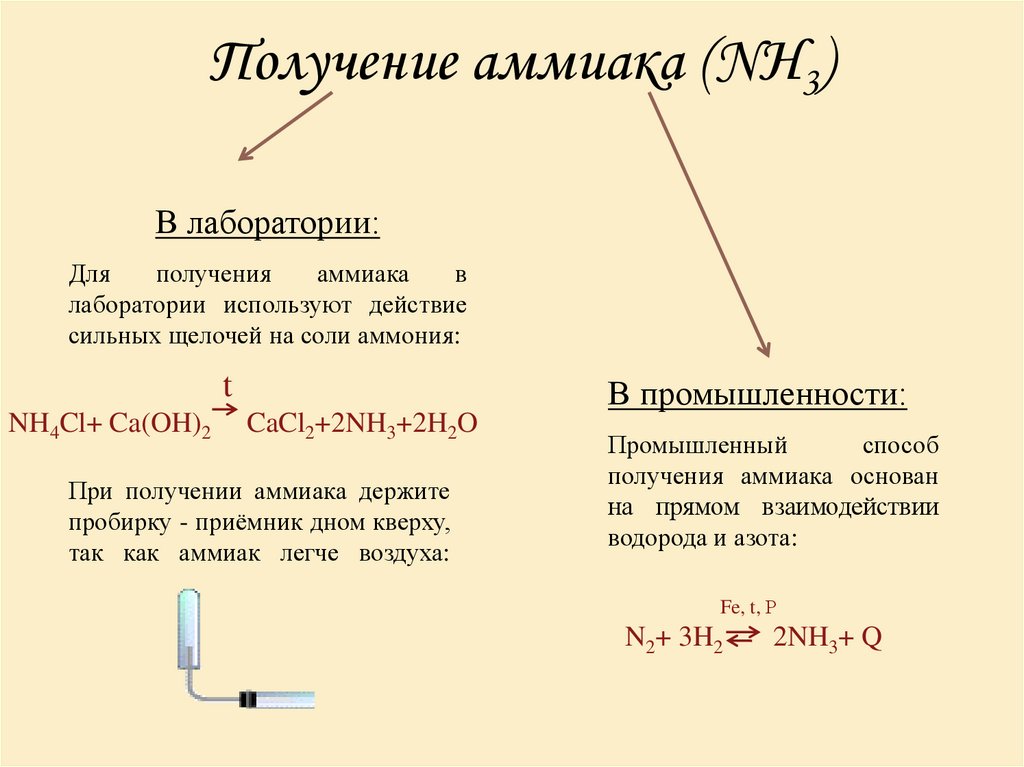
4. Получение аммиака (NH3)
В лаборатории:Для
получения
аммиака
в
лаборатории используют действие
сильных щелочей на соли аммония:
t
NH4Cl+ Ca(OH)2
В промышленности:
CaCl2+2NH3+2H2O
При получении аммиака держите
пробирку - приёмник дном кверху,
так как аммиак легче воздуха:
Промышленный
способ
получения аммиака основан
на прямом взаимодействии
водорода и азота:
Fe, t, Р
N2+ 3H2
2NH3+ Q
5. Физические свойства аммиака NH3
NH3 аммиак – бесцветный газ с резким запахом, почти в два разалегче воздуха, очень хорошо растворим в воде.
При обычных условиях в одном объеме воды растворяется около 700
объемов аммиака.
При повышенном давлении аммиак сжижается.
Жидкий аммиак имеет большую теплоту испарения. Поэтому его
применяют в холодильных устройствах.
ЯДОВИТ!
6. Химические свойства аммиака
Реакции, идущиес изменением степени окисления азота
NH3 – сильный восстановитель
1. Аммиак – непрочное соединение,
при нагревании разлагается:
2. Аммиак горит в кислороде:
NH3 + O2 → N2 + H2O
3. Окисление аммиака кислородом
воздуха
в
присутствии
катализатора:
Pt, Rh
1. Аммиак реагирует с водой:
NH3 + H2O NH4OH NH4+ + OH−
гидроксид аммония
2NH3 N2 + 3H2
NH3 + O2
без изменения степени окисления азота
NH3 – слабое основание
NО + H2O
2. Аммиак реагирует с кислотами:
NH3 + HCl → NH4Cl
хлорид аммония
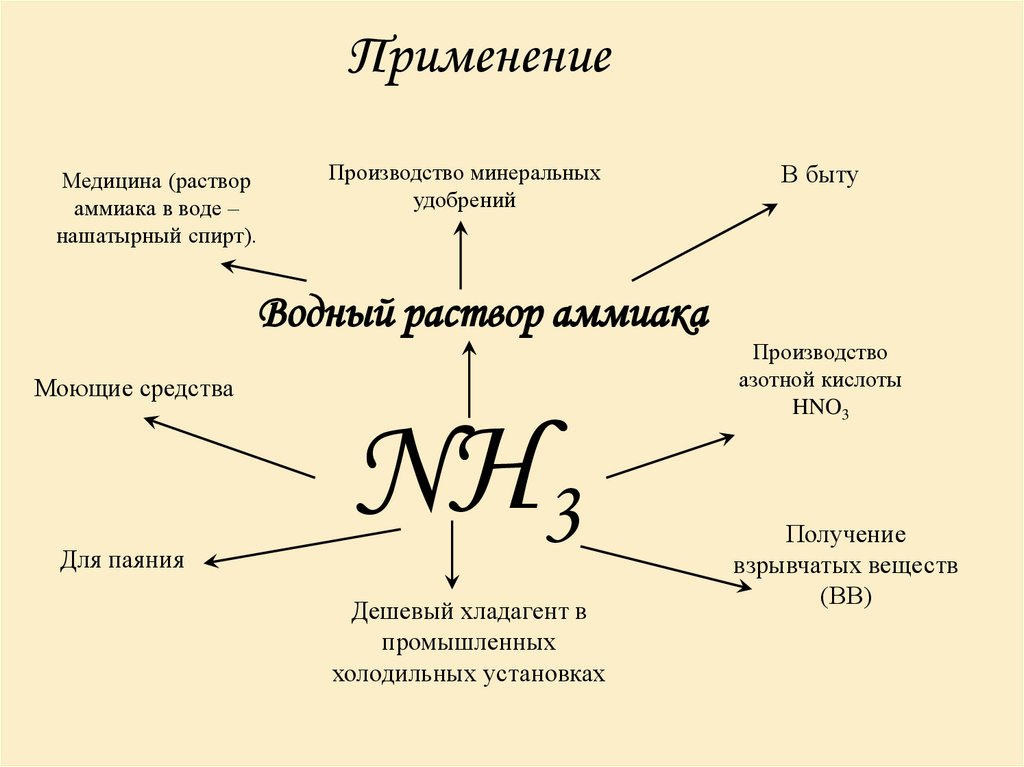
7. Применение
Медицина (раствораммиака в воде –
нашатырный спирт).
Производство минеральных
удобрений
В быту
Водный раствор аммиака
Моющие средства
Для паяния
NH3
Дешевый хладагент в
промышленных
холодильных установках
Производство
азотной кислоты
HNO3
Получение
взрывчатых веществ
(ВВ)
8. Домашнее задание
1. Учебник: § 19 (с. 47), вопросы 8, 9, 12 (с.55)
2. Решить задачи:
а) Какая масса хлорида аммония получится
при взаимодействии 3 моль аммиака с
соляной кислотой?
б) Какой объем кислорода потребуется для
сжигания 34 г. аммиака?





 chemistry
chemistry








