Similar presentations:
Амины. Номенклатура аминов
1. Амины
2. Определение
• Ами́ны — органические соединения, являющиеся производнымиаммиака, в молекуле которого один, два или три атома водорода
замещены на углеводородные радикалы .
• Общая формула R – ( NH 2 )n
3. Номенклатура
1) Название радикала + амин• CH 3 – NH 2 – Метиламин
• CH 3 – NH – C2H5 – Метилэтиламин
2) Амино- + название углеводорода
CH 3 – CH – CH 3
NH 2
2 – Аминопропан
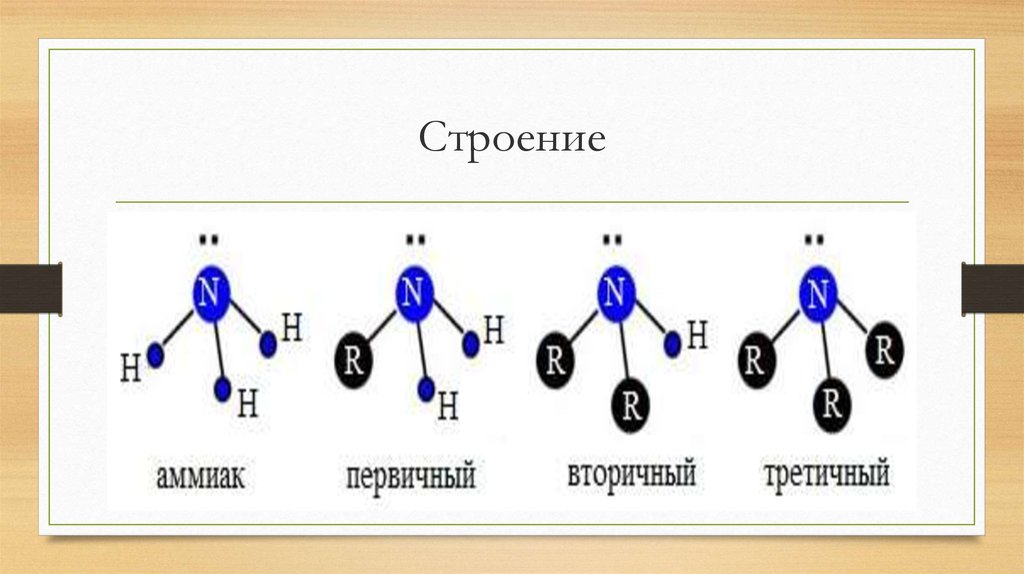
4. Строение
5. Классификация
По числу замещённых атомов H
Первичные CH 3 – NH 2 – Метиламин
Вторичные CH 3 CH 2 – NH – CH 2 – CH 3 – Диэтиламин
Третичный H 3 CH 2 C – N – CH 2 CH 3 – Триэтиламин
CH 2 H 3
6. Классификация
• По типу R• Предельные C2H5 – NH2 – Этиламин
• Ароматические C6H5 – NH 2 – Фениламин ( анилин )
7. Структурная изомерия
а)изомерия углеродного скелета:
8. изомерия положения функциональной группы:
9. межклассовая изомерия
10. Физические свойства аминов
• Простейшие амины (метиламин, диметиламин, триметиламин) —газообразные вещества. Остальные низшие амины — жидкости, которые
хорошо растворяются в воде. Имеют характерный запах, напоминающий
запах аммиака.
• Первичные и вторичные амины способны образовывать водородные связи.
Это приводит к заметному повышению их температур кипения по сравнению
с соединениями, имеющими ту же молекулярную массу, но не способными
образовывать водородные связи.
• Анилин — маслянистая жидкость, ограниченно растворимая в воде, кипящая
при температуре 184 °С.
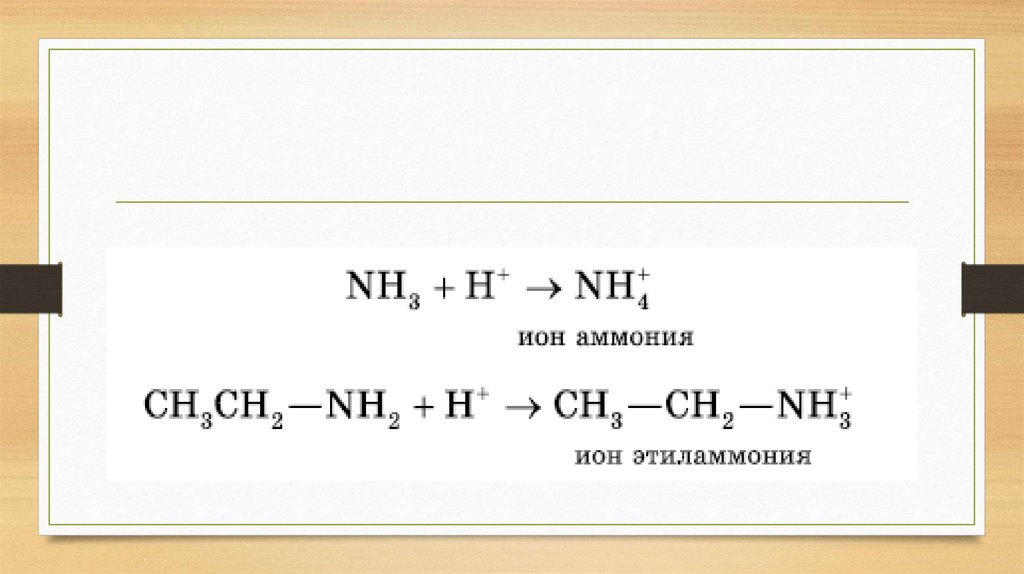
11. Химические свойства аминов
• Химические свойства аминов определяются в основном наличием уатома азота неподеленной электронной пары.
• Амины как основания. Атом азота аминогруппы, подобно атому азота
в молекуле аммиака, за счет неподеленной пары электронов может
образовывать ковалентную связь по донорно-акцепторному механизму,
выступая в роли донора. В связи с этим амины, как и аммиак, способны
присоединять катион водорода, т. е. выступать в роли основания:
12.
13. Реакция амионов с водой приводит к образованию гидроксид-ионов
Реакция амионов с водой приводит кобразованию гидроксид-ионов
14. Реакция с кислотами
15. Горение амионов
16. Получение
Синтез из спиртов.Пропусканием паров спирта и
аммиака при 400 0С над
катализатором получают
смесь первичных, вторичных
и третичных спиртов:
17. Реакция Гофмана.
Действие аммиака нагалогенопроизводные
позволяет получить смесь
солей различных аминов:
18. Реакция Зинина
Нитросоединениявосстанавливаются
водородом в
присутствии
катализатора:
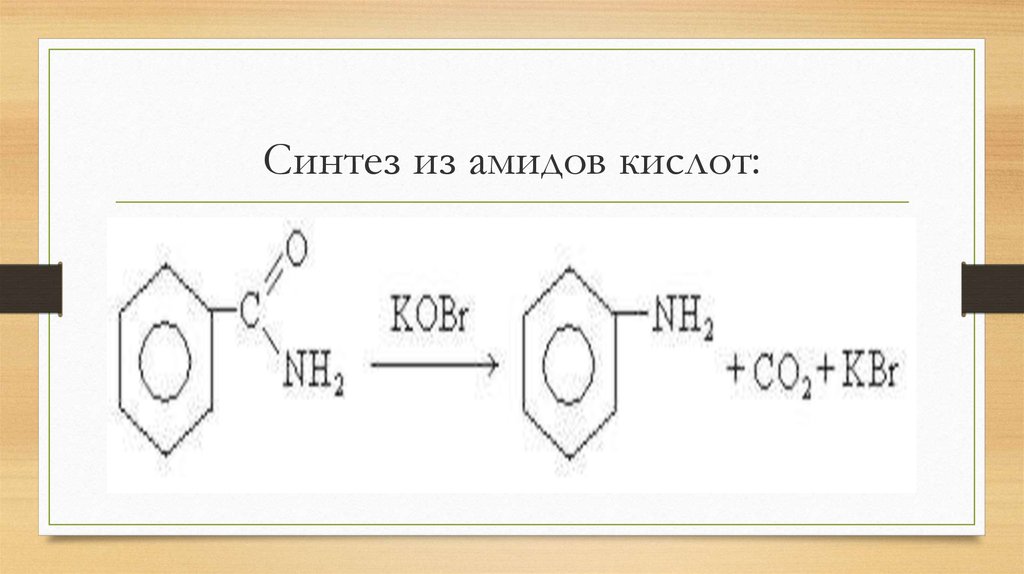
19. Синтез из амидов кислот:
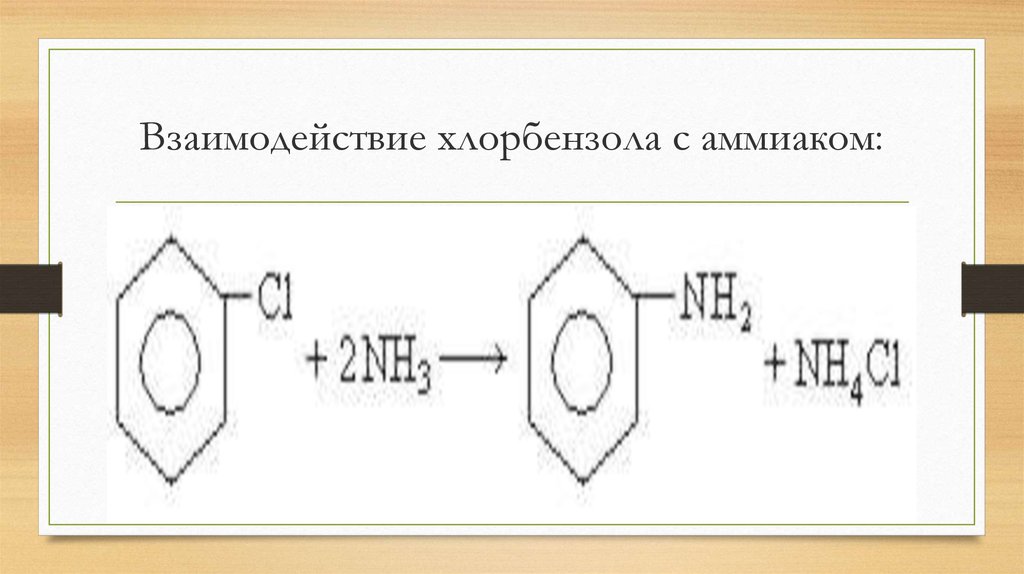
20. Взаимодействие хлорбензола с аммиаком:
21. Применение аминов
• Амины широко применяются для получения лекарств, полимерныхматериалов. Анилин — важнейшее соединение данного класса, которое
используют для производства анилиновых красителей, лекарств
(сульфаниламидных препаратов), полимерных материалов
(анилинформальдегидных смол).

















 chemistry
chemistry








