Similar presentations:
Амины
1. «Амины».
ГБГАПОУ ВО «Владимирский политехнический колледж»
«Амины».
Азотосодержащие
органические соединения
2. Что такое амины?
Амины — это органическиесоединения*, являющиеся
производными аммиака,
в молекуле которого один, два или
три атома водорода замещены на
углеводородные радикалы.
*Органические соединения - это класс химических соединений, в состав которых
входит углерод (за исключением карбидов, угольной
кислоты, карбонатов, оксидов углерода, тиоцианатов и цианидов).
3.
Простейший представитель –метиламин :
4.
По числу замещённых атомов водорода различаютсоответственно первичные (замещен один атом водорода).
- первичныйамин
Вторичные (замещены два атома водорода из трех).
- вторичныйамин
И третичные (замещены три атома водорода из трех) амины.
- третичныйамин
5.
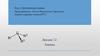
По характеру органической группы, связанной сазотом, различают алифатические CH3-N< .
Ароматические C6H5-N< .
И жирно-ароматические (содержат
ароматический и алифатический радикалы) амины.
6. Номенклатура
К названию органических остатков, связанных с азотом,добавляют слово «амин» при этом группы упоминают в алфавитном
порядке: CH3NHC3H7 — метилпропиламин, CH3N(C6H5)2 —
метилдифениламин.
Для высших аминов название составляется, взяв за основу
углеводород, прибавлением приставки «амино», «диамино»,
«триамино», указывая числовой индекс атома углерода:
2-аминопентан
Для некоторых аминов используются
тривиальные названия: C6H5NH2 — анилин.
7. Изомерия аминов
Структурная изомерия*- углеродного скелета, начиная с С4H9NH2:
- положения аминогруппы, начиная с С3H7NH2:
- изомерия аминогруппы, связанная с изменением степени
замещенности атомов водорода при азоте:
8.
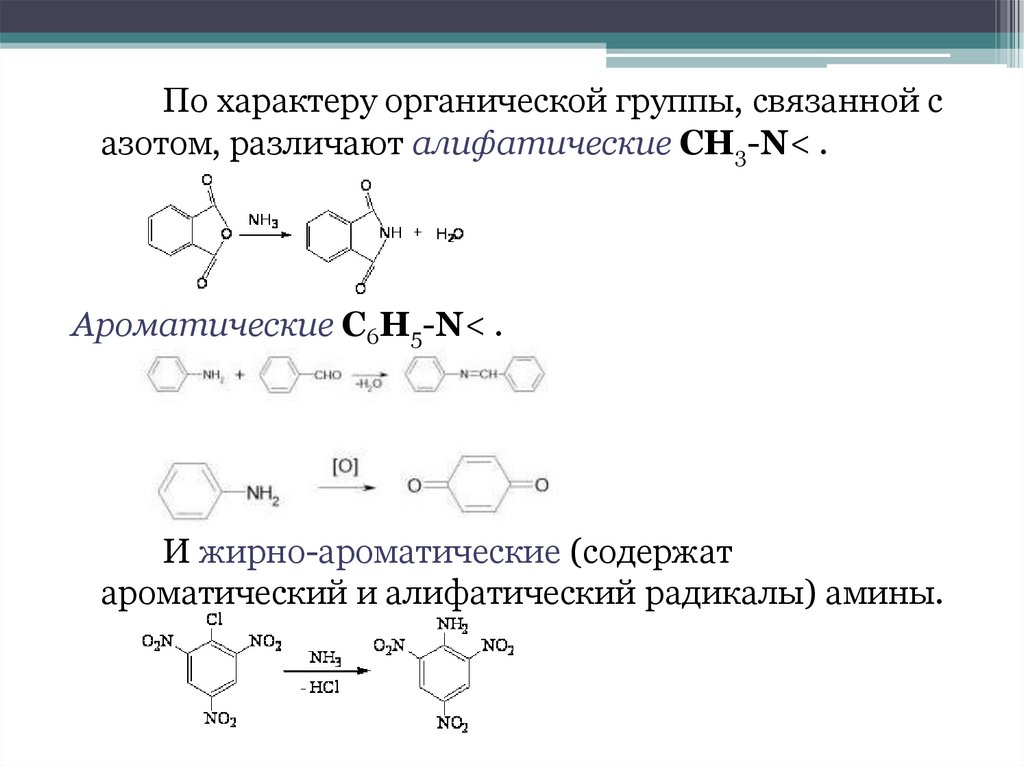
Пространственная изомерияВозможна оптическая изомерия**, начиная
с С4H9NH2:
*Изомерия - явление, заключающееся в существовании химических
соединений — изомеров, — одинаковых по атомному составу и молекулярной
массе, но различающихся по строению или расположению атомов в
пространстве и, вследствие этого, по свойствам.
**Оптические (зеркальные) изомеры - пространственные изомеры,
молекулы которых относятся между собой как предмет и несовместимое с
ним зеркальное изображение (как левая и правая руки).
9. Физические свойства аминов
Связь N–H является полярной, поэтому первичные и вторичные аминыобразуют межмолекулярные водородные связи (несколько более слабые, чем
Н-связи с участием группы О–Н).
Это объясняет относительно высокую температуру кипения аминов по
сравнению с неполярными соединениями со сходной молекулярной массой.
Например:
При обычной температуре только низшие жирные амины CH3NH2,
(CH3)2NH, (CH3)3N – газы (с запахом аммиака), средние амины – жидкости с
резким запахом гниющей рыбы, высшие – твердые вещества без запаха.
10.
Амины способны к образованию водородных связей сводой:
Поэтому низшие амины хорошо растворимы в воде. С
увеличением числа и размеров углеводородных радикалов
растворимость аминов в воде уменьшается, т.к.
увеличиваются пространственные препятствия
образованию водородных связей. Ароматические амины –
бесцветные жидкости и твердые вещества с неприятным
запахом, в воде практически не растворяются.
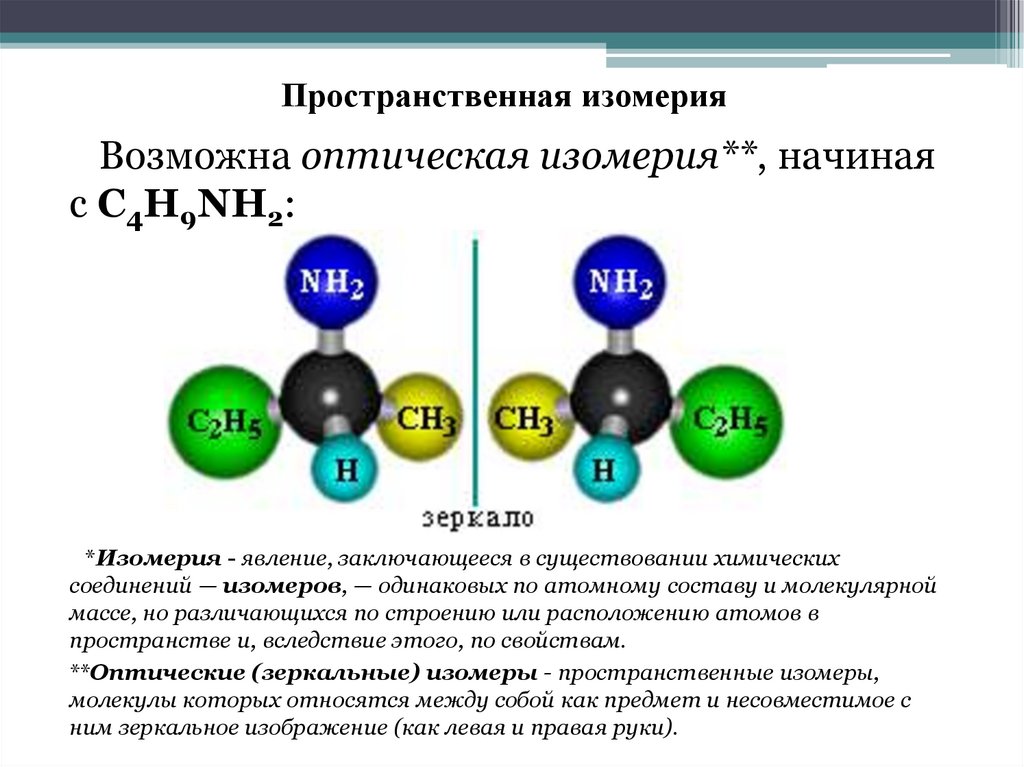
11. Химические свойства аминов
Амины, являясь производными аммиака, имеют сходное с ним строение и проявляютподобные ему свойства.
Модели молекул
Как в аммиаке, так и в аминах атом азота имеет неподеленную пару электронов:
Поэтому амины подобно аммиаку проявляют свойства оснований.
12.
I. Свойства аминов как оснований1. Водные растворы алифатических аминов проявляют щелочную реакцию, т.к. при их
взаимодействии с водой образуются гидроксиды алкиламмония, аналогичные
гидроксиду аммония:
Связь протона с амином, как и с аммиаком, образуется по донорно-акцепторному
механизму за счет неподеленной электронной пары атома азота.
Алифатические амины – более сильные основания, чем аммиак, т.к. алкильные
радикалы увеличивают электронную плотность на атоме азота за счет +I-эффекта. По
этой причине электронная пара атома азота удерживается менее прочно и легче
взаимодействует с протоном.
13.
2. Взаимодействуя с кислотами, амины образуют соли:Соли аминов – твердые вещества, хорошо растворимые в воде. При нагревании щелочи
вытесняют из них амины:
Ароматические амины являются более слабыми основаниями, чем аммиак, поскольку
неподеленная электронная пара атома азота смещается в сторону бензольного кольца, вступая в
сопряжение с его π-электронами.
Уменьшение электронной плотности на атоме азота приводит к снижению способности
отщеплять протоны от слабых кислот. Поэтому анилин взаимодействует лишь с сильными
кислотами (HCl, H2SO4), а его водный раствор не окрашивает лакмус в синий цвет.
Таким образом, основные свойства изменяются в ряду:
C6H5NH2 < NH3 < RNH2 < R2NH < R3N (в газовой фазе)
14.
II. Окисление аминовАмины, особенно ароматические, легко окисляются на воздухе. В отличие от аммиака, они
способны воспламеняться от открытого пламени.
4СH3NH2 + 9O2 → 4CO2 + 10H2O + 2N2
III. Взаимодействие с азотистой кислотой
Азотистая кислота HNO2 – неустойчивое соединение. Поэтому она используется только в
момент выделения. Образуется HNO2, как все слабые кислоты, действием на ее соль (нитрит)
сильной кислотой:
KNO2 + HCl → НNO2 + KCl
или NO2- + H+ → НNO2
Строение продуктов реакции с азотистой кислотой зависит от характера амина. Поэтому данная
реакция используется для различения первичных, вторичных и третичных аминов.
Первичные алифатические амины c HNO2 образуют спирты:
R-NH2 + HNO2 → R-OH + N2 + H2O
Первичные ароматические амины при повышенной температуре реагируют аналогично, образуя
фенолы. При низкой температуре (около 0° С) реакция идет иначе.
Вторичные амины (алифатические и ароматические) под действием HNO2 превращаются в
нитрозосоединения (вещества с характерным запахом):
R2NH + H-O-N=O → R2N-N=O + H2O
алкилнитрозамин
Реакция с третичными аминами приводит к образованию неустойчивых солей и не имеет
практического значения.
15. Получение
Восстановление нитросоединений — Реакция Зинина.Эту реакцию впервые осуществил Н. Н. Зинин в 1842 году.
Действуя на нитробензол сульфидом аммония, он получил анилин:
Восстановление железом:
Восстановление водородом в присутствии катализатора и при высокой температуре:
Также возможно получение путем восстановления нитрилов, оксимов, амидов,
путем алкилирования аммиака, путем перегруппировки бензильных четвертичных
аммониевых солей , путем перегруппировки гидроксамовых кислот.
16. Общий вывод.
Амины по химическим свойствамсходны с аммиаком, но в отличие от
него горят на воздухе.
17. Домашнее задание
• Внимательно изучить лекцию.• Подготовиться к С.Р. по данной теме.
• На дополнительную оценку подготовить
доклад, презентацию по реакции Н. Н.
Зинина














 chemistry
chemistry