Similar presentations:
Химические явления. Уравнения химических реакций
1. Химические явления Уравнения химических реакций
01.03.20182. Химические явления
Химические явления (Химические реакции) – это явления, происходящие свеществами, при которых происходит превращение одних веществ в другие
Резонный вопрос
Как же понять, что из одного
вещества получилось совершенно
другое?
Картинка, иллюстрирующая возникновение
резонного вопроса
Наводящий вопрос для ответа на
резонный вопрос
Что позволяет сказать нам, что
стекло – это стекло, а не
деревяшка?
Ответ на резонный вопрос
Так как каждое вещество обладает набором характерных только ему свойств, то
при превращении одного вещества в другое мы будем иметь возможность
пронаблюдать изменение этих свойств
3. Признаки химических реакций
1. Выпадение осадкаОсадок – это нерастворимое в воде вещество, получившееся в результате
химической реакции
2. Растворение осадка
Получение растворимого в воде вещества из нерастворимого
3. Выделение газа
О выделении газа свидетельствует шипение и бурление
4. Изменение цвета
5. Выделение или поглощение тепла
В результате химической реакции вещества могут нагреваться (тепло выделяется)
или охлаждаться (тепло поглощается)
6. Появление запаха
Многие химические вещества имеют запах
4. Классификация реакций по тепловому эффекту
Тепловой эффект химической реакции – это такое количество теплоты, котороебыло выделено или поглощено в результате химической реакции
Химические реакции
(по тепловому эффекту)
Экзотермические
(экзо- наружу)
Реакции протекающие с
выделением теплоты
Экзоскелет «монолитовца»
Эндотермические
(эндо- внутрь)
Реакции протекающие с
поглощением теплоты
Скелет человека –
внутренний скелет
или эндоскелет
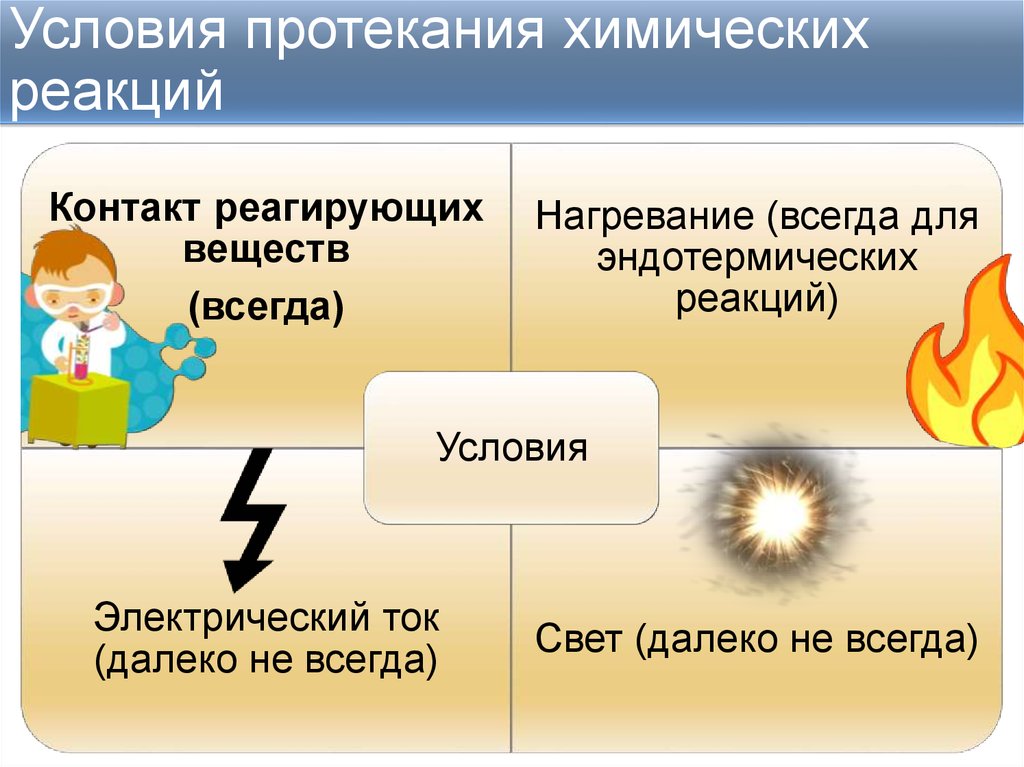
5. Условия протекания химических реакций
Контакт реагирующихвеществ
(всегда)
Нагревание (всегда для
эндотермических
реакций)
Условия
Электрический ток
(далеко не всегда)
Свет (далеко не всегда)
6. Закон постоянства состава
Закон постоянства состава (Ж. Л. Пруст, 1801—1808гг.) — любое определенное химически чистое
соединение, независимо от способа его получения,
состоит из одних и тех же химических элементов,
причём отношения их масс постоянны, а
относительные числа их атомов выражаются
целыми числами.
Жозеф Луи Пруст
Упрощенная формулировка – каждое вещество имеет характерный только для
него качественный и количественный набор химических элементов
7. Опыт Ломоносова
8. Выводы, которые сделал Ломоносов
1. Так как носителями массы в химическом веществе являются атомы химическихэлементов, то в результате химической реакции горения свечи новые атомы не
образовывались, а старые не разрушались
2. Значит, новые вещества в результате реакции образовались за счет того, что
атомы перегруппировались, и образовали новые молекулы
Закон сохранения массы
Все перемены, в натуре случающиеся, такого суть состояния, что сколько чего у
одного тела отнимается, столько присовокупиться к другому. Так, ежели где убудет
несколько материи, то умножится в другом месте
Ломоносов М. В. (с)
Масса веществ, вступивших в химическую реакцию, равна массе веществ,
образовавшихся в результате реакции
Современная формулировка
9. Химическое уравнение. Уравнение химической реакции
Химическим уравнением называют условную запись химической реакции спомощью химических формул и математических знаков
Например, попробуем записать с помощью уравнения химической реакции, что
хлорид железа (III) взаимодействует с гидроксидом натрия, при этом образуется
нерастворимый в воде гидроксид железа (III) и хлорид натрия











 chemistry
chemistry








