Similar presentations:
Химические уравнения. Типы химических реакций
1. Химические уравнения. Типы химических реакций.
2.
3.
-Распространение запаха духов
Испарение и замерзание воды
Горение сахара
Извержение вулкана
Образование инея
Гниение листьев осенью
Горение бумаги, древесины
Образование тумана, облаков
Таяние льда
Притягивание железа магнитом
Скисание молока
Плавление металла
Засахаривание варенья
Коррозия металлов
4. Условия протекания химической реакции?
5.
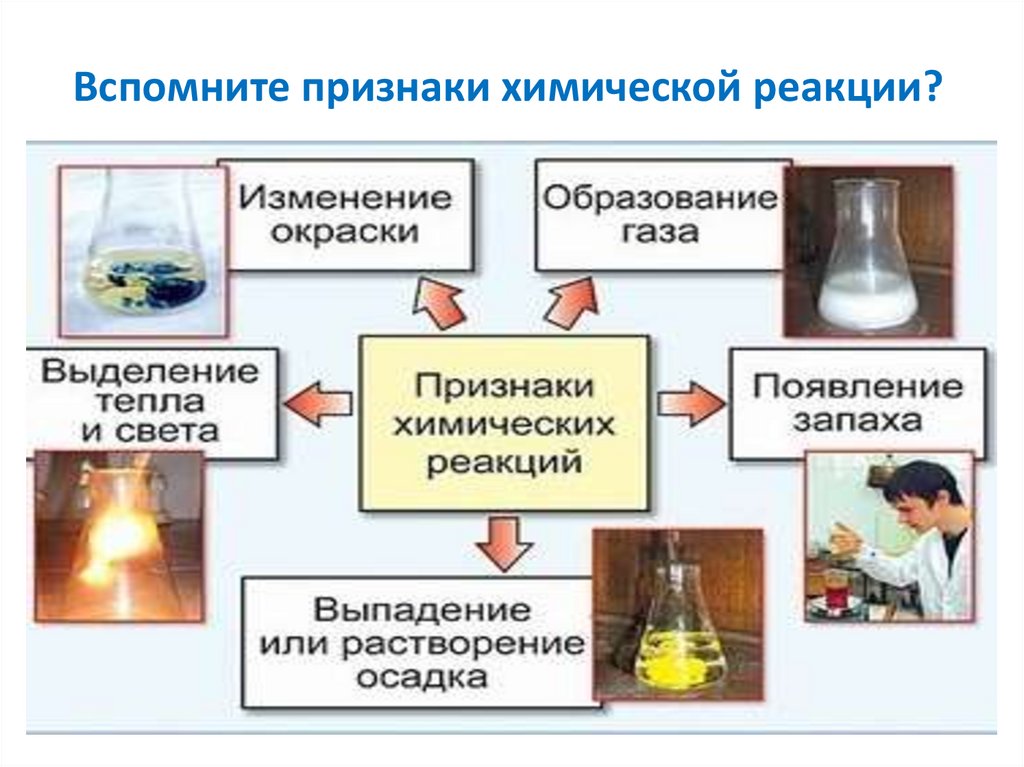
6. Вспомните признаки химической реакции?
7.
8. Экзотермическая реакция — химическая реакция, сопровождающаяся выделением теплоты. Эндотермическая реакция — химическая
реакция,сопровождающаяся
поглощением теплоты.
9.
10.
11.
12. Химические уравнения -
Химические уравнения это условная запись химическойреакции с помощью
химических формул,
коэффициентов
и математических знаков
13. По уравнению можно определить тип химической реакции
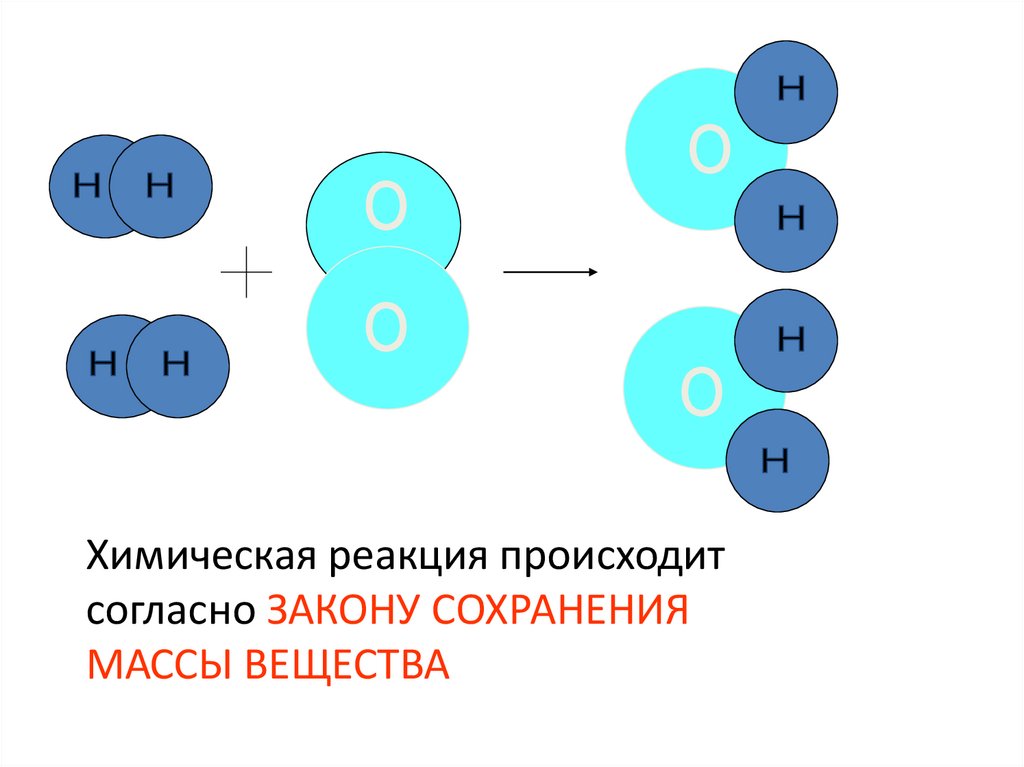
14. 2 H2 + O2 = 2 H2O
15.
Химическая реакция происходитсогласно ЗАКОНУ СОХРАНЕНИЯ
МАССЫ ВЕЩЕСТВА
16. Закон сохранения массы вещества ( М.В. Ломоносов – 1756 г.)
Масса веществ, вступивших вхимическую реакцию,
равна массе веществ,
получившихся в ее результате
17. NaOH + HCl = NaCl + H2O
18. Реакции соединения
Несколько простых или сложныхвеществ соединяются в одно, более
сложное
Zn + S = ZnS
CaO + CO2 = CaCO3
Na2O + H2O = 2 NaOH
4Al + 3O2 = 2 Al2O3
Левая часть уравнения – несколько веществ,
правая часть – только одно сложное!
19. Реакции разложения
• Являются обратными реакциям соединения• Из одного сложного вещества получаются
несколько других веществ
CaCO3 = CaO + CO2
2 KMnO4 = K2MnO4 + MnO2 + O2
2 Fe(OH)3 = Fe2O3 + 3 H2O
В левой части уравнения – одно сложное
вещество, в правой – несколько различных.
20. Реакции замещения
Это реакции между простым и сложнымвеществами, в которых атомы простого вещества
замещают атомы одного из элементов в сложном
веществе
Mg + 2 HCl = MgCl2 + H2
3 CuSO4 + 2 Al = Al2(SO4)3 +3 Cu
Левая часть уравнения – простое и сложное
вещества, правая – новое простое и новое
сложное
21. Реакции обмена
• Это реакции, при которых два сложныхвещества обмениваются своими
составными частями
CuSO4 + 2 NaOH = Cu(OH)2 + Na2SO4
AgNO3 + HCl = HNO3 + AgCl
22. Составьте уравнения химических реакций:
Горение угля
Взаимодействие цинка с соляной кислотой
Разложение воды электрическим током
Прокаливание карбоната кальция
Взаимодействие оксида меди (II) с серной
кислотой
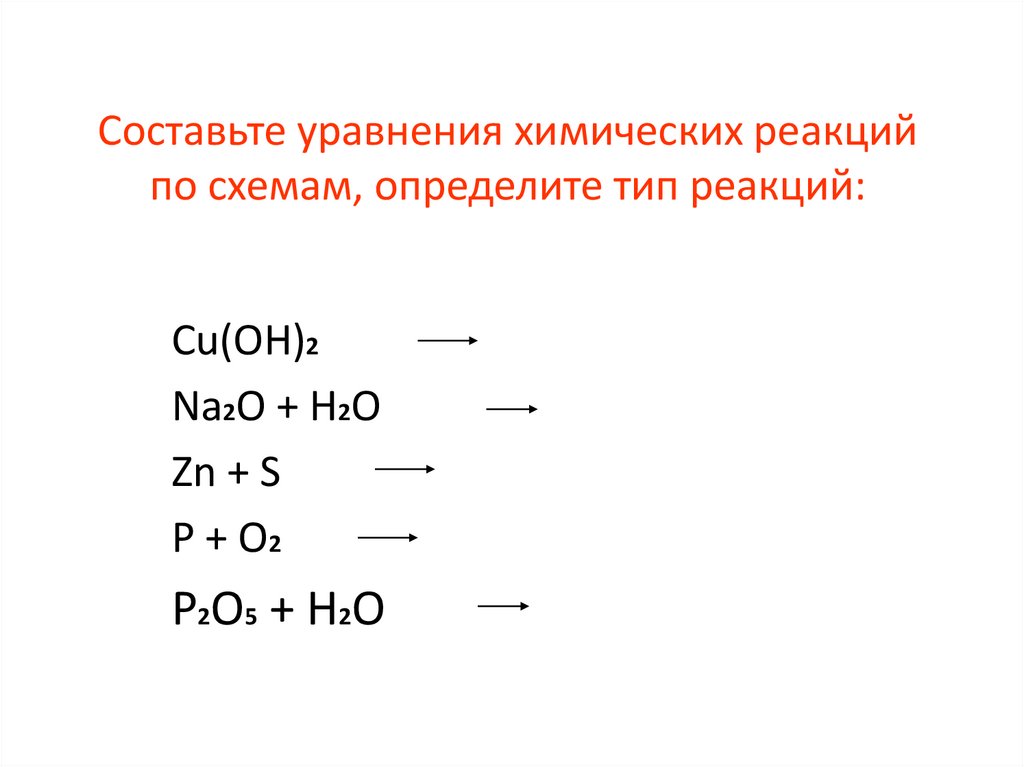
23. Составьте уравнения химических реакций по схемам, определите тип реакций:
Cu(OH)2Na2O + H2O
Zn + S
P + O2
P2O5 + H2O
24. Расставьте коэффициенты в предложенных схемах уравнений, определите тип реакций:
Al + O2Al2O3
Fe2O3 +H2O
Fe(OH)3
K + H3PO4
K3PO4 + H2
NaOH + H2SO4
Na2SO4 + H2O
KMnO4
K2MnO4 + MnO2 + O2
25. Домашняя работа
Учебник: Габриелян О.С. - § 27, 28, упр.2, 3, стр. 166
или
Габриелян О.С. и другие - § 9, 10, упр. 4,
5, стр. 53




















 chemistry
chemistry








