Similar presentations:
Кинетическое уравнение математическая запись закона действующих масс
1.
2. Кинетическое уравнение математическая запись закона действующих масс
aA + bB = cC + dDV=k CаА CbВ
V=k [A]a [B]b
V - скорость реакции
k - константа скорости реакции
моль
[A],[B] (C A ,C B ) - молярные [
]
л
концентрации реагентов
a,b - кинетический порядок реакции по
веществам А и В , соответственно
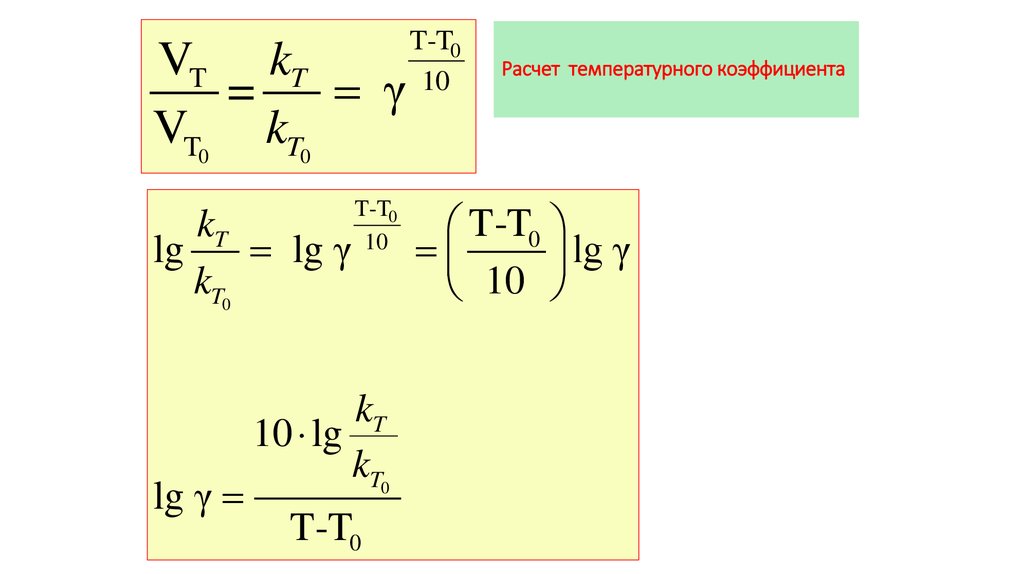
3. Расчет температурного коэффициента
VT kT=
γ
VT0 kT0
kT
lg
lg γ
kT0
lg γ
T-T0
10
kT
10 lg
kT0
T-T0
T-T0
10
Расчет температурного коэффициента
T-T0
lg γ
10
4. Уравнение Аррениуса
-E Ak = A exp
RT
• k – константа скорости химической реакции (константа в уравнении
основного постулата кинетики)
• ЕА – энергия активации
• R – газовая постоянная, равная
8,314
• Т – температура, градусах Кельвина
• А – предэкспоненциальный множитель
Дж
моль К
5.
6.
7.
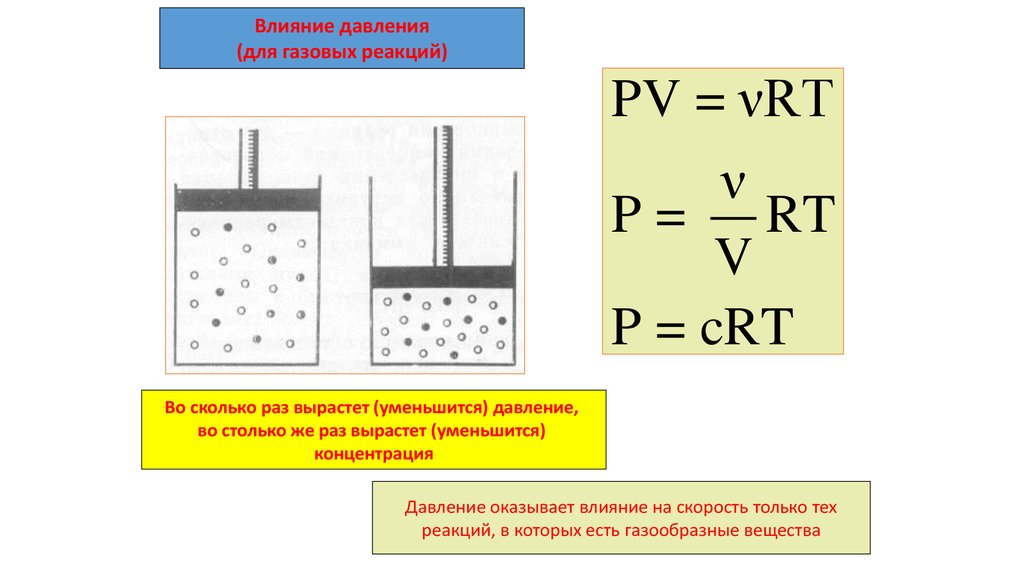
Влияние давления(для газовых реакций)
PV = νRT
ν
P = RT
V
P = cRT
Во сколько раз вырастет (уменьшится) давление,
во столько же раз вырастет (уменьшится)
концентрация
Давление оказывает влияние на скорость только тех
реакций, в которых есть газообразные вещества
8.
aA + bB = сС +dDV=k [A] [B]
a
b
VT kT
=
γ
VT0 kT0
T-T0
10
-E A
k = A exp
RT
y e x
P = cRT
x
ЕА
RT
9. Задача
1. Найти значение константы скорости реакцииА(г) + 2В(г) = АВ2 (г)
если при начальных концентрациях [А]0=0,05 и [В]0=0,01 М скорость
реакции при Т=298 К равна 5 ∙ 10-5 моль/л ∙с.
2. Определить значение скорости реакции в момент времени t, когда
концентрация вещества В станет равной [В]t=0,002 М
3. Как необходимо изменить давление в системе, чтобы скорость реакции в
момент времени t вновь стала равной первоначальной?
4. Как необходимо изменить температуру в системе, чтобы скорость реакции в
момент времени t вновь стала равной первоначальной? Принять значение
температурного коэффициента реакции γ=1,76.
5. Рассчитать энергию активации этой реакции, если известно, что значение
температурного коэффициента не изменяется в температурном интервале
298 – 350 К0
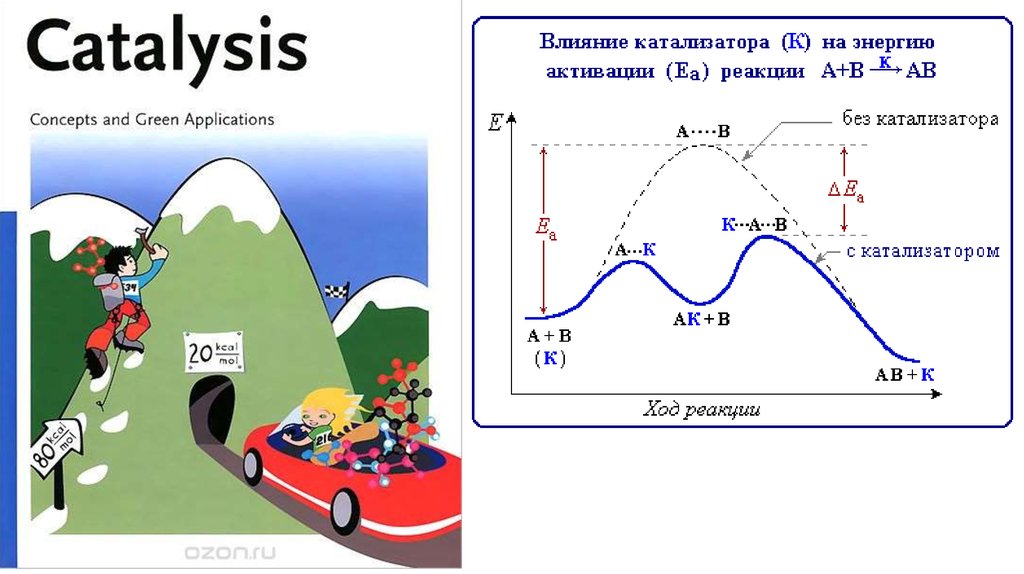
6. Как необходимо изменить энергию активации этой реакции посредством
введения катализатора при Т=298 К, чтобы скорость реакции вновь стала
равной первоначальной?
10.
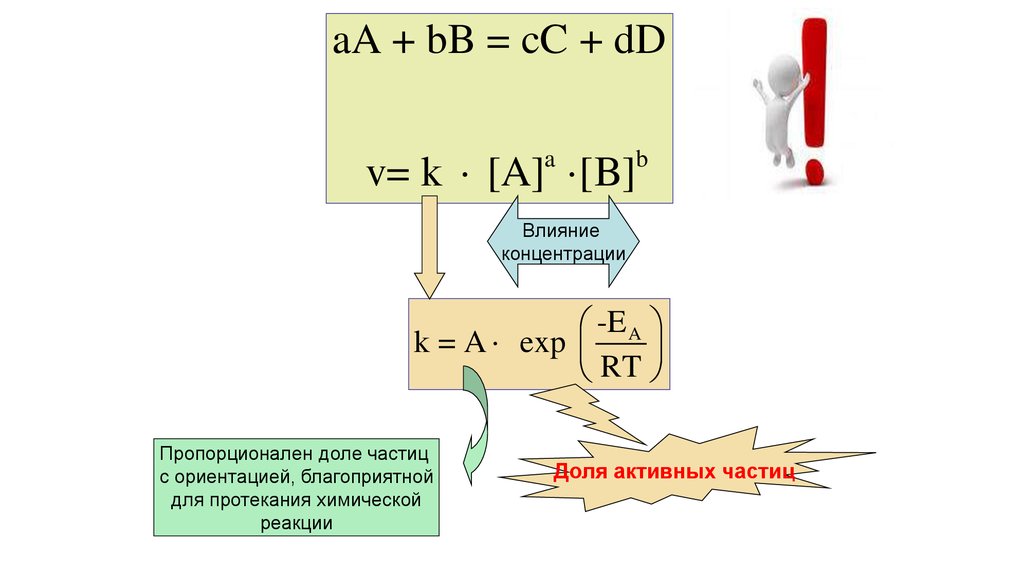
aA + bB = cC + dDv= k [A] [B]
a
b
Влияние
концентрации
-E A
k = A exp
RT
Пропорционален доле частиц
с ориентацией, благоприятной
для протекания химической
реакции
Доля активных частиц






 chemistry
chemistry








