Similar presentations:
Аммиак. Строение, свойства, получение, применение
1. Аммиак
Строение, свойства, получение, применение.2.
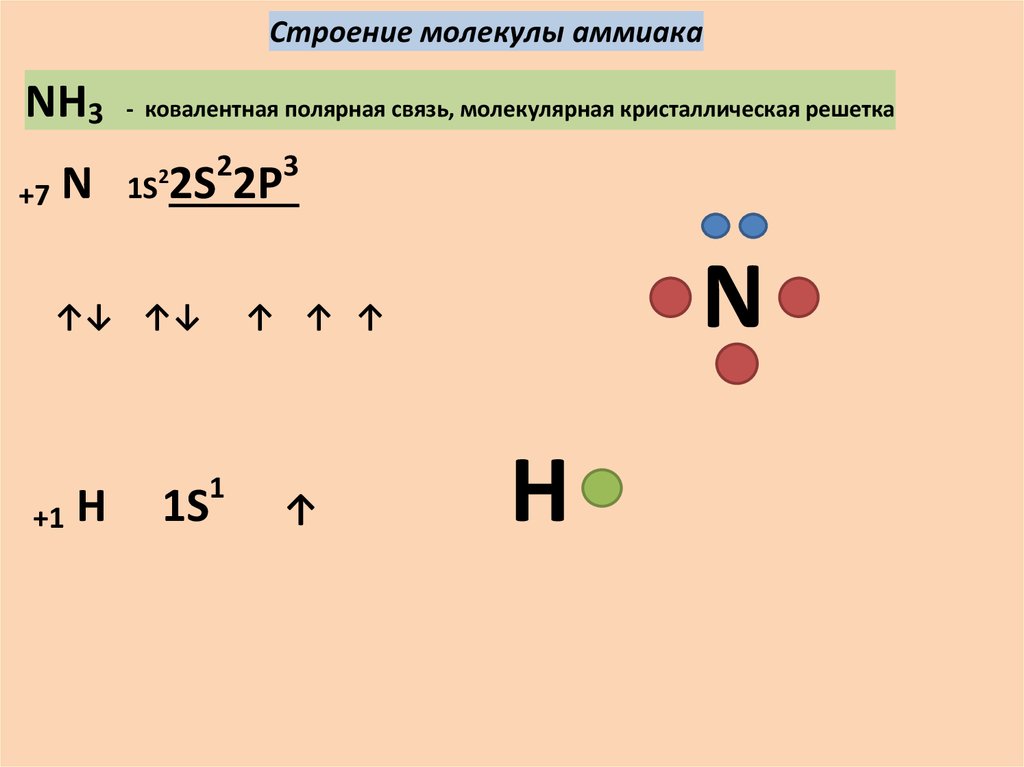
Строение молекулы аммиакаNH3
+7
N
- ковалентная полярная связь, молекулярная кристаллическая решетка
1S
2
2S 2P
2
↑↓ ↑↓
+1
H
1S
3
N
↑ ↑ ↑
1
↑
H
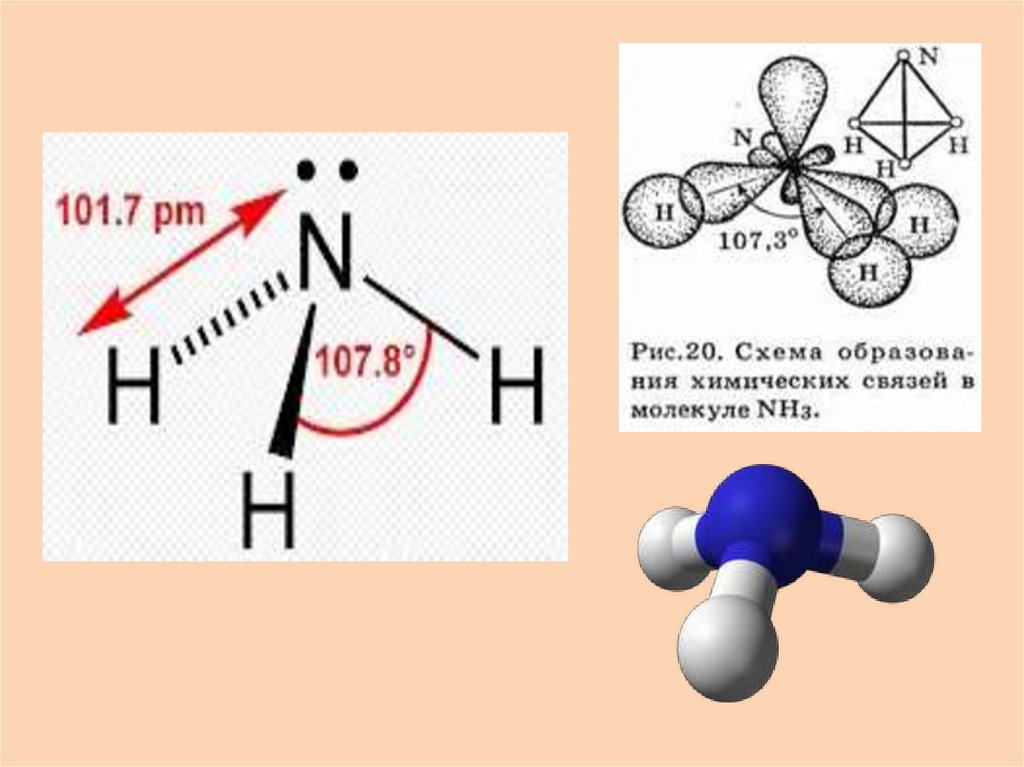
3.
H N HH N H
H
H
электронная формула
графическая формула
аммиака
4.
5.
Физические свойства аммиакаПри нормальных условиях — бесцветный газ с резким
характерным запахом (запах нашатырного спирта), почти вдвое
легче воздуха, ядовит.
По физиологическому действию на организм относится к группе
веществ удушающего и нейротропного действия, способных при
ингаляционном поражении вызвать токсический отёк лёгких и
тяжёлое поражение нервной системы.
Аммиак обладает как местным, так и резорбтивным действием.
Пары аммиака сильно раздражают слизистые оболочки глаз и
органов дыхания, а также кожные покровы. Это мы и
воспринимаем как резкий запах.
Пары аммиака вызывают обильное слезотечение, боль в глазах,
химический ожог конъюктивы и роговицы, потерю зрения,
приступы кашля, покраснение и зуд кожи.
Растворимость NH3 в воде чрезвычайно велика — около 1200
объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды.
6.
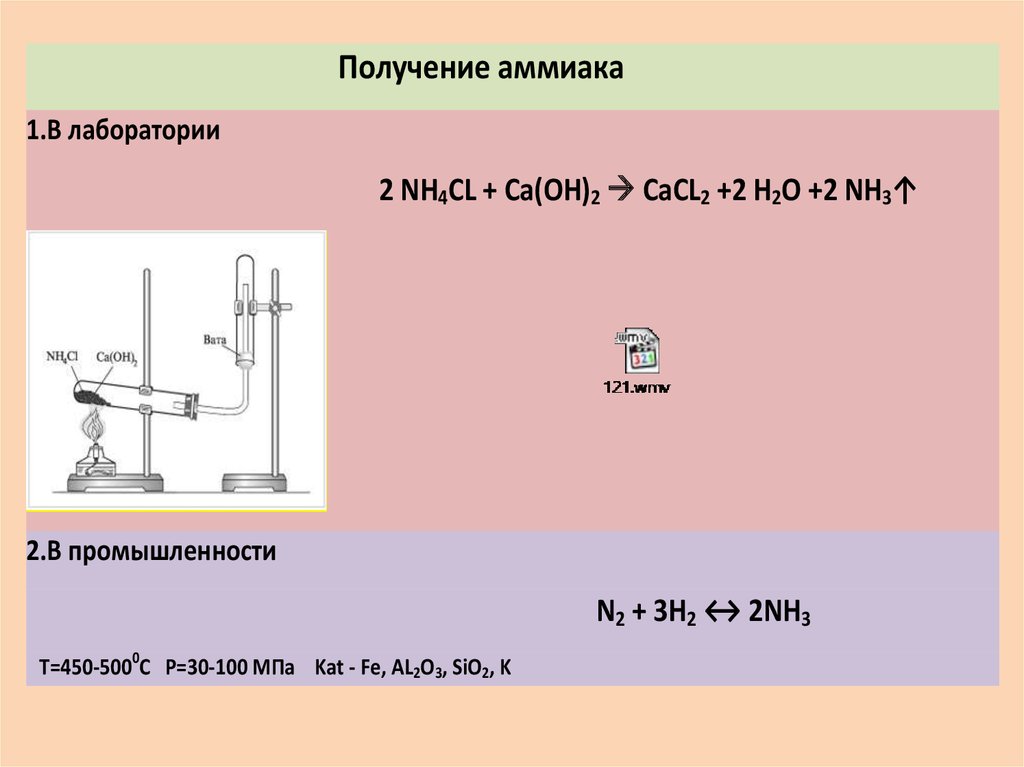
Получение аммиака1.В лаборатории
2 NH4CL + Ca(OH)2 CaCL2 +2 H2O +2 NH3↑
2.В промышленности
N2 + 3H2 ↔ 2NH3
T=450-5000C P=30-100 MПa Kat - Fe, AL2O3, SiO2, K
7.
Химические свойства аммиака1. Горение в кислороде
4N-3H+13 + 3O02 -> 2N02 + 6H+12O-2
2N-3 - 6e -> N02 │ 4 │ 2 ок-е (восст-ль)
O02 + 4e -> 2O-2 │ 6 │ 3 восст-е (ок-ль)
2. Каталитическое окисление
4N-3H+13 + 5O02 -> 4N+2o-2 + 6H+12O-2
N-3 - 5e -> N+2 │ 4 ок-е (восст-ль)
O02 + 4e -> 2O-2 │ 5 восст-е (ок-ль)
3. Взаимодействие с водой
NH3 + HOH ↔ NH4OH
H
∙∙
∙∙
∙∙
H ˸N˸ H + H ˸O˸ H ↔ [ H ˸N˸ H ]+ OHДОНОРНО-АКЦЕПТОРНАЯ СВЯЗЬ
∙∙
∙∙
∙∙
ДОНОР
АКЦЕПТОР H+
H
4. Взаимодействие с кислотами
NH3 + HCL ↔ NH4CL
8.
Применение аммиакаПо объемам производства аммиак занимает одно из первых мест; ежегодно во всем
мире получают около 100 миллионов тонн этого соединения. Аммиак выпускается в
жидком виде или в виде водного раствора – аммиачной воды, которая обычно
содержит 25% NH3. Огромные количества аммиака далее используются для получения
азотной кислоты, которая идет на производство удобрений и множества других
продуктов. Аммиачную воду применяют также непосредственно в виде удобрения, а
иногда поля поливают из цистерн непосредственно жидким аммиаком. Из
аммиака получают различные соли аммония, мочевину, уротропин. Его применяют
также в качестве дешевого хладагента в промышленных холодильных установках.
Аммиак используется также для получения синтетических волокон, например,
нейлона и капрона. В легкой промышленности он используется при очистке и
крашении хлопка, шерсти и шелка. В нефтехимической промышленности аммиак
используют для нейтрализации кислотных отходов, а в производстве природного
каучука аммиак помогает сохранить латекс в процессе его перевозки от плантации до
завода. Аммиак используется также при производстве соды по методу Сольве. В
сталелитейной промышленности аммиак используют для азотирования – насыщения
поверхностных слоев стали азотом, что значительно увеличивает ее твердость.
Медики используют водные растворы аммиака (нашатырный спирт) в повседневной
практике: ватка, смоченная в нашатырном спирте, выводит человека из обморочного
состояния. Для человека аммиак в такой дозе не опасен.
9.
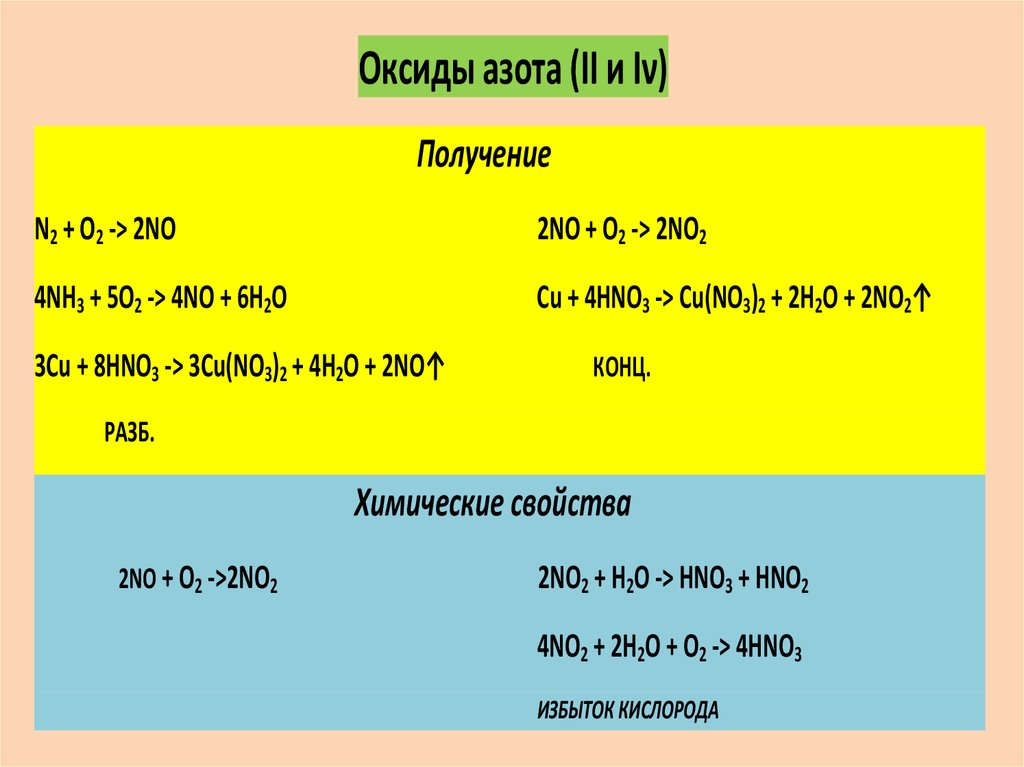
Оксиды азота (ӏӏ и ӏν)Получение
N2 + O2 -> 2NO
2NO + O2 -> 2NO2
4NH3 + 5O2 -> 4NO + 6H2O
Cu + 4HNO3 -> Cu(NO3)2 + 2H2O + 2NO2↑
3Cu + 8HNO3 -> 3Cu(NO3)2 + 4H2O + 2NO↑
КОНЦ.
РАЗБ.
Химические свойства
2NO + O2 ->2NO2
2NO2 + H2O -> HNO3 + HNO2
4NO2 + 2H2O + O2 -> 4HNO3
ИЗБЫТОК КИСЛОРОДА
10.
№1. Осуществить превращения по схеме:а) Азот → Аммиак → Оксид азота (II)
б) Нитрат аммония → Аммиак → Азот
в) Аммиак → Хлорид аммония → Аммиак
→ Сульфат аммония
Для ОВР составить электронный баланс, для
РИО полные, сокращенные ионные уравнения.
Учащиеся работают в группах из 4-х человек.
Каждая группа берет одну цепочку превращения и совместно
составляет уравнения реакций.
11.
Этап информации о домашнемзадании
Пр. 17, 18 (читать), упр. 3, 4 (стр. 82);
упр. 2, 3, 4, 8, 9 (стр. 86 -87) в учебнике,
письменно.







 chemistry
chemistry








