Similar presentations:
Аммиак: состав вещества, получение, применение, строение, свойства
1.
12.
Задание 1 Вставь недостающие слова:Название химического элемента «азот» в переводе на русский
язык означает _________ . Это несправедливо, т. к. азот входит в
состав нуклеиновых кислот и ____________. В составе воздуха
_________% азота, т. к. он химически чрезвычайно ___________.
Такие химические свойства азота объясняются тем, что в его
молекуле имеется _______ химическая связь.
Задание 2 Установите соответствие между
формулой вещества и его названием:
НАЗВАНИЕ
А) нитрид лития
Б) оксид азота (II)
В) аммиак
Г) сернистая кислота
Д) сульфат бария
ФОРМУЛА
1) NH3
2) H2SO3
3) Li3N
4) BaSO4
5) NO
2
3.
34.
5.
Состав веществаПолучение
Применение
Строение
Свойства
6.
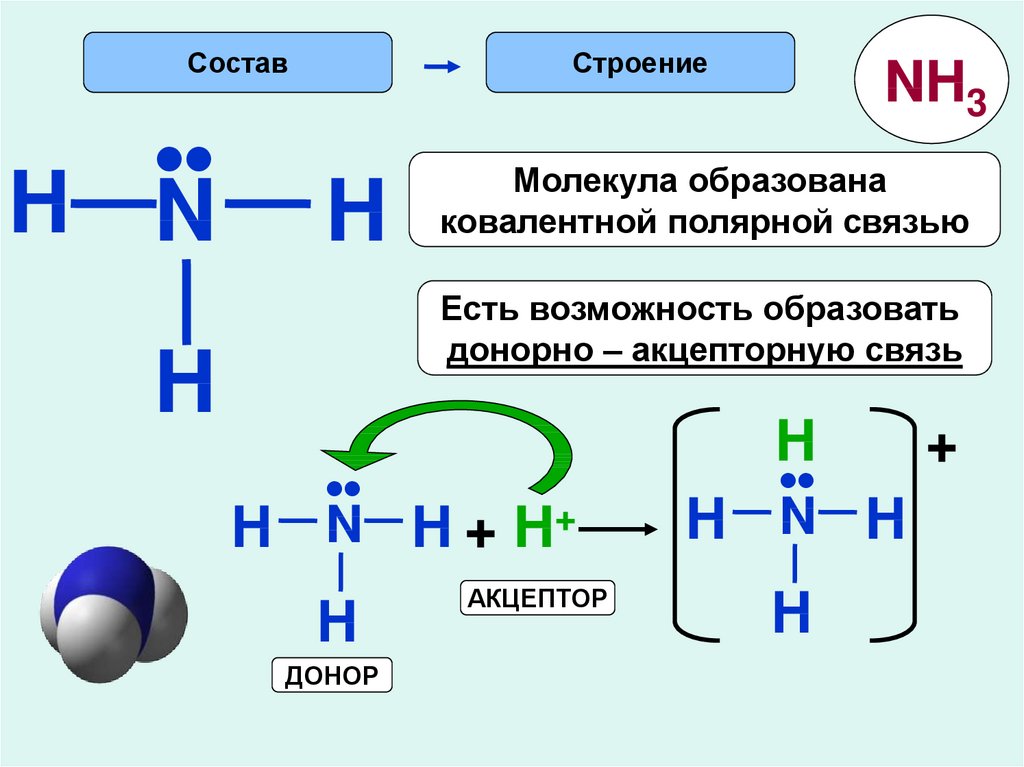
Состав•
H N
Строение
H
NH3
Молекула образована
ковалентной полярной связью
Есть возможность образовать
донорно – акцепторную связь
H
H
•
N H + H+
H
ДОНОР
АКЦЕПТОР
H
H
•
N H
H
+
7.
Задание: а)прочитайте на странице 212 механизм образования донорноакцепторной связи.Б) запишите механизм образования донорно-акцепторной связи между
аммиаком и катионом водорода
В) сделайте вывод: что является донором в данном механизме? Почему?
Донор – частица (атом,молекула,ион),имеющая неподеленные
электронные пары
Г) что является ацептором? Почему?
Акцептор – частица,имеющая свободную (вакантную ) орбиталь
Зарисуйте схему образования катиона водорода.
В результате чего образуется катион водорода?
В каких соединениях находится катион водорода?
8.
Физические свойстваЛегче воздуха
Газ,
с характерным
запахом.
Хорошо растворим в воде
NH3
9.
Аммиак является конечным продуктомазотистого обмена в организме
человека и животных. Он высоко
токсичен для организма, поэтому
большая часть аммиака превращается
печенью в более безвредное и менее
токсичное соединение —мочевину.
Мочевина затем выводится почками.
10.
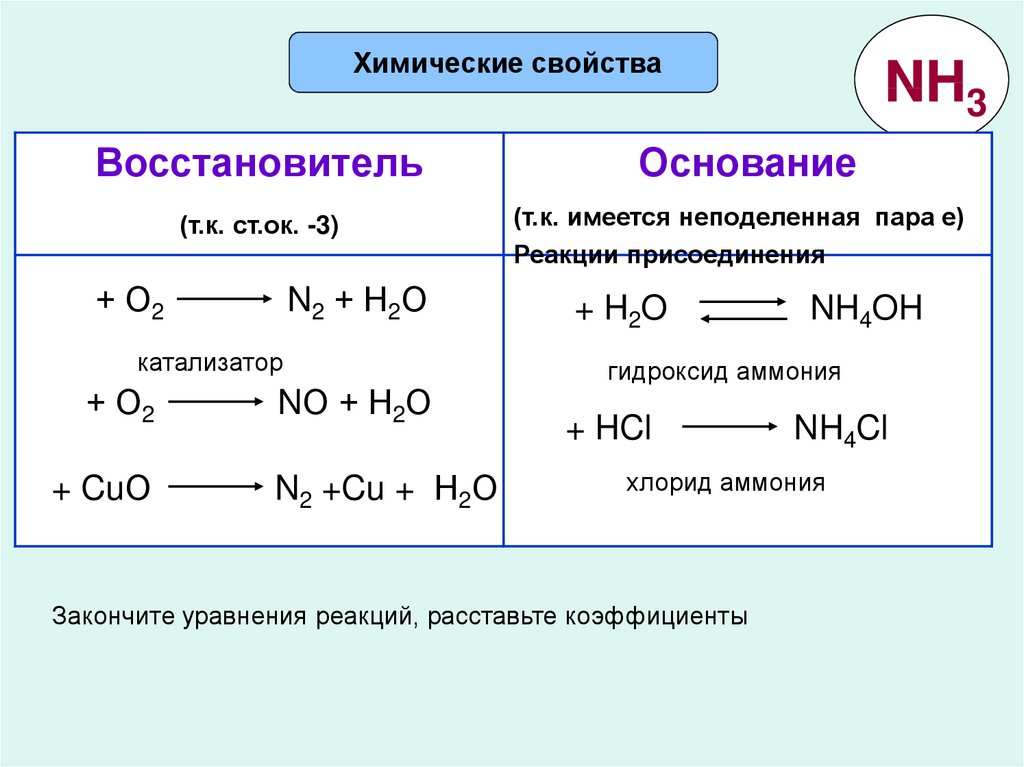
Химические свойстваВосстановитель
(т.к. ст.ок. -3)
+ О2
N2 + Н2О
катализатор
+ О2
+ CuО
NО + Н2О
N2 +Cu + Н2О
NH3
Основание
(т.к. имеется неподеленная пара е)
Реакции присоединения
+ H2O
NH4OH
гидроксид аммония
+ HCl
NH4Cl
хлорид аммония
Закончите уравнения реакций, расставьте коэффициенты
11.
Задание:Закончите уравнения реакций:
1. NH3 + H2SO4 =
2. 2NH3 + H2SO4 =
3. NH3 + H3PO4 =
4. Сколько уравнений реакций можно написать с
многоосновными кислотами?
5. Сколько атомов водорода в кислоте, столько
уравнений реакций можно написать. При этом
образуются кислые соли и средняя соль.
12.
ПРОВЕРЬ СЕБЯ!NH3 + H2SO4 = NH4HSO4
2NH3 + H2SO4= (NH4)2SO4
NH3 + H3PO4 = NH4H2PO4
2NH3 + H3PO4 = (NH4)2HPO4
3NH3 + H3PO4 = (NH4)3PO4
13.
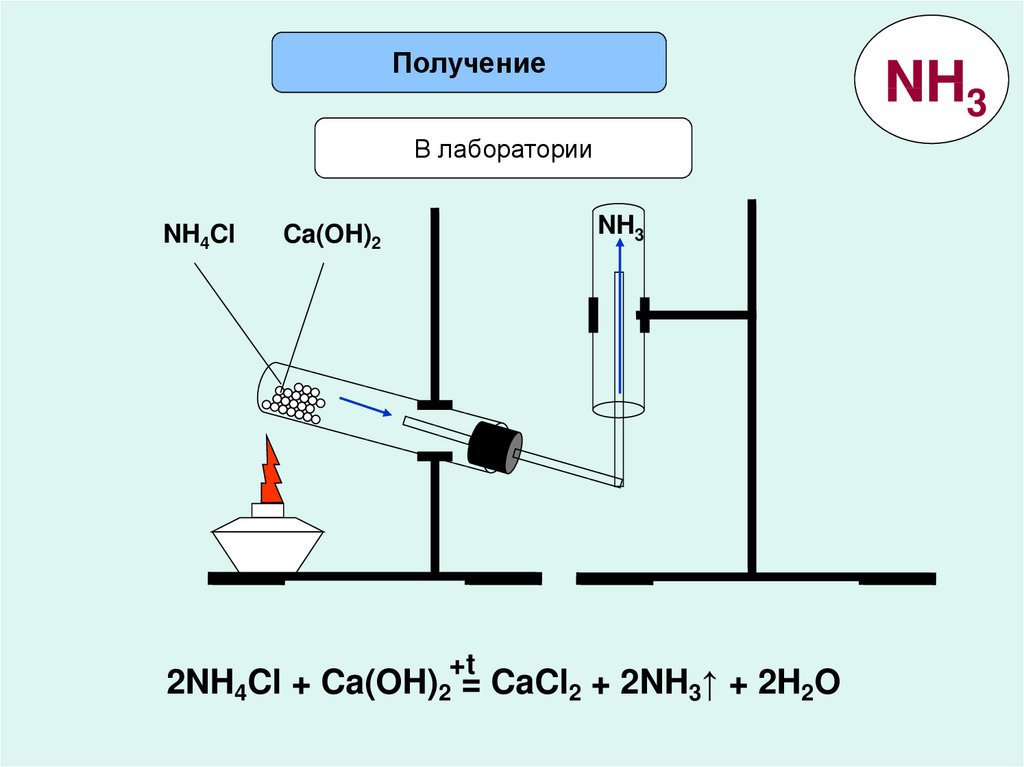
ПолучениеNH3
В лаборатории
NH4Cl
NH3
Ca(OH)2
+t
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑ + 2H2O
14.
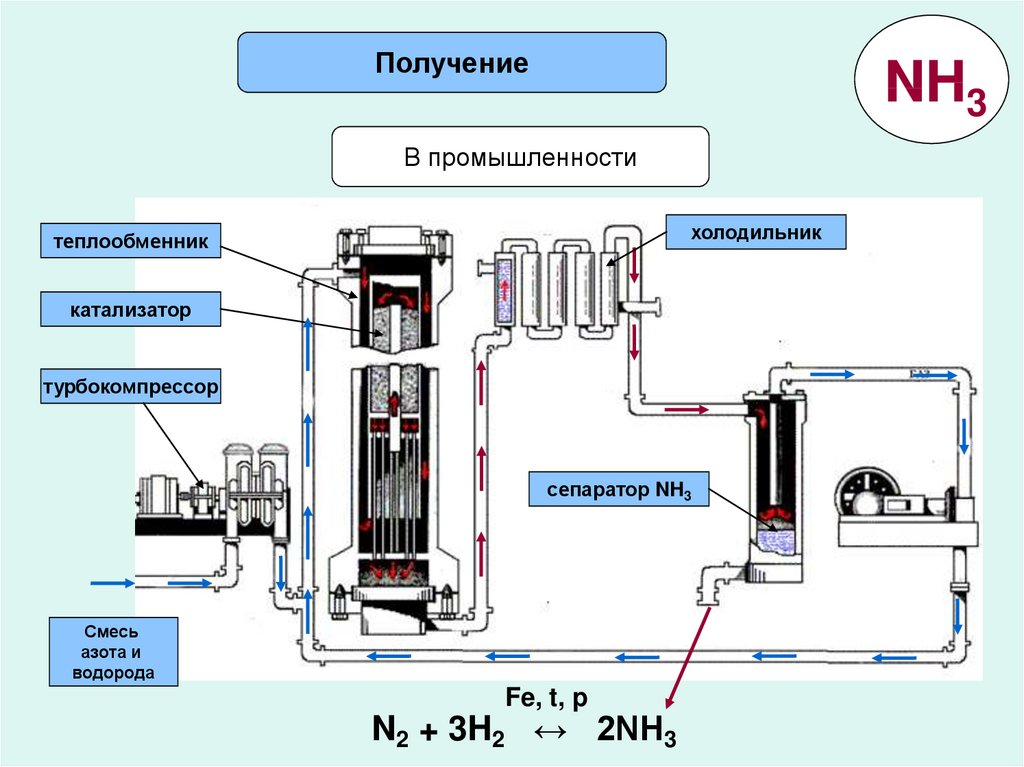
ПолучениеNH3
В промышленности
холодильник
теплообменник
катализатор
турбокомпрессор
сепаратор NH3
Смесь
азота и
водорода
Fe, t, p
N2 + 3H2 ↔ 2NH3
15.
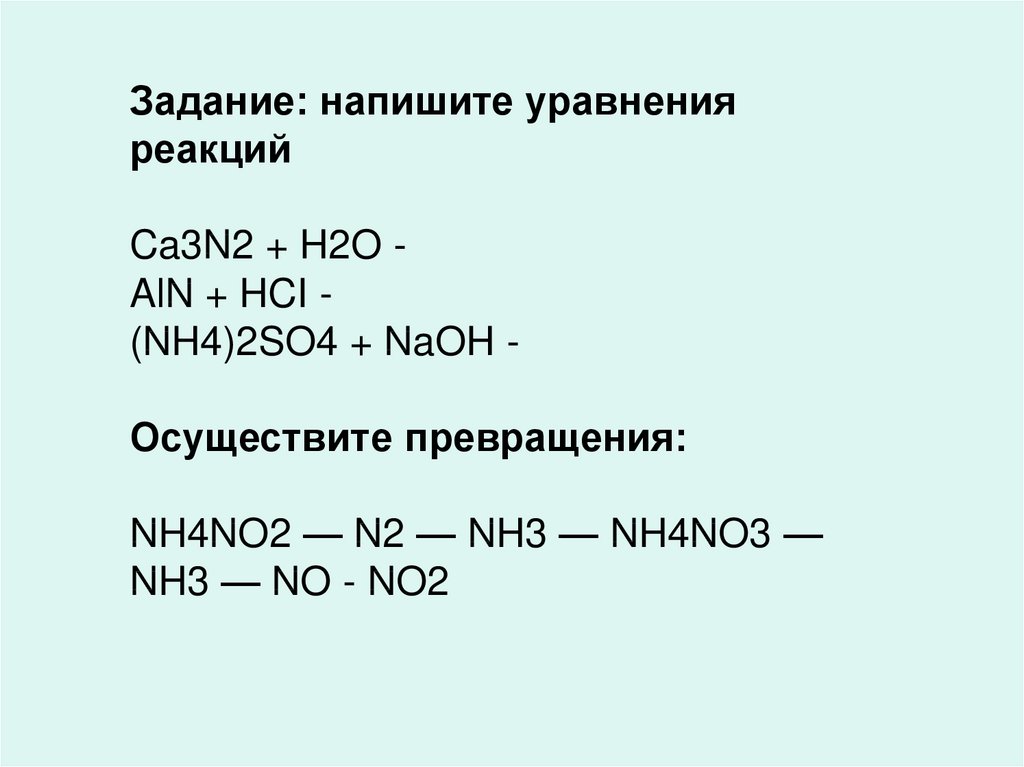
Задание: напишите уравненияреакций
Ca3N2 + H2O AlN + HCI (NH4)2SO4 + NaOH Осуществите превращения:
NH4NO2 — N2 — NH3 — NH4NO3 —
NH3 — NO - NO2
16.
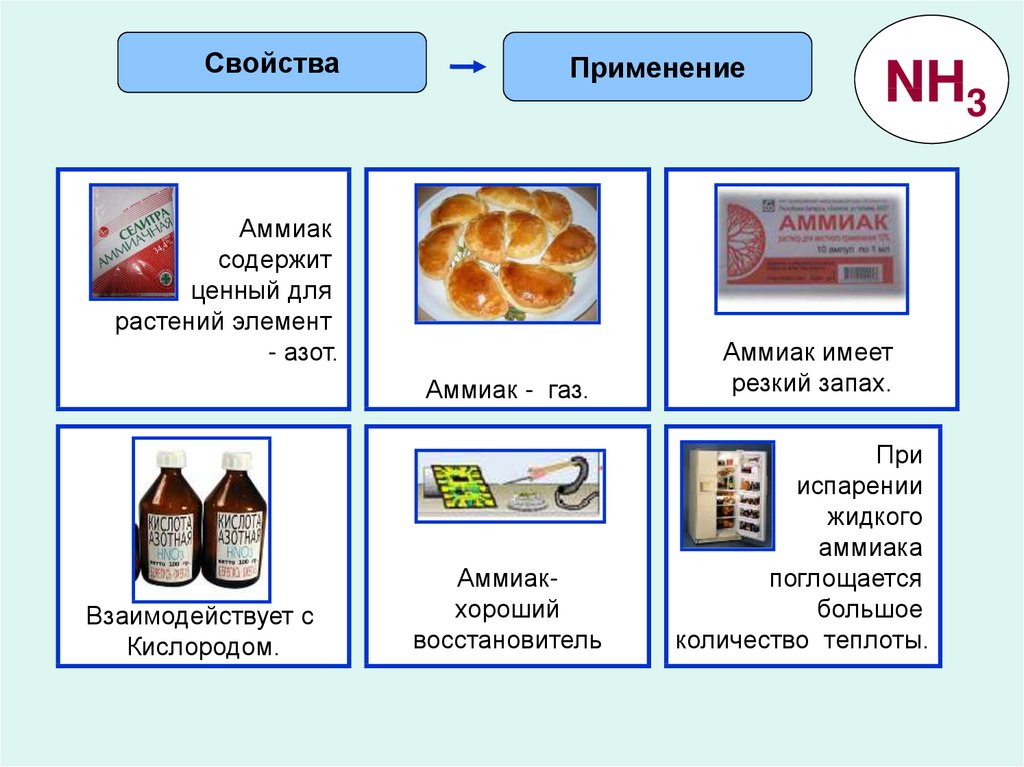
СвойстваПрименение
Аммиак
содержит
ценный для
растений элемент
- азот.
Взаимодействует с
Кислородом.
NH3
Аммиак - газ.
Аммиак имеет
резкий запах.
Аммиакхороший
восстановитель
При
испарении
жидкого
аммиака
поглощается
большое
количество теплоты.
17.
Прочитайте опыт 2 стр.26318.
14.01.1919. Задание
1. п.30 выписать физические свойствасолей аммония
2. . Записать качественную реакцию на
катион аммония (стр.217)
3. Выписать применение солей аммония.
20.
14.01.1921.
ДОМАШНЕЕ ЗАДАНИЕ: п.29-30, упр.8стр.216, 1-2,4,5 стр.219














 chemistry
chemistry








