Similar presentations:
Углекислый газ, угольная кислота и её соли
1.
2. Физические свойства СО2
СО2 – бесцветный газ, без запаха, в 1,5раза тяжелее воздуха, при обычных
условиях в 1 объёме воды растворяется 1
объём углекислого газа.
СО2– «сухой лёд» - для хранения пищевых
продуктов.
3. Химические свойства СО2
СО2 – кислотный оксид.СО2 + H2O = H2CO3
СО2 + CaO = CaCO3
СО2 + 2NaOH = Na2CO3 + H2O
СО2 + Ca(OH)2 = CaCO3↓ + H2O
4. Немного истории
Английский химик Дж. Пристли в 1767 годусделал первую бутылку газировки.
5. При взаимодействии углекислого газа образуется нестойкое соединение – угольная кислота.
Угольная кислота H2CO3 – неустойчивая, всвободном виде не существует, так как разлагается
на CO2 и H2O.
Угольная кислота H2CO3 – двухосновная кислота => 2
ряда солей:
1) средние – карбонаты (MgCO3)
2) кислые – гидрокарбонаты (Сa(HCO3)2
6.
Сталактиты и сталагмитыВода, проникающая в пещеру, растворяет известняк в
химической реакции:
CaCO3 + H2O + CO2
Ca2+ + 2HCO3-
При определённых условиях (разница в парциальном
давлении углекислого газа в растворе и воздухе)
реакция идёт в обратную сторону, и происходит
отложение карбоната кальция — растут сталактиты.
7.
При достаточном количестве карбонатакальция в растворе в месте падения капель с
конца сталактита на полу пещеры вырастает
встречное образование — сталагмит.
8.
Сливаясь со временем, сталактит состалагмитом образуют колонну —
сталагнат.
9.
CaCO3 –мел, мрамор, известнякNa2CO3 – кальцинированная сода
NaHCO3 – питьевая сода
К2CO3 - поташ
10.
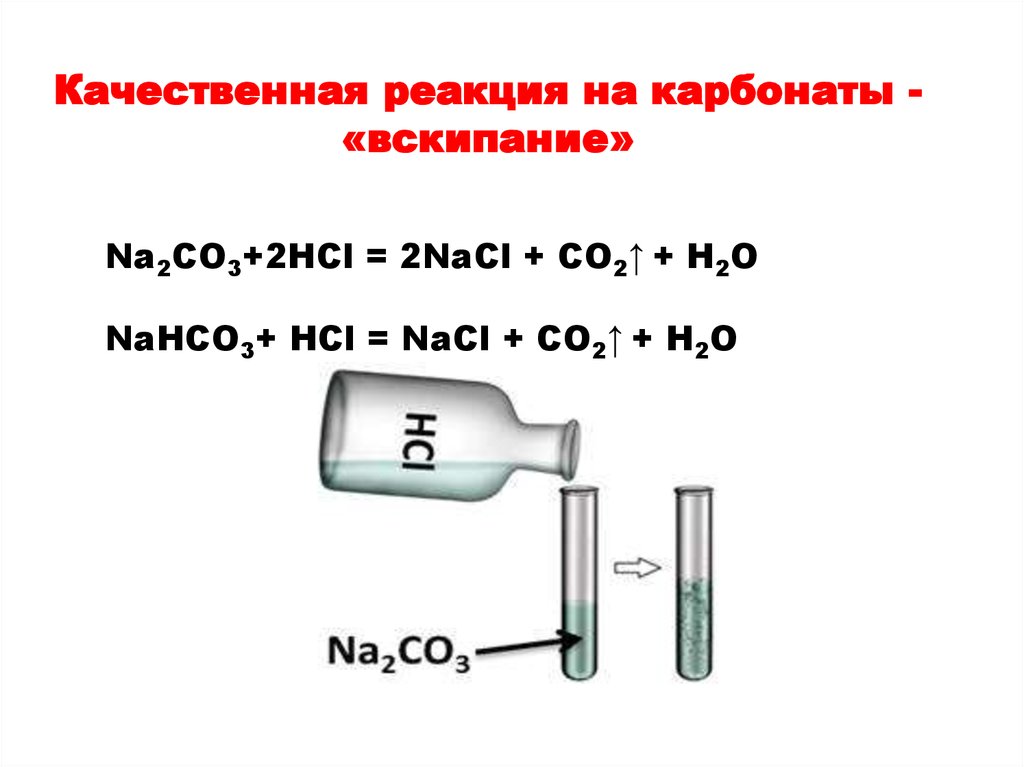
Качественная реакция на карбонаты «вскипание»Na2CO3+2HCl = 2NaCl + CO2↑ + H2O
NaHCO3+ HCl = NaCl + CO2↑ + H2O









 chemistry
chemistry








