Similar presentations:
Угольная кислота и её соли
1. Задание
1) Ознакомиться с презентацией, прочитатьпараграф 32 и на их основании сделать
опорный конспект по теме. 2) Описать
нахождение карбонатов и гидрокарбонатов в
природе (с формулами минералов!).3)
Решить задачу в конце презентации,
составить и решить аналогичную задачу.
4)Выслать фото выполненного задания на
электронный адрес учителя.
2.
3.
Угольная кислота существует только врастворе т.к. она очень легко разлагается на
углекислый газ и воду
Н2CO3
Н2O + CO2
Любая газированная вода представляет
собой раствор угольной кислоты в воде.
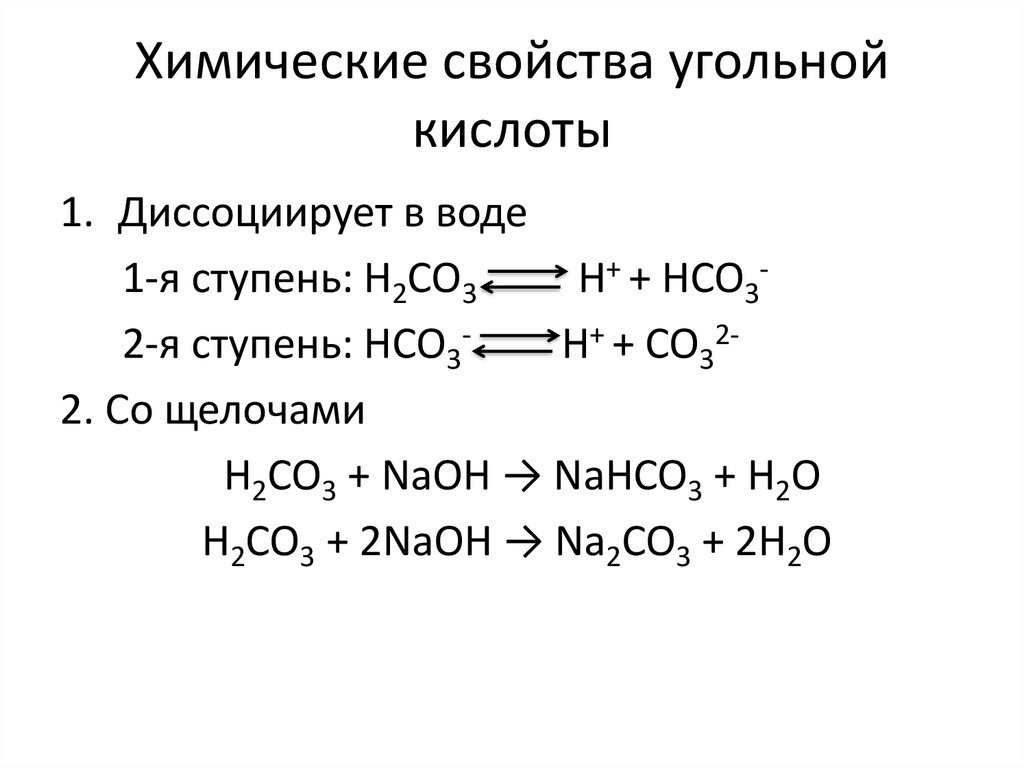
4. Химические свойства угольной кислоты
1. Диссоциирует в воде1-я ступень: H2CO3
H+ + HCO32-я ступень: HCO3H+ + CO322. Со щелочами
H2CO3 + NaOH → NaHCO3 + H2O
H2CO3 + 2NaOH → Na2CO3 + 2H2O
5.
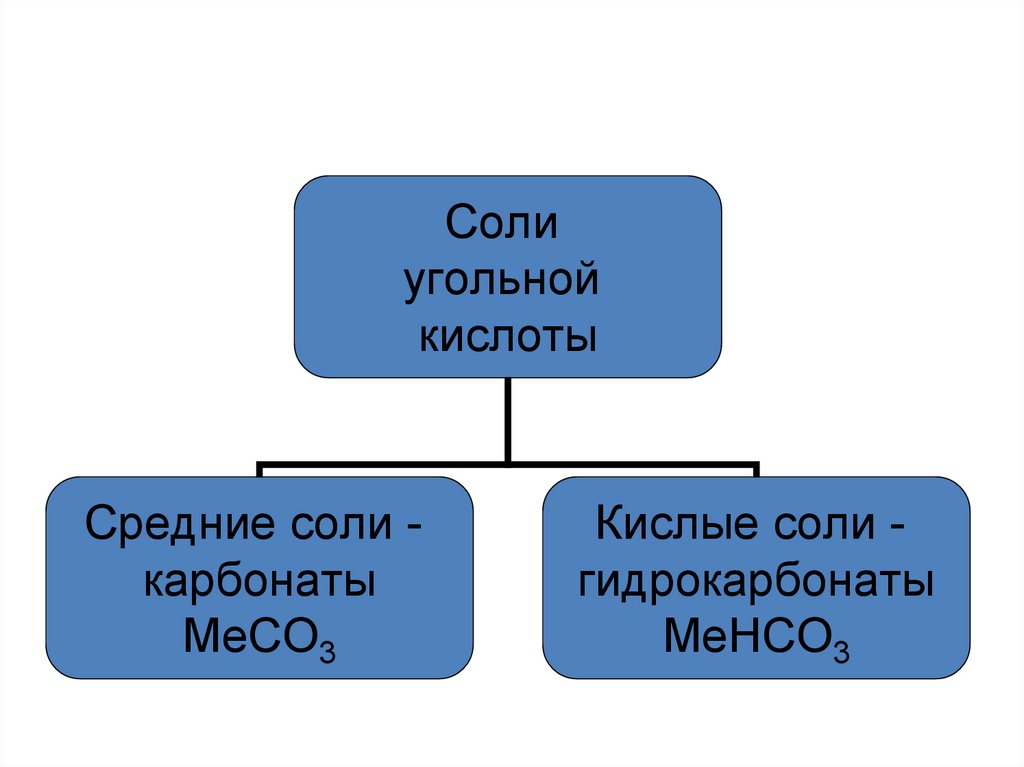
Солиугольной
кислоты
Средние соли карбонаты
MeCO3
Кислые соли гидрокарбонаты
MeHCO3
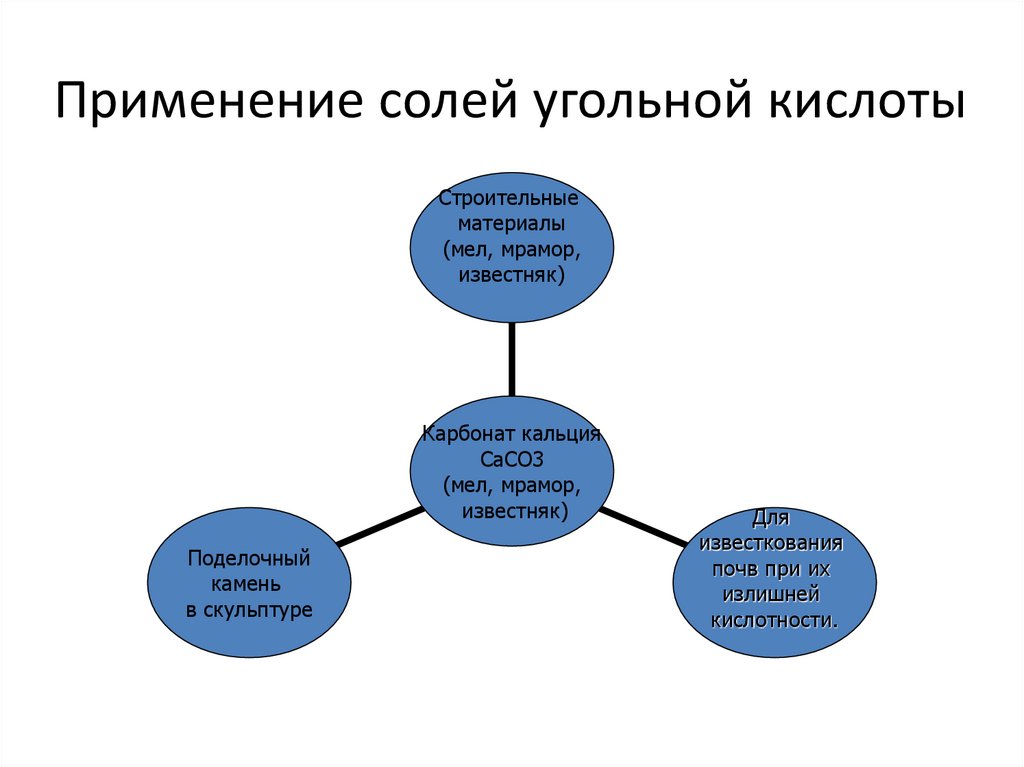
6. Применение солей угольной кислоты
Строительныематериалы
(мел, мрамор,
известняк)
Карбонат кальция
CaCO3
(мел, мрамор,
известняк)
Поделочный
камень
в скульптуре
Для
известкования
почв при их
излишней
кислотности.
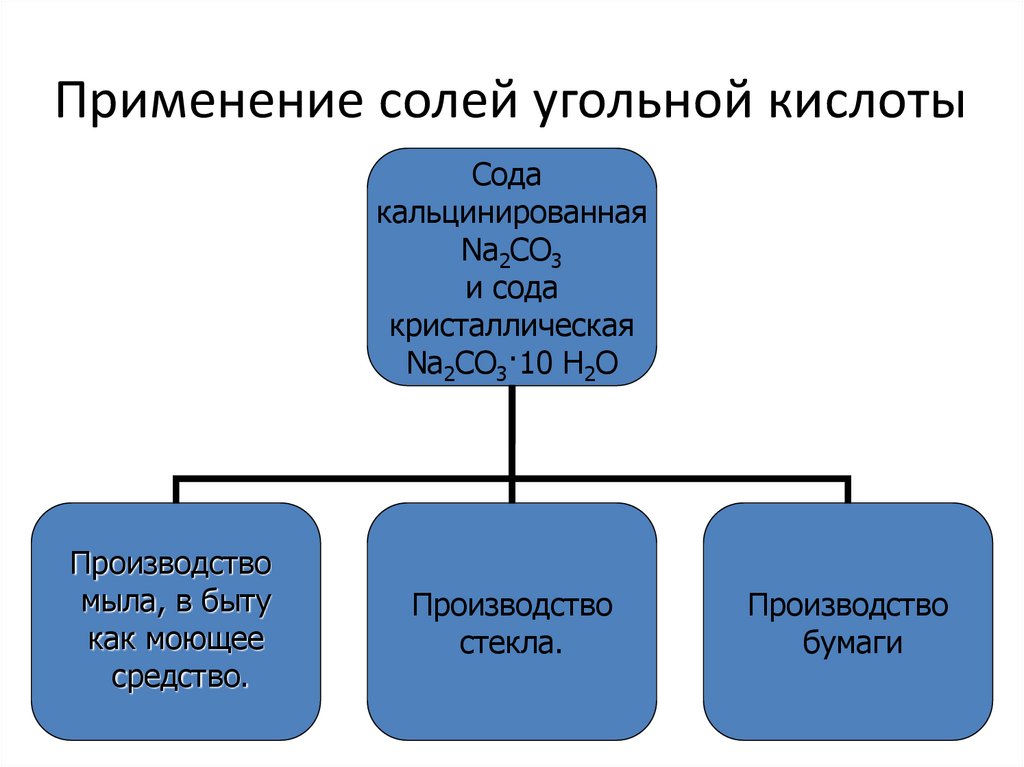
7. Применение солей угольной кислоты
Содакальцинированная
Na2CO3
и сода
кристаллическая
Na2CO3·10 H2O
Производство
мыла, в быту
как моющее
средство.
Производство
стекла.
Производство
бумаги
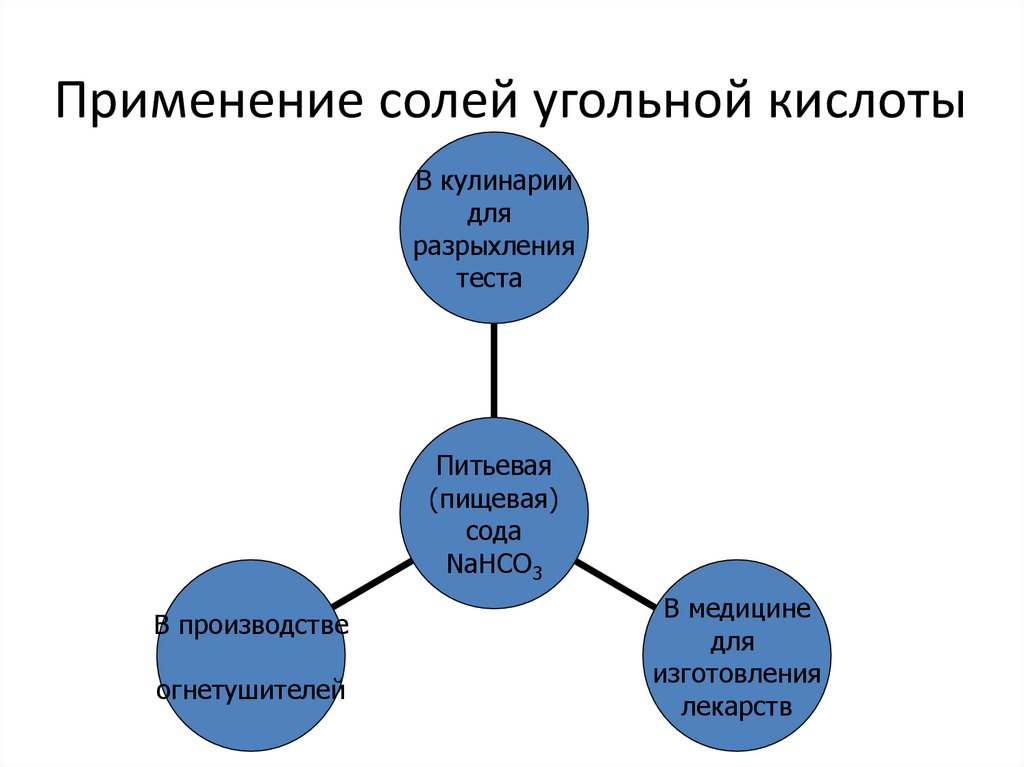
8. Применение солей угольной кислоты
В кулинариидля
разрыхления
теста
Питьевая
(пищевая)
cода
NaHCO3
В производстве
огнетушителей
В медицине
для
изготовления
лекарств
9. Химические свойства карбонатов и гидрокарбонатов
1. Разложение при нагреванииt
MeCO3 → MeO + CО2
(исключ. карбонаты металлов I A группы)
t
MeHCO3 → MeСO3 + CO2 + H2O
2. Все соли взаимодействуют с кислотами –
(Качественная реакция на ионы CO32- и HCO3 - )
MeCO3 + к-та → соль + CO2↑ + H2O
MeHCO3 + к-та → соль + CO2↑ + H2O
10. Химические свойства карбонатов и гидрокарбонатов
3. Соли угольной кислоты вступают в реакцииобмена с другими солями, если образуются
нерастворимые
или
малорастворимые
вещества.
K2CO3 + BaCl2 →
4. Карбонаты превращаются в гидрокарбонаты
при избытке углекислого газа и воды.
MeCO3 + CO2 + H2O → MeHCО3
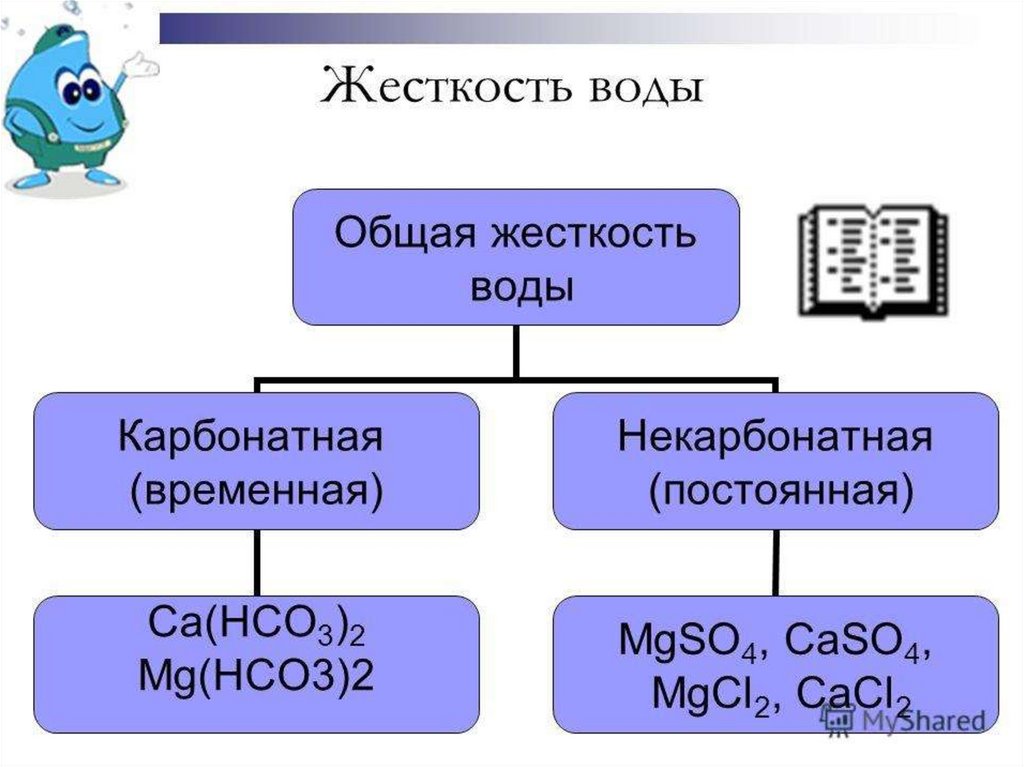
Гидрокарбонаты обуславливают временную
жесткость воды.
11.
12. Способы устранения временной жесткости воды
1. Кипячение2. Добавление соды (Na2CO3) (Так же используется и для
устранения постоянной жесткости)
3. Добавление гидроксида кальция (известковое молоко)
13. Установите соответствие между левыми и правыми частями уравнений
левые части уравненийt
1)2KHCO3 =
t
2)CaCO3 =
3)Na2CO3 + 2HCI =
4)СaCO3+CO2+H2O =
5)2KHCO3 + H2SO4 =
правые части уравнений
а)K2SO4 + 2CO2 + 2H2O
б)Ca(HCО3)2
в)K2CO3 + CO2 + H2O
г)CaO + CO2
д)2NaCI + CO2 + H2O
14. ответы
1-в
2-г
3-д
4-б
5-а
15.
• Задача:Вычислите массовую долю примесей в
образце мела массой 170г, если при его
прокаливании выделилось 33,6л
углекислого газа.









 chemistry
chemistry








