Similar presentations:
Фенол: что представляет вещество, его влияние на организм человека
1.
МБОУ Большемурашкинская средняя школаПрезентация по химии на тему
«Фенол: что представляет вещество,
его влияние на организм человека»
Выполнила: Дарвезян Хатуна
Проверила: Сарбаева О. М.
2017-2018
2.
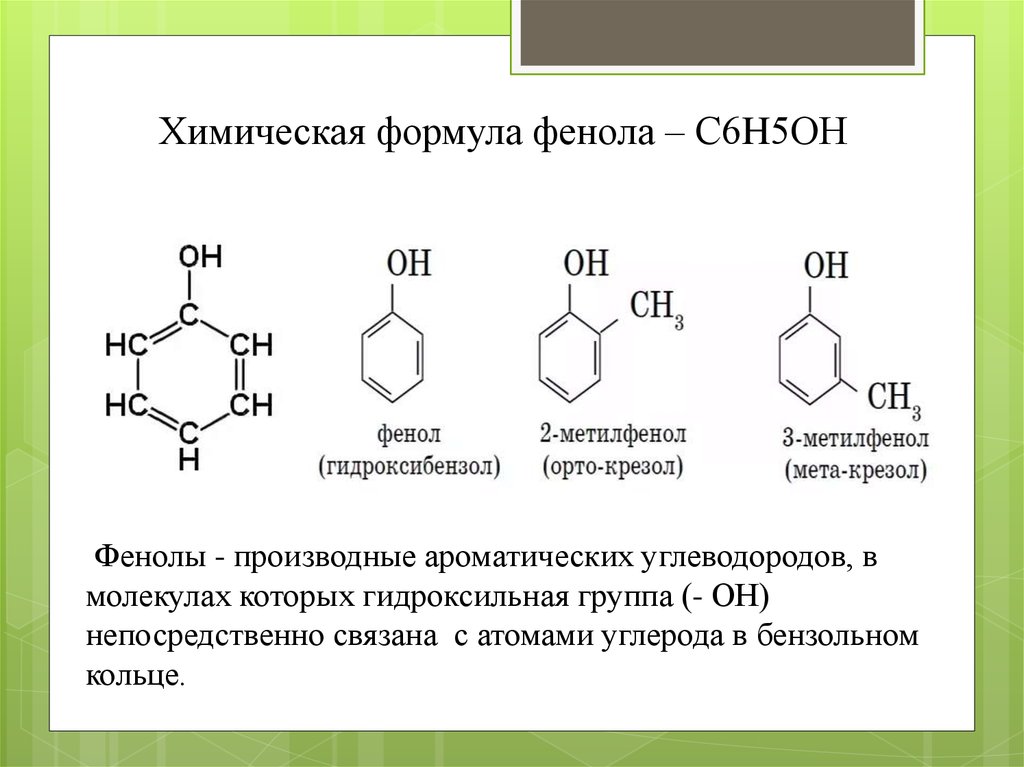
Химическая формула фенола – С6H5ОНФенолы - производные ароматических углеводородов, в
молекулах которых гидроксильная группа (- ОН)
непосредственно связана с атомами углерода в бензольном
кольце.
3.
Строение молекулыФенильная группа C6H5 – и гидроксил –ОН взаимно
влияют друг на друга
4.
Не поделённая электронная пара атома кислородапритягивается 6-ти электронным облаком бензольного кольца,
из – за чего связь О–Н еще сильнее поляризуется.
Фенол - более сильная кислота, чем вода и спирты.
В бензольном кольце нарушается симметричность
электронного облака, электронная плотность повышается в
положении 2, 4, 6. Это делает более реакционноспособными
связи С-Н в положениях 2, 4, 6. и – связи бензольного кольца.
5.
Химические свойства фенолаI. Свойства гидроксильной группы
Кислотные свойства – выражены ярче, чем у предельных спиртов (окраску
индикаторов не меняют):
Реакции с активными металлами:
2C6H5-OH + 2Na → 2C6H5-ONa + H2 - фенолят натрия
Со щелочами:
C6H5-OH + NaOH (водн. р-р) ↔ C6H5-ONa + H2O
Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой:
C6H5-ONa + H2O + СO2 → C6H5-OH + NaHCO3
По кислотным свойствам фенол превосходит этанол в 106 раз. При этом во
столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот,
фенол не может вытеснить угольную кислоту из её солей
C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных
растворах щелочей, он фактически не растворяется в водном растворе
гидрокарбоната натрия.
Кислотные свойства фенола усиливаются под влиянием связанных с
бензольным кольцом электроноакцепторных групп (NO2-, Br-)
6.
II. Свойства бензольного кольца1). Взаимное влияние атомов в молекуле фенола проявляется не только
в особенностях поведения гидроксигруппы, но и в большей
реакционной способности бензольного ядра. Гидроксильная группа
повышает электронную плотность в бензольном кольце, особенно, в
орто- и пара-положениях (+М-эффект ОН-группы):
Поэтому фенол значительно активнее бензола вступает в
реакции электрофильного замещения в ароматическом
кольце.
7.
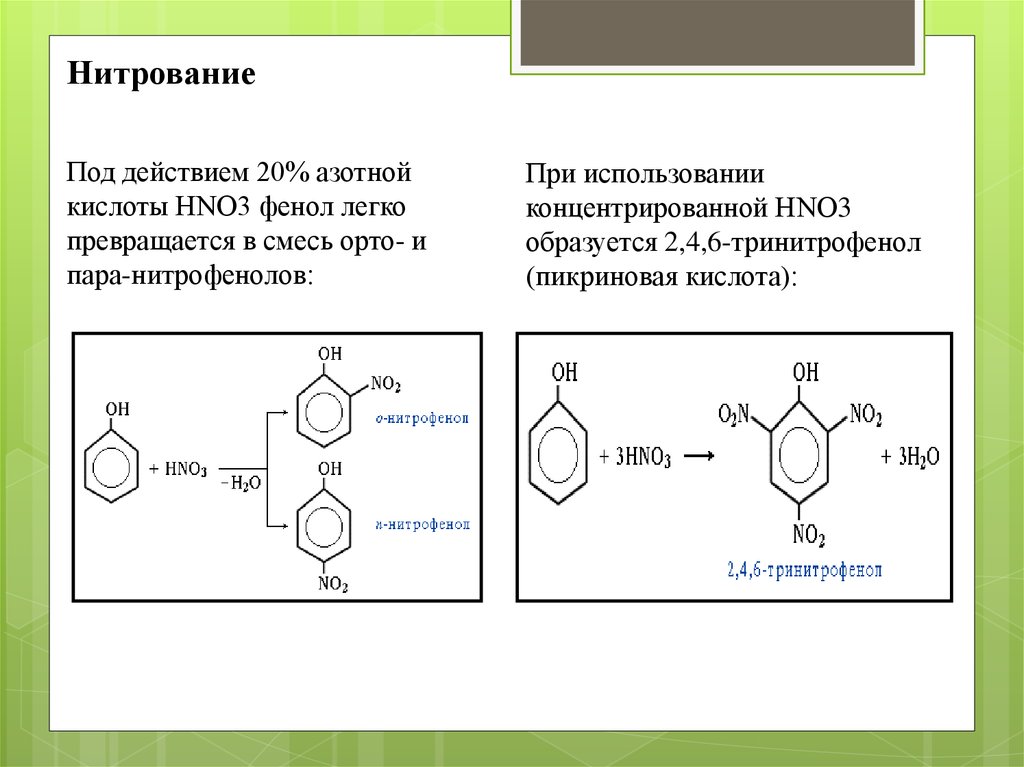
НитрованиеПод действием 20% азотной
кислоты HNO3 фенол легко
превращается в смесь орто- и
пара-нитрофенолов:
При использовании
концентрированной HNO3
образуется 2,4,6-тринитрофенол
(пикриновая кислота):
8.
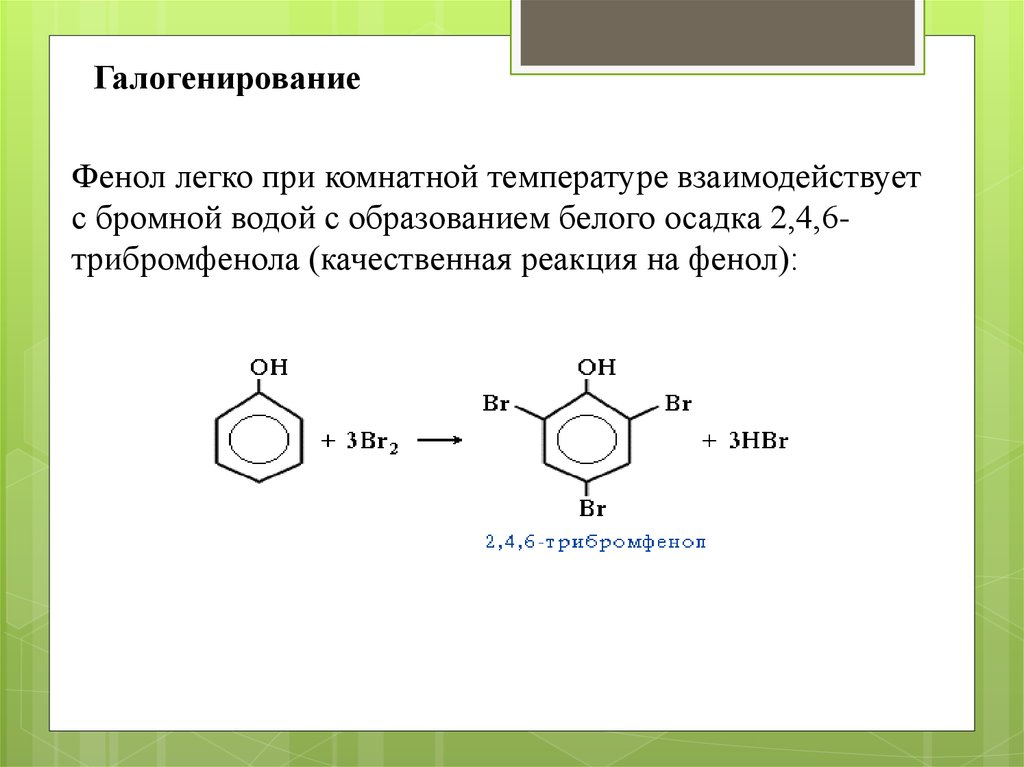
ГалогенированиеФенол легко при комнатной температуре взаимодействует
с бромной водой с образованием белого осадка 2,4,6трибромфенола (качественная реакция на фенол):
9.
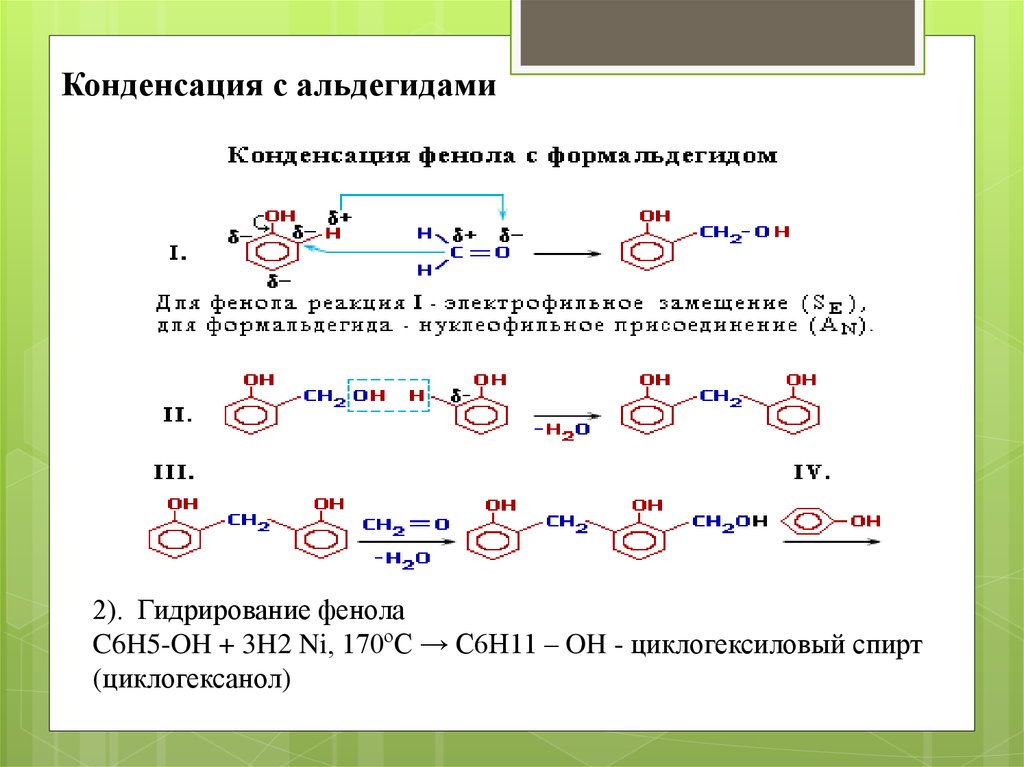
Конденсация с альдегидами2). Гидрирование фенола
C6H5-OH + 3H2 Ni, 170ºC → C6H11 – OH - циклогексиловый спирт
(циклогексанол)
10.
Физические свойстваБольшинство одноатомных фенолов при нормальных условиях
представляют собой бесцветные кристаллические вещества с
невысокой температурой плавления и характерным запахом.
Фенолы малорастворимый в воде, хорошо растворяются в
органических растворителях, токсичны, при хранении на воздухе
постепенно темнеют в результате окисления.
Фенол C6H5OH (карболовая кислота) — бесцветное
кристаллическое вещество на воздухе окисляется и становится
розовым, при обычной температуре ограниченно растворим в
воде, выше 66 °C смешивается с водой в любых соотношениях.
Фенол — токсичное вещество, вызывает ожоги кожи, является
антисептиком
11.
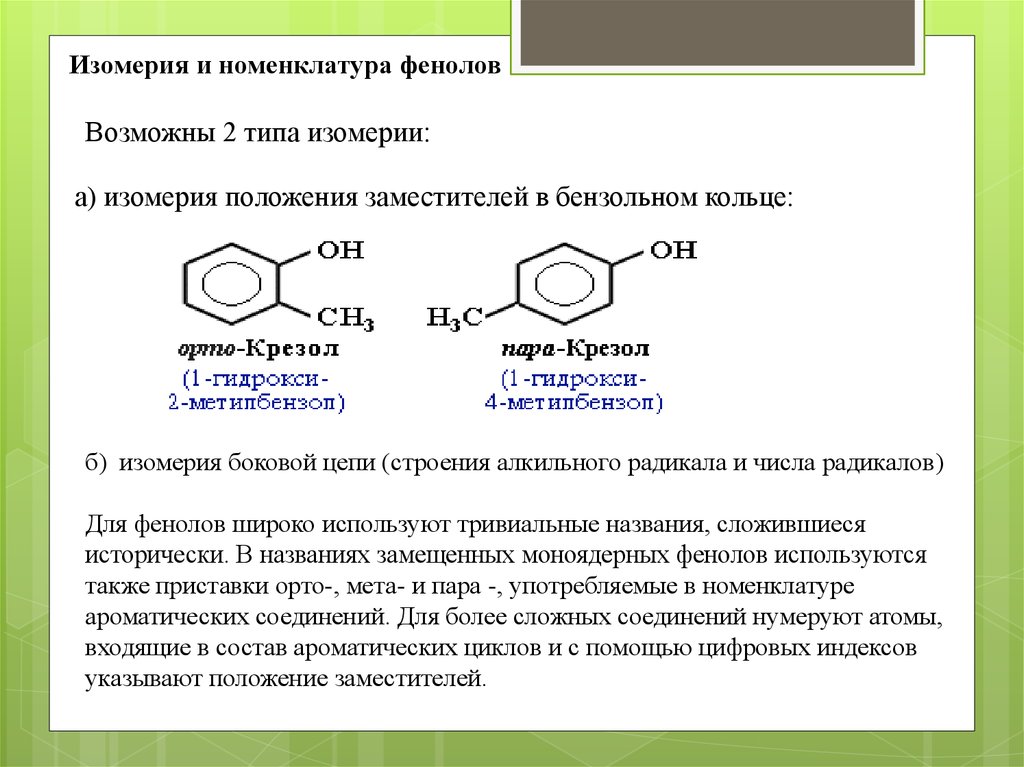
Изомерия и номенклатура феноловВозможны 2 типа изомерии:
а) изомерия положения заместителей в бензольном кольце:
б) изомерия боковой цепи (строения алкильного радикала и числа радикалов)
Для фенолов широко используют тривиальные названия, сложившиеся
исторически. В названиях замещенных моноядерных фенолов используются
также приставки орто-, мета- и пара -, употребляемые в номенклатуре
ароматических соединений. Для более сложных соединений нумеруют атомы,
входящие в состав ароматических циклов и с помощью цифровых индексов
указывают положение заместителей.
12.
Токсические свойстваФенол ядовит. Вызывает нарушение функций нервной системы.
Пыль, пары и раствор фенола раздражают слизистые оболочки глаз,
дыхательных путей, кожу. Попадая в организм, Фенол очень быстро
всасывается даже через неповрежденные участки кожи и уже через
несколько минут начинает воздействовать на ткани головного мозга.
Сначала возникает кратковременное возбуждение, а потом и паралич
дыхательного центра. Даже при воздействии минимальных доз
фенола наблюдается чихание, кашель, головная боль,
головокружение, бледность, тошнота, упадок сил. Тяжелые случаи
отравления характеризуются бессознательным состоянием, синюхой,
затруднением дыхания, нечувствительностью роговицы, скорым,
едва ощутимым пульсом, холодным потом, нередко судорогами.
Зачастую фенол является причиной онкозаболеваний.
13.
Применение фенолов1. Производство синтетических смол, пластмасс,
полиамидов;
2.
Лекарственных препаратов;
3.
Красителей;
4.
Поверхностно-активных веществ;
5.
Антиоксидантов;
6.
Антисептиков;
7.
Взрывчатых веществ;
14.
Строение молекулыФенильная группа C6H5
– и гидроксил –ОН
взаимно влияют друг на
друга
Неподеленная электронная пара атома кислорода
притягивается 6-ти электронным облаком
бензольного кольца, из – за чего связь О–Н еще
сильнее поляризуется.
Фенол - более сильная кислота, чем вода и
спирты.
В бензольном кольце нарушается симметричность электронного облака,
электронная плотность повышается в положении 2, 4, 6. Это делает более
реакционноспособными связи С-Н в положениях 2, 4, 6. и – связи бензольного
кольца.










 chemistry
chemistry








