Similar presentations:
Правила образования названий разветвленных алканов по международной номенклатуре (ИЮПАК)
1. Правила образования названий разветвленных алканов по международной номенклатуре (ИЮПАК)
Лекция №12. Правило.
4 «С»1.
Найти самую
длинную
(главную)
2.
неразветвленн
ую цепь
углеродных
3.
атомов.
Таким образом, в данном соединении главная цепь содержит 6 углеродных
атомов.
5 «С»
6 «С»
3.
65
4
3
Пронумеровать атомы
CH3 − CH2 − CH2 − CH − CH3
углерода главной
∣
цепи. Номер атома
2 CH2
углерода, у которого
∣
находится
1 CH3
заместитель
(алкильный радикал),
3
должен быть
CH3 − CH2 − CH2 − CH − CH3
наименьшим.
∣
Указать положение
CH2
заместителя (номер
∣
CH3
атома углерода, у
3-….
которого находится
алкильный радикал).
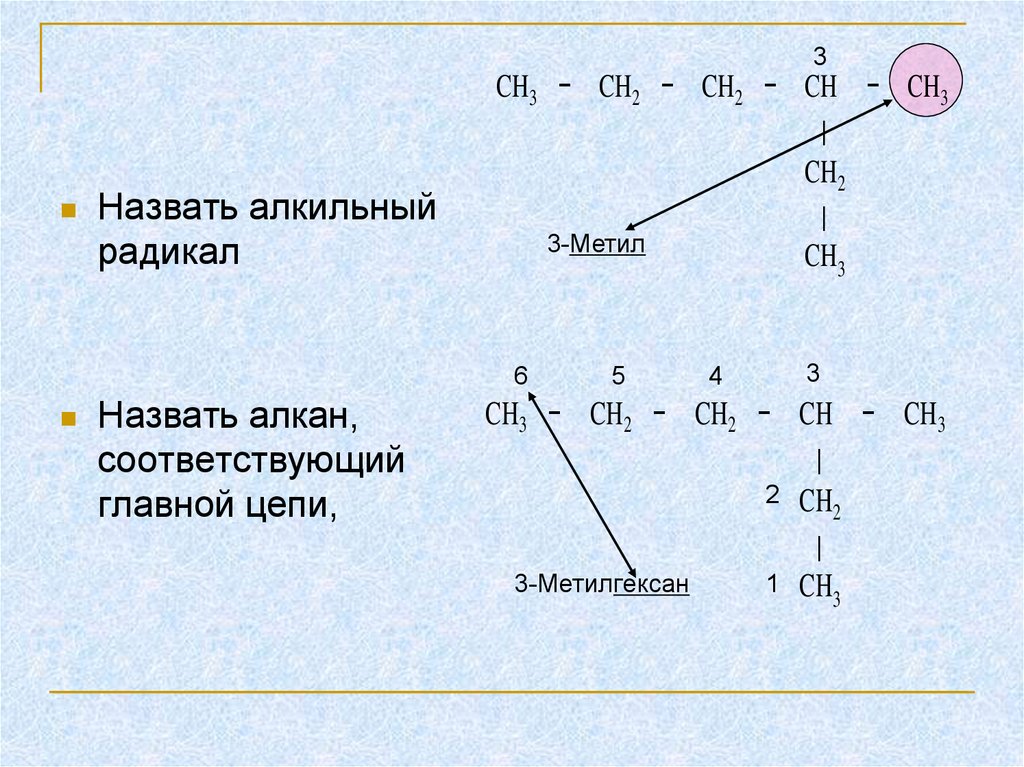
4.
3Назвать алкильный
радикал
CH3 − CH2 − CH2 − CH − CH3
∣
CH2
∣
3-Метил
CH3
6
Назвать алкан,
соответствующий
главной цепи,
5
4
3
CH3 − CH2 − CH2 − CH − CH3
∣
2 CH
2
∣
3-Метилгексан
1 CH
3
5.
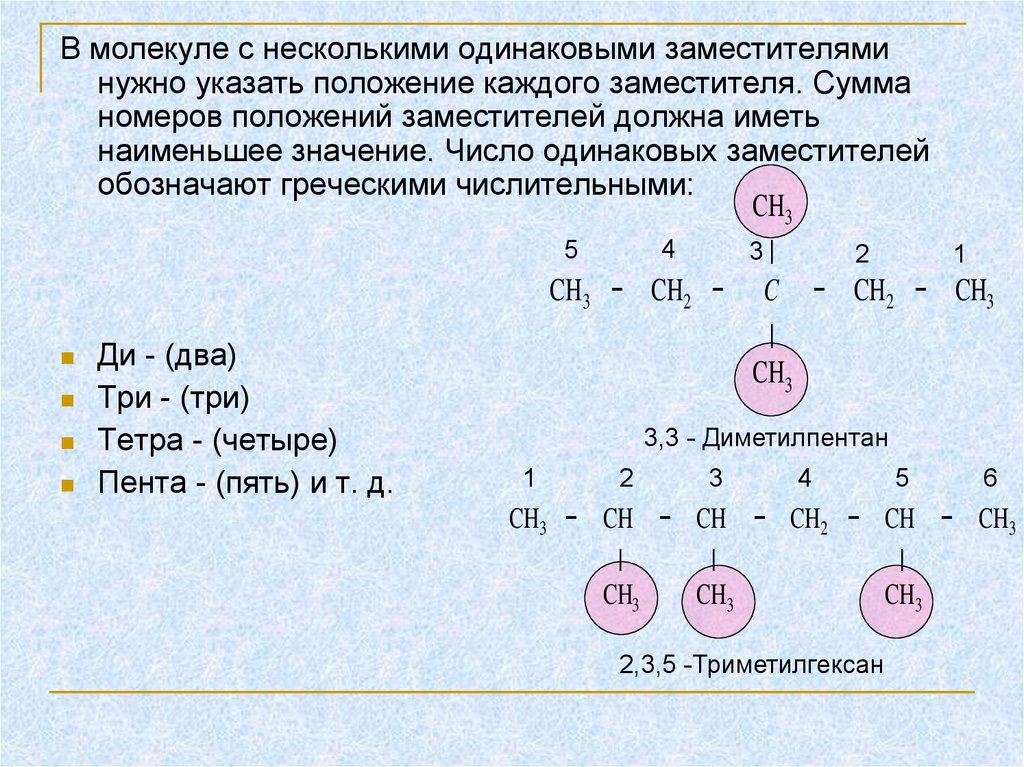
В молекуле с несколькими одинаковыми заместителяминужно указать положение каждого заместителя. Сумма
номеров положений заместителей должна иметь
наименьшее значение. Число одинаковых заместителей
обозначают греческими числительными:
CH3
4
5
3∣
2
1
CH3 − CH2 − C − CH2 − CH3
∣
Ди - (два)
CH3
Три - (три)
3,3 - Диметилпентан
Тетра - (четыре)
1
2
3
4
5
6
Пента - (пять) и т. д.
CH3 − CH − CH − CH2 − CH − CH3
∣
∣
∣
CH3
CH3
CH3
2,3,5 -Триметилгексан
6. Свойства алканов
7. Физические свойства алканов
СН4... С4Н10— Газы (без запаха)
С5Н12... С15Н32 — Жидкости (имеют запах)
C16H34
— Твердые вещества (без
запаха)
t° кипения и t° плавления увеличиваются
Алканы — бесцветные вещества, легче
воды, плохо растворяются в воде.
8. Химические свойства алканов
Для алканов наиболее характерныреакции замещения.
В этих реакциях происходит
гомолитическое расщепление
ковалентных связей.
9. Реакция замещения (разрыв связей С-Н)
1. Реакция замещения (разрывсвязей С-Н)
RH XY
RX HY
или
∣
− С − H
∣
X − Y
∣
− C − X
∣
HY
10. 1.1 Галогенирование
Галогенирование (замещение атома водородаатомом галогена с образованием галогеналкана
RHal).
CH3− CH2 Cl2
HCl¿
Низшие алканы можно прохлорировать
полностью.
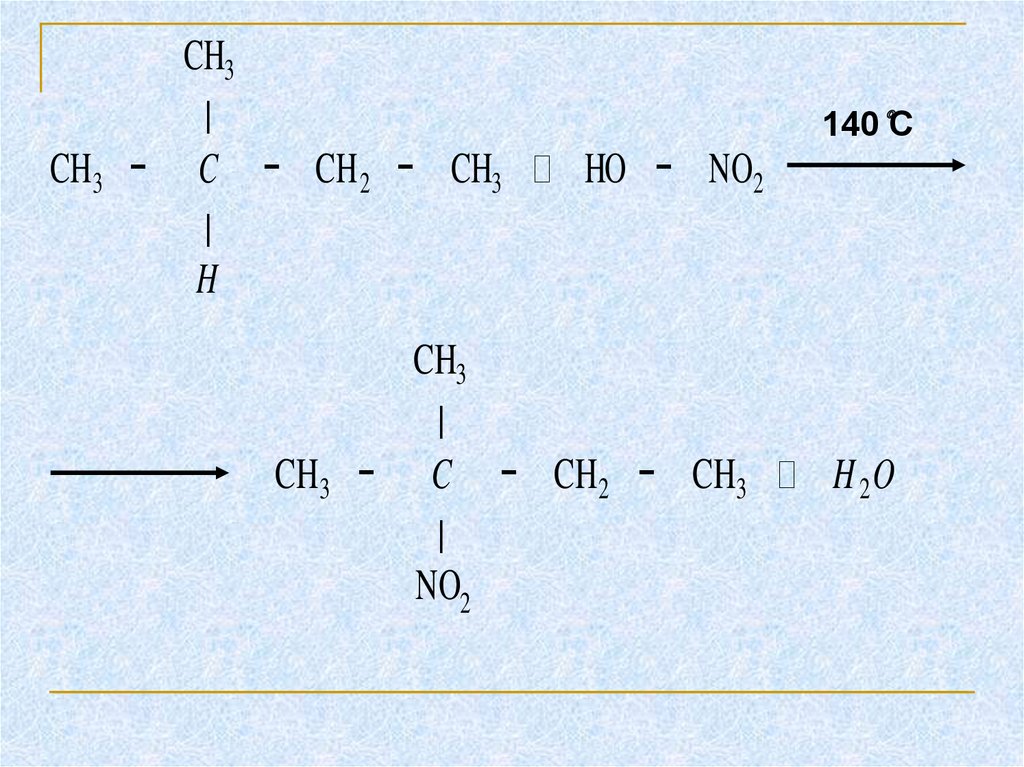
11. 1.2 Нитрование
Нитрование (замещение атома водороданитрогруппой — NO2 с образованием
нитроалканов R—NO2). Нитрующий реагент —
азотная кислота HNO3(HO—NO2).
В результате реакции образуется смесь
изомерных нитросоединений. Наиболее легко
замещаются атомы водорода у третичного атома
углерода, труднее – у вторичного, наиболее
трудно – у первичного:
12.
CH3∣
CH3 − C − CH 2 − CH3
∣
H
140°C
HO − NO2
CH3
∣
CH3 − C − CH2 − CH3
∣
NO2
H 2O
13. 1.3 Сульфирование.
Замещение атома водородасульфогруппой — SO3H с образованием
алкансульфокислот.
Сульфирующий реагент — серная кислота
H2SO4 (HO-SO3H).
14. 2. Реакция окисления
При обычных условиях алканыустойчивы к действию окислителей
(КMnО4, К2Сг207).
15. 2.1 Окисление кислородом воздуха при высоких температурах (горение).
полное окисление (избыток О2) с образованиемуглекислого газа и воды:
CO2
2H2 O ¿
Не полное окисление (недостаток О2)
2CO2
4H2 O ¿
2CO2 2H2 O ¿
16. 2.2 Окисление кислородом воздуха при невысоких температурах в присутствии катализаторов (не полное каталитическое окисление).
В результате могут образоваться альдегиды, кетоны R
O
R −
C
H
− C − R,
∣∣
O
спирты ROH,
карбоновые кислоты RCOOH
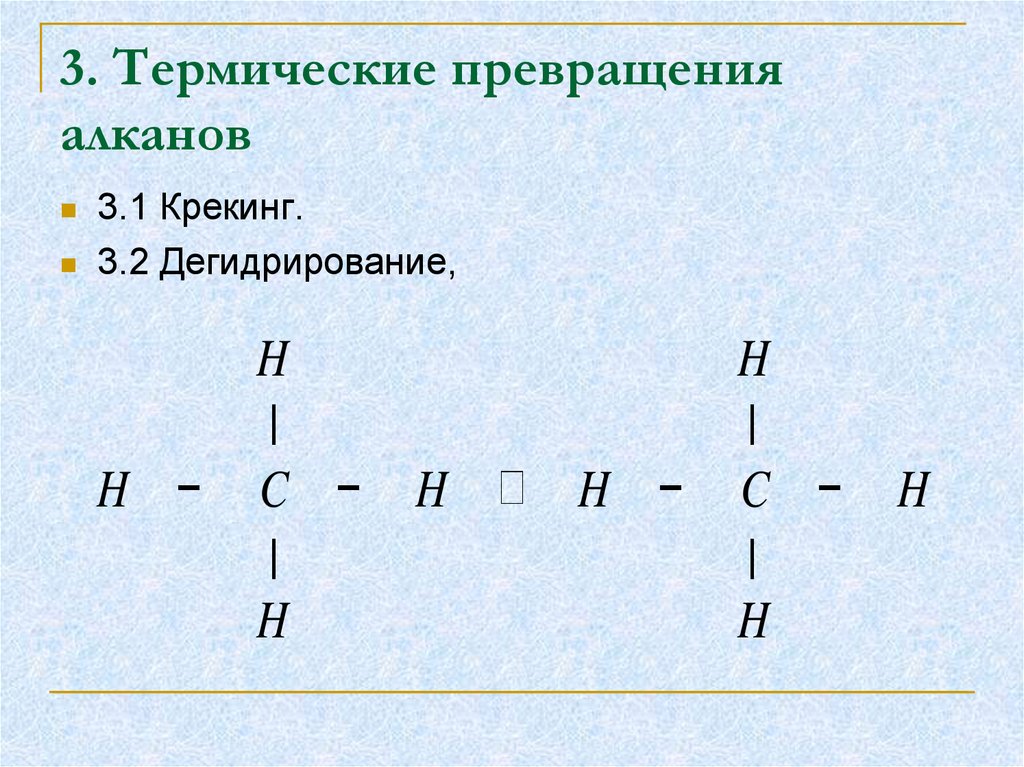
17. 3. Термические превращения алканов
3.1 Крекинг.3.2 Дегидрирование,
H −
H
∣
C −
∣
H
H
H −
H
∣
C −
∣
H
H
18. 3.1 Крекинг
Крекинг (англ. cracking — расщепление) —это разрыв связей С — С в молекулах
алканов с длинными углеродными цепями,
в результате которого образуются алканы
и алкены с меньшим числом атомов
углерода.
Термический крекинг (пиролиз)
осуществляется при температуре 450—
700о С.
19. 3.1 Дегидрирование
Дегидрирование:отщепление водорода происходит в результате
разрыва связей С — Н;
Осуществляется в присутствии катализаторов при
повышенных температурах.
При дегидрировании метана образуется этим
(ацетилен):
t°, кат.
CnH2n+2
C 2H 6
этан
t°, кат.
CnH2n+H2
C2H4+H2
этен
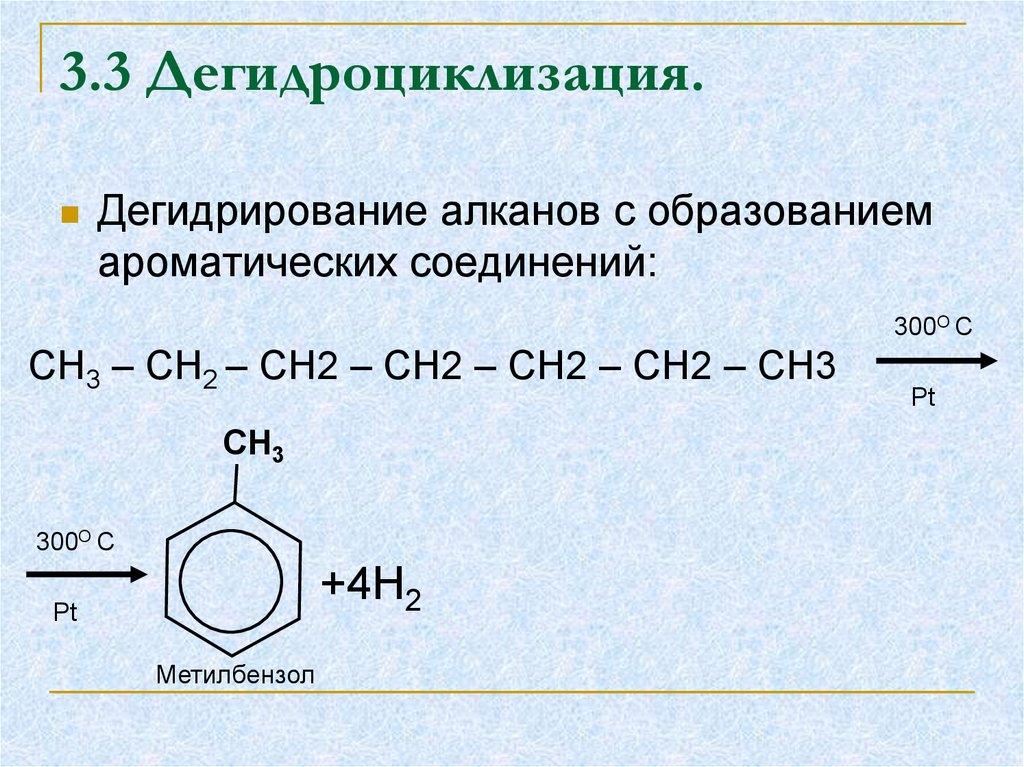
20. 3.3 Дегидроциклизация.
Дегидрирование алканов с образованиемароматических соединений:
300O C
CH3 – CH2 – CH2 – CH2 – CH2 – CH2 – CH3
CH3
300O C
+4H2
Pt
Метилбензол
Pt
21. 3.4 Изомеризация
Изомеризация – превращение химическогосоединения в его изомер:
н-алкан изоалкан
22. Способы получения алканов
Каждый класс органических соединенийхарактеризуется рядом общих методов
синтеза. Последние позволяют судить о
связи соединений данного класса с
соединениями других классов и о путях их
взаимных превращений.
Синтез из непредельных углеводородов
Каталитическое гидрирование (+H2)
непредельных углеводородов.

















 chemistry
chemistry








