Similar presentations:
Непредельные, ненасыщенные, ацетиленовые алкины
1. АЛКИНЫ (непредельные, ненасыщенные, ацетиленовые)
Общая формула СnH2n-2Алкины – это углеводороды, в молекулах которых помимо одинарных
связей между атомами углерода присутствует одна тройная связь (2π-связь).
2. I. Строение и общие свойства
Первый представитель ряда алкинов – ацетилен Н-С≡С-НАтом С находится в sp-гибридизации,
состоящей из 2 sp-гибридизованных орбиталей
и 2 p-орбиталей
π
Н
σ С σ С
σ
π
Н
σ-Связи С-С и С-Н находятся в одной плоскости
под углом 180 0 друг к другу,
Две π-связи перпендикулярны плоскости σ-связи,
и перпендикулярны по отношению друг к другу.
Характеристика С≡С связи:
энергия (σ – π)
828 кДж/моль
длина
0,120 нм
валентный угол
180 0
3. II. Изомерия и номенклатура алкинов
Гомологический ряд алкинов СnH2n-2Формула
Название
брутто
структурная
систематическое
рациональное
С2Н2
СН≡СН
этин
ацетилен
С3Н4
СН≡С-СН3
пропин
метилацетилен
С4Н6
СН≡С-СН2-СН3
бутин-1
этилацетилен
С4Н6
СН3-С≡С-СН3
бутин-2
диметилацетилен
С5Н8
СН ≡ С-СН2-СН2-СН3
пентин-1
пропилацетилен
В названии по систематической номенклатуре:
1. Главная цепь, обязательна должна содержать тройную связь.
2. Нумерация цепи с той стороны, где ближе тройная связь.
3. В названии углеводорода после суффикса –ин, цифрой
указывают положение двойной связи.
1
2
3
CH3-CH-C
CH3
4 5
6
7
C-CH-CH2-CH3
CH3 метил
2,5-диметигептин-3
4.
Рациональная номенклатура:Названия алкинов дают от родоначальника ряда ацетилена, представляя,
что атомы водорода замещены на радикалы.
Записывая название соединения, радикалы располагают по алфавиту.
CH3-CH-C
C-CH-CH2-CH3
CH3
CH3
втор-бутилизопропилацетилен
Для алкинов характерно несколько видов изомерии:
• изомерия углеродного скелета
C5H8
1
HC
2
3
4
5
C-CH2-CH2-CH3
пентин-1
4
3
2
1
CH3-CH-C CH
CH3 3-метилбутин-1
• изомерия положения тройной связи
С4Н6
СН≡С-СН2-СН3
бутин-1
• межклассовая изомерия
C6 H12
СН3-С≡С-СН3
бутин-2
CH2=CH-CH=CH-CH2-CH3
гексадиен-1,3
циклогексен
5.
III. Физические свойстваФизические свойства закономерно изменяются, с ростом молекулярной массы,
но имеют более высокие температуры плавления и кипения.
Ацетилен – бесцветный, легко сжижаемый газ с т.кип. -84 0С.
При горении ацетилена в чистом кислороде, в его пламени развивается
температура до 3 000 0С.
Образует с воздухом взрывчатые смеси при его содержании от 3 до 82 %.
Слабо растворим в воде и этаноле, умеренно в ацетоне, особенно под давлением.
IV. Способы получения
1. Карбидный способ – промышленный и лабораторный метод.
Ca
C
+
H-OH
H-OH
C
карбид кальция – СаС2
H-C
C-H + Ca(OH)2
ацетилен
6.
2. Пиролиз природного газа – основная часть которого метан.2 CH4
метан
0
1500 C H-C
C-H
ацетилен
+
3H 2
3. Дегидрогалогенирование дигалогенпроизводных соединений.
H Cl
2 KOH
H-C - C-H
спирт. .р-р
Cl H
1,2-дихлорэтан
H Br
CH3- C - C - H 2 KOH
спирт. .р-р
H Br
1,2-дибромпропан
H-C
C-H + 2 KCl + 2 H2 O
ацетилен
CH3-C
C-H + 2 KBr + 2 H2 O
ацетилен
Отщепление галогеноводорода протекает по правилу Зайцева.
7.
V. Химические свойстваУчитывая особенности тройной связи, для алкинов характерны реакции
присоединения, которые протекают в две стадии, т.е. с избытком реагента.
1. Гидрирование – присоединение водорода, с образованием алкенов и алканов.
H-C
C-CH3
пропин
H2
Ni t
CH2 = CH-CH3
пропилен
H2
Ni t
CH3-CH2-CH3
пропан
2. Галогенирование – присоединение галогенов (Cl2, Br2, I2) с образованием
тетрагалогенпроизводных.
Cl Cl
HC
CH + Cl 2
ацетилен
CH = CH + Cl2
Cl Cl
1,2-дихлорэтан
CH - CH
Cl Cl
1,1,2,2-тетрахлорэтан
8.
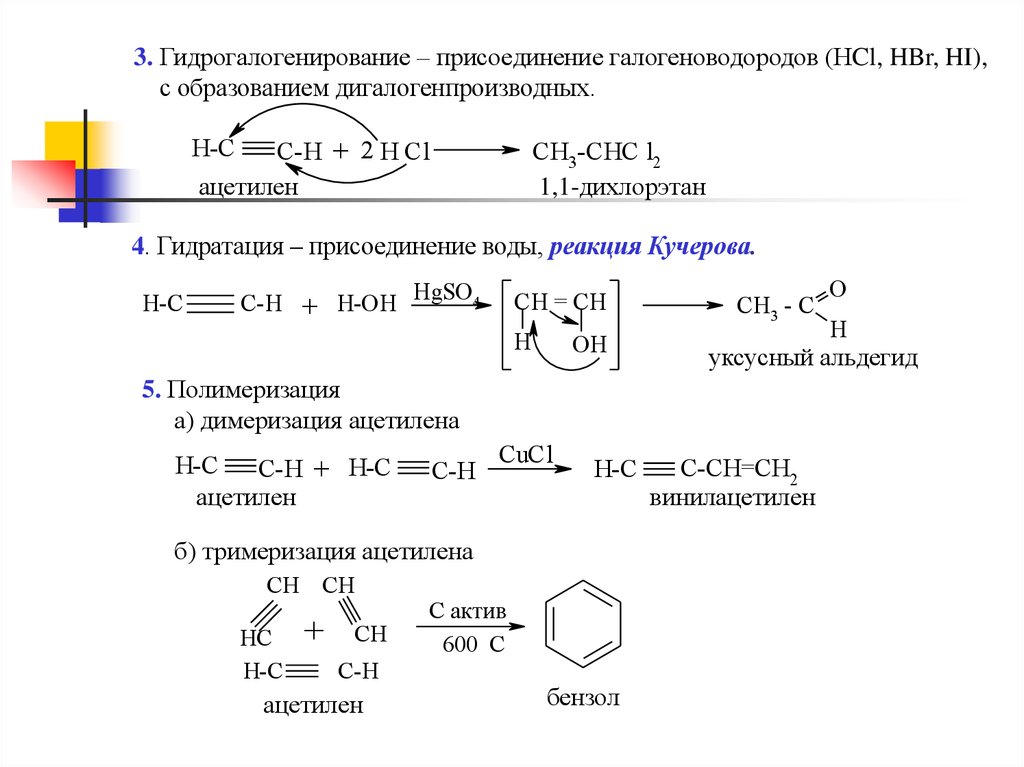
3. Гидрогалогенирование – присоединение галогеноводородов (НCl, HBr, HI),с образованием дигалогенпроизводных.
H-C
C-H + 2 H Cl
ацетилен
CH3-CHC l2
1,1-дихлорэтан
4. Гидратация – присоединение воды, реакция Кучерова.
H-C
C-H + H-OH
HgSO4
CH = CH
H
OH
CH3 - C
C-H
CuCl
H-C
б) тримеризация ацетилена
CH CH
HC
H-C
+
CH
C-H
ацетилен
C актив
600 С
бензол
H
уксусный альдегид
5. Полимеризация
а) димеризация ацетилена
H-C
C-H + H-C
ацетилен
O
C-CH=CH2
винилацетилен
9.
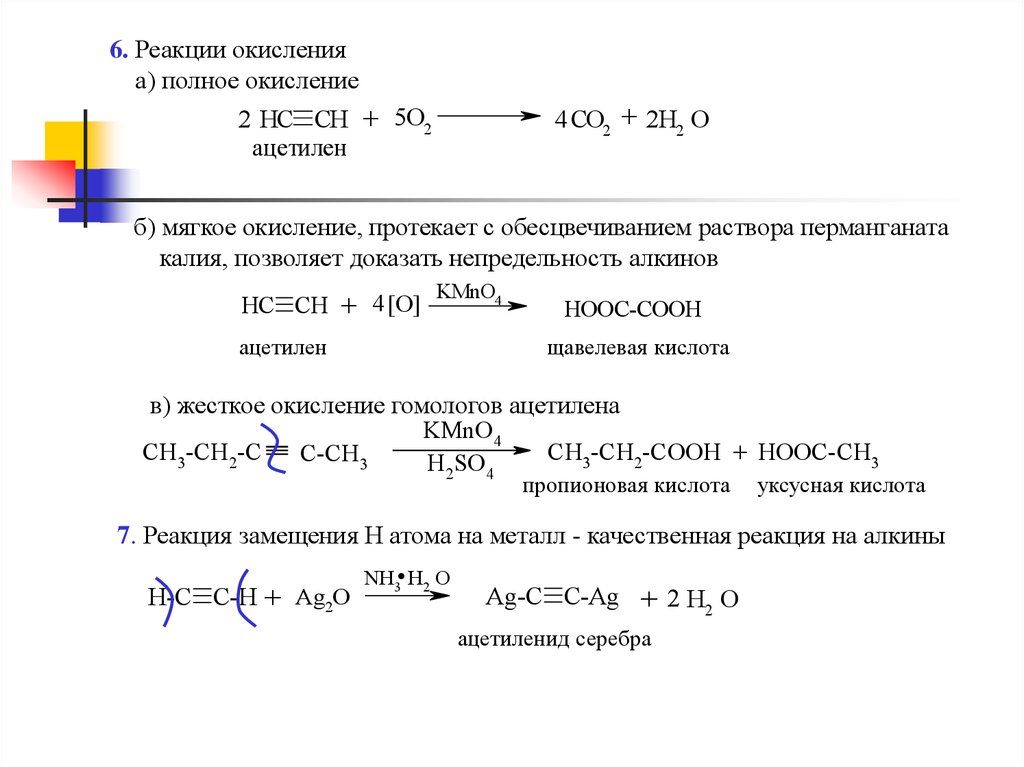
6. Реакции окисленияа) полное окисление
4 CO2 + 2H2 O
2 HC CH + 5O2
ацетилен
б) мягкое окисление, протекает с обесцвечиванием раствора перманганата
калия, позволяет доказать непредельность алкинов
HC CH + 4 [O]
KMnO4
ацетилен
HOOC-COOH
щавелевая кислота
в) жесткое окисление гомологов ацетилена
KMnO4
CH3-CH2-C
CH3-CH2-COOH + HOOC-CH3
C-CH3
H2SO4
пропионовая кислота
уксусная кислота
7. Реакция замещения Н атома на металл - качественная реакция на алкины
H-C C-H + Ag2O
.
NH3 H2 O
Ag-C C-Ag + 2 H2 O
ацетиленид серебра
10. VI. Применение
Алкины не используют в качестве топлива, вследствие высокой химическойактивности, их выгоднее использовать в качестве исходного сырья для
промышленного синтеза.
Чаще всего используется ацетилен для получения:
ацетилен НС≡СН – для сварки и резки металлов;
этилового спирта C2H5OH – в производстве парфюмерных средств;
хлористый винил СН2=СНСl – в производстве полихлорвинила
(канцелярская пластмасса);
уксусной кислоты CH3-COOH - в производстве красителей и лекарств;
акрилонитрил СН2=СН-СN – синтетические волокна;
хлоропрен СH2=CHCl-CH=CH2 - в производстве автошин;
хлорпроизводные – хорошие растворители.
11. АЛКАДИЕНЫ
Общая формула СnH2n-2Диеновые углеводороды – это непредельные углеводороды,
в молекулах которых имеются две двойные связи.
Различают три типа диенов, в зависимости от расположения двойных связей:
а) с кумулированными двойными связями
СH2=C=CH2
пропадиен
аллен
б) с сопряженными двойными связями
СH2=CH-CH=CH2
бутадиен-1,3
CH2 =CH-CH=CH-CH3
пентадиен-1,3
дивинил
CH2 =C-CH=CH2
CH3
2-метилбутадиен-1,3
в) с изолированными двойными связями
CH2=CH-CH2-CH2-CH=CH2
(изопрен)
гексадиен-1,5
12.
Методы получения1. Дегидрирование н-бутана (двухстадийный каталитический процесс).
H
Cr2 O3 550-600 0 C CH2 =CH-CH2 -CH3+ 2 MgO, ZnO
CH2 =CH-CH=CH2
бутен-1
CH3 -CH2 -CH2 -CH3
550-600
C
бутадиен-1,3
CH3 -CH=CH-CH3 + H 2
Al2 O3
бутен-2
Аналогичным способом получают изопрен (2-метилбутадиен-1,3).
Al2 O3 , Cr2 O3
CH3 -CH-CH2 -CH3 550-600
0
C
CH3
CH2 =CH-CH=CH2
CH3
2. Метод Лебедева, включает две реакции одновременно - дегидратацию и
дегидрирование. Промышленный метод получения дивинила.
2 CH3-CH2-OH
этиловый спирт
Al2 O3, ZnO
425 0C
CH2=CH-CH=CH2 + 2 H2 O + H 2
бутадиен-1,3
Физические свойства
В обычных условиях пропадиен-1,2 (аллен) и бутадиен-1,3 – газы,
2-метилбутадиен-1,3 (изопрен) – летучая жидкость.
13.
Химические свойстваДиены способны присоединять водород, галогены, галогеноводороды.
Особенностью присоединения к диенам является способность присоединять
молекулы как в положение 1,2- так и в положение 1,4-.
1,2СH2=CH-CH=CH2 + H 2
бутадиен-1,3
CH3-CH2-CH=CH2
бутен-1
1,4- CH -CH=CH-CH
3
3
бутен-2
Br Br
CH2-CH-CH=CH2
3,4-дибромбутен-1
1,4 CH -CH=CH-CH
2
2
Br
Br
1,4-дибромбутен-2
1,2
СH2=CH-CH=CH2 + Br2
бутадиен-1,3
H2
CH3-CH2-CH2-CH3
бутан
Br Br Br Br
CH2-CH-CH-CH2
1,2,3,4-тетрабромбутан
Br2
14. Реакции полимеризации Реакция является основой для получения синтетических каучуков.
.... -CH2-CH=CH-CH2- .....n СH2=CH-CH=CH2
синтетический n
бутадиеновый каучук
бутадиен-1,3
Полимеризация сопряженных диенов протекает по механизму 1,4-присоединения,
в этом случае звено имеет цис- или транс-конфигурацию:
H
....
С=С
CH2
CH2
цис-
H
H
.....
CH2
С=С
CH2
....
H
транс-
Вулканизация – процесс, в котором происходит сшивание полимерных цепей за
счет сульфидных мостиков, с образованием эластичного материала, называемого
резиной. Нагревании каучука проводят с серой в количестве 8%.
Это приводит к увеличению прочности, устойчивости к истиранию, к действию
органических растворителей и других веществ.
15. Применение
Основная область применения диенов – это получение полимеров,обладающих высокой эластичностью и напоминающих природный каучук.
изопрен (2-метилбутадиен-1,3) натуральный каучук – в
производстве камер и покрышек для автомобилей, самолетов,
мотоциклов, тракторов, велосипедов, для производства обуви,
игрушек;
дивинил (бутадиен-1,3) синтетический каучук – в производстве шин,
обмотки кабелей и проводов;
хлоропрен (2-хлорбутадиен-1,3) – в производстве резины,
обладающей бензо-, масло- и теплостойкость.
16. ЦИКЛОАЛКАНЫ (циклопарафины)
Общая формула СnH2nЦиклоалканы – это предельные насыщенные углеводороды, в молекулах которых
атомы углерода связаны между собой в замкнутые цепи.
CH2
CH2
CH2
циклопропан
CH2
CH2
CH2
CH2
метилциклобутан
CH2
CH2
CH2
CH2
CH2
CH2
циклопентан
CH2
CH2
CH2
CH2
CH2
циклогексан
Циклоалканы с пятью и шестью атомами углерода в цикле,
т.е. циклопентан и циклогексан называют нафтенами.
Содержание циклоалканов в нефти составляет от 15 до 40% .
17. Методы получения
В промышленности циклоалканы получают из нефти и природного газа.В лаборатории:
1. Дегалогенирование дигалогенпроизводных (внутримолекулярная реакция Вюрца).
В основном свойственна для получения трех- и четырехчленных циклов.
CH2-CH2-Br
CH2-CH2-Br
+
t
Zn
+ ZnBr2
циклобутан
1,4-дибромбутан
2. Гидрирование бензола и его гомологов (получение 6-ти членных циклов).
CH3
CH3
+
толуол
H2
Pt
метилциклогексан
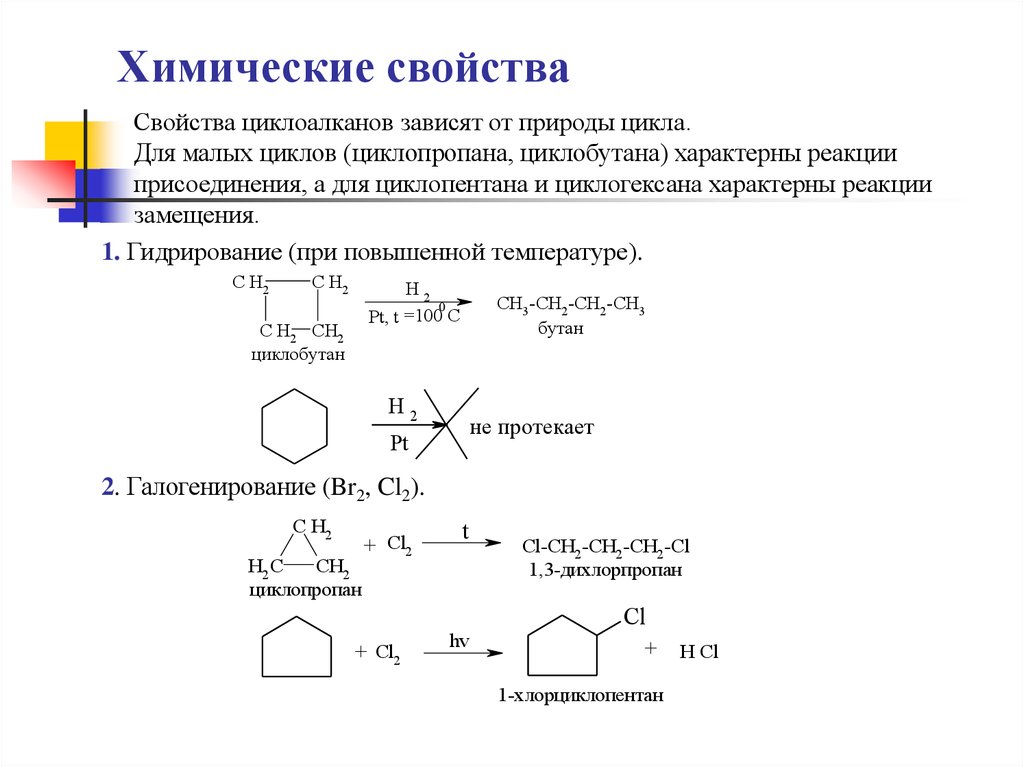
18. Химические свойства
Свойства циклоалканов зависят от природы цикла.Для малых циклов (циклопропана, циклобутана) характерны реакции
присоединения, а для циклопентана и циклогексана характерны реакции
замещения.
1. Гидрирование (при повышенной температуре).
C H2
C H2
H2
0
Pt, t =100 C
C H2 CH2
циклобутан
CH3 -CH2-CH2-CH3
бутан
H2
не протекает
Pt
2. Галогенирование (Br2, Cl2).
C H2
H2 C
CH2
циклопропан
+ Cl2
+ Cl2
t
hv
Cl-CH2 -CH2 -CH2 -Cl
1,3-дихлорпропан
Cl
+
1-хлорциклопентан
H Cl
19.
3. Нитрование разбавленной азотной кислотой.NO2
0
+
циклогексан
HNO3 120 С
10% р-р
+ H2 O
нитроциклогексан
4. Дегидрирование циклогексана реакция Зелинского – ароматизация цикла
Pt
0
300 C
циклогексан
+3H2
бензол
Применение
Соединения с циклами С5 и С6 входят в состав природных веществ – простагландинов,
содержащихся в тканях живых организмов (коралл, лук).
Обладают гормональной зависимостью, являются регулятором функций клеток.
Используются в медицине, ветеринарии и растениеводстве.
• циклопропан – в хирургии анестезирующее средство,
• циклогексан – растворитель,
• гексахлорциклогексан – инсектицид,
• циклогексанон – полиамидные волокна – капрон и найлон.
















 chemistry
chemistry








